蒲公英提取物与牛血清白蛋白相互作用研究
2016-08-09吕艳阳陈芳芳查纯婷
吕艳阳,陈芳芳,查纯婷
(信阳师范学院 化学化工学院,河南 信阳 464000)
0 引言
蒲公英为菊科多年生草本植物,由于蒲公英中的植物活性成分含有黄酮类、酚酸类物质及植物甾醇等,故有一定的药用价值,比如抑菌、解毒、抗氧化、抗肿瘤、通乳、提高免疫力、降低血糖等[1-4].现已广泛应用于临床各科,如急性乳腺炎、呼吸道感染、淋巴结炎[5]等多种感染性炎症.牛血清白蛋白(BSA)由580个氨基酸残基组成的单链蛋白质,其中包括能够发出内源性荧光的色氨酸残基、酪氨酸残基、苯丙氨酸残基等[6-8].BSA的氨基酸序列与人血清白蛋白(HSA)的氨基酸序列高度相似,并且BSA具有相对分子质量小、溶解度大、性质稳定、廉价易得的优点.为了研究药物与人血清白蛋白相互结合情况,所以人们经常研究药物与BSA的相互作用,因此具有广泛的应用价值.目前,关于天然药物蒲公英与牛血清白蛋白相互作用的研究报道较少,本文利用荧光光谱法研究了蒲公英提取物与牛血清白蛋白BSA的相互作用,探讨了不同浓度的蒲公英提取物和溶剂种类这两个因素对荧光强度的影响.
1 实验部分
1.1 仪器与试剂
Cary Eclipse型荧光分光光度计,美国瓦里安公司;HH-2 数显恒温水浴锅,金坛市杰瑞儿电器有限公司;SHB-Ⅲ循环水式多用真空泵,郑州长城科工贸有限公司.甲醇、95%乙醇、盐酸、三(羟甲基)氨基甲烷(Tris)(以上试剂均为分析纯),牛血清白蛋白(BSA,分子量为67 000,生化试剂),实验用水均为二次蒸馏水.蒲公英于2015年4月7日清晨采自信阳师范学院.
1.2 溶液的配制
0.100 0 mol/LTris溶液的配制:准确称量三(羟甲基)氨基甲烷3.028 9 g,配成250 mL水溶液.
0.100 8 mol/L的HCl溶液的配制:用移液管准确移取2.1 mL浓盐酸至250 mL容量瓶中,然后加蒸馏水定容.
1.0×10-4mol/L BSA水溶液的配制:称量0.335 7 g,分子量为67 000 g/mol的牛血清白蛋白,加蒸馏水使之完全溶解,然后定容至50 mL容量瓶中.
1.3 实验方法
1.3.1 蒲公英预处理
将新鲜的蒲公英洗净,去除根.将蒲公英花、叶分离并剪碎.称量20 g蒲公英花、蒲公英叶,分别加入100 mL甲醇、95%乙醇进行水浴回流,分别得到蒲公英花、叶甲醇提取液和蒲公英花、叶95%乙醇提取液.然后稀释得到浓度为0.2 g/L的蒲公英花、叶甲醇分析试液,20 g/L的蒲公英花、叶95%乙醇分析试液.
1.3.2 相互作用的荧光发射光谱
在10 mL比色管中依次加入0、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5 mL蒲公英花(或叶)甲醇分析试液,1.5 mL盐酸溶液,0.5 mLTris 溶液(pH=7.6),浓度为1×10-4mol/L的BSA水溶液1 mL.最后加入蒸馏水定容至10 mL.混合均匀后静止放置10 min,以280 nm为荧光激发波长,用Cary Eclipe 型荧光光谱仪在300~500 nm 范围内扫描其荧光发射光谱,并记录实验结果.
在10 mL比色管中依次加入0、1、2、3、4、5、6、7 mL蒲公英花(或叶)95%乙醇分析试液,1.5 mL盐酸溶液,0.5 mL Tris 溶液(pH=7.6),浓度为1×10-4mol/L的BSA水溶液1 mL.最后加入蒸馏水定容至10 mL.混合均匀后静止放置10 min,以280 nm为荧光激发波长,用Cary Eclipe 型荧光光谱仪在300~500 nm 范围内扫描其荧光发射光谱,并记录实验结果.
2 结果与讨论
2.1 蒲公英提取液浓度对荧光光谱的影响
按1.3.2实验方法,分别改变蒲公英花、叶甲醇提取液,蒲公英花、叶乙醇提取液的浓度范围,并分别扫描4种蒲公英提取液与BSA相互作用的荧光发射光谱,结果见图1和图2.
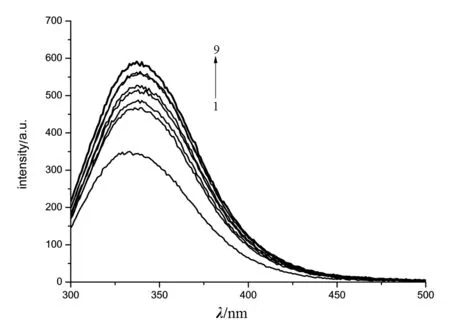
图1 蒲公英花甲醇提取液与BSA的荧光发射光谱Fig.1 Fluorescence emission spectra of methanol extract of dandelion and BSA图中从1到9曲线蒲公英甲醇提取液的浓度依次为:0、0.04、0.05、0.06、0.07、0.08、0.09、0.10、0.11 g/L,Slit=5.0/5.0
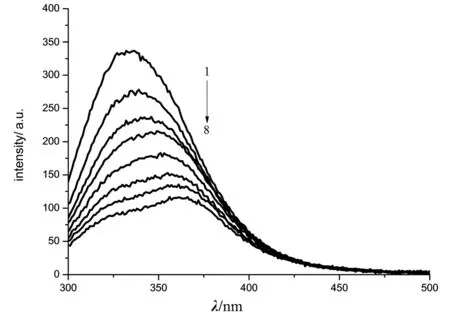
图2 蒲公英花乙醇提取液与BSA的荧光发射光谱Fig.2 Fluorescence emission spectra of ethanol extract of dandelion and BSA图中从1到8曲线蒲公英乙醇提取液的浓度依次为:0、2、4、6、8、10、12、14 g/L,Slit=5.0/5.0
由图1可以看出,在一定的蒲公英花甲醇提取液浓度范围内,其提取液会使BSA的荧光增强,且其荧光强度随着蒲公英花甲醇提取液浓度的增加而增加.BSA的荧光最大发射波长随着其浓度的增加无明显红移.蒲公英叶甲醇提取液也有类似现象.该结果表明,蒲公英花、叶甲醇提取液与BSA分子中能够产生内源荧光的色氨酸残基发生了相互作用,其微环境发生了变化,以及受分子内能量转移效应的影响[6],从而使其荧光强度增强.
由图2可以看出,在一定的蒲公英花乙醇提取液浓度范围内,蒲公英花乙醇提取液均使BSA荧光猝灭,且其荧光强度随着蒲公英花乙醇提取液浓度的增加而降低,BSA的荧光最大发射波长随着蒲公英花乙醇提取液浓度的增加而明显红移.蒲公英叶乙醇提取液也有类似现象.该结果表明,BSA发出的内源荧光强度的降低不仅是由于其残基所处微环境的变化,还受分子内能量转移效应与荧光猝灭效应的影响,BSA荧光的最大发射波长的红移是由于BSA分子中Trp残基[7]区域的疏水性减弱,导致BSA中荧光发色团本身及周围环境极性增加.
2.2 荧光强度增值与蒲公英提取液浓度变化关系
蒲公英提取液与BSA相互作用的荧光强度增值随其浓度的变化关系如图3和图4所示.
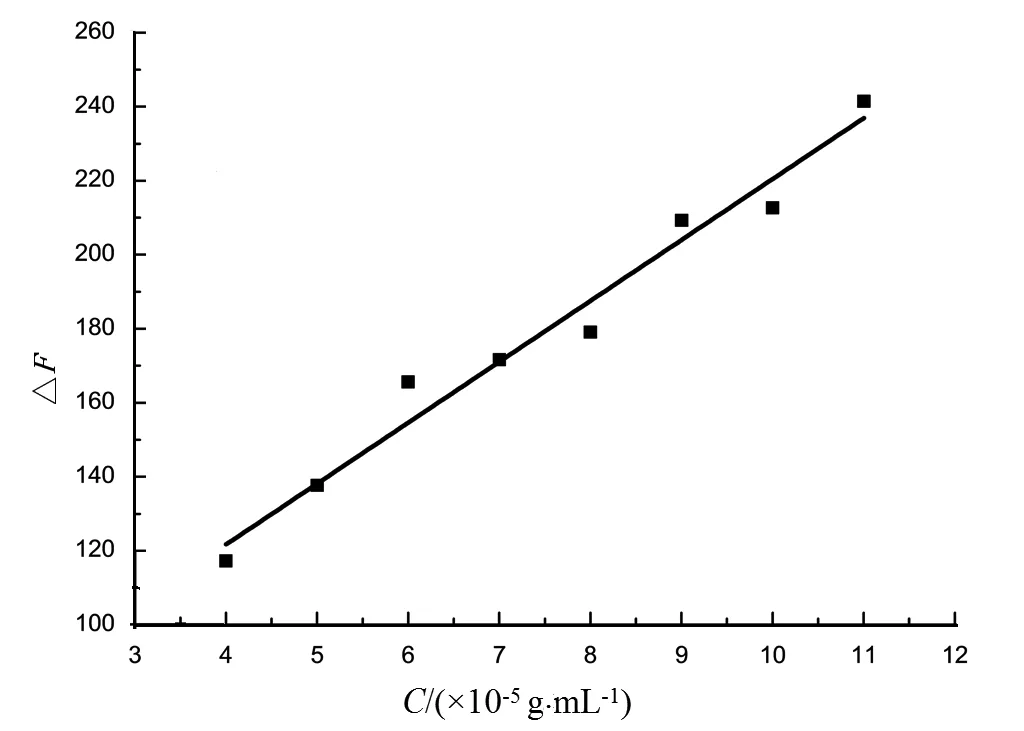
图3 蒲公英花甲醇提取液与BSA相互作用的荧光强度增值随其浓度的变化图Fig.3 A graph of the fluorescence intensity value-added of methanol extract of dandelion and BSA interaction over its concentration
由图3可以看出,随着蒲公英花甲醇提取液浓度的增加,其与BSA相互作用的荧光强度增值也增加,基本呈线性增加关系.蒲公英叶甲醇提取液也是如此.

图4 蒲公英花乙醇提取液与BSA相互作用的荧光强度增值随其浓度的变化图Fig.4 A graph of the fluorescence intensity value-added of ethanol extract of dandelion and BSA interaction over its concentration
由图4可以看出,蒲公英花乙醇提取液与BSA相互作用的荧光强度增值随其浓度的增加呈线性减少的关系.蒲公英叶乙醇提取液也是如此.
3 结论
通过对蒲公英提取物与BSA的相互作用的荧光光谱的研究,发现:蒲公英花、叶甲醇提取物使BSA的荧光强度增强,且其最大荧光发射波长无明显红移;蒲公英花、叶乙醇提取物使BSA的荧光产生猝灭,且其最大荧光发射波长明显红移;甲醇溶剂的荧光强度随着其体积增加而增加,影响较大,乙醇则基本不变.蒲公英花或者叶甲醇提取液与BSA相互作用的荧光强度增值与其浓度的增加呈线性增加关系.蒲公英花乙醇提取液与BSA相互作用的荧光强度增值与其浓度的增加呈线性下降趋势.蒲公英叶乙醇提取液与BSA相互作用的荧光强度增值与其浓度的增加呈平滑下降趋势.
