光生物反应器和跑道式循环生物反应器对荒漠藻类生物量和多糖产量的影响
2016-08-09吴易雯饶本强梅海霞娄亚敏王艳璐刘永定
吴易雯,饶本强,梅海霞,娄亚敏,王艳璐,刘永定
(1. 中国科学院 水生生物研究所,湖北 武汉 430072;2. 中国环境科学研究院 地下水与环境系统工程创新基地,北京 100012;3. 信阳师范学院 生命科学学院,河南 信阳 464000)
0 引言
荒漠藻类是指生长在荒漠地区的土壤藻类,是陆生藻类中特定的生态学类群,而非藻类分类学上的概念.荒漠藻类主要营光合自养方式生存,其生长的生境条件非常恶劣.
在漫长的进化过程中,荒漠藻形成了一套对极端环境的适应机制,能够在贫瘠、干旱、强光辐射、盐碱和较大温度变化下的荒漠环境中生存繁衍[1].荒漠藻类作为荒漠、半荒漠生态系统的先行者,在荒漠土壤的保水、改良、防风固沙及全球气候变化等方面都有明显的生态功能,使得一些藻类学家、土壤学家和生态学家开始致力于荒漠藻类的基础与应用研究[2]. 荒漠藻类在自身的代谢过程中,能够向周围环境分泌多种代谢物,如多糖、氨基酸、蛋白质和生长调节物质等[3].特别是荒漠蓝藻分泌的胞外多糖(Exopolysaccharides, EPS)可为荒漠生态系统提供碳源[4].
目前对藻类多糖的研究,主要集中在淡水微藻和海洋微藻多糖的提取、分离纯化和活性功能及其应用等方面.研究较多的有螺旋藻(Spirulinasp.)、盐藻(Dunaliellasalina)、小球藻(Chlorellasp.)和紫球藻(Porphyridiumcruentum)等[5].藻多糖为带负电荷的多聚大分子,含有多种功能基团,具有悬浊剂、乳化剂和离子螯合剂的性质.因此可通过开发藻多糖获取制药、纺织和污水处理等多种工业的新型材料.此外,由于荒漠蓝藻胞外多糖的抗肿瘤和抗衰老等功效,显示了在医药工业上的潜在应用价值.在微藻多糖中,荒漠蓝藻多糖被认为是一种有前景的多糖资源,其开发应用研究亟待加强.微藻的规模化培养或大量培养是微藻生物技术领域的关键技术,也是微藻资源开发利用及其生物制品开发生产的瓶颈.在微藻的大规模培养中,较常见的是光生物反应器(密闭式)和跑道式循环生物反应器(开放式).光生物反应器主要有管道式、平板式、光纤光生物反应器等,主要特点是最大的表面积与体积比、最有效的光源系统、光能传递到微藻最短光路、最有效的混合循环等[6-7],因此可得高密度、高产、高效培养.跑道式循环生物反应器是最传统的微藻培养模式,结构简单、成本低、易于建造和操作,培养技术较成熟,已成功地应用于螺旋藻、小球藻和杜氏藻的室外大规模培养.目前,关于荒漠藻类的规模化培养的应用研究报道并不多见.本文针对当前荒漠藻类生物资源应用热点和生物技术的难点,探索了利用光生物反应器和跑道式循环生物反应器两种不同的装置规模化培养荒漠藻类,为微藻大规模培养奠定理论基础和提供实践经验.
1 材料与方法
1.1 荒漠藻试验站概况
实验于2012年5-8月在内蒙古自治区荒漠藻工程化培养试验站进行.试验站位于内蒙古自治区鄂尔多斯市达拉特旗境内,库布齐沙漠南缘的解放滩镇(40°21′N, 109°51′E),海拔1040 m.
1.2 材料与培养基
具鞘微鞘藻(MicrocoleusvaginatusGom) 和爪哇伪枝藻(Scytonemajavanicum)由荒漠生物结皮中采集、分离、纯化所得.接种时,采用具鞘微鞘藻和爪哇伪枝藻的混合藻种(二者体积比5∶1),BG11培养基培养.
1.3 两种荒漠藻规模化培养系统
采用荒漠藻试验站温室内的光生物反应器(密闭气升式)和跑道循环生物反应器(开放式)两种类型的培养系统对藻类进行培养.气升式光生物反应器和开放式跑道循环.生物反应器所需藻种用玻璃瓶在无菌条件下培养.藻种活化培养条件:(25±1 ℃)通气培养,光强40 μE/(m2·s),连续光照,然后将培养10~14 d的藻种分别转入气升式光生物反应器和开放式跑道循环池内,在温度(28±2 ℃)、光强60 μE/(m2·s)条件下进行规模化培养.气升式光生物反应器中,通气培养采用空气压缩机通过橡胶管由底部向培养液中通入无菌的空气,开放式跑道循环生物反应器采用叶轮搅拌培养液在跑道池中循环流动,以增加培养液中的含氧量.实验中,用J1和J2分别代表两个容量 80 L的气升式光生物反应器;T1和T2分别代表两个容量1 m3的跑道式循环生物反应器;B和C 分别代表两个容量60 m3的跑道式循环生物反应器;A1, A2分别代表两个容量100 m3的跑道式循环生物反应器. 见图1.在图1中,光生物反应器(a)为有机玻璃制成、圆柱形、半径20 cm、高100 cm,反应器容积为80 L,从中部自上而下导入通气管连接砂轮,由空气泵送出的气体经空气过滤器再由砂轮充入培养液,在中间设置阀门控制气体通入量.温室大棚内的跑道循环生物反应器(b)分为三种容积:1 m3, 60 m3和100 m3,培养池深度均为45 cm ,接入培养基深度为20 cm.

a.气升式光生物反应器 b.开放式跑道生物反应器
2 试验测定
2.1 藻类生物量测定
培养过程中,容量较大的60 m3和100 m3的跑道式生物反应器,采用藻类鲜重计算藻类的生物量.即,取分布均匀的培养液1 L,经过滤布过滤去培养基之后剩余的藻类的质量.
1 m3容量的跑道式生物反应器和气升式光生物反应器,藻类生物量用叶绿素a含量表示.取藻类均匀悬浮的培养基50 mL,6000 r/min离心10 min后,弃去上清液.加10 mL 80 %的丙酮充分混匀后,4 ℃避光提取24 h,8 000 r/min离心10 min取上清液,用分光光度计(722型紫外/可见光分光光度计)在663、645 nm波长下分别测定吸光值,由公式(1)计算出叶绿素a的含量[8],表示为μg/mL.
Ca= 12.7D663- 2.69D645.
(1)
2.2 藻类多糖含量测定
采用苯酚-硫酸法[9]测定藻类多糖.吸取经过离心的培养基上清液10 mL,加入2 mL 6 mol/L的HCl,在96 ℃ 条件下水浴 30 min.水浴后,流水冷却至室温后,加入2 mL 6 mol/L的NaOH,摇匀,定容至25 mL.取1 mL样液,补充蒸馏水至2 mL后,加 1 mL 9 % 的苯酚溶液及 5 mL浓硫酸,在485 nm处测定吸光度.计算出培养基中藻类多糖含量(mg/L).
2.3 培养条件测定
培养温度测定:选取某一天的培养过程中,测定温室内的气温和水温的变化.同时测定在整个培养周期内,温室大棚内气温的变化.
培养基酸碱度测定:在培养过程中,连续测定1周时间内气升式光生物反应器和开放式跑道循环生物反应器中培养基pH随培养时间的变化.
培养基中总氮、总磷含量测定:在培养过程中,连续测定1周时间内气升式光生物反应器和开放式跑道循环生物反应器中培养基中总氮 (TN)和总磷(TP)含量.测定方法参见《水和废水监测分析方法(第四版)》[10].
3 结果与分析
3.1 培养温度变化
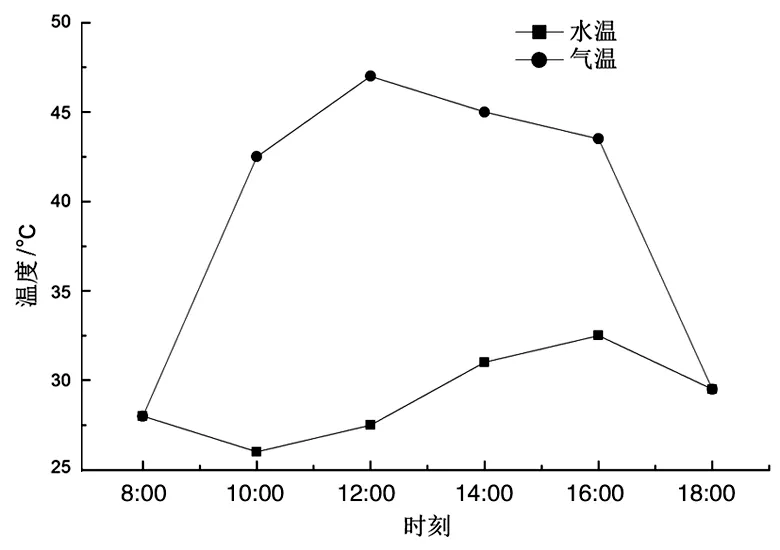
图2 温室内一天中温度的变化比较
图2为在一天的培养过程中,温室内的气温和水温的变化趋势.可以看出,气温和水温的变化趋势不同.一天中8时到12时,温室内的气温逐渐升高,在中午12时左右达到最高温,随后至18时,气温逐渐降低.而温室内培养基的温度则呈现出缓慢升高的趋势,在16时左右达到最高温,随后伴随着日落,水温逐渐下降,到18时左右,水温与气温达到相同.
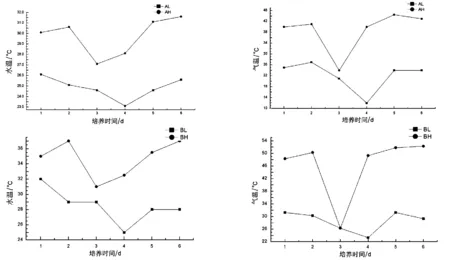
图3 一个培养周期内温室的最高气温和最低气温变化
注:AL表示A池的最低温度,AH表示A池的最高温度;BL表示B池的最低温度,BH表示B池的最高温度.
图3为一个培养周期内(7 d),不同规格温室内的最高气温和最低气温的变化趋势图.由于温室没有人为添加辅助设备,温度以及光照均受自然环境的影响.在培养中后期,出现阴雨天气,故最高气温和最低气温都有所下降.同时由图中可以看出,在阴雨天气,由于自然界中气温变化不明显,导致温室内最高气温和最低气温也没有太大差距,气温变化没有晴朗天气时明显.
3.2 两种培养系统中藻类生物量变化
图4表示的是一个培养周期内(7 d),两种反应器中藻类生物量的增长变化趋势.图4中,A1、A2体积为100 m3容积的反应池,B和C分别为60 m3容积的反应器,但是通风口朝向相反.从图4可见,在A1、A2、B和C四个大型的跑道式循环生物反应器中,藻种接种后均没有经过停滞期,立即进入对数生长期,藻类生物量呈现出急速增加的趋势.随后,在培养的第3天,藻类生长基本进入了稳定期,在第4天补加了磷源之后,藻类生物量再次有个小的生长高峰,随后在第5天,藻类生物量基本稳定,进入稳定生长期.而 T1、T2、J1和J2中途没有补加磷源,在培养的前2天时间里,接种的藻种由于接触到一个新的培养环境中,需要经过一个休整适应阶段.在此期间,不适应新环境的藻细胞逐渐死亡,叶绿素a含量变化不明显,甚至呈现出一个下降趋势.经过适应期的休整之后,适应环境的藻细胞开始迅速生长,使得叶绿素a含量从培养的第3天开始进入对数生长期,直到培养周期结束都呈现出一个增长的趋势.在培养的第6天,三种藻类均基本进入稳定生长期.
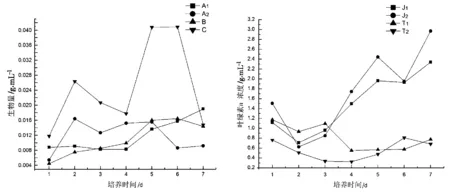
图4 跑道式和气升式光生物反应器中藻类生物量变化
注:A1, A2代表两个容量100 m3的跑道式生物反应器;B和C 代表两个容量60 m3的跑道式生物反应器;T1和T2分别代表两个容量1 m3的跑道式生物反应器;J1和J2代表两个容量 80 L的气升式光生物反应器.
3.3 两种培养系统中藻类多糖变化
图5是在7 d的培养时间内,两种类型的培养系统藻类多糖的变化趋势.在培养期的1~2 d内,藻类多糖产量逐渐增加;随后的2~3 d内,藻类多糖呈现下降趋势;在3~4 d内,藻类多糖产量又呈现增加趋势;在4~6 d期间,藻类多糖出现连续性下降趋势.在6~7 d中,藻类多糖再次呈现增加趋势.与图4中两种类型培养系统中藻类生物量的变化趋势有所不同,在培养期1-7 d内,大型的跑道式循环池(A1、A2、B、C)中藻类的生长状况和小型跑道式循环池(T1、T2)以及光生物反应器(J1、J2)中藻类生长状况有很大差异,但不同培养系统中藻类多糖产量的变化呈现相同的波动性变化趋势.也就是说,在规模化培养过程中,荒漠藻类生物量增殖和分泌的胞外多糖产量受培养条件的影响并不完全同步.这可能是在藻类生长周期的早期阶段,由于藻类处于适应期、对数生长期或是刚刚进入稳定生长期,藻细胞中多糖的合成尚保持在较低水平或处于不稳定状态,而导致荒漠藻类胞外多糖的分泌呈现较大的波动.
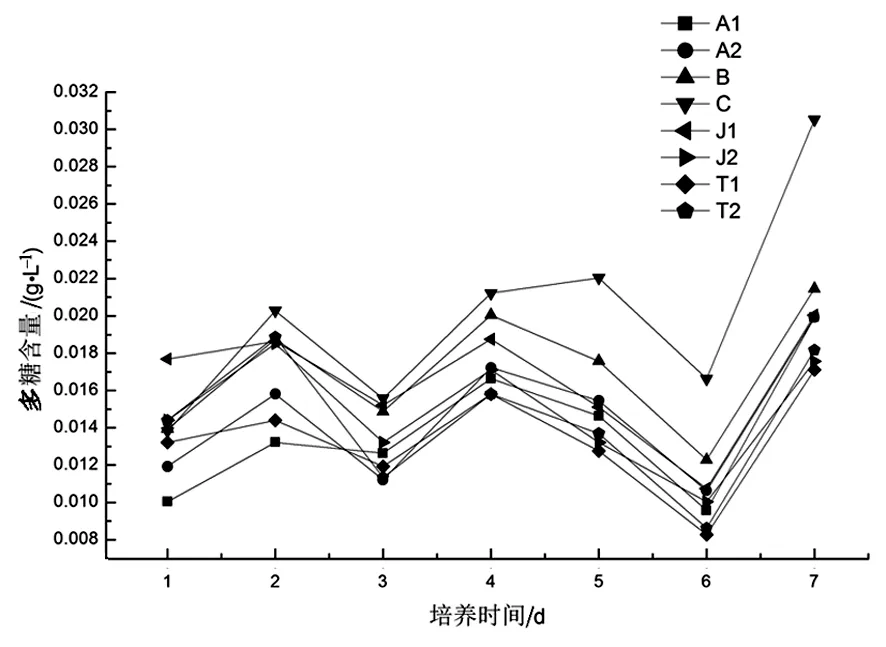
图5 两种反应器培养基中藻类多糖的变化趋势
3.4 培养过程中培养基营养物质的变化
A1、A2、B和C跑道式反应器培养基中,TP的浓度在培养过程中呈现一个迅速降低的趋势(图6),如A1池中,TP浓度从0.836 mg/L骤然降至0.089 mg/L,接近初始值的1/10.即使在培养的第4天补加了相当于初始磷源一半浓度的P,培养基中浓度还是在第5天即迅速回落至 0.073 mg/L,然后趋于平衡.T1和T2池中,TP浓度也分别从2.587 mg/L和2.415 mg/L降至0.900 mg/L和0.848 mg/L.而在气升式光生物反应器中,总磷的浓度变化也在第1天的培养时间内呈现出一个迅速下降的趋势,在随后几天的培养过程中,TP含量变化较为平缓.J1从培养的第2天开始,培养基中TP的浓度就由开始的2.060 mg/L减少为原来的1/3,0.653 mg/L.
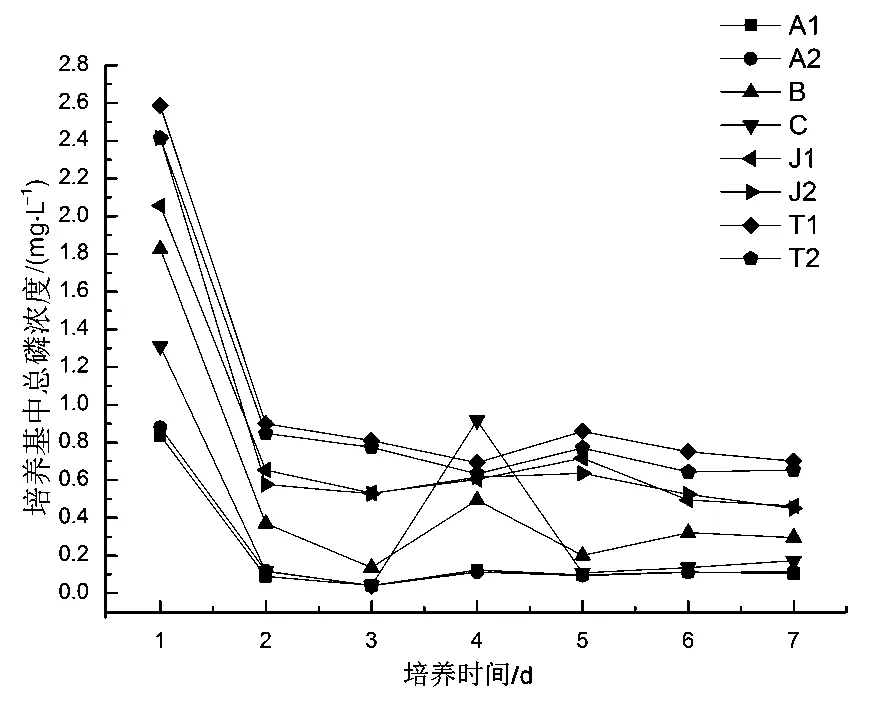
图6 两种反应器培养基中的总磷含量变化
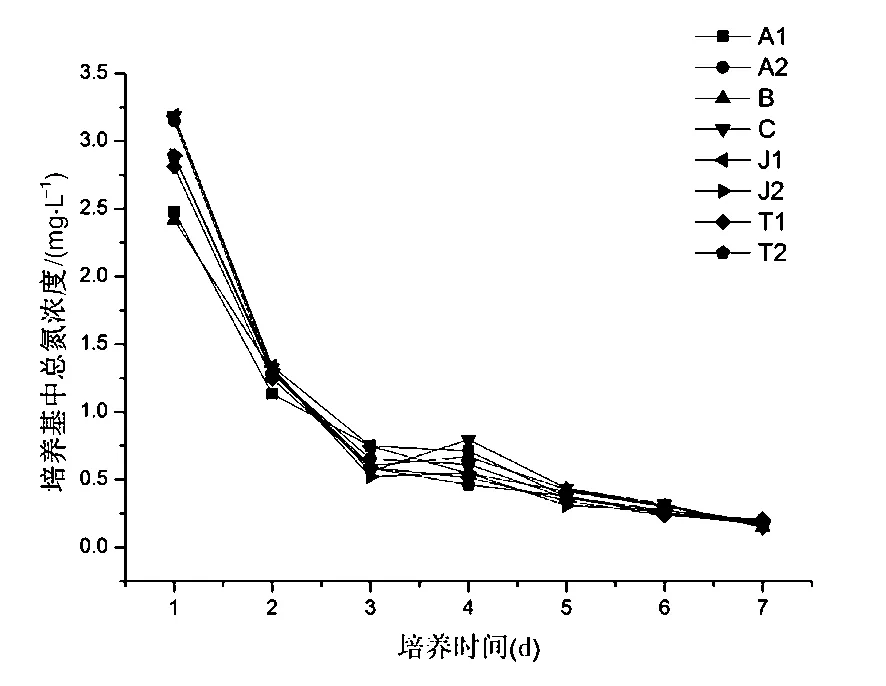
图7 两种反应器培养基中总氮含量变化
在跑道式反应器中,培养基中的总氮的含量变化趋势与总磷相似,都在培养的第1天出现一个迅速减少的过程,例如,A1和T1生物反应器中,TN的浓度分别由2.478 mg/L和3.187 mg/L迅速降至1.135 mg/L和1.338 mg/L.在随后的培养周期内,总氮浓度在培养的第4天时呈现出一个小幅的增加后,又逐渐降低,直到培养结束(如图7).在气升式光生物反应器中,培养基中的TN浓度呈现出一个相对类似的下降趋势.
3.5 培养基酸碱度的变化
图8显示,在培养过程中,气升式光生物反应器培养基中的pH随着培养时间的延长呈现出增加的趋势,由8.1增加至9.2,培养基呈碱性.在第5天,藻类生长进入稳定期后,pH逐渐与8.7左右趋于平稳.跑道式反应器中培养基的酸碱度变化呈现出一个逐渐升高的趋势.例如,A1反应器中,在培养开始的第2天,pH由11.5骤降至10.8后,开始逐渐攀升,由10.8升高至11.0左右.培养基呈碱型.
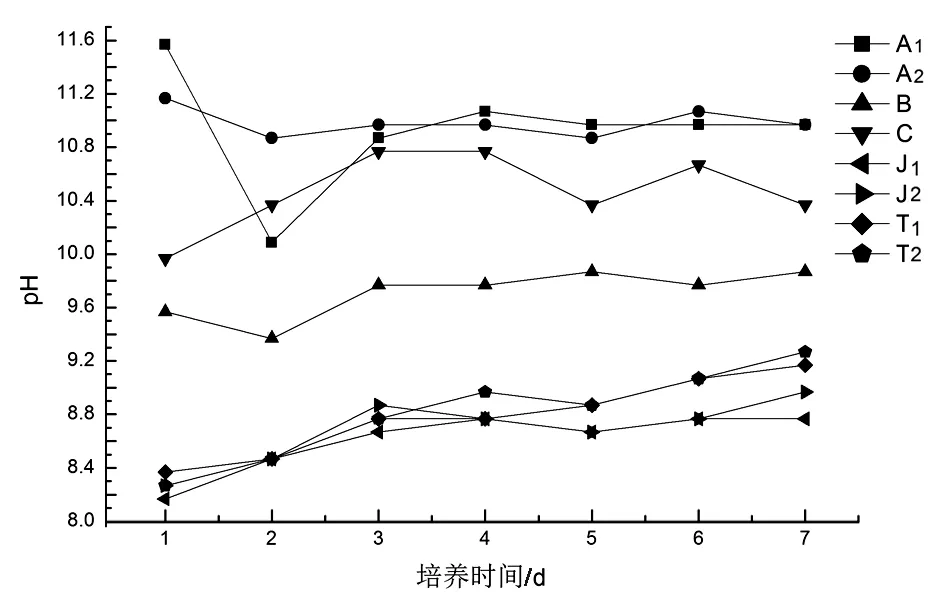
图8 两种反应器中培养基酸碱度的变化
4 讨论
M.Vaginatus和S.Javanicum两种藻类是生物结皮土壤中的优势种和伴生种,所以采用混合培养.通过人工混合培养,能够模拟两种藻类在生态共存条件下的生长情况.在野外自然条件下,生物结皮层的表层主要分布的是S.javanicum,该藻能够产生大量的伪枝藻素,屏蔽强光和紫外辐射,从而对结皮中的生物起到保护作用;M.Vaginatus能够分泌大量的胞外多糖,能够很好地胶结结皮土壤颗粒,形成致密的结皮结构.在混合培养过程中,M.Vaginatus的藻丝发达、生长速度较快,很容易利用培养装置中的光、二氧化碳和养分资源,并聚集在一起形成“雪片状”的藻丝体结构,从而具有较大的种群生物量.S.Javanicum藻丝细小,藻细胞繁殖速度较快,但与M.Vaginatus的生长竞争中处于劣势,产生的种群生物量也较小.
在工程化藻类的培养过程中,反应器的不同会造成培养过程中光强、光质、水体中溶解氧显著不同,进而导致藻类的生长趋势以及培养基中的营养物质的消耗规律同实验室内培养的结果也不尽相同.从本试验的结果可以看出,荒漠藻类更适宜于在气升式光生物反应器中培养.在气升式光生物反应器中,藻类的生长遵循了微生物的生长规律,适应期、对数生长期、成熟期各阶段区别较为明显.同时,藻类对培养基中的营养物质的消耗也较为平缓,培养基中的N源、P源的变化趋势均显示出与生长曲线相对应的变化趋势.这可能是由于气升式光生物反应器中,光源来自四面八方,增加了培养基中的透光性,使得藻类可以得到充分的光源进行光合作用.同时,反应基中泵入的新鲜空气被均匀地破碎为气泡由反应器底部输入,培养基与空气的接触面积增大,培养基中的气体较为充分.开放式跑道反应器可以实现荒漠藻类的大规模生物量的生产.但跑道式反应器中藻类的生长呈现出骤然增长,然后维持在成熟期.同时,培养基中营养物质的消耗剧烈,尤其是P源.因此,在大规模生产中,实时监测培养基中营养物质的消耗,及时补充缺失的营养物质显得尤为重要.
在两种不同的培养系统中,接种荒漠藻类后藻类对环境呈现出不同的反应.在跑道式循环反应器中,荒漠藻类几乎不需要经过适应期或停滞期而很快进行大量增殖,进入对数生长期,藻类生物量呈现出急速增加的趋势.在光生物反应器中,荒漠藻类需要经过一个短暂的休整适应期之后,藻细胞才开始迅速生长,直到培养周期结束都呈现出一个增长的趋势.在两种不同的培养系统中,荒漠藻类多糖产量的变化呈现相同的波动性变化趋势,并且藻类生物量增殖和分泌的多糖产量受培养条件的影响并不同步.在对多种微藻合成多糖的研究中也发现,微藻一般在对数生长期的后期和稳定期时它们的多糖产率最高[5].我们认为,微藻多糖的分泌机制与生长周期可能存在密切关系,微藻在整个生长周期过程中都能不断地合成并释放胞外多糖,但在进入稳定期后分泌量增大.
温度、酸碱度、营养盐以及生长周期等都对荒漠藻类的生长和分泌多糖产生影响,并且在跑道式循环生物反应器中采用半连续培养的方式及时采用新鲜培养基更新培养液,有利于荒漠藻类生物量和多糖产量处于合理的状态.研究表明,温度、光强和更新率是大量培养荒漠藻类生物量和多糖产量的重要影响因子[11].一些微生物多糖在营养不平衡(如高的碳氮比)和较低培养温度的条件下有利于其合成[12].在对紫球藻的研究中发现,pH也能影响其胞外多糖的合成,当pH为偏中性时胞外多糖产量达到最大[13].有研究指出[11],无论在开放式跑道循环反应器的半连续培养条件下,还是在封闭的光生物反应容器的连续培养条件下,荒漠藻类M.Vaginatus的胞外多糖产量都随温度的升高而增加.这表明高温胁迫提高了荒漠藻类胞外多糖的积累,这可能与荒漠藻类对高温具有应变机制有关.饶本强等[14]研究发现,荒漠藻类S.Javanicum在常温下培养骤然降至低温时,其胞外多糖的分泌量显著下降,而经过低温适应后再降至更低温度时,胞外多糖的分泌却出现了大幅度增加.吴沛沛等[15]采用不同高温处理荒漠藻类S.Javanicum时,发现随温度升高,S.Javanicum胞外多糖分泌量呈现出逐渐增大的趋势,即使在40 ℃的高温条件也能够分泌大量的胞外多糖.在对S.Javanicum分泌胞外多糖的研究中发现,温度、盐度、碱度和生长周期等环境因子对该藻胞外多糖分泌具有重要调控作用[16].葛红梅等[17]研究了光强和氮源对荒漠蓝藻Nostocsp.分泌胞外多糖的影响,表明Nostocsp.在氮源利用和光强适应方面都有明显优势, 而且该藻在快速生长的对数期,也可分泌相当量的胞外多糖.有学者研究了非营养条件如pH、装液量、光照强度、摇床速度对土壤蓝藻N.Commune生物量和胞外多糖分泌的影响,表明最佳摇床速度和最佳光照强度对生物量和胞外多糖含量的提高均有着显著效果[18].
光生物反应器具有光能利用率高、生长条件易于控制、污染少等优点,适合荒漠微藻的高密度培养.采用封闭式光生物反应器是微藻规模化培养发展趋势,对于培养条件温和、种群竞争力弱的微藻,卫生要求严格的微藻以及基因工程微藻,都需采用封闭式光生物反应器培养.而跑道式循环池培养方式相对粗放,结构简单、易于操作,培养技术较成熟,非常适合荒漠藻类的大规模培养.因此,在微藻的规模化培养实践中,要针对培养藻类的特点和目标产物的需要,合理选择规模化培养的方式.规模化培养荒漠微藻对于荒漠微藻的产品开发利用、荒漠化防治以及荒漠生态环境整治与保护等方面都具有十分重要的意义.人类在研究和利用荒漠藻类方面做了一些有意义的探索,但由于荒漠藻类分布在荒漠地区而不易引起研究者的注意,迄今为止国内外有关荒漠藻类规模化培养方面的文献并不多见,规模化培养的工艺技术条件有待进一步深入开展.荒漠藻类作为土壤改良剂、生物肥料、环境指示生物和医药材料等方面的资源利用,特别是在土壤改良和荒漠化治理方面的应用,将会很快成为微藻研究及应用的热点内容之一.
5 结论
在气升式光生物反应器和跑道式反应器中培养荒漠藻,其生物量变化与培养基中的N源、P源的消耗趋势相一致.荒漠藻类多糖产量的变化呈现相同的波动性变化趋势,但藻类生物量变化与多糖产量变化受两种装置培养条件的影响并不同步.温度、酸碱度、营养盐、生长周期等培养条件对荒漠藻类的生长和多糖合成有重要影响.
