人乳头瘤病毒HPV33型E6E7蛋白的表达及多克隆抗体的制备
2016-08-09卢钧雄段炼王若伦易俊波
卢钧雄 段炼 王若伦 易俊波
518000,广州医科大学附属第二医院
人乳头瘤病毒HPV33型E6E7蛋白的表达及多克隆抗体的制备
卢钧雄段炼王若伦易俊波
518000,广州医科大学附属第二医院
【摘要】目的表达人乳头瘤HPV33型病毒癌蛋白E6E7,并免疫小鼠制备抗体。方法从HPV33型基因组中扩增出E6 E7的基因片段,通过基因测序加以证实;将其克隆至原核表达载体pET28a中,在大肠埃希菌中经IPTG诱导表达,经HIS亲核层析对重组蛋白进行纯化,收集重组蛋白免疫的小鼠阳性血清,经ProteinA/G亲核层析柱纯化得到多克隆抗体,同时将E6 E7克隆至真核表达载体pCDNA3.1/His C中,转染293细胞,分别采用免疫荧光法和Western Blot检测抗体的特异性。结果用得到高纯度的重组蛋白E6、E7 制备的多克隆抗体,具有良好的特异性。结论这种高纯度重组E6、E7蛋白和抗体有望用于HPV33型人乳头瘤疾病的临床检测及发生机制的研究。
【主题词】宫颈肿瘤;人乳头瘤HPV33;E6 E7蛋白,多克隆抗体
Fund programs: National Natural Science Foundation of China(81403031)
人乳头瘤病毒(Human Papilloma Virus, HPV)感染是宫颈癌发生的最重要的原因之一,它们在生殖肿瘤的病因学中起着关键作用[1]。HPV是一类无包膜的DNA 病毒,通过感染上皮组织细胞,引起上皮组织的良恶性增生,HPV分为高危型HPV(如HPV16/18/31/33/58)和低危型(如HPV6/11)[2],其中高危型HPV感染是宫颈癌发生的主要诱因[3],受到HPV感染,就可能会发展为宫颈癌前病变,在癌变的过程中被认为癌基因的E6、E7蛋白又是诱发肿瘤的关键因素[4-6]。
HPV病毒在壳体内以环状双链DNA存在,全长约为8 kb,其中E6、E7基因序列相当保守,E6编码大约150个氨基酸,E7蛋白由98个氨基酸组成。E6、E7基因在HPV整合状态时,总是保留完整,也就是说它们是病毒诱导细胞转化所必需的癌蛋白,其功能分别通过干扰宿主细胞的关键调控蛋白,如p53和pRB促进永生化。E6蛋白的表达,与p53的相互作用,是造成被感染细胞染色体不稳定性的原因,E7蛋白则降解灭活视网膜母细胞瘤抑制蛋白(pRB)[7],导致恶性肿瘤发生。
我们克隆到HPV33型E6、E7基因,表达重组蛋白,得到多克隆抗体,经检测,多克隆抗体具有高度的特异性。
1材料与方法
1.1病毒、菌株和质粒HPV33型病毒组织液由深圳市慢性病防治院赠送,本研究室保存;宿主菌Rosetta、DH5α、表达载体pET28a、pCDNA3.1/His C由本实验室保存。
1.2试剂各种限制性内切酶、T4 DNA连接酶、脱氧核苷三磷酸(dNTP)、Ex Taq DNA聚合酶、BamHⅠ及EcoRⅠ购于大连宝生物公司;DNA抽提试剂盒及DNA凝胶回收试剂盒购于德国Qiagen公司;DNA标志物DL 2 000、十二烷基硫酸钠(SDS-Na)、Tris碱、异丙基-β-D-硫代半乳糖苷(IPTG)及氨苄青霉素系上海生工生物工程公司产品;蛋白质标志物购于美国Biorad公司。
1.3扩增E6 /E7 基因片段采用病毒基因组DNA提取试剂盒从HPV33型病毒组织液中提取HPV33病毒DNA,贮存于-20℃。设计一对引物扩增E6基因片段克隆入表达载体pET28a及pCDNA3.1/His C中, P1: 5’-AGCGGATCCTTTCAAGACACTGAGGAA-3’;P2: 5’-ATCGAATTCCAGTGCAGTTTCTCTACG-3’;
上游引入BamHⅠ酶切位点,下游引入EcoRⅠ酶切位点;设计一对引物扩增E7基因片段克隆入表达载体pET28a及pCDNA3.1/His C中, P3: 5’-AGTGGATCCAGAGGACACAAGCCAACG-3’;P4: 5’-CATGAATTCTTGTTGTGCACAGGTAGG-3’;上游引入BamHⅠ酶切位点,下游引入EcoRⅠ酶切位点。
1.4序列分析特异性PCR产物纯化后与pM18-T载体进行连接,将连接产物转化到大肠埃希菌DH5α,挑取单克隆菌落培养,鉴定后进行DNA测序分析。
1.5重组表达质粒的构建分别用BamHⅠ和EcoRⅠ双酶切目的基因片段的PCR产物和表达载体pET28a及pCDNA3.1/His C,经琼脂糖凝胶电泳后,回收,分别转化大肠埃希菌DH5α,挑取单克降菌落,PCR鉴定成功后提取质粒,经BamHⅠ和EcoRⅠ双酶切进一步鉴定质粒pET28a-HPV33-E6、 pET28a-HPV33-E7及pCDNA3.1/His C-HPV33-E6、pCDNA3.1/His C-HPV33-E7。
1.6E6 /E7重组蛋白的表达将获得的阳性克隆质粒pET28a-HPV33-E6、pET28a-HPV33-E7转化到表达宿主菌Rosetta中,挑菌培养诱导表达,离心收集菌体,裂解后,取上清进行SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。
1.7表达蛋白的纯化以摇瓶发酵pET28a-HPV33-E6/Rosetta和pET28a-HPV33-E7/Rosetta,离心收集1升菌体,超声破碎,离心取上清以经HIS亲核层析对重组蛋白进行纯化,SDS-PAGE电泳检测纯度。
1.8小鼠多抗制备及纯化分别取50 μg E6/E7纯蛋白免疫小鼠,每种蛋白各免疫三只小鼠,免疫结束后以眼球取血法收集小鼠血清,小鼠血清用protein A柱进行纯化,最后将抗体加入50%后贮存于-20℃中。
1.9E6 /E7在真核细胞中表达平铺293细胞于六孔板中至细胞密度达到80%,无血清DMEM培养基清洗细胞,每孔中再加入无血清DMEM培养基1.5 ml,取pCDNA3.1/His C-E6、pCDNA3.1/His C-E7质粒转细胞,48 h后收集细胞,细胞裂解液裂解,收集蛋白,贮存于-20℃备用。
1.10多克隆抗体的特异性检测分别取pCDNA3.1/His C-E6、pCDNA3.1/His C-E7质粒转染的293细胞蛋白液20 μl,经SDS-PAGE凝胶电泳后,转印蛋白至硝酸纤维素膜(NC膜)上,分别对应加入制备的HPV33 E6/E7小鼠多抗,室温摇2 h后置于4 ℃过夜,TBST洗涤3次,以1∶40000比例加入羊抗鼠二抗(标记HRP)(购于吉泰公司),室温作用1 h,TBST洗涤3次,ECL显色。
1.11多克隆抗体与目标蛋白E6E7的细胞免疫学实验培养293细胞,平铺置有盖玻片的24孔板中,待细胞浓度达到70%时,转染真核表达质粒pCDNA3.1/His C-HPV33-E6、pCDNA3.1/His C-HPV33-E7,24 h冰甲醇固定, PBSA穿膜,PBS清洗后每孔加入重组抗体反应液(1∶500)200 μl,室温静止反应1 h,PBS清洗后每孔加入鼠抗羊两种荧光(Rhodamine,FITC)二抗反应液(1∶500)200 μl,避光室温反应1 h后,PBS反复清洗,加入200 μl DAPI反应液静止5 min,纯水反复冲洗,取出玻片压片,置于共聚焦显微镜上观察。
2结果
2.1E6/E7基因的扩增取PCR产物经1.5%的琼脂糖凝胶电泳检测,结果显示,分别扩增出特异的目的DNA片段,大小分别约440 bp和300 bp, 与预期的大小基本一致,初步证实PCR产物为目的基因片段,并且经测序证实为正确的E6/E7基因。
2.2表达质粒的构建与鉴定将构建成功的重组质粒pET28a-HPV33-E6 和pET28a-HPV33-E7及pCDNA3.1/His C-HPV33-E6和pCDNA3.1/His C-HPV33-E7分别用相对应的酶进行双酶切,结果均切出与预期大小一致的基因片段(图1)。
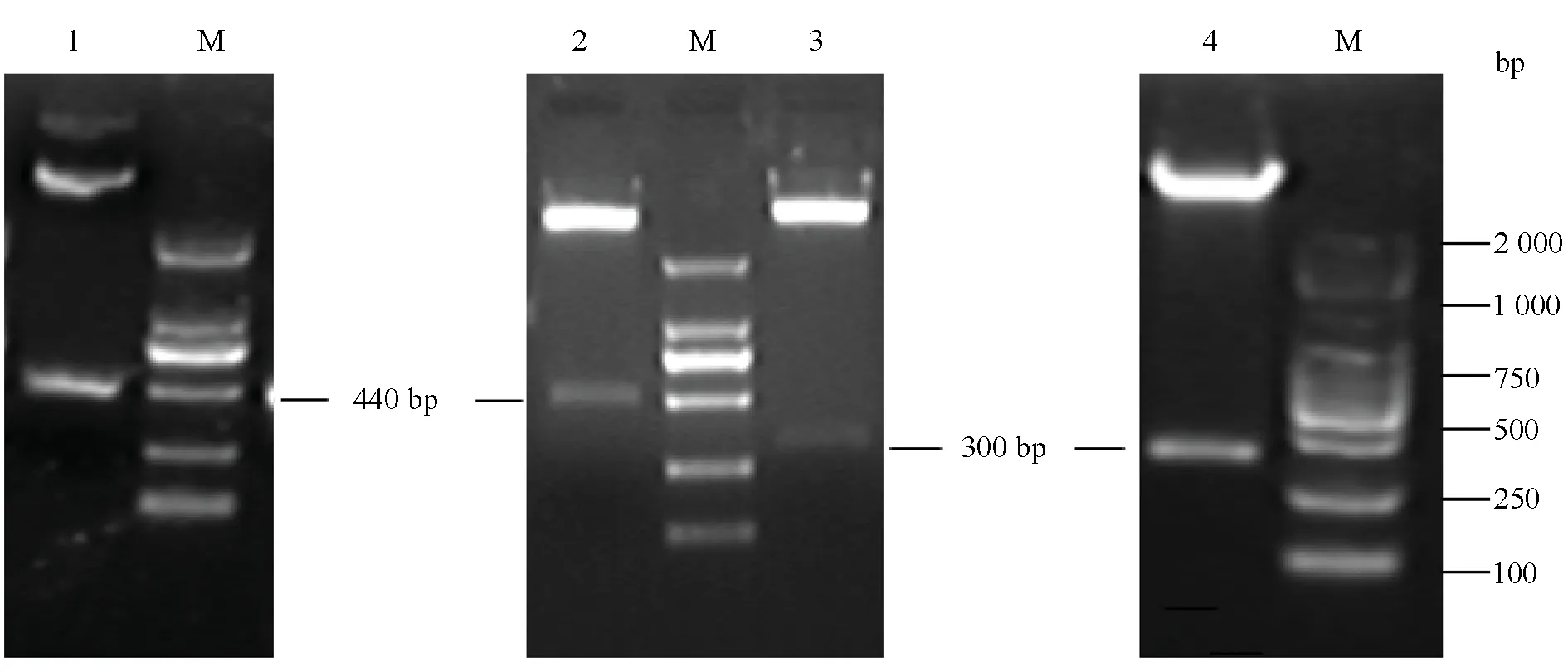
1, pET28a-HPV33-E6质粒经BamHⅠ/ EcoRⅠ酶切;2,pCDNA3.1/His C-HPV33-E6质粒经BamHⅠ/EcoRⅠ酶切;3, pET28a-HPV33-E7质粒经BamHⅠ/ EcoRⅠ酶切;4, pCDNA3.1/His C-HPV33-E7质粒经BamHⅠ/EcoRⅠ酶切鉴定图1 重组质粒的酶切鉴定1, pET28a-HPV33-E6 plasmid digested with BamHⅠand EcoRⅠ;2 ,pCDNA3.1/His C-HPV33-E6 plasmid digested with BamHⅠand EcoRⅠ;3 ,pET28a-HPV33-E7 plasmid digested with BamHⅠand EcoRⅠ;4, pCDNA3.1/His C-HPV33-E7 plasmid digested with BamHⅠand EcoRⅠFig.1 Identification of recombinant plasmids by restrictive enzyme digestion
2.3HPV33 E6/E7蛋白的原核表达及纯化含有表达质粒pET28a-HPV33-E6 和pET28a-HPV33-E7重组菌的裂解液经SDS-PAGE分离、染色后,发现经诱导的pET28a-HPV33-E6 和pET28a-HPV33-E7重组菌在约Mr20000、Mr14000处各出现1条明显新生蛋白带,而未经诱导的pET28a-HPV33-E6 和pET28a-HPV33-E7重组菌及空菌Rosetta在Mr处均没有蛋白带(图2A),可断定此处 Mr20000、Mr14000蛋白带为pET28a-HPV33-E6 和pET28a-HPV33-E7重组菌的表达带。以摇瓶发酵菌体,收集10克湿菌,以破碎缓冲液悬浮,经过超声破碎(3s/3s,500 W,15 min),离心,上清经HIS亲核层析穿出,洗脱得到纯品(图2B)。

2A 重组菌经IPTG诱导表达 1. pET28a-HPV33-E7; 2. pET28a-HPV33-E6;2B 重组蛋白的纯化 1. E6;2. E7图2 重组HPV33 E6 E7蛋白的电泳及纯化图谱2A:1, pET28a-HPV33-E7 transformants with IPTG induction; 2, pET28a-HPV33-E6 transformants with IPTG induction; M, Protein molecular weight marker; 2B: 1,Purified pET28a-HPV33-E6 protein;2,Purified pET28a-HPV33-E7 protein;M, Protein molecular weight markerFig.2 SDS-PAGE of recombinants HPV33 E6 E7 proteins
2.4动物免疫及多抗的制备以E6/E7纯蛋白免疫小鼠制备多抗,经与E6/E7纯蛋白免疫印迹,均能够产生抗体反应(图3)。
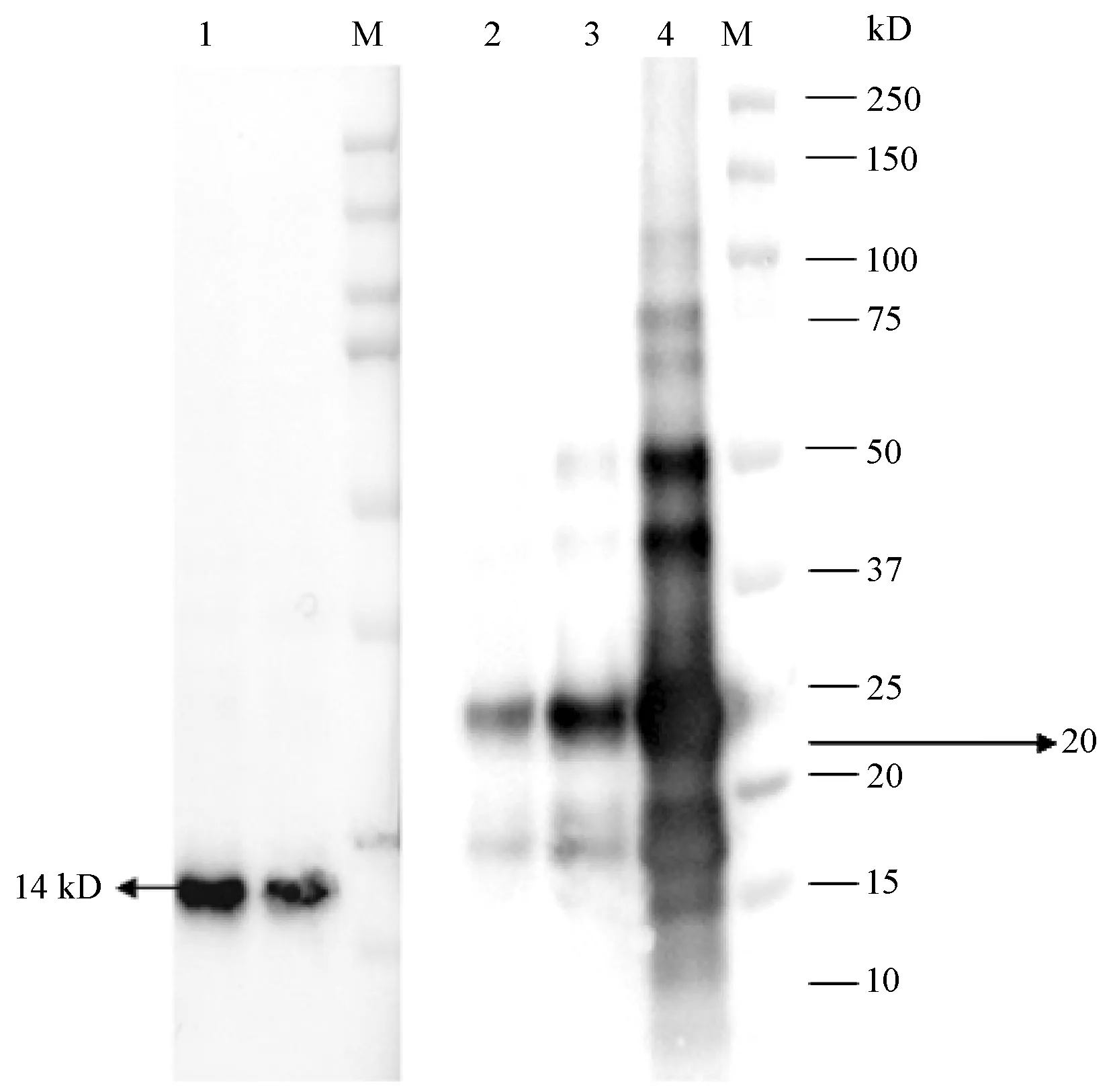
1:pCDNA3.1/His C-HPV33-E7细胞裂解液与E7抗体的Weston-Blot图;2,3,4:pCDNA3.1/His C-HPV33-E6细胞裂解液与E6抗体的Weston-Blot图3 HPV33E6/ E7抗体的免疫印迹1:Lysis buffer of pCDNA3.1/His C-HPV33-E7 with E7 antibody;2,3,4:Lysis buffer of pCDNA3.1/His C-HPV33-E6 with E6 antibodyM Protein molecular weight markerFig.3 Western Blot of HPV33 E6/ E7 antibodies
2.5抗体的细胞免疫学结果结果显示,在细胞表面均能观察到二抗的红色和绿色荧光,说明制备的抗体能够和E7蛋白有效结合。
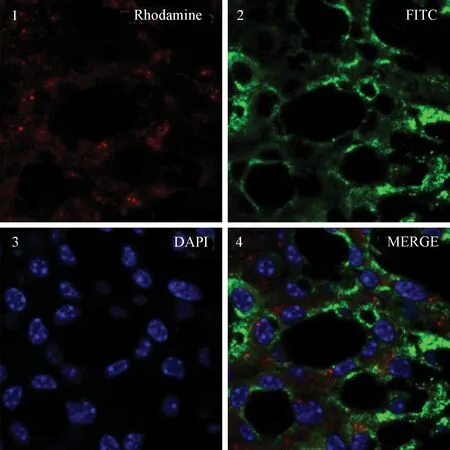
1,pCDNA3.1/His C-HPV33-E7-293细胞与抗体E7反应后通过红荧光鼠二抗显色图;2,pCDNA3.1/His C-HPV33-E7-293细胞与抗体E7反应后通过绿荧光鼠二抗显色图;3,pCDNA3.1/His C-HPV33-E7-293细胞核染色图;4,照片叠加图(1,2,3合并图)图4 HPV E7抗体的细胞免疫学结果1, pCDNA3.1/His C-HPV33-E7-293 with E7 antibody by using goat anti-mouse IgG-Rhodamine as secondary antibody; 2, pCDNA3.1/His C-HPV33-E7-293 with E7 antibody by using goat anti-mouse IgG-FITC as secondary antibody;3, DAPI; 4, MERGEFig.4 Immunological result of HPV E7 antibody
3讨论
HPV病毒感染中,HPV16型检出率最高, HPV33型的检出率位居第二,并且在感染HPV33型的病例中还伴随着混合感染,所以对HPV病毒的研究必需采用联合检测和治疗。对HPV病毒各亚型要进一步深入研究和探讨,目前对HPV病毒的检测采用三种方法,第一种方法是对HPV抗原的检测,第二种方法是HPV抗体的检测,第三种方法则是HPV-DNA检测,单一的检测方法准确率都达不到80%,但HPV抗原/抗体与HPV-DNA的联合检测则检出准确率达94.8%[8]。我们针对抗原抗体的研究入手[9],将HPV33的癌蛋白E6E7作为研究对象,从临床检测作为出发点来研究HPV33型在疾病中的应用。
我们从病毒样本中克隆到HPV33 E6 E7基因,装入到原核表达载体中并成功在大肠埃希菌中表达,通过纯化得到纯蛋白,通过免疫小鼠制备抗体,通过对抗体的检测,我们采用两种方法,一种是通过常规的Westen-Blot方法,发现E7抗体特异性和灵敏度均非常好,E6抗体灵敏度比较特异性方面差一些,我们将进一步改进。针对E7抗体我们进一步用另一种方法来检定,即通过细胞免疫学的方法在细胞水平上检测,我们将目标蛋白E7分泌表达在细胞膜上[10],用制备的E7抗体进行反应,再通过两种荧光二抗显色,在共聚焦显微镜下可以清楚观察到荧光,我们制备的抗体可以应用于宫颈癌疾病的理论研究及临床治疗。
4参考文献
[1]徐耀先,周晓峰,刘立德. 分子病毒学.湖北科学技术出版社,1999. ISBN:9787535219923.
[2]De Vincenzo R, Ricci C, Conte C, et al. HPV vaccine cross-protection: Highlights on additional clinical benefit. Gynecol Oncol. 2013,130:642-51.doi: 10.1016/j.ygyno.2013.05.033.
[3]Wang J, Aldabagh B, Yu J, et al. Role of human papillomavirus in cutaneous squamous cell carcinoma: a meta-analysis. J Am Acad Dermatol. 2014,70:621-9. doi: 10.1016/j.jaad.2014.01.857.
[4]De Sanjose S, Quint WG, Alemany L, et al. Human papillomavirus genotype attribution in invasive cervical cancer: a retrospective cross-sectional worldwide study. Lancet Oncol,2010,11:1048-1056. doi: 10.1016/S1470-2045(10)70230-8.
[5]Lagunas-Martínez A,Madrid-Marina V,Gariglio P. Modulation of apoptosis by early human papillomavirus proteins in cervicalcancer. Biochim Biophys Acta, 2010, 1805:6-16. doi: 10.1016/j.bbcan.2009.03.005
[6]Zakrzewska K, Regalbuto E, Pierucci F, et al. Pattern of HPV infection in basal cell carcinoma and in perilesional skin biopsies from immunocompetent patients.Virol J, 2012, 9:309. doi: 10.1186/1743-422X-9-309.
[7]Lissouba P, Van de Perre P, Auvert B. Association of genital human papillomavirus infection with HIV acquisition: a systematic review and meta-analysis.Sex Transm Infect, 2013, 89:350-6.doi: 10.1136/sextrans-2011-050346.
[8]甘钊杏,黎丽红,曾小明,等. 鳞状上皮细胞癌抗原和HPV-DNA联合检测对宫颈癌诊断的临床意义.中国医药导报,2012,18:61-62.doi:1673-7210(2012)06(c)-0061-02.
[9]易俊波,买制刚,卢海蓉,等.人乳头瘤病毒HPV31型宫颈癌细胞模型的建立, 病毒学报,2012,28:554-559. doi:1000-8721(2012)05-0000-04.
[10] 李梅, 宋娟, 孙鹏, 等. 脑心肌炎病毒(EMCV)3C真核表达载体的构建及其功能鉴定. 中华实验和临床病毒学杂志,2014,28: 156-158. doi: 10.3760/cma.j.issn.1003-9279.2014.02.029.
通信作者:易俊波, Email: myspacebo@hotmail.com
DOI:10.3760/cma.j.issn.1003-9279.2016.01.021
基金项目:国家自然科学基金项目(81403031)
(收稿日期:2015-11-17)
Preparation of the polyclonal antibody of human papillomavirus type HPV33 for E6E7
LuJunxiong,DuanLian,WangRuolun,YiJunbo
TheSecondAffiliatedHospitalofGuangzhouMedicalUniversity,Guangzhou518000,ChinaCorrespondingauthor:YiJunbo,Email:myspacebo@hotmail.com
【Abstract】ObjectiveTo clone and efficiently express E6E7 proteins of human papilloma virus HPV33 in E.coli. The recombinant proteins were purified and immunized to mice, and polyclonal antibodies were purified. MethodsE6 and E7 genes of HPV33 were amplified by PCR using HPV33 human papilloma virus as template,and were sub-cloned into pET28a and pCDNA3.1 / His C vectors. The recombinant plasmids pET28a-HPV33 E6 and pET28a-HPV33 E7 were transformed into Escherichia coli BL21 (DE3) strain.We purified the recombinant proteins and immunized mice for preparing antibodies, and the polyclonal antibodies were purified. Moreover the plasmids pCDNA3.1 / His C-HPV33 E6 and pCDNA3.1 / His C-HPV33 E7 were transfected into 293 cells.The cells were used in immunofluorescence and Western-Blot to detect antibody specificity. ResultsThe recombinant proteins were successfully obtained, and the polyclonal antibody was prepared, which had good specificity. ConclusionThe recombinant proteins and antibodies may be used in the clinical detection and pathogenesis research of HPV33 type human papilloma disease.
【Key words】Cervix neoplasms; Human papillomavirus type 33(HPV33);E6,E7 proteins;Polyclonal antibody
