光损伤对大鼠血-视网膜屏障功能的影响
2016-08-08王小婷徐国兴谢茂松
王小婷,徐国兴,徐 巍,谢茂松
光损伤对大鼠血-视网膜屏障功能的影响
王小婷1,徐国兴2,徐巍2,谢茂松2
1Teaching Center for Clinical Skill, Fujian University of Traditional Chinese Medicine, Fuzhou 350122, Fujian Province, China;2Department of Ophthalmology, the First Affiliated Hospital of Fujian Medical University, Fuzhou 350003, China
Correspondence to:Guo-Xing Xu. Department of Ophthalmology, the First Affiliated Hospital of Fujian Medical University, Fuzhou 350003, China. fjmuxgx@163.com
Received:2016-03-09Accepted:2016-07-07
•AIM: To investigate the influence on blood-retina barrier after intense light exposure in rats.
•METHODS: The rats were randomly divided into light exposure group and control group. Rats in light exposure group were exposed in white light (10000lux,12h on-off, continuing 1-14d) . Rats in control group were only exposed in natural light. The eyes of the rats in the two groups were removed when the rats in light exposure group acceptted intense light after 1, 3, 7 and 14d. We observed the change of retinal structure using hematoxylin-eosin (HE) staining, and observed the change of retinal ultrastructure using electron microscope. We quantified the change of retinal vascular permeability using laser scanning confocal fluorescence microscope and spectrophotometry after perfusion of Evans-blue, to evaluate the change of blood-retinal barrier.
•RESULTS: At 1d after intense light exposure, the retinal ultrastructure of rats changed, such as denaturation of photoreceptor cells and falling of membranous disc outer segment and thinning of the outer nuclear layer thickness, and so on; and the longer the rats exposure to intense light, the more serious change of the retinal ultrastructure were found. At 3d later, photoreceptor cells began apoptosis. At 14d later, the outer nuclear layer became thinner obviously, and the number of cells reduce obviously. At 1d after intense light exposure, EB leaked from the retinal vascular, and at 14d later the leaking of EB was more obvious.
•CONCLUSION: The photoreceptor cell of the outer nuclear layer of retina will degenerate and apoptosis, and the outer nuclear layer will be thinner, and the structure and function of blood-retinal barrier will be destroied, if the eyes of rats exposed in intense light.
Citation:Wang XT, Xu GX, Xu W,etal. Effect of light damage on the function of blood-retinal barrier in rats.GuojiYankeZazhi(IntEyeSci) 2016;16(8):1435-1438
摘要
目的:探讨强光对大鼠血-视网膜屏障功能的影响。
方法:大鼠随机分为光照组及对照组,光照组大鼠经散瞳后进行10000lx强光照射(12h光照,12h避光,连续1~14d),对照组只接受自然光线照射。分别于强光照射后第1、3、7、14d摘除相应的光照组和对照组大鼠双侧眼球;并用HE染色观察视网膜各层结构变化,用电镜观察视网膜超微结构变化,用伊凡思蓝(Evans blue,EB)灌注后激光共聚焦显微镜下微循环成像及分光光度法定量检测视网膜微循环通透性变化,来评估血-视网膜屏障变化。
结果:大鼠在强光照射1d后就出现视网膜光感受器细胞变性、外节膜盘脱落、外核层厚度变薄等超微结构改变,并随着强光照射持续而逐渐加重,3d后出现光感受器细胞凋亡,至14d时外核层厚度已明显变薄、细胞数也明显减少。大鼠在强光照射1d后视网膜血管就出现EB染料渗漏,至14d时EB染料渗漏最明显。
结论:强光照射可导致大鼠视网膜外核层光感受器细胞变性、凋亡,外核层厚度变薄、细胞数减少,血-视网膜屏障结构、功能破坏。
关键词:视网膜光损伤;血-视网膜屏障;细胞凋亡
引用:王小婷,徐国兴,徐巍,等.光损伤对大鼠血-视网膜屏障功能的影响.国际眼科杂志2016;16(8):1435-1438
0引言
正常光线刺激视网膜后,通过复杂神经传导后产生了视觉。如果光照强度或光照时间超过了视网膜的承受力,就可能造成视网膜损伤,从而影响视力。近年来由于手机、电脑等电子产品广泛应用,由此导致视网膜损伤的病例越来越多,这促使人们对人工光源造成的视网膜损伤越来越关注。有研究发现,光损伤视网膜后的病理变化与年龄相关性黄斑变性及视网膜色素变性的病理变化有许多相似之处,可见光损伤机制在诸多眼底疾病中有着重要作用。因此对视网膜光损伤机制的深入研究有着重要的临床意义和社会价值。本文研究强光照射对大鼠视网膜结构及血-视网膜屏障功能的影响,为相关的眼底疾病的防治提供理论依据。
1材料和方法
1.1材料4~6周龄健康SD大鼠80只,体质量80~100g,屈光间质透明,由上海斯莱克实验动物有限责任公司提供;室温18℃~25℃,空气流通,相对湿度40%~70%;动物自由摄食饮水,饲料为全价鼠颗粒饲料,由福建医科大学动物中心提供。实验过程符合国家科学技术委员会颁布的《实验动物管理条例》。普通荧光灯管(Philips照),DHG.9140A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司),可见光分光光度计(Beckman,Fulletton),CAPHILIPS EM208型透射电镜、恒冷冰冻切片机(Shanton,英国),台式高速冷冻离心机(Beckman Coulter,USA),光照度计(TES电子)。
1.2方法
1.2.1动物分组及处理大鼠80只随机分到对照组(40只)和光照组(40只)。光照组再随机分成4个亚组(每组10只),按照昼夜节律分别接受1、3、7、14d人工强光照射:用白色荧光灯管(30W),照射12h(10000lx,6∶00~18∶00),避光12h。对照组只接受自然光线照射,不接受人工强光照射,按照4个时间点随机分成4个亚组(每组10只)。箱内温度控制在22℃~25℃,每3d给予阿托品凝胶点眼1次。于强光照射后1、3、7、14d分别摘取相应时间点光照亚组10只大鼠及对照亚组10只大鼠双侧眼球。每组每个时间点各取2只大鼠,一眼用于病理检查,另一眼用于超微结构观察;各取2只用于EB灌注-视网膜铺片-激光共聚焦检测;各取6只大鼠用于EB定量检测视网膜血管通透性检测。
1.2.2组织病理切片检测摘取眼球后立即置于4%多聚甲醛磷酸盐缓冲液中,在解剖显微镜下取下后段眼杯,并将眼杯重新置于4%多聚甲醛磷酸盐缓冲液中,4℃固定24h后取出眼杯,脱水后OCT包埋剂、-20℃冰冻,平行于角膜和视盘做矢状方向连续切片,厚度8μm,经复水、苏木素染液染色后进行脱水、透明,用中性树脂封片,在光学显微镜下观察并摄像。
1.2.3视网膜光损伤超微结构观察将眼球置于含3%戊二醛-1.5%多聚甲醛-0.1mol/L PBS(pH=7.2)的固定液内,在解剖显微镜下取出眼杯,将眼杯重新置于4℃的3%戊二醛-1.5%多聚甲醛-0.1mol/L PBS(pH=7.2)溶液中固定24h,然后在解剖显微镜下以光滑的圆头细玻璃棒小心剥离视网膜,在视乳头处剪断视网膜与巩膜粘连,修剪视网膜成宽约1mm的条状组织;经漂洗、固定、漂洗、脱水、浸透、包埋、聚合、切片、染色后,做厚度为70~80nm切片,再分别经醋酸铀染色、柠檬酸铅染色,最后在PHILIPS EM208型透射电镜下观察并摄像。
1.2.4视网膜血管通透性检查
1.2.4.1激光共聚焦检测通过鼠尾静脉注射EB(45mg/kg),然后麻醉处死大鼠,并迅速取眼球放入4%多聚甲醛固定1h后,取出在手术显微镜下进行视网膜铺片,再以波段为540nm绿色激光激发视网膜中EB染料发红光,最后照相系统拍摄。
1.2.4.2 EB定量检测视网膜血管通透性改变通过鼠尾静脉注射EB(45mg/kg),然后每隔15min经股动脉抽血0.3mL入抗凝管,离心30min,取上清液检测血浆中EB浓度。注射EB 2h后经左心室灌注多聚甲醛柠檬酸盐缓冲液(37℃,pH=3.5),灌注维持2min,灌注压为120mmHg;然后在显微镜下分离后部视网膜,并放入预先称重的EP管内;再将EP管放入60℃快速真空干燥器中5h,最后称重。计算视网膜干重后,加入120μL甲酰胺,离心30min,去除视网膜碎片后取上清液100μL,采用双波可见光分光光度计检测EB浓度(EB吸收峰620nm,吸收谷740nm,OD=OD620nm-OD740nm),通过标准曲线计算上清液中EB浓度。视网膜中EB的浓度通过下列公式计算:
EB吸收峰和吸收谷测定:采用浓度为2000μg/L的EB标准液进行波长扫描,检测EB的吸收峰和吸收谷。
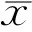
2结果
2.1组织病理学结果光镜观察结果显示,对照组视网膜形态正常,结构层次清楚,内外节排列整齐规则。光照组在强光照射下1d后开始出现外核层厚度变薄;7d后外核层细胞厚度与内核层相当;14d时外核层细胞大量减少,厚度较内核层明显变薄(图1)。
2.2视网膜超微结构观察结果透射电子显微镜检查结果显示,对照组大鼠视网膜组织结构层次清楚,细胞形态规整。光照组大鼠视网膜1d后就出现超微结构改变,视网膜光感受器细胞外节膜盘大量脱落,叠状结构解离,内节线粒体肿胀、空泡变性和嵴消失;3d后,光感受器细胞线粒体肿胀,视网膜内、外节空泡变性明显增多,部分细胞核开始出现皱缩,核电子密度增强,呈现凋亡的迹象(图2)。
2.3激光共聚焦结果激光共聚焦显微镜视网膜微血管成像显示,光照组在1d后就出现EB从视网膜血管漏出,第14d渗漏最明显;而对照组各个时间点上均未发现EB从视网膜血管漏出(图3)。
2.4 EB视网膜血管通透性检测结果图4显示EB浓度的标准曲线(0~40000μg/L,y=0.00007196x,R2=0.999519,P<0.001)。两组各时间点的测量结果如图5所示。采用重复测量数据的方差分析结果:光照组与对照组视网膜EB浓度的差异具有统计学意义(F组间=108.556,P<0.01);在不同时间点上,光照后1d两组间视网膜EB浓度的差异有统计学意义(t=5.945,P<0.050),光照后3d两组间视网膜EB浓度的差异有统计学意义(t=6.457,P<0.05),光照后7d两组间视网膜EB浓度的差异有统计学意义(t=4.272,P<0.05),光照后14d两组间视网膜EB浓度的差异有统计学意义(t=6.110,P<0.05)。采用重复测量数据的方差分析结果:各个时间点上光照组视网膜上EB浓度的差异无统计学意义(F时间=1.577,P=0.203)。

图1视网膜HE染色A:正常对照组;B:光照组7d;C:光照组14d。

图2视网膜超微结构观察结果A:正常对照组(×3000);B:光照1d(×3000);C:光照3d(×10000)。

图3激光共聚焦结果A:正常对照组;B:光照组3d;C:光照组14d。

图4EB浓度的标准曲线。

图5定量检测不同时间点对照组、光照组视网膜EB的浓度。
3讨论
血-视网膜屏障是由内屏障和外屏障组成。内屏障由视网膜血管内皮细胞及其粘连小带和闭锁小带构成,具有严格的选择通透性及单向主动转运作用[1]。外屏障由视网膜色素上皮细胞及其紧密连接组成,具有选择通透性,同时可主动转运各种离子、分子和液体[2]。正常情况下血-视网膜屏障内向通透性明显低于外向通透性,这与视网膜血管内皮细胞的单向主动转运作用及视网膜色素上皮细胞上皮泵作用有关,细胞间紧密连接和转运功能的正常是维持神经视网膜内环境稳定的必要条件[3];任何损伤累及视网膜血管内皮细胞和视网膜色素上皮细胞皆可引起血-视网膜屏障破坏。目前研究表明,视网膜经强光长时间的照射后易引起光感受器层的光损伤,启动了细胞凋亡,光感受器细胞进行性凋亡,外节膜盘不断脱落,视网膜色素上皮细胞不断吞噬,在超出其负荷时即出现了视网膜色素细胞的凋亡,继而引起血视网膜内、外屏障均破坏[4-5]。本实验观察到强光照射1d视网膜光感受器细胞外节膜盘不断脱落,光感受器细胞变性,视网膜外核层厚度变薄;随着强光照射时间延长,视网膜外核层进行性变薄,并逐渐出现视网膜外节膜盘完全丢失、光感受器细胞凋亡。在相应的时间点采用Evans蓝定量检测和激光共聚焦显微镜观察血管渗漏情况的方法,对血-视网膜屏障功能进行了定量和定性检测。实验结果显示视网膜在强光照射1d后就出现EB从视网膜血管漏出,在激光共聚焦显微镜下可清楚观察到14d时EB从血管渗漏情况比3d明显;通过定量检测视网膜上EB浓度方法,并进一步统计分析,却得出不同时间点上视网膜EB浓度差异无统计学意义。这似乎有矛盾,我们将从以下三个方面进一步分析:第一从实验方法上分析,显微镜下观察只是观察到视网膜某一局部EB渗漏情况,具有局限性,而对视网膜上EB浓度的定量检测可克服此局限性;第二从统计方法上分析:由于我们样本量较少,有抽样误差可能,最好通过增加样本量来减少抽样误差,以确保结果可靠性;第三从病理生理机制上分析:从上述各种实验方法都说明,强光刺激早期就能够损伤视网膜的超微结构并破坏血-视网膜屏障,导致视网膜血管渗透性增加。随着强光照射持续,视网膜超微结构损伤一直逐渐在加重,并出现细胞变性、凋亡(其中具体机制有待于我们进一步研究);但血-视网膜屏障破坏程度并没有显著增加,甚至在7d时较前还有一定好转,但统计学分析没有显著差异可能与样本数较少有关,这可能暗示我们强光损伤血-视网膜屏障后,视网膜会自发去修复部分血-视网膜屏障,这个修复机制研究可能会产生重要临床价值,甚至可能找到相关眼底疾病治疗的新方法。当然这种自身修复血-视网膜屏障的能力是有限度,当光损伤因素持续存在,到14d时,视网膜上EB浓度明显增加,说明血-视网膜屏障损伤程度在加重;如果我们把实验时间再延长,也许能更全面显示光损伤时间与血-视网膜屏障损伤程度之间的关系。另一方面也提示我们,如果在血-视网膜屏障损伤早期,及时消除光损伤因素,也许可以终止血-视网膜屏障进一步损伤,并随着视网膜自身修复机制启动,血-视网膜屏障损伤可能有不同程度修复,这就为防治不恰当光照损伤视网膜提供策略。
参考文献
1 Elkouby-Naor L,Ben-Yosef T. Functions of claudin tight junction proteins and their complex interactions in various physiological systems.IntRevCellMolBiol2010;279:1-32
2刘哲丽,吴景天.视网膜色素上皮的形态与功能.中国实用眼科杂志 1997;15(8):450-452
3 Xie MS,Xu GX. Cultureinvitromodulation of human leukocyte antigenmolecules and costimulatory molecules on human retinal pigment epithelium.Ophthalmologica2008;222(1):48-52
4 Organisciak DT,Vaughan DK. Retinal light damage: mechanisms and protection.ProgRetinEyeRes2010;29(2):113-134
5 Wang S, Lu B, Girman S,etal. Non-invasive stem cell therapy in a rat model for retinal degeneration and vascular pathology.PLoSOne2010;5(2):e9200
基金项目:国家自然基金(No.81271026)
作者单位:1(350122)中国福建省福州市,福建中医药大学临床技能教学中心;2(350003)中国福建省福州市,福建医科大学第一附属医院眼科
作者简介:王小婷,女,硕士,助教,研究方向:视网膜疾病。
通讯作者:徐国兴,男,教授,主任医师,博士研究生导师,研究方向:晶状体、视网膜病.fjmuxgx@163.com
收稿日期:2016-03-09 修回日期: 2016-07-07
Foundation item:National Natural Science Foundation of China(No.81271026)
DOI:10.3980/j.issn.1672-5123.2016.8.08
•KEYWORDS:retinal injury of light; blood-retina barrier; apoptosis
Effect of light damage on the function of blood-retinal barrier in rats
Xiao-Ting Wang1, Guo-Xing Xu2, Wei Xu2, Mao-Song Xie2
Abstract
