壳聚糖导管复合辛伐他汀/泊洛沙姆407水凝胶修复大鼠外周神经缺损的研究
2016-08-08宋纯理徐迎胜
郭 琦,刘 灿,海 宝,马 腾,王 红,宋纯理,徐迎胜
(1.北京大学第三医院神经内科, 北京 100191;2.北京大学第三医院骨科, 北京 100191)
壳聚糖导管复合辛伐他汀/泊洛沙姆407水凝胶修复大鼠外周神经缺损的研究
郭琦1,刘灿2,海宝2,马腾2,王红2,宋纯理2,徐迎胜1
(1.北京大学第三医院神经内科, 北京100191;2.北京大学第三医院骨科, 北京100191)
目的探讨壳聚糖导管复合辛伐他汀/泊洛沙姆407水凝胶作为无细胞人工神经支架修复坐骨神经缺损的可行性。方法制备壳聚糖导管和辛伐他汀/泊洛沙姆407水凝胶, 通过体视显微镜、扫描电镜、体外降解实验和流变学检测来观察复合材料的性能。选取SPF级SD大鼠40只, 分为单纯导管组、导管复合辛伐他汀0 mg组、导管复合辛伐他汀0.5 mg组, 和导管复合辛伐他汀1 mg组共4组其中前2组为对照组,后2组为辛伐他汀治疗组, 每组10只, 造成左侧坐骨神经10 mm缺损模型, 用壳聚糖导管桥接缺损, 其内填充不同浓度的辛伐他汀水凝胶。移植后10周, 取再生神经的中间段进行HE染色、透射电镜观察再生神经的形态学改变, 并对再生神经的轴突数量、髓鞘厚度、G-ratio等进行统计学分析;免疫组化观察再生神经中NF200和S100蛋白的表达和神经营养因子PTN、HGF、GDNF和VEGF的表达。结果壳聚糖导管和辛伐他汀/泊洛沙姆407水凝胶是适合神经缺损的无细胞修复材料。植入10周后四组均可见再生神经, 但HE染色显示辛伐他汀治疗组的神经干明显较对照组粗;透射电镜显示辛伐他汀治疗组的再生轴突数量显著增多, 髓鞘显著增厚, G-ratio显示髓鞘化程度亦明显好于对照组;免疫组化显示辛伐他汀治疗组再生神经中标记轴突的NF200和标记雪旺细胞的S100的阳性表达明显增强, 且内源性神经营养因子PTN、HGF、VEGF和GDNF呈现高表达。结论壳聚糖导管复合辛伐他汀/泊洛沙姆407水凝胶明显促进神经缺损组织学的重建, 可用于修复坐骨神经缺损。
外周神经损伤;辛伐他汀;壳聚糖导管;泊洛沙姆407水凝胶;外周神经再生
外周神经缺损一直以来对于基础和临床学者来说都是严格的挑战[1]。短距离缺损通过端端吻合即可达到治愈的目的[2], 而对于长距离神经缺损, 自体神经移植虽然被认为是“金标准”, 却也面临着一系列的困扰[3]。现今, 人工神经导管复合神经营养因子被认为是自体神经的理想的替代物[4-5]。然而, 单纯应用一种外源性神经营养因子不足以支撑外周神经再生的全过程;而且, 外源性神经营养因子大部分都是蛋白质, 存在半衰期短和免疫排斥反应[5]。因此, 利用某种可以诱导内源性神经营养因子分泌的小分子化合物能够显著提高促进外周神经再生的效果。
他汀类药物作为降脂药, 由于它的抗炎、抗氧化、调节免疫和神经保护作用而被应用在神经系统疾病[6-8]。我们先前的实验结果表明辛伐他汀能够显著促进脊髓损伤大鼠神经功能的恢复, 上调脑源性神经营养因子(brain derived neurotrophic factor, BDNF)、神经胶质细胞源性的神经营养因子(glial cell line-derived neurotrophic factor, GDNF)表达[9-10]。但辛伐他汀作为降脂药, 其靶器官是肝脏, 口服后由于肝脏的首过效应, 口服他汀只有不足5%能够进入血液循环[11], 因此我们期待利用一种缓释他汀, 提高其生物利用度的载体可以显著提高受损神经再生的效果。
目前, 关于局部应用辛伐他汀对于外周神经再生的效果仍无报道。我们研究的目的是探索一种辛伐他汀/泊洛沙姆407温敏型水凝胶复合壳聚糖导管促进坐骨神经缺损10 mm大鼠的外周神经再生的效果。从形态学角度观察桥接后缺损神经的再生修复情况, 为研究神经缺损的桥接材料提供形态学基础。
1 材料和方法
1.1材料
1.1.1实验动物及饲养环境: SPF级SD大鼠, 40只, 雄性, 6~7周龄, 体重250~300 g。均购自于北京维通利华实验动物技术有限公司【SCXK(京)2012-0001】。饲养于北京大学医学部实验动物科学部【SYXK(京)2011-0039】。按照实验动物适用的“3R”原则给与人道关怀。实验前适应性饲养1周, 自由摄取食水。
1.1.2药品与试剂:辛伐他汀原料药(中国药品生物制品检定所);壳聚糖(中国浙江金壳药业);泊洛沙姆407(德国BASF公司);一抗NF200和S100(英国Abcam公司);一抗PTN、HGF、VEGF和GDNF(北京博奥森生物技术有限公司);一步法聚合物检测系统、DAB显色试剂盒(北京中杉金桥生物技术有限公司)。
1.1.3主要仪器:体视显微镜(德国Leica公司);光学显微镜(日本Nikon公司);扫描电子显微镜(日本JEOL公司);透射电子显微镜(日本JEOL公司);流变仪(奥利地Anton Paar公司)。
1.2方法
1.2.1壳聚糖导管和辛伐他汀/泊洛沙姆407水凝胶的制备与特性检测
壳聚糖导管的制备参考文献[12], 略微改良。壳聚糖粉末溶解在冰醋酸中达到8%的浓度。外径为1.6 mm的玻璃毛细管竖直插入壳聚糖溶液中, 竖直拔出, 再浸入5%的NaOH溶液中30 min, 双蒸水反复冲洗直至pH值为中性。最后, 拔出玻璃毛细管留下壳聚糖导管, 切成14 mm长度的节段备用。
泊洛沙姆407 粉末溶解在双蒸水中达到25%的浓度, 添加辛伐他汀至三种剂量, 分别为每20 μL混悬液中含有0 mg, 0.5 mg和1 mg辛伐他汀。水凝胶的流变学检测利用流变仪, 设置参数为频率为1 Hz, 幅度为0.1%,弹性模量(G′)和黏性模量(G″)的温度范围为4℃~45℃, 以0.5℃/min的速率加温。
壳聚糖导管填充辛伐他汀/泊洛沙姆407温敏型水凝胶使用体视显微镜观察宏观形态。另外, 取一片壳聚糖膜和水凝胶冻干、喷金、扫描电镜观察微观结构。
1.2.2辛伐他汀/泊洛沙姆407水凝胶的体外降解实验
取2 mL辛伐他汀/泊洛沙姆407温敏型水凝胶置于4.0 mL离心管内并在37℃恒温箱中孵育呈凝胶状。再向离心管内添加2 mL PBS。每24 h换一次缓冲液。在第0, 3, 5, 7, 10和14天拍图观察水凝胶的降解情况。
1.2.3外周神经损伤模型制作
大鼠麻醉后, 消毒备皮, 于左侧大腿外侧切开皮肤, 皮下, 沿肌间隙分离暴露坐骨神经, 于梨状肌下孔5 mm处完全横断坐骨神经, 造成10 mm缺口, 两端用9-0缝线缝合壳聚糖导管, 根据实验分组填充不同剂量的辛伐他汀水凝胶。伤口处洒青霉素粉末以防感染, 分层缝合肌肉与皮肤, 术后分笼饲养, 每笼3只, 术后观察大鼠精神状态、术侧肢体活动、饮食、伤口愈合情况等。手术操作过程见图1。
1.2.4动物分组及给药
标准分笼饲养的SD大鼠40只, SPF级, 雄性, 6~7周龄, 体重250~300 g, 由北京大学医学部实验动物科学部提供, 采用随机数字表法将40只SD大鼠随机分为A、B、C、D共 4组, 每组10只:A组:壳聚糖导管组(conduit);B组:壳聚糖导管复合辛伐他汀水凝胶0 mg(c+sim 0 mg);C组:壳聚糖导管复合辛伐他汀水凝胶0.5 mg(c+sim 0.5 mg);D组:壳聚糖导管复合辛伐他汀水凝胶1 mg(c+sim 1 mg)。
1.2.5组织学观察
术后10周进行组织学观察。取再生坐骨神经置于10%福尔马林固定, 脱水, 石蜡包埋。取再生神经最中间段切片(5 μm)行HE染色, 光镜下观察。
1.2.6透射电镜观察
术后10周进行透射电镜观察。取再生坐骨神经置于2.5%戊二醛中固定, PBS冲洗, 锇酸固定, 脱水, 树脂包埋。半薄切片(100 nm)行甲苯胺蓝染色, 超薄切片(50 nm)行铀酸-柠檬酸铅染色。透射电镜下观察, 计量髓鞘化轴突的直径、髓鞘的厚度和G-ratio(轴突直径与神经纤维总直径的比值),并进行统计分析。
1.2.7免疫组织化学观察
术后10周进行免疫组织化学观察。取再生坐骨神经置于10%福尔马林固定, 脱水, 石蜡包埋, 切片(5 μm)孵育一抗NF200和S100, 分别标记轴突和雪旺细胞, 4℃过夜, PBS水洗, 滴加山羊抗IgG/HRP聚合物, 室温30 min, DAB显色, 光镜下观察。以上一抗浓度均为1∶200。
1.2.8神经营养因子的免疫组织化学观察
术后10周进行神经营养因子免疫组织化学观察。取再生坐骨神经置于10%福尔马林固定, 脱水, 石蜡包埋, 切片(5 μm),孵育一抗多效生长因子(pleiotrophin, PTN)、肝细胞生长因子(hepatocyte growth factor, HGF)、血管内皮生长因子(vascular endothelial growth factor, VEGF)和胶质细胞源性神经营养因子(glial cell line derived neurotrophic factor, GDNF), 4℃过夜, PBS水洗, 滴加山羊抗IgG/HRP聚合物, 室温30 min, DAB显色, 光镜下观察。以上一抗浓度均为1∶200。
1.3统计学分析
2 结果
2.1实验动物数量分析
参加实验40只SD大鼠均进入结果分析。术后各组大鼠精神良好, 均成活, 进食及饮水正常, 营养状况良好, 切口愈合良好、无感染。
2.2壳聚糖导管的特性观察
如图2所示, 壳聚糖导管呈现为半透明状, 直径为1.6 mm, 长度为14 mm。通过扫描电子显微镜可以观察到良好的微观结构。
2.3辛伐他汀/泊洛沙姆407水凝胶的特性观察
如图3,体外降解实验显示水凝胶在14d内几乎降解完全。且通过扫描电子显微镜可观察到水凝胶的多孔状微观结构。图4可见辛伐他汀/泊洛沙姆407水凝胶呈现出温敏性, 即在4℃呈现为液相, 37℃转为固相。
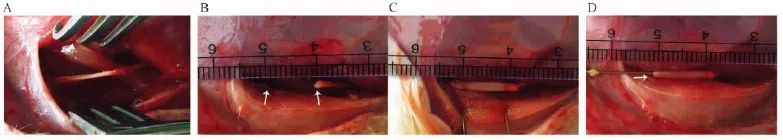
注:A:暴露手术野;B:横断坐骨神经;C:桥接壳聚糖导管;D:注射水凝胶。图1 手术操作图Note. A: Exposure of surgical site; B: Transection of sciatic nerve; C: Grafting of chitosan conduit; D: Injection of hydrogel.Fig.1 Pictures of surgical procedure

注:A:壳聚糖导管的大体结构观察;B:壳聚糖导管的扫描电镜观察。图2 壳聚糖导管特性Note:A: The gross structure of the chitosan conduits; B: The SEM of the chitosan conduits.Fig.2 Characteristics of the chitosan conduits

注:A:水凝胶在体外不同时间的降解情况; B:水凝胶在扫描电镜下观察到的多孔状结构。图3 辛伐他汀/泊洛沙姆水凝胶特性的观察Note:A: Degradation of the simvastatin/pluronic F-127 hydrogel at 37℃ on days 0, 3, 5, 7, 10, and 14 in vitro; B: SEM of the simvastatin/pluronic F-127 hydrogel.Fig.3 Characteristics of the simvastatin/pluronic F-127 hydrogel
2.4再生神经在体观察
如图5所示, 再生神经在体观察可发现填充辛伐他汀/泊洛沙姆407水凝胶组的再生坐骨神经显著粗于对照组, 表明其再生情况明显优于对照组。
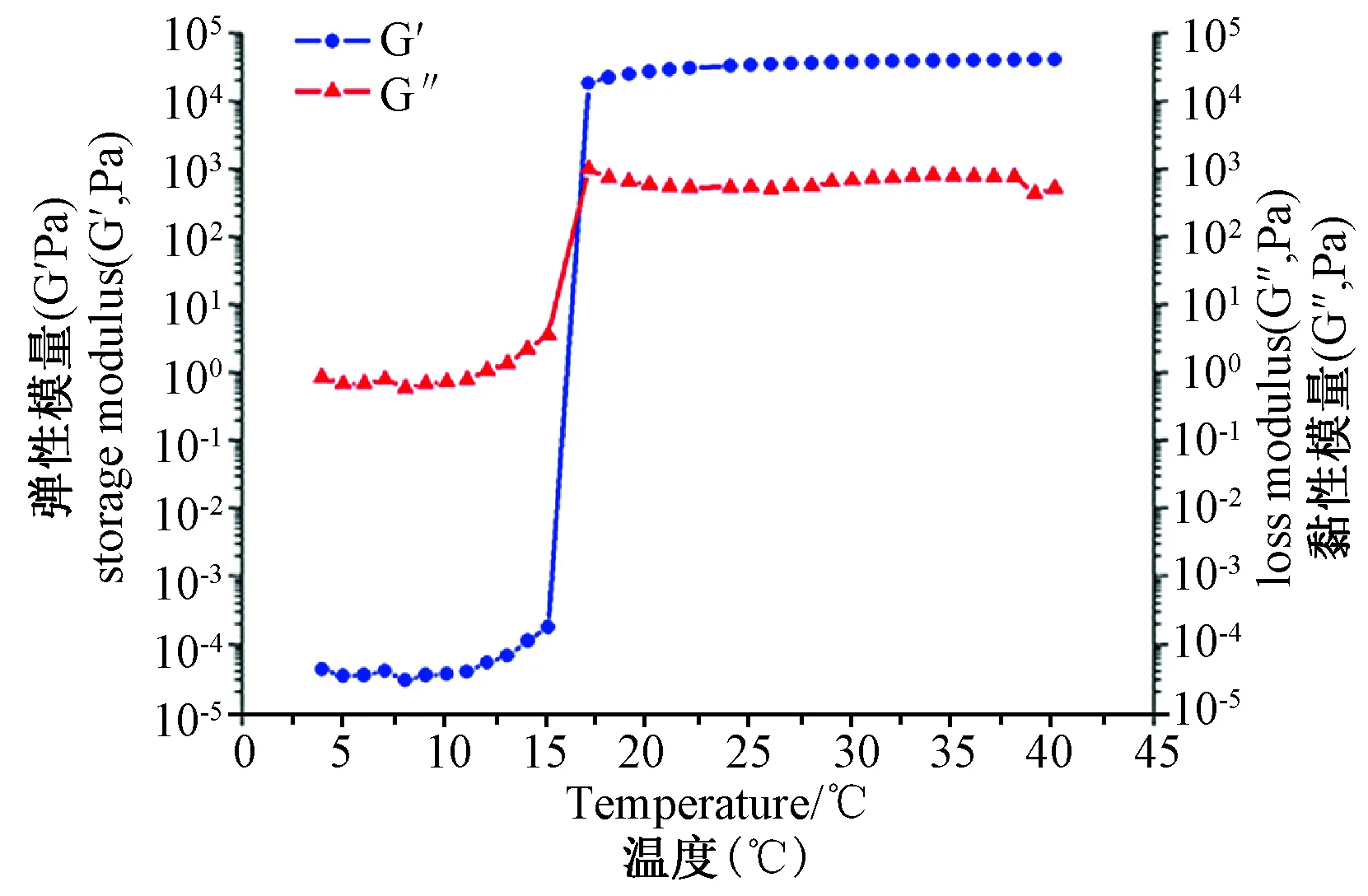
注:在弹性模量(G′)和黏性模量(G″)相交接的温度下, 实现液相-固相的相转变。图4 辛伐他汀/泊洛沙姆水凝胶流变学检测结果Note:It underwent a phase transition from solution to gel at the temperature where the storage modulus (G′) and loss modulus (G″) cross.Fig.4 The rheological properties of the simvastatin/pluronic F-127 hydrogel
2.5再生神经的组织学和免疫组化
如图6所示, HE染色表明辛伐他汀治疗组的再生神经明显粗于对照组, 且镜下微观结构显示再生神经纤维多且直径较粗大, 排列更为规则, 较接近正常坐骨神经。
2.6再生神经的组织学和免疫组化
如图7所示, 辛伐他汀治疗组中标记再生轴突的NF(神经丝)阳性细胞数和标记雪旺细胞的S100阳性细胞数显著多于对照组。
2.7透射电镜观察
图8所示为再生神经中段的甲苯胺蓝和醋酸铀-柠檬酸铅双染色结果。如图9所示, 经统计学分析,辛伐他汀1 mg组的髓鞘化轴突数目最多, 而导管组数目最少。相同的趋势可在髓鞘化轴突的直径和髓鞘厚度中可见。并且, 辛伐他汀治疗组中再生神经的G-ratio值(轴突直径与纤维总直径比值)显著低于对照组,表明其髓鞘化程度更好。
2.8内源性营养因子的表达情况
如图10所示,免疫组化表明辛伐他汀诱导内源性神经营养因子包括PTN、HGF、VEGF和GDNF的高表达。

注:辛伐他汀组再生的坐骨神经较对照组明显增粗。图5 每组于术后10周再生神经的大体情况Note:The regenerated sciatic nerves in the rats whose defects were bridged by chitosan conduits filled with simvastatin/pluronic F-127 hydrogel were much thicker than that without simvastatin.Fig.5 Gross views of the regenerated sciatic nerves 10 weeks after surgery
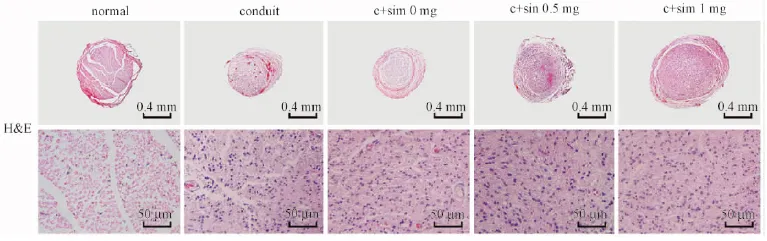
图6 再生坐骨神经中段HE染色观察Fig.6 The HE staining of the regenerated sciatic nerve

注:A:NF标记再生轴突;B:S100标记雪旺细胞。图7 免疫组化染色Note: A: NF to lable the regenerated axons; B: S-100 to lable the Schwann cells.Fig.7 The immunohistochemical staining of the regenerated nerves
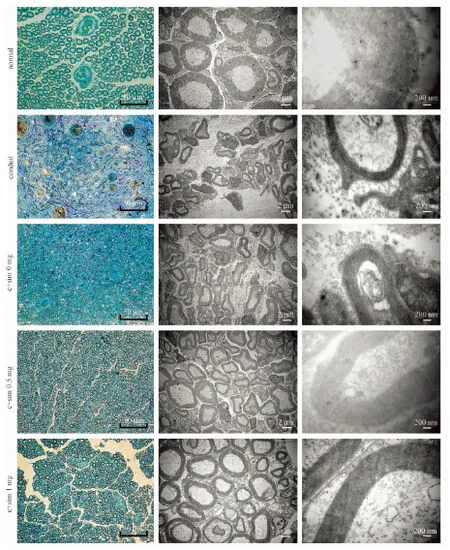
图8 再生神经轴突和髓鞘的透射电镜观察Fig.8 Observation of the regenerated axons and myelin sheaths by TEM
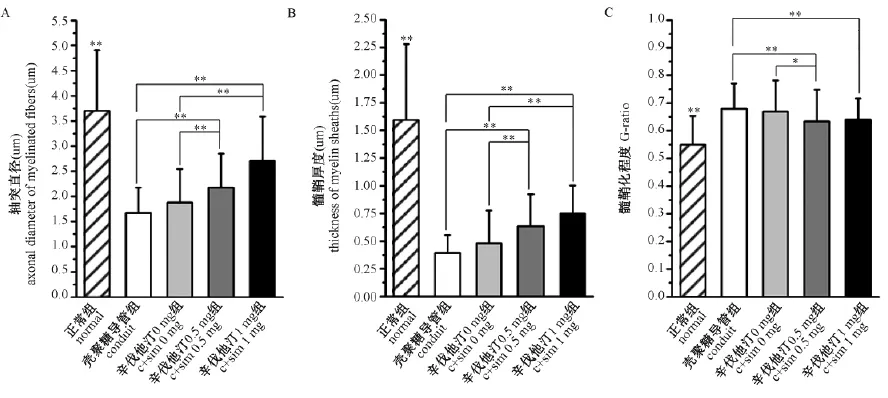
注:A:再生轴突直径的统计学分析;B:髓鞘厚度的统计学分析;C:髓鞘化程度(G-ratio)的统计学分析。图9 再生坐骨神经中段的透射电镜观察Note:A: Quantifications of axonal diameter; B: Quantifications of the thickness of the myelin sheaths; C: Quantifications of the G-ratios of the myelinated nerve fibers. Fig.9 Observation of the regenerated nerves by TEM



组别Group轴突直径(μm)Axonaldiameter髓鞘厚度(μm)Thicknessofthemyelinsheaths髓鞘化程度G-ratio正常组normal3.72±1.181.59±0.680.55±0.10壳聚糖导管组conduit1.67±0.500.39±0.160.68±0.10辛伐他汀0mg组c+sim0mg1.88±0.660.48±0.300.67±0.11辛伐他汀0.5mg组c+sim0.5mg2.17±0.68**0.64±0.29**0.63±0.11*/**辛伐他汀1mg组c+sim1mg2.70±0.89**0.75±0.25**0.64±0.08**
注:对于轴突直径, 髓鞘厚度:与导管组和辛伐他汀0mg组比较,*P<0.05,**P<0.01;对于G-ratio:与导管组比较,*P<0.05,**P<0.01。
Note: For the axonal diameter and thickness of the myelin sheaths : Compared with the groups of conduit and c+sim 0mg,*P<0.05,**P<0.01; For G-ratio: Compared with the groups of conduit,*P<0.05,**P<0.01.

注:辛伐他汀治疗组的局部神经营养因子表达明显增高。图10 内源性营养因子PTN、HGF、VEGF和GDNF的免疫组化结果Note:Simvastatin dramatically induces the secretion of PTN, HGF, VEGF and GDNF.Fig.10 The immunohistochemical staining for PTN, HGF, VEGF and GDNF
3 讨论
寻找诱导性促进神经再生生物材料一直是神经修复领域研究的热点。有研究发现, 壳聚糖降解产物可以促进雪旺细胞增殖和神经再生[13], 水凝胶作为可生物降解、良好生物相容性的高分子材料可作为缓释载体[14-16], 并可填充壳聚糖空导管, 形成轴突再生的有效支架。
本研究中, 我们观察到了壳聚糖导管中填充辛伐他汀/泊洛沙姆407水凝胶可以显著促进大鼠缺损10 mm的坐骨神经再生, 在组织学上能够明显促进神经再生的结构的修复。并且, 在辛伐他汀治疗组中与神经再生相关的内源性神经营养因子的分泌包括 PTN、HGF、VEGF 和GDNF也显著增加。
有研究发现, 短期口服大剂量阿托伐他汀可以预防坐骨神经损伤, 促进睫状神经营养因子(ciliary neurotrophic factor, CNTF)高表达[6];腹腔注射给予辛伐他汀(20 mg/kg/d)能够促进大鼠坐骨神经挫伤的恢复[17]。相似的, 也有报道称连续14 d腹腔注射阿托伐他汀(5 mg/kg/d)有助于大鼠坐骨神经完全横断后的神经-肌肉再支配的重建[18]。与此相对, 另有报道称口服给予低剂量辛伐他汀(2 mg/kg/d)连续14 d会延缓神经纤维的再生, 但对电生理检测并无影响[19]。这相反的结果在某种程度上与他汀在肝脏的首过效应有关, 口服给与的他汀只有少于5%能够到达系统循环中[11], 而高剂量的辛伐他汀又会引起一系列的副作用[20]。因此, 局部应用辛伐他汀既可以避免副作用, 又可以提高局部辛伐他汀的生物利用度从而有效地促进神经再生。本实验的数据表明辛伐他汀对于神经再生是很有前景的生物小分子化合物。
大量的神经营养因子在中枢或外周神经损伤中均有促进神经再生的作用[4-5]。人工神经通过缓释神经营养因子作为神经修复材料取得一定的效果, 但外源性神经营养因子由于其价格昂贵、半衰期短、免疫源性、制备缓释载体困难及储备、存储不便等因素限制了临床的应用;并且单一的神经营养因子难以满足神经修复再生的全过程。国内罗卓荆课题组[21]通过c-Jun基因修饰雪旺细胞, 可以促进多种神经营养因子如GDNF, BDNF, LIF等分泌。 同基因修饰等遗传学方法及通过种子细胞和外源性神经营养因子等组织工程学方法相比, 采用辛伐他汀这一小分子化合物的局部缓释促进内源性神经营养因子的表达, 促进周围神经再生, 无疑具有重要的研究价值。
本研究中, 采用的辛伐他汀剂量为0.5、1 mg, 均显示可显著促进大鼠周围神经损伤修复, 但两者(0.5 mg vs. 1 mg)之间没有显著性差异, 结合泊洛沙姆水凝胶的体外降解实验结果, 2周内即基本完全降解, 提示更小剂量的辛伐他汀即能促进神经再生;同时延长缓释时间或将更好地发挥促进神经再生的作用。
本研究中, 我们首次报道辛伐他汀显著增加大鼠外周神经中PTN的分泌、PTN一直以来被认为在体内和体外实验中具有促进轴突再生的作用[22]。HGF被报道在大鼠坐骨神经损伤[4]、面神经损伤[23]和视神经损伤[24]后均有促进神经再生和功能恢复的效果。最近, 更多的研究表明VEGF也有神经营养和神经保护的作用[25], 加速神经再生和促进神经功能的恢复[26-27]。以上这些发现均表明局部应用辛伐他汀通过促进内源性神经营养因子的分泌来促进缺损坐骨神经的再生。
综上, 我们的结果表明局部应用辛伐他汀通过增加内源性PTN、HGF、VEGF和GDNF的分泌, 从而促进坐骨神经缺损大鼠模型的神经再生。
[1]Zhan X, Gao M, Jiang Y,etal. Nanofiber scaffolds facilitate functional regeneration of peripheral nerve injury [J]. Nanomedicine, 2013, 9(3): 305-315.
[2]Zhu S, Ge J, Wang Y,etal. A synthetic oxygen carrier-olfactory ensheathing cell composition system for the promotion of sciatic nerve regeneration [J]. Biomaterials, 2014, 35(5): 1450-1461.[3]Matsumoto K, Ohnishi K, Kiyotani T,etal. Peripheral nerve regeneration across an 80-mm gap bridged by a polyglycolic acid (PGA)-collagen tube filled with laminin-coated collagen fibers: a histological and electrophysiological evaluation of regenerated nerves [J]. Brain Res, 2000, 868(2): 315-328.
[4]Li Z, Peng P, Wang G,etal. Effects of local release of hepatocyte growth factor on peripheral nerve regeneration in acellular nerve grafts [J]. Exp Neurol, 2008, 214(1): 47-54.
[5]Ma FK, Xiao ZF, Meng DQ,etal. Use of Natural Neural Scaffolds Consisting of Engineered Vascular Endothelial Growth Factor Immobilized on Ordered Collagen Fibers Filled in a Collagen Tube for Peripheral Nerve Regeneration in Rats [J]. International Journal Of Molecular Sciences, 2014, 15(10): 18593-18609.
[6]Pan HC, Yang DY, Ou YC,etal. Neuroprotective effect of atorvastatin in an experimental model of nerve crush injury [J]. Neurosurgery, 2010, 67(2): 376-389.
[7]Shi XQ, Lim TK, Lee S,etal. Statins alleviate experimental nerve injury-induced neuropathic pain [J]. Pain, 2011, 152(5): 1033-1043.
[8]Morishita S, Oku H, Horie T,etal. Systemic Simvastatin Rescues Retinal Ganglion Cells from Optic Nerve Injury Possibly through Suppression of Astroglial NF-kappa B Activation [J]. Plos One, 2014, 9(1): e84387.
[9]Han X, Yang N, Cui Y,etal. Simvastatin mobilizes bone marrow stromal cells migrating to injured areas and promotes functional recovery after spinal cord injury in the rat [J]. Neurosci Lett, 2012, 521(2): 136-141.
[10]Han X, Yang N, Xu Y,etal. Simvastatin treatment improves functional recovery after experimental spinal cord injury by upregulating the expression of BDNF and GDNF [J]. Neurosci Lett, 2011, 487(3): 255-259.
[11]Schachter M. Chemical, pharmacokinetic and pharmacodynamic properties of statins: an update [J]. Fundam Clin Pharmacol, 2005, 19(1): 117-125.
[12]Li X, Yang Z, Zhang A,etal. Repair of thoracic spinal cord injury by chitosan tube implantation in adult rats [J]. Biomaterials, 2009, 30(6): 1121-1132.
[13]Wang Y, Zhao Y, Sun C,etal. Chitosan Degradation Products Promote Nerve Regeneration by Stimulating Schwann Cell Proliferation via miR-27a/FOXO1 Axis [J]. Mol Neurobiol, 2016, 53(1): 28-39.
[14]Carballo-Molina OA, Velasco I. Hydrogels as scaffolds and delivery systems to enhance axonal regeneration after injuries [J]. Front Cell Neurosci, 2015, 9: 13.
[15]Strappe PM, Hampton DW, Cachon-Gonzalez B,etal. Delivery of a lentiviral vector in a Pluronic F127 gel to cells of the central nervous system [J]. Eur J Pharm Biopharm, 2005, 61(3): 126-133.[16]Yang Y, Wang J, Zhang X,etal. A novel mixed micelle gel with thermo-sensitive property for the local delivery of docetaxel [J]. J Control Release, 2009, 135(2): 175-182.
[17]Xavier AM, Serafim KG, Higashi DT,etal. Simvastatin improves morphological and functional recovery of sciatic nerve injury in Wistar rats [J]. Injury, 2012, 43(3): 284-289.
[18]Cloutier FC, Rouleau DM, Hebert-Davies J,etal. Atorvastatin is beneficial for muscle reinnervation after complete sciatic nerve section in rats [J]. Journal Of Plastic Surgery And Hand Surgery, 2013, 47(6): 446-450.
[19]Daglioglu E, Berker M, Demirci M,etal. Microscopic and electrophysiological changes on regenerating sciatic nerves of rats treated with simvastatin [J]. Folia Neuropathol, 2010, 48(1): 49-56.
[20]England JD, Viles A, Walsh JC,etal. Muscle side effects associated with simvastatin therapy [J]. Med J Aust, 1990, 153(9): 562-563.
[21]Huang L, Quan X, Liu Z,etal. c-Jun gene-modified Schwann cells: upregulating multiple neurotrophic factors and promoting neurite outgrowth [J]. Tissue Eng Part A, 2015, 21(7-8): 1409-1421.
[22]Mi RF, Chen WR, Hoke A. Pleiotrophin is a neurotrophic factor for spinal motor neurons [J]. Proceedings Of the National Academy Of Sciences Of the United States Of America, 2007, 104(11): 4664-4669.
[23]Esaki S, KitohCJ, Katsumi S,etal. Hepatocyte growth factor incorporated into herpes simplex virus vector accelerates facial nerve regeneration after crush injury [J]. Gene Therapy, 2011, 18(11): 1063-1069.
[24]Wong WK, Cheung AW, Yu SW,etal. Hepatocyte growth factor promotes long-term survival and axonal regeneration of retinal ganglion cells after optic nerve injury: comparison with CNTF and BDNF [J]. CNS Neurosci Ther, 2014, 20(10): 916-929.
[25]Ruiz de Almodovar C, Lambrechts D, Mazzone M,etal. Role and therapeutic potential of VEGF in the nervous system [J]. Physiol Rev, 2009, 89(2): 607-648.
[26]Pereira Lopes FR, Lisboa BC, Frattini F,etal. Enhancement of sciatic nerve regeneration after vascular endothelial growth factor (VEGF) gene therapy [J]. Neuropathol Appl Neurobiol, 2011, 37(6): 600-612.
[27]Jin K, Zhu Y, Sun Y,etal. Vascular endothelial growth factor (VEGF) stimulates neurogenesis in vitro and in vivo [J]. Proc Natl Acad Sci U S A, 2002, 99(18): 11946-11950.
Bridging sciatic nerve defect with simvastatin delivered by injectable thermosensitive pluronic F-127 hydrogel repairs peripheral nerve defect in rats
GUO Qi1, LIU Can2, HAI Bao2, MA Teng2, WANG Hong2, SONG Chun-li2, XU Ying-sheng1
(1. Department of Neurology, Peking University Third Hospital, Beijing 100191, China;2. Department of Orthopedics, Peking University Third Hospital, Beijing 100191, China)
ObjectiveTo explore the feasibility of combining chitosan conduit filled with simvastatin/ pluronic F-127 thermosensitive hydrogel to repair peripheral nerve defects in rats. Methods The chitosan conduits and simvastatin/ pluronic F-127 hydrogel were prepared and tested by stereomicroscope, SEM, vitro degradation testing and rheometer property. A total of 40 Sprague-Dawley rats were randomly divided into 4 groups (n=10 per group): the chitosan conduit alone (conduit group) or the conduit filled with pluronic F-127 hydrogel containing 0 (c+sim 0mg), 0.5 (c+sim 0.5mg), and 1 mg (c+sim 1mg) simvastatin. A 10mm nerve defect was created in the rat left sciatic nerve and bridged with the chitosan conduit filled with pluronic F-127 hydrogel containing different doses of simvastatin. At 10 weeks after surgery, the regenerated nerves were performed the H&E and TEM to observe the morphological change. The diameters of the myelinated axons, the thickness of the myelin sheath, and the G-ratios (the ratio of the axon diameter to the total fiber diameter) were calculated to make statistical analyses. And the immunohistochemical method was used to measure the expression of NF200 and S100 protein in the regenerated nerves and to detect the expression of neurotrophins including pleiotrophin (PTN), hepatocyte growth factor (HGF), vascular endothelial growth factor (VEGF) and glial cell line-derived neurotrophic factor (GDNF). Results The chitosan conduits filled with simvastatin/ pluronic F-127 promote nerve regeneration in rats. All groups showed the regenerated nerves, but H&E staining showed that the regenerated nerves in the simvastatin treated groups were much thicker than those without simvastatin; And the same trend was also found for the diameter of the myelinated axons, the thickness of the myelin sheath and G-ratio; In addition, the numbers of NF-positive cells indicating regenerated axons and S100-positive cells indicating Schwann cells were significantly larger in simvastatin treated groups than those without simvastatin. And immunohistochemical staining indicated that simvastatin induced an increased expression of PTN, HGF, VEGF and GDNF compared to those found in the control group. Conclusions Taken together, the simvastatin/ pluronic F-127 hydrogel filling in the chitosan conduits promoted the reconstruction of histological in peripheral nerve defects, which can be used for peripheral nerve regeneration.
Peripheral nerve injury; Simvastatin; Chitosan conduit; Pluronic F-127 hydrogel; Peripheral nerve regeneration
国家自然科学基金(81171693;81100895);国家高技术研究发展计划“863计划”(SS2015AA020304)。
郭琦(1989-),女,硕士生,研究方向:神经损伤、修复与重建。
徐迎胜(1971-)女,主任医师,副教授。 E-mail:xys@bjmu.edu.cn。
研究报告
R-332
A
1671-7856(2016) 05-0001-09
10.3969.j.issn.1671-7856. 2016.005.001
2016-03-28
