Fenton氧化降解苯胺及机制研究
2016-08-05王丽萍余美维
邹 红,王丽萍,余美维
(中国矿业大学 环境与测绘学院 ,江苏 徐州 221116)
Fenton氧化降解苯胺及机制研究
邹红,王丽萍,余美维
(中国矿业大学 环境与测绘学院 ,江苏 徐州 221116)
摘要:以苯胺(C6H7N)废水为处理对象进行Fenton氧化降解试验,考察pH、H2O2投加量、n(H2O2)/n(Fe2+)比值以及苯胺初始浓度对Fenton降解苯胺的影响,并分析其降解途径.结果表明:苯胺初始浓度为50~200 mg·L-1,pH=2~4,n(H2O2)/n(Fe2+)=10,n(H2O2)/n(C6H7N)=10~15,反应60 min苯胺去除率达75.4%~87.4%;若苯胺浓度大于600 mg·L-1,所需反应时间延长且降解率降低.检测发现苯胺降解需经过羟基化、取代、脱氢、开环产酸阶段,其中丁烯二酸为苯胺降解过程中产酸阶段重要的中间产物,且可生化性高,易降解.因此,认为在Fenton预处理苯胺过程中,可将苯胺降解到控制丁烯二酸阶段,以丁烯二酸作为后续生化处理目标污染物的处理方法有利于苯胺的完全矿化.
关键词:Fenton反应;苯胺;中间产物;丁烯二酸
苯胺(C6H7N)是重要的有机化工原料和精细化工中间体,具有毒性以及致畸和致癌作用,大量的生产和应用对环境造成了污染,也给人体带来了危害,因此苯胺废水降解的研究备受关注[1].目前主要处理方法是生物法[2],但因其可生化性不高而处理效果不佳[3].高级氧化技术是利用化学试剂产生具有强氧化能力的羟基自由基(·OH,E0=2.80 V),氧化降解有机污染物[4].Fenton法利用Fe2+与H2O2反应产生·OH(式1),具有原料易获取、反应速率快、处理效率高、操作简单灵活的优点[5],在预处理难降解有机物质上有较大的应用前景.
(1)
国内外有较多学者对苯酚、染料废水[6]等氧化降解机制进行了深入研究,对其降解产物也进行过较为全面的分析[7-8],而苯胺的降解机制还未有深入的分析.为了研究Fenton技术对苯胺的处理效果和降解规律,笔者以苯胺模拟废水为处理对象,以苯胺去除率和COD为考察指标,探究初始pH值、过氧化氢投加量、n(H2O2)/n(Fe2+)比值及苯胺初始浓度[6]对Fenton法降解苯胺的影响,确定最佳工艺条件,寻找降解途径和重要中间产物,为苯胺废水处理的工程应用提供参考.
1材料与方法
1.1实验方法
实验采用浓度为(100±2) mg·L-1的苯胺废水,反应装置如图1所示.反应器由电热套维持控制温度(30 ℃),取水样0.5 L,先后加入定量的催化剂(硫酸亚铁)和过氧化氢,在200 r·min-1转速下匀速搅拌、反应,考察苯胺、COD去除率和氧化还原电位(oxidation redox potential,简称ORP)随时间的变化.
图1 Fenton反应装置Fig.1 The reactor of Fenton process
1.2试剂与仪器
pH值和ORP分别用雷磁pH计(上海精科)、ORP测定仪(上海康仪,411型) 测定;COD用重铬酸钾法测定;H2O2的测定采用碘量法;苯胺浓度用N-(1-萘基)乙二胺偶氮分光光度法(GB11889-89)测定;Fe2+、Fe3+浓度用邻菲啰啉分光光度法(HJ/T345-2007)测定,实验所用可见光光度计为北京瑞利VIS-7220型.
气相色谱质谱联用仪为安捷伦公司7890-5975C型.色谱条件:DB-5MS(30 μM×0.25 mm×0.2 μM),载气为高纯氮气,流量比为1 mL·min-1,分流比为20∶1,进样1 μL,初始柱温为100 ℃,以20 ℃·min-1的速度升至290 ℃.质谱条件:离子源为EI源,电子能量为70 eV,离子源温度为200 ℃,离子扫描范围为50~300 amu.
2结果与讨论
2.1pH对苯胺降解的影响
当pH为2~4,反应结束时 ORP保持在500~600 mV,Fenton试剂对COD和苯胺去除率可维持较高水平,分别可达至50%,70%以上(如图2).尤其在pH为3.3条件下,COD、苯胺去除率为最高,分别达67.1%,87.4%.pH继续增大或者减少,COD和苯胺去除率都会随之下降,特别是pH大于7时,苯胺及COD的去除率可降至30%.
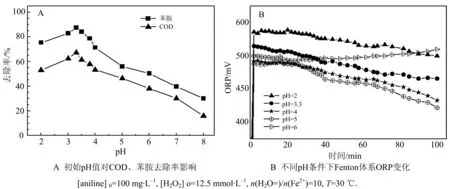
图2 不同初始pH对苯胺降解及Fenton 体系ORP的变化Fig.2 Effect of initial pH on aniline degradation and the ORP change of Fenton system
体系中Fe3+/Fe2+是ORP值的主要影响因素[9],ORP随着Fe3+/Fe2+浓度比的增加而增加.pH在4~6范围内,苯胺去除率降低但体系氧化还原电位仍高,原因是pH为4~6时不利于Fe3+水解,Fe3+的积累使Fe3+/Fe2+摩尔浓度比增大[10-11],体系ORP升高.但Fenton降解苯胺的核心是·OH,酸性条件有利于·OH的产生[12-13],因此,pH宜在2~4之间.
2.2n(H2O2)/n(Fe2+)比值对苯胺废水处理的影响
n(H2O2)/n(Fe2+)对苯胺降解的影响如图3A所示,n(H2O2)/n(Fe2+)为10∶1时,苯胺去除率和COD去除率达到最大值,分别为87.8%,66.8%.n(H2O2)/n(Fe2+)比例过大或过小都会造成苯胺和COD去除率下降,这是因为n(H2O2)/n(Fe2+)过小会导致Fenton体系中Fe2+相对过剩,多余Fe2+会与·OH发生反应生成Fe3+和OH-,造成了体系内·OH的消耗[14],而n(H2O2)/n(Fe2+)从10持续增大,使反应体系中铁催化剂浓度显著降低,抑制了H2O2的分解反应速度,不利于·OH的产生,使得该体系的氧化能力下降.
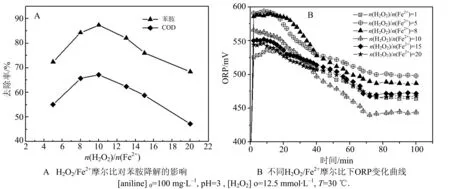
图3 不同H2O2/Fe2+摩尔比对苯胺降解及Fenton 体系ORP的变化Fig.3 Effect of n(H2O2)/n(Fe2+) on aniline degradation and the ORP change of Fenton system
从图3B观察体系内氧化还原状态,反应体系内ORP大于550 mV或小于500 mV,会引起铁离子浓度比值过高或过低,从而影响苯胺降解,因此ORP宜控制在500~550 mV,n(H2O2)/n(Fe2+)投加摩尔比宜为10.
2.3H2O2投加量对苯胺降解的影响
从图4A中可以看出,当 H2O2投加量从2.5 mmol·L-1增加到12.5 mmol·L-1时,COD和苯胺去除率分别从30.9%,37.2%升高至67.1%,87.4%.若H2O2投加量从12.5 mmol·L-1继续增加,苯胺以及COD去除率将不再增加反而有小幅度下降.不同的H2O2投加量会改变体系的ORP和苯胺降解率[15].如图4B所示,当 H2O2投加量在2.5~10 mmol·L-1时,ORP值随着反应的进行有所降低,并在约30min时达到稳定;若H2O2投加量大于12.5 mmol·L-1,整个反应过程中ORP的降低则不明显,苯胺降解完全后ORP仍可维持在550 mV以上,但苯胺去除率却随着H2O2投加量增加而降低.

图4 不同H2O2/Fe2+摩尔比对苯胺降解及Fenton 体系ORP的变化Fig.4 Effect of H2O2 concentration on aniline degradation and the ORP change of Fenton system
H2O2是体系中·OH的直接来源,在一定范围内,·OH越多则体系ORP越高,苯胺降解率也随之增大;但·OH处于过量时,·OH之间会发生内部反应[16],导致·OH与目标污染物的接触几率降低[17],从而抑制苯胺降解;此外,H2O2过量时反应体系转化以Fe3+的氧化为主[18],将削减·OH产率[19],削弱Fenton体系对水质中苯胺和COD的去除效果.氧化剂H2O2投加量是影响降解苯胺降解性能的重要因素,实验结果表明苯胺为100 mg·L-1时,12.5 mmol·L-1为H2O2最佳投加量.在实际工程中,综合考虑操作条件、废水处理效果和药剂成本,H2O2投加量宜在10~15 mmol·L-1.
2.4正交优化实验
上述实验中,只对单个因素进行了分析,为了研究各因素的相互作用,设计了三因素三水平的正交试验,三因素为pH、n(H2O2)/n(Fe2+)、H2O2,反应时间为90 min,其结果列于表1.
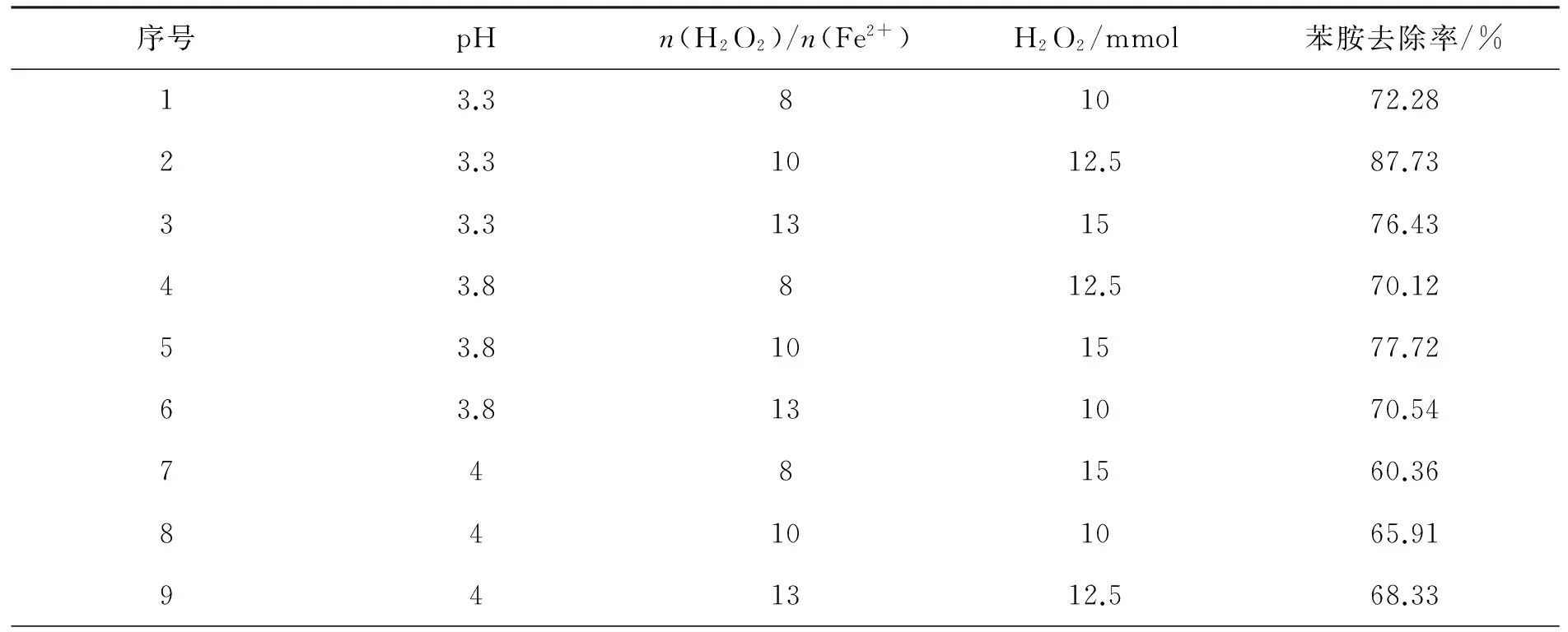
表1 正交试验结果

续表1
由表1分析可知,在这3个因素中,H2O2绝对投加量对体系的影响最大,初始pH值对体系的影响最小.由试验结果可以确定在试验号2的情况下,苯胺的去除率可以高达87.73%,是最优试验结果,因此认为pH=3.3,n(H2O2)/n(Fe2+)=10,H2O2投加量为12.5 mmol·L-1是Fenton降解苯胺的最优条件.
2.5苯胺浓度对Fenton 反应的影响
上述实验以100 mg·L-1苯胺废水为目标污染物浓度,为了探究苯胺初始浓度对Fenton降解苯胺的影响,保持上述最优条件pH=3.3,n(H2O2)/n(Fe2+)和n(H2O2)/n(C6H7N)比值分别为10,12.5,增加苯胺浓度测定苯胺降解率,实验条件如表2所示.反应结果如图5所示.

表2 苯胺的初始浓度所对应的反应条件
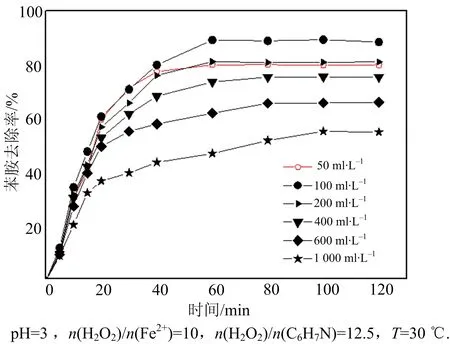
图5 苯胺初始浓度对苯胺去除率的影响Fig.5 Effect of Aniline concentration on aniline degradation
当pH=3.3、n(H2O2)/n(Fe2+)=10时,从理论上讲n(H2O2)/n(C6H7N)为12.5是充足的,前面的实验也已证实.然而,实验发现(图5)当苯胺浓度从50 mg·L-1增加至1 000 mg·L-1时,苯胺降解率从80.2%降至55.3%.苯胺浓度为50~200 mg·L-1,反应60 min后其去除率可达80%以上;若苯胺浓度高于600 mg·L-1,反应时间延迟至80 min,苯胺去除率低于60%.因为在高浓度溶液中分子数的增加会降低H2O2与Fe2+、·OH与苯胺及中间产物有效碰撞的几率[20],增加氧化剂的内耗,导致苯胺降解率大幅度降低,可见反应物的初始浓度对反应速率、反应程度有着重大影响.因此,在Fenton实际应用中,为了保证苯胺降解率,在高浓度苯胺废水处理中可进一步提高n(H2O2)/n(C6H7N)比值,增大体系H2O2相对含量.此外,还应采取分批投加 H2O2的方式,这样既可以保证产生的·OH的浓度,又能使H2O2得到充分利用,有效提高氧化降解的效率.
3Fenton降解苯胺途径分析
Fenton降解苯胺过程中溶液颜色会发生明显变化,1 min内变成浅红色,溶液的颜色随着H2O2量增加而变深成棕红色,随着反应的进行最终变为深黄色,这说明在苯胺降解过程中存在中间产物的生成与转化[15].在反应约10 min后将反应液迅速移入分液漏斗中,同时加入5 mL二氯甲烷萃取,振摇30 min,取下层有机相稀释10倍,过滤后用GC/MS 检测溶液中所含有机物质.除苯胺外,GC/MS检测到苯二酚和丁二烯(图6),经分析他们应该为中间产物,其相对分子质量分别为110和116,其结果与谢春娟等[12]的研究结果吻合.据理论分析苯胺降解过程中应该会产生氨基苯酚,但这种物质反应速率快而不易检测.

图6 苯胺降解产物苯二酚(110)(A)和丁烯二酸(116)(B)质谱图Fig.6 The mass spectrogram of benzenediol (A) and butenedioic acid (B)
·OH有极强的氧化性,但对有机物的进攻能力还与基团供电子能力的强弱有关.吸电子基团(如—NO2,—COOH等)则会抑制·OH的反应,而—NH2,—OH,—RO等供电子基团的存在则会提高·OH的进攻能力[19].苯胺的化学结构中的—NH2作为强给电子基团 ,增加了苯环的电子云密度,增强·OH对苯胺的进攻能力[21].因此,在氨基的作用下,苯环上首先发生羟基化反应(如式2),使苯胺转化为氨基苯酚.

(2)
羟基化过程是亲电子反应.羟基化有3种产物,邻氨基苯酚、间氨基苯酚和对氨基苯酚,邻位上电子云密度最高、还原性强,所以在邻位上发生羟基化几率最大.氨基苯酚的电子云密度较苯胺高,故氨基苯酚与·OH的作用速度很快,在实验中很难捕捉到氨基苯酚.
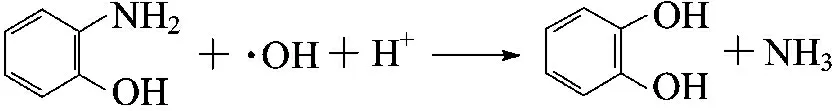
(3)
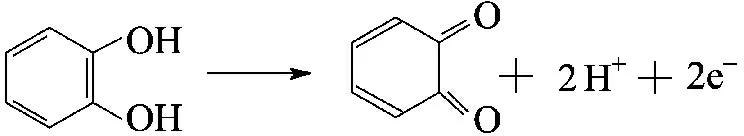
氨基苯酚中—NH2被—OH取代进一步生成苯二酚(式3).·OH可以进一步进攻苯二酚与其发生反应,使苯环分裂,形成小的分子酸或醛类[22].苯二酚是一种极强的还原剂,在·OH强氧化作用下发生脱氢反应,生成邻苯醌(式4)和对苯醌.根据价键原理,不存在间苯醌,无法生成两个双键,因此间苯二酚反应生成对苯醌.醌类结构也不稳定, Fenton体系中的·OH进一步攻击苯环,使其开环进一步氧化为丁烯二酸.
(4)
丁烯二酸的可生化性能相较于苯胺要高[23], 在苯胺与丁烯二酸之间,·OH会优先选择与苯胺反应,这是因为与苯胺的反应速率常数相对较大[23-24],因此,根据化学动力学理论可知[25-26],在 Fenton试剂的催化降解中,若H2O2和Fe2+量充足时,含有足够量的羟基自由基·OH,可以使中间产物进一步降解(图7),最终矿化为二氧化碳和水[27-28]; 当H2O2和Fe2+的量不足时,苯胺不能被完全矿化,而苯胺却可以得到很好的去除,从上述实验中也可以看出,苯胺的去除率很高,而COD的去除率略低,反应终止于产酸阶段.因此,在苯胺降解过程中丁烯二酸是关键的中间产物,Fenton预处理苯胺的产物可控制到丁烯二酸产酸阶段,进行生化处理.

图7 苯胺降解途径Fig.7 Degradation path of aniline
4结论与建议
(1) 在苯胺浓度为50~200 mg·L-1条件下,pH为3.3,n(H2O2)/n(Fe2+)=10,H2O2投加量为12.5 mmol·L-1,反应60 min后苯胺的降解率趋于稳定,最高可达87%;随着苯胺浓度的增高,体系内·OH的内耗作用增强,降解率逐渐降低,反应时间延迟至80 min,对此,可增大氧化剂的量,通过提高n(H2O2)/n(C6H7N)比值来保证苯胺降解效果.
(2) Fenton降解苯胺途径分析:在酸性环境下,·OH与苯胺发生羟基化、取代反应生成氨基苯酚和苯二酚,脱氢生成苯醌类物质,并进一步使苯环开环产生丁烯二酸,通过控制条件使反应终止于产酸阶段.
(3) 工程应用中,苯胺类废水可采用Fenton氧化与微生物技术联合处理, Fenton氧化反应控制至产丁烯二酸阶段,以丁烯二酸为后续微生物处理的目标物,进一步被氧化为二氧化碳和水.关于苯胺降解过程中丁烯二酸的积累及其影响因素值得进一步研究,以便开发Fenton联合生物法处理难降解有机废水方法与技术.
参考文献:
[1]马祥麟, 付爱萍. 苯胺工业废水处理技术新进展[J]. 化学工程与装备, 2012 (7): 139-141.
[2]王哲, 魏利, 马放, 等. 苯胺废水SBR工艺生物强化处理效能[J]. 哈尔滨工业大学学报, 2010, 6 (6): 949-953.
[3]王治业, 祝英, 季彬, 等. 生物强化技术处理苯胺废水难降解有机物的研究[J]. 环境工程, 2014, 32 (S1): 16-18.
[4]袁凤英, 秦清风. UV助Fenton高级氧化技术处理黑索今废水研究[J]. 中北大学学报 (自然科学版), 2006, 27 (6): 511-514.
[5]林恒, 张晖. 电-Fenton及类电-Fenton技术处理水中有机污染物[J]. 化学进展, 2015, 27 (8): 1123-1132.
[6]张先炳, 袁佳佳, 董文艺, 等. 芬顿法处理活性艳红X-3B的试验优化及降解规律[J]. 化工学报, 2013, 64 (3): 1049-1054.
[7]ZHANG C, ZHOU M , REN G B. Heterogeneous electro-Fenton using modified iron-carbon as catalyst for 2,4-dichlorophenol degradation: Influence factors,mechanism and degradation pathway[J]. Water Research, 2015, 70: 414-424.
[8]MATIRA E M, CHEN T C, LU M C, et al. Degradation of dimethyl sulfoxide through fluidized-bed Fenton process[J]. Journal of Hazardous Materials, 2015, 300: 218-226.
[9]高迎新, 张昱, 杨敏. Fenton反应中氧化还原电势的变化规律[J]. 环境化学, 2004, 23 (2): 135-139.
[10]褚衍洋, 李玲玲, 付融冰. Fenton试剂氧化苯酚过程中Fe(Ⅱ)浓度的变化[J]. 环境工程学报, 2008, 2 (8): 1057-1061.
[11]ANOTAI J, SU C C, TSAI Y C, et al. Effect of hydrogen peroxide on aniline oxidation by electro-Fenton and fluidized-bed Fenton processes[J]. Journal of Hazardous Materials, 2010, 183 (1): 888-893.
[12]谢春娟, 朱琨, 李剑. Fenton试剂氧化苯胺的影响因素及机理研究[J]. 净水技术, 2007, 26 (2): 13-15.
[13]LIU Q Y, LIU Y X, LU X J. Combined photo-Fenton and biological oxidation for the treatment of aniline wastewater[J]. Procedia Environmental Sciences, 2012, 25 12: 341-348.
[14]高迎新, 杨敏, 王东升, 等. Fenton反应中水解Fe(Ⅲ)的形态分布特征研究[J]. 环境科学学报, 2002, 25 (5): 551-556.
[15]邹寒, 王树涛, 尤宏, 等. 湿式过氧化氢催化氧化降解喹啉及其机理[J]. 化工学报, 2014, 65 (11): 4400-4405.
[16]程丽华, 黄君礼, 倪福祥. Fenton试剂生成·OH的动力学研究[J]. 环境污染治理技术与设备, 2003, 4 (5): 12-14.
[17]汪昆平, 杨林, 汪春艳, 等. Fenton氧化体系·OH、ORP、H2O2和Fe2+变化特征[J]. 水处理技术, 2011, 37 (12): 36-41.
[18]HE S L, WANG L P, ZHANG J, et al. Fenton pre-treatment of wastewater containing nitrobenzene using ORP for indicating the endpoint of reation[J]. Procedia Earth and Planetary Science, 2009, 1 (1): 1268-1274.
[19]董蓓, 颜家保, 庄容, 等. Fenton试剂·OH生成率的影响因素研究[J]. 化学工程师, 2009 (3): 14-16.
[20]李亚峰, 朱爱霞, 姚敬博, 等. UV/Fenton法处理废水中苯酚[J]. 沈阳建筑大学学报 (自然科学版),2008 ,24 (4): 637-640.
[21]林春绵, 王军良, 徐明仙, 等. 磺酸萘在超临界水中氧化降解路径的研究[J]. 高校化学工程学报, 2005, 19 (1): 103-107.
[22]卞文娟, 周明华, 雷乐成. 高压脉冲液相放电降解水中邻氯苯酚[J]. 化工学报, 2005, 56 (1): 152-156.
[23]WU X, ZHANG T, ZHAO J, et al. Photodegradation of a dye in the presence of Fe3+/H2O2under visible light irradiation[J]. Chem Lett, 1998, 6: 857-858.
[24]LIN S H, LO C C. Fenton process for treatment of desizing wastewater[J]. Wat Res, 1997, 31 (8): 2050-2056.
[25]TOKUMURA M, MORITO R, HATAYAMA R, et al. Iron redox cycling in hydroxyl radical generation during the photo-Fenton oxidative degradation: dynamic change of hydroxyl radical concentration[J]. Applied Catalysis B: Environmental, 2011, 106 (3): 565-576.
[26]GALANO A, MARTNEZ A. Capsaicin, a tasty free radical scavenger: mechanism of action and kinetics[J]. Journal of Physical Chemistry B, 2012, 116 (3):1200-1208.
[27]MASOMBOON N, RATANATAMSKUL C, LU M C. Kinetics of 2,6 -dimethylaniline oxidation by various Fenton processes[J]. Journal of Hazardous Materials, 2011, 192 (1): 347-353.
[28]ZIMBRON J A, REARDON K F. Continuous combined Fenton’s oxidation and biodegradation for the treatment of pentachlorophenol-contaminated water[J]. Water Research, 2011, 45 (17): 5705-5714.
(责任编辑于敏)
doi:10.3969/j.issn.1000-2162.2016.04.016
收稿日期:2015-11-12
基金项目:江苏高校优势学科建设工程资助项目
作者简介:邹红(1993-),女,重庆人,中国矿业大学硕士研究生;*王丽萍(通信作者),中国矿业大学教授,博士生导师,E-mail:15062129650@163.com.
中图分类号:X703.1
文献标志码:A
文章编号:1000-2162(2016)04-0101-08
Research of aniline degradation and mechanism in Fenton process
ZOU Hong, WANG Liping, YU Meiwei
(School of Environment Science and Spatial Informatics, China University of Mining and Technology, Xuzhou 221116, China)
Abstract:Based on the C6H7N wastewater, a series of experiments referring to the Fenton oxidative degradation were conducted, and all of the following were investigated, including the dosage of pH, H2O2, the ration of n(H2O2)/n(Fe2+), and the initial concentration of aniline, in addition, the degradation pathways of aniline were also analyzed. It turned out that when the concentration of aniline was between 50 mg·L-1and 200 mg·L-1, the pH ranged from 2 to 4, and the n(H2O2)/n(C6H7N) was between 10 and 15, the aniline removal was from 75.38% to 87.38% after the reaction about 60 minutes; when the concentration of aniline exceeded 600 mg·L-1, the reaction time could be extended and the removal rate was decreased. After the investigating, the degradation of aniline included four stages, the hydroxylation, substitution, dehydrogenation and ring opening. Regarding that the butenedioic acid played a crucial role in the aniline degradation process and was with high biodegradability, the new idea that the butenedioic acid was not only the expected production, but also was target pollutants as in the subsequent targets of bio-treatment was advised, which was beneficial to aniline mineralization.
Keywords:Fenton process; aniline; intermediate; butenedioic acid
