胶质瘤中STAT3通路及其负调控因子PIAS3活化状态和生物学效应的分析
2016-08-05张朋孙铮刘哲宇李阳
张朋,孙铮,刘哲宇,李阳
(大连医科大学1.基础医学院细胞生物学教研室,辽宁 大连 116044;2.中西医结合基础研究所,辽宁 大连 116044;3.附属第一医院神经外科,辽宁 大连 116011)
胶质瘤中STAT3通路及其负调控因子PIAS3活化状态和生物学效应的分析
张朋1,孙铮2,刘哲宇2,李阳3
(大连医科大学1.基础医学院细胞生物学教研室,辽宁 大连 116044;2.中西医结合基础研究所,辽宁 大连 116044;3.附属第一医院神经外科,辽宁 大连 116011)
目的探讨STAT3信号通路及其负调控因子PIAS3在胶质瘤细胞中的活化状态及生物学效应。方法采用免疫组织化学方法检测胶质瘤中p⁃STAT3及PIAS3的活化状态;STAT3通路抑制剂60 μmol/L AG490作用胶质瘤U118、U87细胞24、48 h,MTT法观察U118、U87细胞增殖能力的变化;免疫荧光检测AG490作用前后细胞p⁃STAT3及PIAS3蛋白表达的变化。结果p⁃STAT3及PIAS3在不同级别胶质瘤细胞胞质和胞核内的表达无统计学差异,但在细胞核内p⁃STAT3和PIAS3的表达呈负相关;AG490处理细胞后,U118细胞数量无明显改变,U87细胞则表现为生长抑制。免疫荧光结果显示,AG490处理后,U118细胞p⁃STAT3和PIAS3表达水平均无显著改变,U87细胞p⁃STAT3核内表达下调,PIAS3出现明显核易位。结论PIAS3通过核易位调控STAT3信号通路的活性,抑制胶质瘤细胞生长。
胶质瘤;STAT3信号通路;PIAS3;AG490
网络出版地址
胶质瘤是神经间质细胞,即神经胶质前体细胞,向成熟方向分化时受阻所致。研究[1⁃3]发现,胶质瘤中存在多个信号转导通路的异常活化,其中STAT信号通路是最重要的1条。STAT家族中以JAK⁃STAT3信号通路表现最为活跃,这条信号通路主要由3部分组成:酪氨酸激酶相关受体、酪氨酸激酶JAK和转录激活因子STAT3。STAT3通常以无活性的单体形式存在于细胞质中,当其酪氨酸磷酸化后激活,活化的STAT3以二聚体形式进入细胞核与下游靶基因结合,调控基因的转录。STAT3持续激活常继发于异常的上游信号或内源性调节因子的缺失,导致肿瘤发生和异常生长。目前除药物学手段抑制STAT3,内源性负调控因子也成为研究热点。
PIAS是STAT3的活化抑制蛋白,包含4个成员PIAS1、PIAS3、PIASx和PIASy。其中PIAS3是最为重要的成员之一。当细胞受到外界刺激时,PIAS3可与活化的STAT3二聚体结合,阻断STAT3与DNA相互作用,抑制STAT3信号通路活性。目前,STAT3已成为恶性胶质瘤间质转化的重要引发剂和调节点[4⁃5],但不同恶性级别胶质瘤STAT3及其负调控因子PIAS3的表达和活化特点及其活化程度与肿瘤进展的联系及相关性目前尚不清楚。本研究通过观察胶质瘤细胞中STAT3信号通路的活化状态以及PIAS3的表达特点,分析各因子在不同恶性程度胶质瘤中的表达规律及其与肿瘤进展的联系,分析PIAS3与STAT3核易位的相关性,并通过体外实验进一步证实,为制定胶质瘤关键靶点的治疗策略提供分子生物学实验依据。
1 材料与方法
1.1材料
1.1.1细胞:人胶质母细胞瘤石蜡包埋组织由大连医科大学附属第一医院提供;人胶质母细胞瘤U118、U87细胞系购自上海中科院细胞库。
1.1.2主要试剂:DMEM培养基、胎牛血清、HEPES缓冲液、胰酶、L⁃谷氨酰胺、青霉素-链霉素(美国GIBCO公司);AG490(美国Sigma公司);兔抗人多克隆PIAS3抗体、兔抗人多克隆p⁃STAT3抗体(美国Santa Cruz公司);FITC标记山羊抗兔IgG(H+L)(ZF⁃0311)、罗丹明标记山羊抗兔IgG(H+L)(ZF⁃0316)(北京中杉金桥公司);免疫组化试剂盒SP⁃9000(通用SP kit)(北京中杉生物技术有限公司,系美国Zymed公司进口分装)。
1.2方法
1.2.1细胞培养:胶质瘤细胞系U118、U87用含10%胎牛血清DMEM培养液培养于37℃、5%CO2温育箱。待其贴壁生长至70%~80%融合时,用0.25%胰酶进行消化、传代。
1.2.2细胞爬片制备:将U118、U87细胞接种于培养皿之前,预先在皿底铺数张已灭菌的盖玻片(直径5 mm)。待细胞生长稳定后,弃培养液,分别加入含60 μmol/L AG490的新鲜培养液,同时平行设置正常培养组作为对照。每12 h于倒置显微镜下观察细胞形态变化,并用数码相机照相,持续观察24 h、48 h。取出盖玻片,浸入1×PBS(pH7.4)中洗3次,5 min/次,然后用100%冷丙酮-20℃固定20 min,自然风干,用于免疫荧光分析。
1.2.3细胞增殖检测:将U118、U87细胞接种于96孔培养板中(2.0×103/mL),分别设立对照组和给药组(60 μmol/L AG490),每组均设4个平行孔。继续培养至24 h、48 h。每孔加MTT(5 mg/mL)20 μL混匀,继续培养4 h,离心弃上清,每孔加150 μL DMSO,酶标仪测吸光度值(D490nm)。计算相对抑制率(%)=(1-实验组D值/对照组D值)×100%。
1.2.4免疫荧光测定:取出细胞爬片,1×PBS (pH7.4)洗3次,用含10%山羊血清的PBS封闭20 min;分别加入不同工作浓度的一抗(p⁃STAT3 1∶80,PIAS3 1∶100),4℃湿盒中过夜;在暗室避光条件下加入绿色荧光素标记山羊抗兔p⁃STAT3及红色荧光素标记山羊抗兔PIAS3二抗,37℃湿盒中孵育60 min;暗室中,细胞片用PBS洗3遍,经抗荧光淬灭封片液封片后,于荧光显微镜下观察并数码成像。图像处理采用Adobe Photoshop 8.0软件完成。
1.3统计学分析
采用SPSS11.5统计软件对数据进行分析。采用Mann⁃Whitney分析p⁃STAT3和PIAS3在不同级别胶质瘤组织中胞质/胞核的表达差异,采用Spear⁃man Rank Correlation分析p⁃STAT3与PIAS3在胶质瘤组织胞质与胞核表达的相关性,采用Independent Ttest统计学方法分析AG490处理前后2组细胞增殖的改变。P<0.05为差异有统计学意义。
2 结果
2.1STAT3及PIAS3在不同级别胶质瘤组织中的表达情况
应用所制备的石蜡组织,对人胶质瘤组织中p⁃STAT3和PIAS3蛋白的表达进行免疫组织化学染色,对结果进行统计与分析。结果显示,比较p⁃STAT3或PIAS3在Ⅰ~Ⅳ级胶质瘤细胞胞质和胞核中的表达水平,均无统计学差异(P>0.05)。见表1、2。
对p⁃STAT和PIAS3蛋白在人胶质瘤组织中表达情况的相关性进行统计分析,结果表明,人胶质瘤组织中胞质内STAT3和PIAS3的表达无相关性,而胞核内p⁃STAT3和PIAS3的表达呈负相关,有统计学意义(胞质内:r=0.005,P=0.958;胞核内:r= -0.213,P=0.038)。见表3。
2.2AG490对U118、U87细胞增殖的影响
MTT检测结果显示:与对照组相比,60 μmol/LAG490对U118细胞的增殖无明显抑制作用,而U87细胞的增殖则受到明显抑制,且受抑制程度呈时间依赖性,见表4。
2.3免疫荧光检测AG490对U118、U87细胞p⁃STAT3及PIAS3表达的影响
正常培养条件下,p⁃STAT3在U118、U87细胞质和胞核中呈阳性表达。经60 μmol/L AG490处理48 h后,U118细胞质和胞核中p⁃STAT3变化不明显,U87细胞核中p⁃STAT3表达水平降低(图1,绿色荧光)。
正常培养条件下,STAT3的抑制因子PIAS3分布于胞质和胞核中。经60 μmol/L AG490处理后,U118细胞中PIAS3表达水平未出现明显的变化,而U87细胞则表现出PIAS3表达水平增高,并呈现明显核易位(图1,红色荧光)。
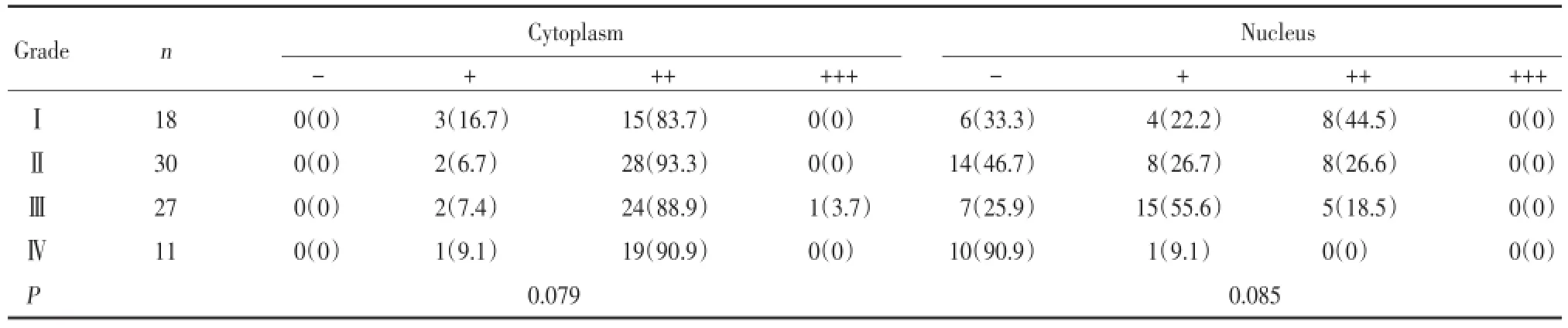
表1 p⁃STAT3在不同级别胶质瘤组织中的表达[n(%)]Tab.1 Expression of p⁃STAT3 in various grades of glioma tissues[n(%)]

表2 PIAS3在不同级别的胶质瘤组织中的表达[n(%)]Tab.2 Expression of p⁃STAT3 in various grades of glioma tissues[n(%)]
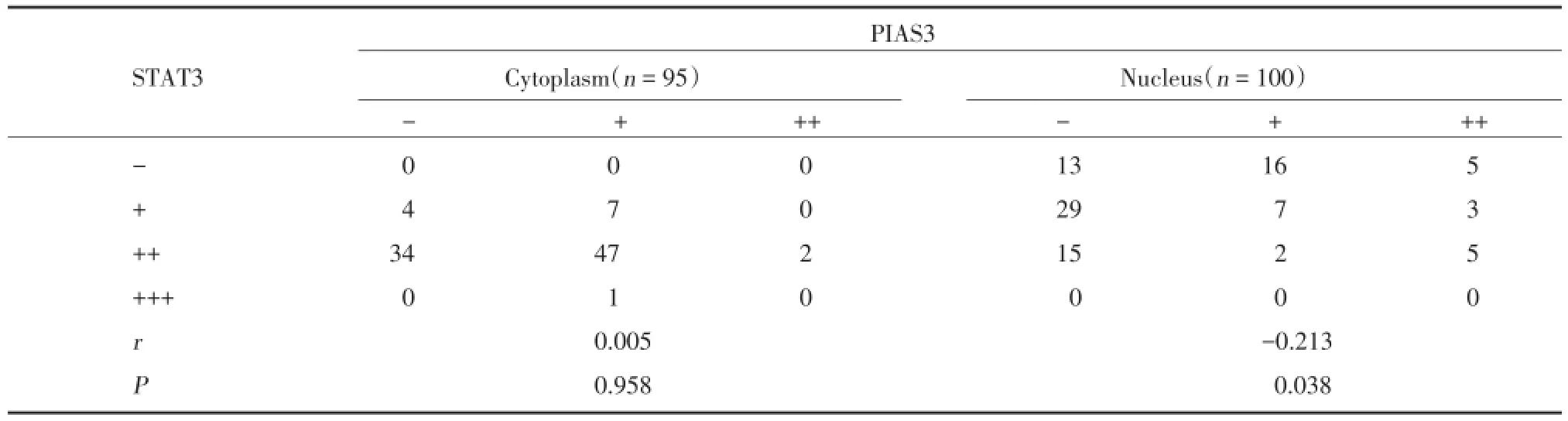
表3 人胶质瘤组织中p⁃STAT3和PIAS3表达的相关性(n)Tab.3 Analysis of the correlation with the status of p⁃STAT3 and PIAS3 in glioma tissues(n)
3 讨论
胶质瘤是最常见的原发性脑肿瘤之一,WHO将其恶性程度由低至高分为Ⅰ~Ⅳ级。胶质瘤具有生长迅速、侵袭力强等特点,故手术难以根除,预后差。研究发现,胶质瘤发病中存在多个信号通路异常活化,其中JAK/STAT3信号通路在胶质瘤发生发展过程中起重要作用。正常情况下,STAT3活化短暂且可调节,但在肿瘤中STAT3持续活化,导致肿瘤细胞无限增殖[6-7]。目前,导致STAT3信号通路异常活化的原因尚未清楚。已知的在脑肿瘤中正向调控STAT3信号通路活化的因子有很多,但特异性差[8⁃9]。因此,研究STAT3的特异性调控因子,特别是负向调控因子,具有重要的肿瘤治疗学意义。
PIAS3是STAT3的激活蛋白抑制剂,结合磷酸化STAT3的二聚体,影响磷酸化STAT3在胞核内激活下游基因发挥作用。研究[10⁃12]证实,PIAS3不仅能抑制肿瘤细胞的生长,也能增加肿瘤细胞对化疗药物的敏感性。尽管大部分研究表明肿瘤组织或癌细胞中PIAS3的表达显著降低甚至出现表达缺失,然而WIBLE等[13]发现前列腺癌及肝癌等肿瘤组织中PIAS3表达水平比正常组织高。提示PIAS3在某些肿瘤中的高表达可能抑制活化的STAT3,与STAT3形成自调节反馈环,即STAT3在活化的同时也诱导了其自身的抑制剂PIAS3的高表达。本研究结果发现,胶质瘤的恶性程度与p⁃STAT3和PIAS3在胞质/胞核的分布水平间无统计学差异(P>0.05)。Ⅰ~Ⅳ级胶质瘤细胞核中,PIAS3与p⁃STAT3蛋白的表达水平呈负相关,而胞质中二者无相关性。提示PIAS3是否发生核易位是其发挥对STAT3抑制作用的关键。
为了进一步验证上述结论,本研究以胶质瘤细胞系U118和U87细胞作为研究模型,采用60 μmol/L AG490(STAT3信号通路抑制剂)分别处理24 h和48 h,MTT检测药物处理前后细胞增殖情况。结果表明,AG490作用后,U118细胞数量变化不明显;而相同处理条件下U87细胞则表现为明显的生长抑制。进一步的免疫荧光检测结果显示,AG490作用后,U118细胞中p⁃STAT3和PIAS3表达水平均无显著改变,U87细胞则表现出p⁃STAT3核内表达下调,PIAS3表现出明显核易位。因此,推测PIAS3通过核易位调控STAT3的活性,从而抑制胶质瘤细胞生长。
除了PIAS3以外,目前发现STAT3信号通路的负向调控因子还包括细胞因子信号转导抑制分子和蛋白酪氨酸磷酸酶,上述蛋白在不同环节特异性抑制STAT3信号通路,并与细胞恶性转化存在密切联系[14⁃15]。针对这些蛋白在胶质瘤中的表达特点、生物学功效及肿瘤治疗学价值有待于进一步探究。
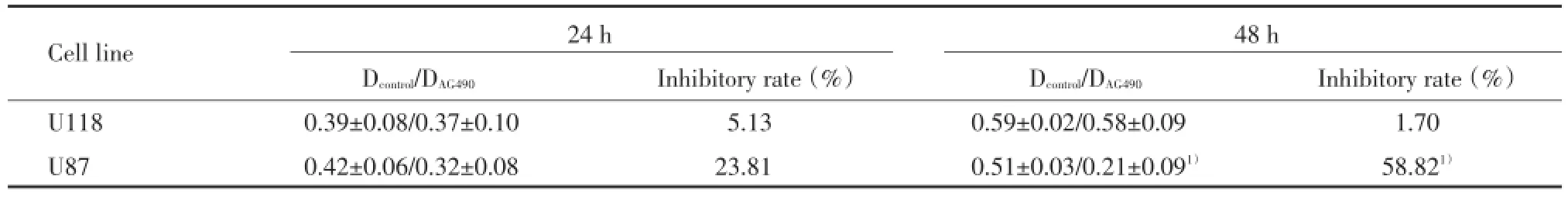
表4AG490对U118和U87细胞增殖的影响Tab.4 Effect of AG490 on cell proliferation in U118 and U87 cells

图1 免疫荧光检测AG490处理前后U118和U87细胞中p⁃STAT3和PIAS3的表达情况Fig.1 The expression of p⁃STAT3 and PIAS3 in U118 and U87 cells before and after AG490 treatment by immunofluo⁃rescence
[1]GURSEL DB,CONNELL YS,TUSKAN RG,et al.Control of prolif⁃eration in astrocytoma cells by the receptor tyrosine kinase/PI3K/ AKT signaling axis and the use of PI⁃103 and TCN as potential anti⁃astrocytoma therapies[J].Neuro Oncol,2011,13(6):610-621. DOI:10.1093/neuonc/nor035.
[2]WICK W,WELLER M,WEILER M,et al.Pathway inhibition:emerging molecular targets for treating glioblastoma[J].Neuro On⁃col,2011,13(6):566-579.DOI:10.1093/neuonc/nor039.
[3]NG JM,CURRAN T.The Hedgehog′s tale:developing strategies fortargeting cancer[J].Nat Rev Cancer,2011,11(7):493-501.DOI:10.1038/nrc3079.
[4]SENFT C,PRIESTER M,POLACIN M,et al.Inhibition of the JAK⁃2/STAT3 signaling pathway impedes the migratory and invasive po⁃tential of human glioblastoma cells[J].J Neurooncol,2011,101 (3):393-403.DOI:10.1007/s11060⁃010⁃0273⁃y.
[5]RAHAMAN SO,HARBOR PC,CHERNOVA O,et al.Inhibition of constitutively active Stat3 suppresses proliferation and induces apoptosis in glioblastoma multiformecells[J].Oncogene,2002,21 (55):8404-8413.DOI:10.1038/sj.onc.1206047.
[6]FURTEK SL,BACKOS DS,MATHESON CJ,et al.Strategies and approaches of targeting STAT3 for cancer treatment[J].ACS Chem⁃Biol,2016,11(2):308-318.DOI:10.1021/acschembio.5b00945.
[7]CHAI EZ,SHANMUGAM MK,ARFUSO F,et al.Targeting tran⁃scription factor STAT3 for cancer prevention and therapy[J].Phar⁃macol Ther,2016,162:86-97.DOI:10.1016/j.pharmthera.2015. 10.004.
[8]BALL S,LI C,LI PK,et al.The small molecule,LLL12,inhibits STAT3 phosphorylation and induces apoptosis in medulloblastoma and glioblastoma cells[J].PLoS One,2011,6(4):e18820.DOI:10.1371/journal.pone.0018820.
[9]CARMIGNANI M,VOLPE AR,ALDEA M,et al.Glioblastoma stem cells:a new target for metformin and arsenic trioxide[J].J Biol Regul Homeost Agents,2014,28(1):1-15.
[10]BORGHOUTS C,TITTMANN H,DELIS N,et al.The intracellular delivery of a recombinant peptide derived from the acidic domain of PIAS3 inhibits STAT3 transactivation and induces tumor cell death[J].Mol Cancer Res,2010,8(4):539-553.DOI:10.1158/ 1541⁃7786.MCR⁃09⁃0417.
[11]LIU LM,YAN MG,YANG DH,et al.PIAS3 expression in human gastric carcinoma and its adjacent non⁃tumor tissues[J].Clin Res Hepatol Gastroenterol,2011,35(5):393-398.DOI:10.1016/j. clinre.2010.12.002.
[12]SHI L,WAN Y,SUN G,et al.miR⁃125b inhibitor may enhance the invasion⁃prevention activity of temozolomide in glioblastoma stem cells by targeting PIAS3[J].Bio Drugs,2014,28(1):41-54. DOI:10.1007/s40259⁃013⁃0053⁃2.
[13]WIBLE BA,WANG L,KURYSHEV YA,et al.Increased K+efflux and apoptosis induced by the potassium channel modulatory pro⁃tein KChAP/PIAS3beta in prostate cancer cells[J].J Biol Chem,2002,277(20):17852-17862.DOI:10.1074/jbc.M201689200.
[14]GAO H,WARD PA.STAT3 and suppressor of cytokine signaling 3:potential targets in lung inflammatory responses[J].Expert Opin Ther Targets,2007,11(7):869-880.DOI:10.1517/1472822 2.11.7.869.
[15]LEE JH,CHIANG SY,NAM D,et al.Capillarisin inhibits constitu⁃tive and inducible STAT3 activation through induction of SHP⁃1 and SHP⁃2 tyrosine phosphatases[J].Cancer Lett,2014,345(1):140-148.DOI:10.1016/j.canlet.2013.12.008.
(编辑王又冬)
Activation Status and Biological Effects Analysis of STAT3 Signaling Pathway and
Its Negative Regulator PIAS3 in Gliomas
ZHANG Peng1,SUN Zheng2,LIU Zheyu2,LI Yang3
(1.Department of Biology,College of Basic Medical Sciences,Dalian Medical University,Dalian 116044,China;2.Institute of Integrative Medicine,Dalian Medical University,Dalian 116044,China;3.The First Affiliated Hospital of Dalian Medical University,Dalian 116011,China)
ObjectiveTo discuss the activation and biological effects of STAT3 signaling pathway and its negative regulator PIAS3 in glioma cells.MethodsImmunohistochemistry(IHC)was used to test the expression of p⁃STAT3 and PIAS3 in gliomas.AG490(60 μmol/L),the in⁃hibitor of STAT3 signaling pathway,was used to treat U118 and U87 cells for 24/48 h,and the method of MTT assay was taken to evaluate the pro⁃liferation after AG490 treatment.The expression of p⁃STAT3 and PIAS3 was also examined by immunofluorescence(IF).ResultsThere was no obvious significance between p⁃STAT3 and PIAS3 in nuclei or cytoplasm at different grades of gliomas.Whereas,p⁃STAT3 and PIAS3 were nega⁃tively correlated in the nuclei of vary grades malignancy gliomas.After AG490 treatment,U118 cells showed no obvious quantitative changes.How⁃ever,U87 cells showed obvious growth inhibition.IF results showed that there was no significant change at the levels of p⁃STAT3 and PIAS3 after AG490 treatment in U118 cells.However,the expression of p⁃STAT3 in the nuclei was down⁃regulated,and PIAS3 showed obvious nuclear translo⁃cation in U87 cells.ConclusionNuclear translocation of PIAS3 plays the key role in modulating JAK/STAT signaling activation and inhibiting glioma cells proliferation.
glioma;STAT3 signaling pathway;PIAS3;AG490
R739.4
A
0258-4646(2016)08-0719-05
10.12007/j.issn.0258⁃4646.2016.08.012
中国博士后科学基金面上项目(2013M541232)
张朋(1979-),女,讲师,博士研究生.
孙铮,E-mail:sunclank@163.com
2016-03-09
网络出版时间:
