胶质瘤3D ASL灌注指数与VEGF MVD表达相关性研究
2016-08-04王子文杨本强刘文源徐猛张连雪徐志华段阳
王子文 杨本强 刘文源 徐猛 张连雪 徐志华 段阳
胶质瘤3D ASL灌注指数与VEGF MVD表达相关性研究
王子文①杨本强②刘文源②徐猛③张连雪①徐志华①段阳②
目的:探究胶质瘤磁共振三维动脉自旋标记成像(three dimensional arterial spin labeling,3D ASL)肿瘤实质相对血流量(rel⁃ative cerebral blood flow,rCBF)与血管内皮生长因子(vascular endothelial growth factor,VEGF)、微血管密度(micro vessel density,MVD)表达程度的相关性。方法:回顾性分析沈阳军区总医院2014年8月至2016年2月53例经术后病理证实的胶质瘤患者,术前行MR平扫、增强、3D ASL扫描,术后行VEGF、MVD表达程度检测,分析胶质瘤肿瘤实质rCBF与VEGF、MVD表达的关系。结果:胶质瘤肿瘤实质rCBF分别与VEGF、MVD表达呈正相关(rs值分别为0.728、0.620,P<0.05)。结论:胶质瘤肿瘤实质rCBF值与VEGF、MVD表达呈正相关,说明3D ASL灌注成像技术有助于评估胶质瘤微血管生成情况,对临床制定适当的治疗计划和患者预后评估有一定意义。
胶质瘤三维动脉自旋标记血管内皮生长因子微血管密度血管生成
胶质瘤是颅内最常见的原发恶性肿瘤,其边缘常与瘤周正常脑组织的分界不清[1],胶质瘤对周围正常脑组织的侵袭主要受胶质瘤生物学行为的影响,其中肿瘤新生微血管的生成是最主要的影响因素之一[2-3]。目前临床上评价胶质瘤血管生成主要依靠检测血管内皮生长因子(vascular endothelial growth fac⁃tor,VEGF)或肿瘤微血管密度(microvessel density,MVD)。病理检测是评价胶质瘤新生血管情况的金标准,但需术后对肿瘤组织进行病理检测,而穿刺活检又不能准确评估肿瘤整体恶性程度的情况,因此对VEGF、MVD表达程度的检测评估胶质瘤血管生成情况缺乏术前指导意义。而胶质瘤磁共振三维动脉自旋标记成像(three dimensional arterial spin labeling,3D ASL)可以不使用外源对比剂获得体内的血流灌注情况,对术前评估胶质瘤血管生成情况具有一定临床意义。
本研究通过胶质瘤肿瘤实质相对血流量(rela⁃tive cerebral blood flow,rCBF)与VEGF、MVD表达程度的相关性进行比较分析,旨在说明3D ASL灌注成像术前评估胶质瘤微血管生成情况,有利于临床制定更准确的治疗方案和患者预后的评价。
1 材料与方法
1.1病例资料
回顾性分析沈阳军区总医院2014年8月至2016年2月期间,经术后病理确诊为胶质瘤的53例患者。其中男性32例,女性21例,年龄为18~78岁,平均年龄为51.6岁。据世界卫生组织(WHO)中枢神经系统肿瘤分类标准(2007年),将患者分为低级别组(Ⅰ、Ⅱ级)28例、高级别组(Ⅲ、Ⅳ级)25例。
2 结果
2.1胶质瘤3D ASL灌注成像特征
53例胶质瘤患者均获得满意的3D ASL CBF图,其中低级别胶质瘤28例,肿瘤实质rCBF值为1.19± 0.29,呈相对低血流量灌注病灶以蓝黑色成分为主(图1);高级别胶质瘤25例,肿瘤实质rCBF值为3.28±0.89,呈相对较高血流量灌注病灶以红色成分为主(图2)。
2.2高、低级别组胶质瘤肿瘤实质rCBF比较
在53例胶质瘤患者中,高级别组胶质瘤肿瘤实质rCBF高于低级别组,差异具有统计学意义(P<0.05,表1)。
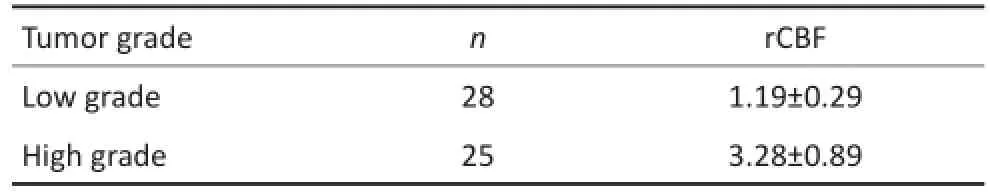
表1 高、低级别组胶质瘤肿瘤实质rCBF的比较Table 1 Comparison of rCBF between the high-and low-grade glioma groups
2.3 高、低级别组胶质瘤VEGF、MVD表达程度的比较
高、低级别组胶质瘤之间的VEGF、MVD表达经比较,差异均具有统计学意义(P<0.05,表2、3)。
2.4胶质瘤肿瘤实质rCBF值与VEGF、MVD表达的关系
肿瘤实质rCBF值与VEGF、MVD的表达均呈正相关,rs值分别为0.728、0.620,差异均具有统计学意义(P<0.05,表4、5)。

表2 高、低级别组胶质瘤VEGF表达的比较Table 2 Comparison of VEGF expression levels between the high-and low-grade

表3 高、低级别组胶质瘤MVD表达的比较Table 3 Comparison of MVD levels between the high-and low-grade glioma groups

表4 胶质瘤肿瘤实质rCBF值与VEGF表达的关系Table 4 Correlation between the solid tumor value of rCBF and the VEGF expression levels

表5 胶质瘤肿瘤实质rCBF值与MVD表达程度的关系Table 5 Correlation between the solid tumor value of rCBF and the MVD levels
3 讨论
常规MR扫描图像和对比增强图像对评估胶质瘤恶性程度具有一定局限性,多项研究[4-6]采用功能性磁共振成像(functional magnetic resonance imaging,fMRI)技术提高胶质瘤恶性程度评价的精确度,以此来帮助临床制定治疗计划和评价患者预后。近年来,由于3D ASL灌注成像技术成熟使其变为临床研究的热点。3D ASL灌注成像是一种不需要造影剂测定组织循环灌注的新技术,已有相关报道发现3D ASL灌注成像对于临床上鉴别诊断胶质瘤恶性程度有重要意义[5-6]。Yoo等[7]研究发现利用3D ASL灌注技术检查并测量肿瘤血流量值,结果显示3D ASL灌注成像技术有助于辨别胶质瘤的恶性程度。
本研究通过比较高低级别胶质瘤3D ASL灌注指数发现,高级别组胶质瘤肿瘤实质rCBF值显著高于低级别组,说明3D ASL灌注成像技术可以对高低级别胶质瘤进行评估,这与引文一致。Roy等[8]研究比较发现高级别组胶质瘤的灌注高于低级别组,肿瘤的灌注情况与肿瘤实质发生钙化、囊变及坏死等有关。本研究还发现在MR增强图像上,高级别胶质瘤实质的强化可不显著,但在CBF图上呈相对高灌注,这可能是因为肿瘤的恶性程度与血管生成有关,恶性程度高的部分并不一定是强化最显著的区域。因此,在胶质瘤的诊断中,单一观察MR增强图像中瘤体的强化程度并不能准确评价胶质瘤的恶性程度,其只反映肿瘤破坏该区域血脑屏障的程度[9]。肿瘤微血管生成和血管生成因子的产生是肿瘤生长、浸润和转移等肿瘤生物学行为的基础[10]。血管生成是胶质瘤生长、进展的必要条件[11]。血管生长因子参与胶质瘤血管生成,其中VEGF最为重要,其在胶质瘤血管生成过程中起驱动作用[12-15]。本研究的53例胶质瘤患者中,高级别组胶质瘤VEGF、MVD均呈阳性表达,其表达程度高于低级别组,差异具有统计学意义(P<0.05)。说明VEGF、MVD的表达既可以反映肿瘤微血管生成情况,又可以作为评估胶质瘤恶性程度的依据[16-17]。本研究还发现,低级别胶质瘤VEGF、MVD呈中度表达、高级别胶质瘤VEGF、MVD呈低度表达的情况。分析原因可能是部分低级别胶质瘤恶性程度具有向高级别胶质瘤进展的趋势,胶质瘤具有组织结构异质性的生物学特征。然而对VEGF、MVD检测需要在术后进行,穿刺活检又不能全面评估整个肿瘤恶性程度的情况。因此,单纯依靠检测VEGF、MVD表达程度评估胶质瘤恶性程度具有局限性,需要结合其他相关诊断技术进一步鉴别。所以,探究胶质瘤肿瘤实质rCBF与VEGF、MVD表达程度的相关性,对进一步评估肿瘤新生血管情况,辨别胶质瘤恶性程度,进而帮助临床制定适当的治疗计划和患者预后的评估是很有必要的。Viel等[18]研究显示胶质瘤的血管生成是评价胶质瘤增殖的关键,胶质瘤的生长、侵袭及生物学行为都依靠血管进行。
本研究中53例胶质瘤患者的肿瘤实质rCBF值与VEGF、MVD表达呈显著正相关,随着VEGF、MVD表达程度增加,胶质瘤肿瘤实质rCBF值也明显增大,说明肿瘤的生长依赖于新生血管的形成,肿瘤细胞产生促使VEGF的能力增强,肿瘤的新生血管越多,肿瘤生长越迅速,肿瘤细胞的恶性程度越高。可见胶质瘤肿瘤实质rCBF的高低和VEGF、MVD表达程度的高低及肿瘤新生微血管活性的高低具有明显的一致性。
3D ASL灌注成像是一种无创获得体内血流灌注情况的技术,能够客观分析瘤体血液动力学改变,间接反映出肿瘤的生物学行为,在胶质瘤恶性程度的评估中具有一定的临床应用价值。但目前研究状态和进展尚需与其他临床技术相结合,并有待于大样本对照研究。
综上所述,胶质瘤肿瘤实质rCBF与VEGF、MVD表达程度呈显著正相关,说明3D ASL灌注成像可通过肿瘤血流量的测量预测肿瘤微血管生成来评估胶质瘤的恶性程度,其临床意义在于提高对肿瘤微血管生成的认识,继而可以帮助临床医生进一步对肿瘤微血管生成、肿瘤侵润等肿瘤生物学特征的研究,对选择适当的治疗方案及患者预后的评估提供帮助。
[1] Di Stefano AL,Bergsland N,Berzero G,et al.Facing contrast-enhancing gliomas:perfusion MRI in gradeⅢand gradeⅣgliomas according to tumor area[J].Bio Res Int,2014,2014(2014):154350.
[2]Ohgaki H,Kleihues P.Epidemiology and etiology of gliomas[J].Acta Neuropathol,2005,109(1):93-108.
[3]Park DM,Rich JN.Biology of glioma cancer stem cells[J].Mol Cells,2009,28(1):7-12.
[4]Tietze A,Hansen MB,Østergaard L,et al.Mean diffusional kurtosis in patients with glioma:initial results with a fast imaging method in a clinical setting[J].AJNR Am J Neuroradiol,2015,36(8):1472-1478.
[5]Zou QG,Xu HB,Liu F,et al.In the assessment of supratentorial glioma grade:the combined role of multivoxel proton Mr spectroscopy and diffusion tensor imaging[J].Clin Radiol,2011,66(10):953-960.
[6]Kousi E,Tsougos I,Tsolaki E,et al.Spectroscopic evaluation of glioma grading at 3T:the combined role of short and long TE[J].Scientific World Journal,2012,2012(4):152-158.
[7]Yoo RE,Choi SH,Cho HR,et al.Tumor blood flow from arterial spin labeling perfusion MRI:a key parameter in distinguishing highgrade gliomas from primary cerebral lymphomas,and in predicting genetic biomarkers in high-grade gliomas[J].J Magn Reson Imaging,2013,38(4):852-860.
[8] Roy B,Awasthi R,Bindal A,et al.Comparative evaluation of 3-dimensional pseudocontinuous arterial spin labeling with dynamic contrast-enhanced perfusion magnetic resonance imaging in grading of human glioma[J].J Comput Assist Tomogr,2013,37(3):321-326.
[9]Wang X,Duan X,Yang G,et al.Honokiol crosses BBB and BCSFB,and inhibits brain tumor growth in rat 9L intracerebral gliosarcoma model and human U251 xenograft glioma model[J].PLoS One,2011,6(4):e18490.
[10]Rahmah NN,Sakai K,Sano K,et al.Expression of RECK in endothelial cells of glioma:comparison with CD34 and VEGF expressions[J]. J Neurooncol,2012,107(3):559-564.
[11]Chaudhry IH,O'donovan DG,Brenchley PE,et al.Vascular endothelial growth factor expression correlates with tumour grade and vascularity in gliomas[J].Histopathology,2001,39(4):409-415.
[12]Baker GJ,Yadav VN,Motsch S,et al.Mechanisms of glioma formation:iterative perivascular glioma growth and invasion leads to tumor progression,VEGF-independent vascularization,and resistance to antiangiogenic therapy[J].Neoplasia,2014,16(7):543-561.
[13]Hamerlik P,Lathia JD,Rasmussen R,et al.Autocrine VEGF-VEGFR2-Neuropilin-1 signaling promotes glioma stem-like cell viability and tumor growth[J].J Exp Med,2012,209(3):507-520.
[14]Fischer I,Gagner JP,Law M,et al.Angiogenesis in gliomas:biology and molecular pathophysiology[J].Brain Pathol,2005,15(4):297-310.
[15]Kukreja I,Kapoor P,Deshmukh R,et al.VEGF and CD 34:A correlation between tumor angiogenesis and microvessel density-an immunohistochemical study[J].J Oral Maxillofac Pathol,2013,17(3): 367-373.
[16]Maderna E,Salmaggi A,Calatozzolo C,et al.Nestin,PDGFRbeta,CXCL12 and VEGF in glioma patients:different profiles of(pro-angiogenic)molecule expression are related with tumor grade and May provide prognostic information[J].Cancer Biol Ther,2007,6(7): 1018-1024.
[17]Yang P,Yuan WJ,He JT,et al.Overexpression of EphA2,MMP-9,and MVD-CD34 in hepatocellular carcinoma:Implications for tumor progression and prognosis[J].Hepatology Research,2009,39(12): 1169-1177.
[18]Viel T,Boehm-Sturm P,Rapic S,et al.Non-invasive imaging of glioma vessel size and densities in correlation with tumour cell proliferation by small animal PET and MRI[J].Eur J Nucl Med Mol Imaging,2013,40(10):1595-1606.
(
2016-03-13收稿)
(2016-06-12修回)
Correlation of 3D ASL perfusion index with the expression of VEGF and MVD in glioma
Ziwen WANG1,Benqiang YANG2,Wenyuan LIU2,Meng XU3,Lianxue ZHANG1,Zhihua XU1,Yang DUAN2
Correspondence to:Yang DUAN;E-mail:duanyang100@126.com
1Jinzhou Medical University,General Hospital of Shenyang Military Region of PLA Training Base for Graduate,Shenyang 110016,China;2Department of Radiology,General Hospital of Shenyang Military Region of PLA,Shenyang 110016,China;3Department of Imaging,Hospital of Panshi,Panshi 132300,China
Objective:To investigate the correlation of the relative cerebral blood flow(rCBF)of three dimensional arterial spin labeling (3D ASL)with vascular endothelial growth factor(VEGF)expression and microvessel density(MVD)in glioma.Methods:Fifty-three glioma patients confirmed by pathology were subjected to conventional,enhanced MR and 3D ASL imaging before operation to determine VEGF expression and MVD levels in each patient.The correlations of rCBF with VEGF expression and MVD in glioma were evaluated,respectively.Results:rCBF was noted to be positively correlated to VEGF expression and MVD in glioma.The rs were 0.728(VEGF)and 0.620(MVD),respectively(P<0.05).Conclusion:The positive correlation of rCBF with VEGF expression and MVD in glioma implied that 3D ASL is beneficial for evaluating microvessel angiogenesis in glioma prior to surgery.This finding is significant for developing clinical treatment plans and for assessing patient prognoses.
glioma,3D arterial spin labeling,vascular endothelial growth factor,microvessel density,angiogenesis
10.3969/j.issn.1000-8179.2016.13.292
①锦州医科大学,中国人民解放军沈阳军区总医院研究生培养基地(沈阳市110016);②沈阳军区总医院放射诊断科;③磐石市医院影像科
段阳duanyang100@126.com
1.2方法
1.2.1检查方法采用GE Discovery MR750 3.0T磁共振扫描仪,头部8通道专用线圈(美国GE公司)。对53例患者行T1WI、T2WI、T2 FLAIR、3D ASL及静脉注射钆贝葡胺(Gd-DTPA,0.2 mmoL/kg体质量)对比增强扫描(注射流率3.0 mL/s)(图1、2)。常规MRI扫描参数:T1WI轴位、矢状位扫描(TR=1 900 ms,TE=19 ms),T2WI轴位扫描(TR=6 000 ms,TE=96 ms),T2WI FLAIR轴位扫描(TR=8 800 ms,TE=94 ms,TI=2 500 ms),T1WI轴位、矢状位、冠状位对比增强扫描(TR=1 860 ms,TE=19 ms),扫描层数21,层厚5 mm,层间距1 mm,视野(FOV)240 mm×240 mm,激励次数(NEX)1,矩阵256×256。
3D ASL成像扫描为TR=4 674 ms,TE=10.5 ms,视野(FOV)240 mm×240 mm,激励次数(NEX)3,层厚5 mm,标记后延迟时间(post label delay time)1 525 ms,根据常规T2WI上病变的范围采用多层采集的方式,共采集21幅灌注原始图像。
1.2.2图像分析方法应用GE ADW 4.6后处理工作站Functool软件进行图像后处理,获得3D ASL脑血流量(cerebral blood flow,CBF)图,观测每位患者的CBF图,并结合常规序列扫描图像,测量层面为肿瘤实质在轴位的最大层面,选定感兴趣区域(region of interest,ROI)。肿瘤实质ROI定位避开肿瘤的坏死或瘤内出血区域。镜像区脑组织ROI定位应避开颅骨、动静脉、脑池等解剖部位,ROI面积为30~40 mm2,在胶质瘤瘤体取灌注最高的区域测量最大肿瘤血流量(the maximal tumor blood flow,TBFmax),在对侧脑组织测量镜像区CBF。因个体性差异,不同患者的CBF会产生差别,为消除个体性差异,本研究采用TBFmax相对标准化,经标准化获取肿瘤实质rCBF。标准化公式为:rCBF=TBFmax/CBF。
1.2.3免疫组织化学染色方法选取患者存档的石蜡标本,连续切片5张,层厚2 μm,采用免疫组织化学链霉菌抗生物素蛋白-过氧化物酶法(streptavi⁃din-peroxidase method,SP法)对切片行免疫组织化学染色。VEGF、MVD阳性表达均为棕黄色。任意确定3个高倍可视范围(×200倍),在每个可视范围内统计阳性细胞的数目。计算阳性百分率取平均值,阳性表达的百分率=阳性表达细胞数/视野区总细胞数。分别将VEGF、MVD表达程度分为4组:阴性及低中高组分别为0、<25%、25%~50%、>50%(图3、4)。

图154岁女性患者左侧颞叶胶质瘤(WHOⅠ级)
Figure 154-year-old female with glioma in the left temporal lobe (WHO gradeⅠ)
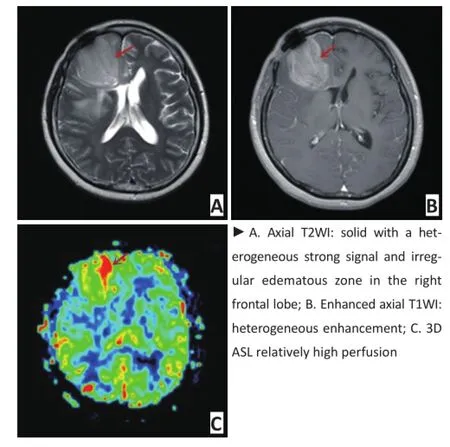
图244岁女性患者右侧额叶胶质瘤 (WHOⅢ级)
Figure 244-year-old female with glioma in the right frontal lobe(WHO gradeⅢ)
1.3统计学方法
采用SPSS 17.0软件进行统计学分析。数据以x±s表示,对高低级别组胶质瘤肿瘤实质rCBF比较采用t检验;对高低级别组之间的VEGF、MVD表达程度的比较采用秩和检验;分析肿瘤实质rCBF与VEGF、MVD表达程度的关系采用Spearman相关系数分析法。统计结果均以P<0.05为差异具有统计学意义。
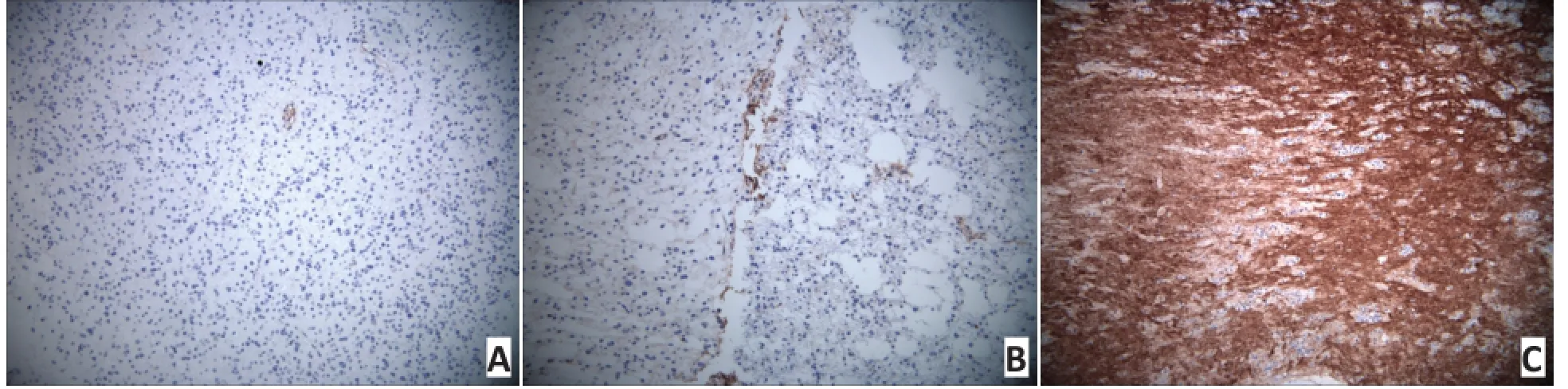
图3胶质瘤VEGF表达 (SP×200)
Figure 3VEGF expression levels in glioma(SP×200)
A.Low VEGF expression;B.Moderate VEGF expression;C.High VEGF expression

图4胶质瘤MVD表达 (SP×200)
Figure 4MVD expression levels in glioma(SP×200)
A.Low MVD expression;B.Moderate MVD expression;C.High MVD expression

王子文专业方向为中枢神经系统肿瘤影像学诊断。E-mail:wangziwen101@126.com
