改良CTAB法用于水环境中超微型浮游生物总DNA的提取
2016-08-03贺云彦刘科赛侯建军刘细霞李运涛
贺云彦,李 诗,刘科赛,侯建军,刘细霞,李运涛
(湖北师范大学 食用野生植物保育与利用湖北省重点实验室,湖北 黄石 435002)
改良CTAB法用于水环境中超微型浮游生物总DNA的提取
贺云彦,李 诗,刘科赛,侯建军,刘细霞,李运涛*
(湖北师范大学 食用野生植物保育与利用湖北省重点实验室,湖北 黄石 435002)
水环境中超微型浮游生物的研究要求有高质量的总DNA。通过对常规的CTAB法进行改良,对提取过程中的几个关键步骤进行优化,包括联合使用CTAB和SDS,利用5×CTAB去除杂质等,建立一种可以高效提取水环境中超微型浮游生物总DNA的方法,并与常规CTAB法以及蛋白酶K法进行比较。改良后的CTAB法提取的DNA的产量、纯度均最高,也最适合后续的实验研究。
水环境;超微型浮游生物;改良CTAB法;DNA提取
近年来,很多学者致力于水环境中的浮游生物研究,其中超微型浮游生物的研究受到越来越多的的重视[1]。研究超微型浮游生物通常采用分子生物学方法,因而获得高质量的总DNA就成了后续研究的重要基础。超微型浮游生物因为粒径小,水样需提前过滤,导致样品起始量少,且样品细胞含有较多的环境杂质,给超微型浮游生物总DNA的提取带来了一定困难[2]。目前虽然已有一些水样及藻类总DNA的提取方法[3] [4],但这些方法不太适用于超微型浮游生物的研究,提取DNA的效果不佳。因此迫切需要一种更简便、高效、经济的提取方法。
1 材料与方法
1.1 材料
先用筛绢过滤除去水样中的泥沙等大型颗粒杂物,再用5μm Isopore滤膜进行初次过滤,然后用GF/F滤膜将初次过滤的水样进行二次过滤。
1.2 主要仪器与试剂
5430R台式高速冷冻离心机(Eppendorf ),BioPhotometer D30 核酸蛋白测定仪(Eppendorf )。CTAB缓冲液(pH8.0,100 mmol/L Tris-HCl ,20mmol/L EDTA,1.4M NaCl,5%CTAB,0.1%PVP,2%β-巯基乙醇),裂解缓冲液(pH8.0,1.0mol/L NaCl,50mmol/L EDTA,50 mmol/L Tris,1% PVP),5×CTAB (pH 8.0,5% CTAB,1.0mol/L NaCl,50mmol/L EDTA,250 mmol/L Tris )。
1.3 DNA提取方法
1.3.1 方法1(CTAB法)
将膜样品剪碎成粉末状,加入65℃预热的800μL CTAB缓冲液,于65℃水浴30min。水浴结束后加入等体积的酚:氯仿:异戊醇(25:24:1),4℃ 6000r/min离心10min。取上清液,加入等体积氯仿:异戊醇(24:1),4℃ 6000r/min离心10min。取上清,加入1/10体积3M醋酸钠,混匀,加2倍体积-20℃预冷的无水乙醇,于-20℃放置1h到2h。12000r/min离心10min使DNA沉淀,去上清。加入70%乙醇1ml,4℃12000g离心5min,去上清。干燥直至无乙醇残留,加入20μL TE。
1.3.2 方法2(改良CTAB法)
将膜样品剪碎成粉末状,加入65℃预热的800μL 裂解缓冲液、2%SDS,65℃水浴30min。然后12000g离心5min,取上清,加1/5倍体积的65℃预热的5×CTAB,混匀后65℃继续水浴10min。水浴结束后加入等体积的酚:氯仿:异戊醇(25:24:1),4℃ 8000g离心10min。取上清,加入等体积氯仿:异戊醇(24:1),4℃ 8000g离心10min。取上清,加入1/10体积3M醋酸钠,混匀,加2倍体积-20℃预冷的无水乙醇,于-20℃放置1h到2h。12000g离心10min,去上清。加入1ml 70%乙醇,4℃ 12000g离心5min,去上清,干燥直至无乙醇残留,加入20μL TE。
1.3.3 方法3(蛋白酶K法)
将膜样品剪碎成粉末状,加入65℃预热的600μL 裂解缓冲液,加入33.5μL 10㎎/mL的蛋白酶K,先37℃水浴50min,再55℃水浴20分钟。4℃,8000g离心10min后,取上清,加入等体积酚:氯仿:异戊醇(25:24:1)。4℃,10000g离心5分钟。取上清,加入等体积的氯仿:异戊醇(24:1),8000g离心10min。取上清,加入等体积的异丙醇和0.4倍体积7.5mol/L的醋酸铵,室温静置10min后,4℃,10000g离心10min,弃上清。加入1mL 70%的乙醇洗涤,4℃,10000g离心5min。弃上清,干燥直至无乙醇残留,加入20μL TE。
1.4 DNA提取效率及质量评价
1.4.1 电泳检测
提取的总DNA用0.8%的琼脂糖凝胶电泳检测,观察DNA产物的完整性和片段分布。
1.4.2 DNA的纯度和浓度
通过测定样品在260和280 nm下的吸光度值,并分别计算A260/280 比值来评价DNA的纯度;DNA浓度按下列公式计算:DNA浓度(μg / μl): OD260×稀释倍数×50/1000。
1.4.3 酶切及PCR扩增
选择真核18S rRNA基因进行PCR扩增,观察PCR扩增结果以评价提取的DNA质量。引物序列为[5]:
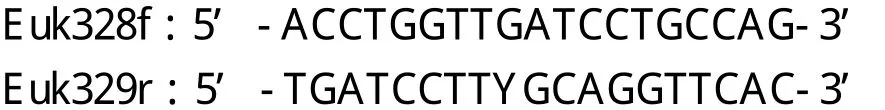
PCR扩增采用25μl体系,PCR条件为:94℃预变性4 min,接着进人35个循环(94℃1 min,55℃1 min, 72℃2 min ),最后72℃延伸8 min。目的产物大小约为1800bp,PCR产物经1%的琼脂糖凝胶电泳检测。
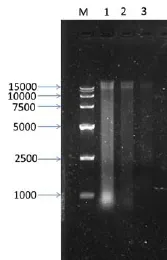
图1 提取的总DNA(M:marker;泳道1、2、3:方法1、2、3提取的DNA。)
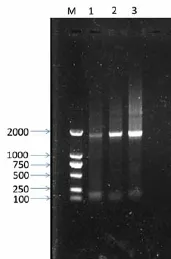
图2 提取的DNA PCR凝胶电泳结果(M:marker;泳道1、2、3:以方法1、2、3提取的DNA为模板的PCR产物。)
2 结果分析
2.1 DNA产率
三种DNA提取方法所用细胞裂解方法和后续步骤各有不同, 不同的DNA提取方法产率不同。从DNA电泳条带亮度可以大致判断DNA产率的高低。本文所用的3种方法中,方法1提取的DNA电泳条带最亮,其次为方法2和方法3(图1)。但方法1提取的DNA拖带严重,提示其质量较低。通过计算,三种方法提取的总DNA的浓度分别为0.545、0.972、0.465μg / μl,方法2的产量最高。
2.2 DNA质量
从琼脂糖凝胶电泳检测结果可以看出(图1),3种方法都能够提取相对完整的DNA。但综合来看,方法2提取的DNA质量较好。根据经验,高纯度DNA A260/280 比值应在1.8-2.0之间。本研究不同方法提取的DNA在纯度上有一定差异(表1)。从A 260/280检测值可以看出,方法2提取的DNA质量较好。其中,方法1和3的比值稍高,提示可能有RNA残留。
分别以三种方法提取的总DNA为模板,使用18s rDNA特异引物进行扩增。从扩增结果可以看出(图2),方法2提取的DNA的扩增效果最好,PCR产物亮度很高,且拖尾很少;而以方法1提取的DNA为模板的PCR产物虽然亮度更高,但有明显拖带。故综合考虑,方法2提取的总DNA质量最高,更适合后续的实验。
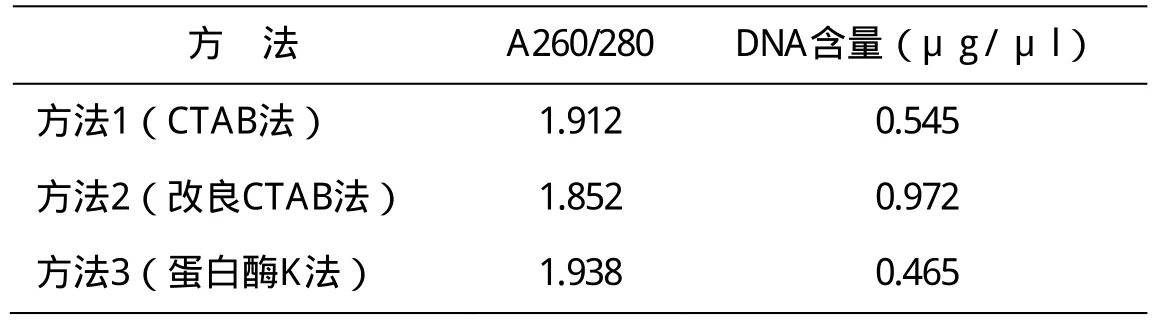
表1 提取的DNA的浓度、纯度
3 讨论
本文比较了三种不同的超微型浮游生物总DNA提取方法。常规CTAB法提取的总DNA条带最亮,但其产量不如改良CTAB法,说明常规CTAB法提取的DNA杂质较多,这从其PCR产物拖带严重也能得到证明。针对环境样品的特点,本研究对常规CTAB法进行了改良,在裂解步骤中,加入了SDS,以增强裂解效果;后续使用5×CTAB以利于杂质的去除[6]。从结果看,改良后的CTAB法提取的DNA产量较高,纯度也很高,以该方法提取的DNA为模板的PCR产物条带明亮,只有轻微拖带,说明提取的DNA适合后续的实验研究。而蛋白酶K法提取的DNA,产量、纯度均最低,以该方法提取的DNA为模板的PCR产物条带最暗。综合得率、纯度、对后续实验的适合度,改良CTAB法更适合于提取现场水环境中的超微型浮游生物总DNA。
A260/280 比值可以作为DNA纯度的参考,该比值大于2.0时, 说明DNA样品中RNA的含量较高;比值小于1.8时,DNA 样品中可能存在蛋白质污染[7],三种方法提取的DNAA260/280 比值均大于1.8小于2.0,说明三种方法提取DNA的蛋白质污染是主要问题。因为提取时没有使用RNA酶,故提取的DNA中均有RNA残留。本研究还探索了裂解液与膜样品的比例,发现800μL的裂解液提取1/3的膜样品(膜直径为3cm)效果比较好。总之,通过对常规CTAB的改良,获得了高质量高产量的DNA样品,在检验实验中发现提取的DNA能满足后续实验的要求,可用于大量提取水环境中的超微型浮游生物总DNA,为水环境中超微型浮游生物的研究奠定了基础。
[1] Simon M, Jardillier L, Deschamps P, et al. Complex communities of small protists and unexpected occurrence of typical marine lineages in shallow freshwater systems[J]. Environ Microbiol, 2015, 17: 3610-3627.
[2] Porteous LA, Amstrong JL. A simple mini-method to extract DNA directly from soil for use with polymerase chain reaction amplification[J].Curr Microbial, 1993, 27: 115-118.
[3] 赖树锦,郭佳,陶新园,等. 四种水体微生物总DNA 提取方法的比较[J].湖北农业科学,2014,53:2440-2442.
[4] 包慧,杨忠委,王华然,等. 3种真核藻类DNA提取方法比较[J].环境与键康杂志,2012,29:451-453.
[5] Romari K, Vaulot D.Composition and temporal variability of picoeukaryote communities at a coastal site of the English Channel from 18S rDNA sequences[J].Limnol Oceanogr, 2004, 49: 784-798.
[6] 孙璐宏, 鲁周民, 张丽.植物基因组DNA提取与纯化研究进展[J].西北林学院学报,2010,25:102-106.
[7] 李金璐,王硕,于婧,等.一种改良的植物DNA提取方法[J].植物学报,2013, 48:72-78.
A Modified CTAB Protocol for DNA Extraction of Picoplankton in Water Environment
HE Yun-yan, LI Shi, LIU Ke-sai, HOU Jian-jun, LIU Xi-xia, LI Yun-tao
(Hubei Key Laboratory of Edible Wild Plants Conservation and Utilization, Hubei Normal University, Huangshi Hubei 435002, China)
The research of picoplankton in water environment requires high quality of total DNA. Through the modification of conventional CTAB method and the optimization of the several key steps in the process of extraction, which included the combining of CTAB and SDS, the removal of impurities by 5× CTAB etc, the method for efficiently extracting total DNA of picoplankton in water environment was established. Furthermore the conventional CTAB method and proteinase K method were compared with modified CTAB method. The yield and purity of DNA extracted by the modified CTAB method were the highest, and it was the most suitable for subsequent experiments.
water environment; picoplankton; modified CTAB method; DNA extraction
Q948.8
A
2095-414X(2016)03-0068-03
李运涛(1979-),男,副教授,研究方向:水域生态学.
国家自然科学基金项目(41171045),湖北师范大学研究生创新科研基金项目(2015024),国家级大学生创新创业训练计划项目(201510513021),湖北师范大学优秀创新团队项目(T201504).
