结构蛋白—猪皮胶原的提取及其理化特性的表征
2016-08-03乔恩楠张传杰
乔恩楠,张传杰,2,颜 超,刘 云,崔 莉,朱 平*,2
(1. 武汉纺织大学 化学与化工学院,湖北 武汉 430073;2. 武汉纺织大学 新型纺织材料绿色加工及其功能化教育部重点实验室,湖北 武汉 430073)
结构蛋白—猪皮胶原的提取及其理化特性的表征
乔恩楠1,张传杰1,2,颜 超1,刘 云1,崔 莉1,朱 平*1,2
(1. 武汉纺织大学 化学与化工学院,湖北 武汉 430073;2. 武汉纺织大学 新型纺织材料绿色加工及其功能化教育部重点实验室,湖北 武汉 430073)
以猪皮为原料,采用醋酸和胃蛋白酶相结合的方法提取胶原,以提取率为指标,进行提取条件优化,并通过紫外光谱、红外光谱、黏度法和荧光光谱等分析方法对提取物的化学结构、变性温度、特征黏度、等电点等理化特性进行了表征。结果表明:猪皮胶原的最佳提取工艺为:料液比1:4、m胃蛋白酶:m猪皮=1:80、pH值2~3、温度4℃、时间60h,此时胶原提取率为18.87%。提取物的结构为猪皮I型胶原,变性温度为37.5℃,特性黏度为4.0230dL/g,等电点pI=6.0。
猪皮胶原;胃蛋白酶;特性黏度;等电点
蛋白质是组成人体一切细胞、组织的重要组成部分,是生命活动的主要承担者,它约占人体重量的16%-20%。结构蛋白作为蛋白质众多种类中的一种,它是构成动物结缔组织和细胞间质的一类蛋白,不仅具有维持细胞形态、机械支持和负重等功能[1],而且还在防御、保护、营养和修复等方面发挥重要作用,主要包含胶原、弹性蛋白和蛋白多糖3种成分。其中,胶原特有的空间结构[2-3]赋予其优异的理化性质和生物活性——生物相容性、生物可降解性和低抗原性等[4-6],从而成为目前研究和应用最为广泛的一类结构蛋白,在食品[7-8]、化妆品[9]、组织工程[10-11]和生物医学材料[12-14]等领域得到了广泛应用。目前,从动物组织中提取胶原的方法主要有单独使用或联用酸法[15-16]、碱法[17]、酶解法[18-19]及热水抽提法[20]。其中酸法、碱法和热水抽提法胶原溶出率很低,且酸法、碱法对环境污染严重,水抽提法得到的往往是胶原的变性产物;而酶法专一性强、破坏性小,能更好的获得活性胶原,但水解不够彻底[21]。因此,通常采用酸、酶结合的方法[22-23]来提取动物胶原,这样不仅胶原溶出率高,而且最大程度的保存了其天然生物活性。
本文以猪肉生产过程中产生的猪皮下脚料为原料,采用醋酸和胃蛋白酶相结合的方法提取猪皮I型胶原。利用正交法设计实验,以胶原蛋白的提取率为指标,对酶用量、提取时间、提取温度进行优化,以便得到最佳提取工艺条件。然后,采用紫外光谱、红外光谱、黏度法和荧光光谱等方法对提取的胶原蛋白的理化性质进行研究,并与I型胶原标准样进行对比。
1 实验部分
1.1 材料、试剂与仪器
新鲜猪皮(武昌关山菜市场);透析袋(生化级 SIGMA公司)。
胃蛋白酶(U=1:3000, High Purity Grade AMRESCO);I型胶原标准样(曲阜海昕实业有限公司);醋酸、十二水合磷酸氢二钠、异丙醇、乙酸乙酯、硝酸银、氯化钠均为分析纯。
1.2 仪器与设备
TGL-16M高速台式冷冻离心机(长沙湘仪离心机仪器公司);LGJ-10-10B冷冻干燥机(长沙湘仪离心机仪器有限公司);F-320型荧光分光光度计(天津港东科技发展股份有限公司);TU-1950紫外-可见光光度计(北京普析通用仪器有限责任公司);DCD-216K冰箱(青岛海尔股份有限公司);HH-S数显恒温水浴锅(国华电器有限公司);JB90-D型强力电动搅拌机(上海标本模型厂制造);BSA124S分析天平(赛多利斯科学仪器(北京)有限公司);TENSOR27红外光谱仪(德国布鲁克光谱仪器公司);PHS-25B型数字酸度计(上海大普仪器有限公司)。
1.3 实验方法
1.3.1 猪皮预处理
用菜刀将猪皮皮下脂肪和表面的毛发剔除干净,蒸馏水彻底洗净后,将其切成5mm×5mm的小颗粒状,再用蒸馏水润洗一遍,沥干水后称重,记为m1。
1.3.2 猪皮胶原的提取及纯化
参照文献[24]方法对预处理后的猪皮进行脱脂处理。在35℃条件下,用体积比为3:1的异丙醇和乙酸乙酯混合有机溶剂按照料液比1:4(m/V)对猪皮颗粒脱脂4h,然后用蒸馏水反复润洗猪皮颗粒直至无有机溶剂气味,沥干水,-20℃保存备用。
在酸性条件下,采用胃蛋白酶对脱脂后的猪皮进行酶解提取,以酶用量(A)、提取温度(B)、提取时间(C)为影响因素,胶原提取率为指标,通过L9(34)正交实验优化确定最佳提取工艺。然后用NaCl碾细粉末对酶解提取的胶原进行盐析两次,使NaCl最终浓度分别为4.4mol/L和1.7mol/L,并析出胶原絮状沉淀[25]。将胶原絮状沉淀溶于0.5mol/L醋酸溶液中,注入透析袋内并先后于0.02mol/L的Na2HPO4溶液和蒸馏水中透析2-3天,用硝酸银溶液检测透析液至无浑浊现象为止。
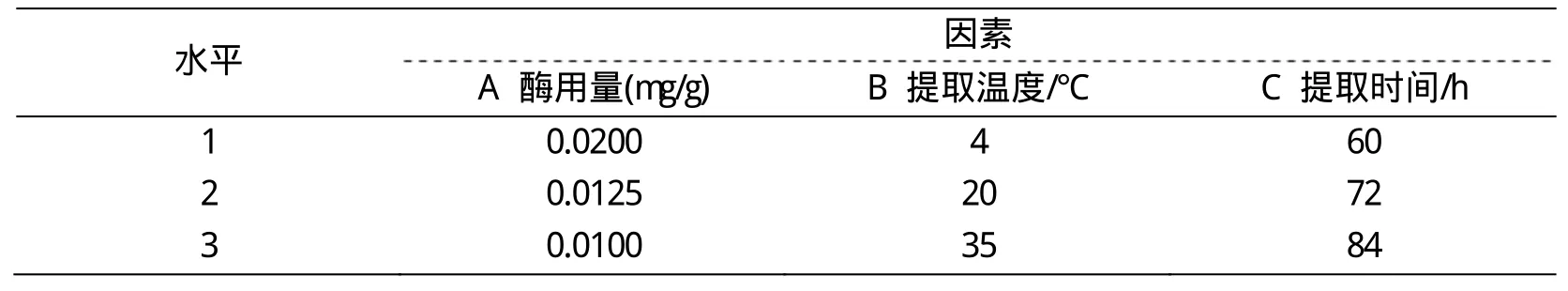
表1 正交实验因素水平表
1.3.3 胶原提取率
纯化后的胶原经真空冷冻干燥后,称其质量,记为m2。采用公式(1)计算胶原提取率,重复5次,取平均值。

式中:m1是脱脂沥干水后猪皮质量/g;m2是冻干胶原样品质量/g。
1.3.4 紫外光谱(UV)测试
将冻干胶原样品和I型胶原标准样分别溶于0.5mol/L醋酸溶液中,配制成1.0mg/mL的溶液,采用TU-1950型紫外-可见光光度计在200~400nm波长范围内进行扫描。
1.3.5 等电点测定
由于胶原分子中含有天然荧光效应的氨基酸(酪氨酸),且在等电点处荧光强度最大,黏度最低。采用荧光光度法测定胶原等电点。参照文献[26]方法,用0.5mol/L醋酸溶液分别配制质量浓度为1.0mg/mL的猪皮胶原溶液和猪皮I型胶原标准样溶液,调节溶液pH值,并分别测定pH为2.0、4.0、6.0、8.0、10.0、12.0时猪皮胶原溶液和I型胶原标准样溶液的荧光强度及对应的黏度值,在荧光强度最大处和黏度最小处所对应的同一pH值即为胶原的等电点。
1.3.6 变性温度测定
热变性温度(Td)为黏度变为最大值一半时所对应的温度。参照文献[27]方法,采用黏度法测定胶原热变性温度。用0.5mol/L醋酸溶液精确配制1.0mg/mL胶原溶液,用乌氏黏度计测定20~45℃(间隔5℃)范围内的增比黏度ηsp,各温度点恒温30min,测定样品溶液在不同温度下流出时间t,每组数据测5次,取平均值,计算公式如(2)所示:

式中:t为胶原样品溶液流出时间/s;t0为溶剂流出时间/s。
1.3.7 红外光谱(FT-IR)测试
明胶、I型胶原标准样及实验提取的I型胶原样品经彻底烘干,与溴化钾混合研磨成细粉后压片制样,采用TENSOR27红外光谱仪测试样品的红外光谱,设定扫描范围4000~400cm-1,分辨率4cm-1,扫描32次。
1.3.8 特性黏度测定
用0.5 mol/L醋酸溶液精确配制0.2mg/mL、0.4mg/mL、0.6mg/mL、0.8mg/mL和1.0mg/mL的标准胶原、实验提取胶原及明胶溶液,在25℃恒温水浴中,采用乌氏黏度法分别测定它们在不同浓度下流出时间ti,每组数据测5次,取平均值。按照公式(2)分别计算ηsp,再以ηsp/C对C作图,当C→0时,直线与纵坐标的交点即为该胶原的特性黏度[η]。
2 结果与分析
2.1 胶原的最佳提取工艺

表2 酸酶法提取猪皮胶原的正交实验设计及结果
由表2可以看出,试验极差因素A>C>B,即影响胶原提取率的因素主次顺序为酶用量>时间>温度,这说明酶用量是影响猪皮胶原提取率的主要因素。正交实验优水平组合为A2B1C3,由于实验中因素C对胶原提取率影响相对较小,所以为了缩短实验提取时间,选择60h为实验提取时间,优组合为A2B1C1。因此,胶原最佳提取工艺为:酶用量 0.0125mg/g,提取温度4℃,时间60h。在此工艺条件下,胶原提取率为18.87%。
2.2 紫外光谱(UV)分析
胶原肽链中含有-C=O、-CONH、-COOH等敏感的生色基团,可在近紫外区检测到特征吸收峰。从图1可见,实验提取的猪皮胶原在230nm处有特征吸收峰,与图中猪皮I型胶原标准样特征吸收峰位置基本一致,说明实验提取物是I型胶原。
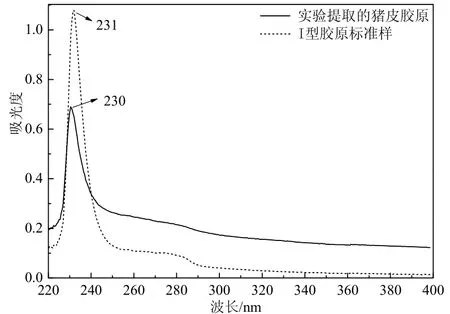
图1 实验提取的猪皮胶原和I型胶原标准样紫外吸收光谱
2.3 等电点分析

图2 pH值对实验提取猪皮I型胶原黏度和荧光强度的影响

图3 pH值对标准I型胶原黏度和荧光强度的影响
由于胶原是一种有多个氨基酸组成的两性聚电解质。在胶原每个肽链的两端都含有α-羧基和α-氨基,当胶原溶液pH发生变化时,会影响其在溶液中的存在状态,成为带有许多正电荷或负电荷离子的蛋白质,此时溶液黏度和荧光强度也会随之变化;当溶液pH值在胶原等电点附近时,胶原分子呈电中性,分子收缩,此时黏度最小,荧光强度最大。

从图2和图3可以看出,实验提取的猪皮胶原的等电点在pI=6.0左右,I型胶原标准样等电点在pI=5.3处,两种胶原蛋白的等电点非常接近,说明实验提取的猪皮胶原是I型胶原。
2.4 变性温度分析
热变性温度是反映胶原生物活性的重要指标之一。从图4猪皮胶原和I型胶原标准样热变性温度曲线可以看出,随着水浴温度的升高,提取的胶原的相对粘度ηr值呈逐渐减小趋势,且实验提取的胶原比I型胶原标准样变化要快,当温度从35℃升到40℃时,两曲线斜率变化都很大。根据热变性温度的定义,实验提取的猪皮胶原和I型胶原标准样的热变性温度分别在37.5℃和38℃左右,这与文献叙述的变性温度在37~39℃范围内一致,说明实验提取的是猪皮I型胶原。
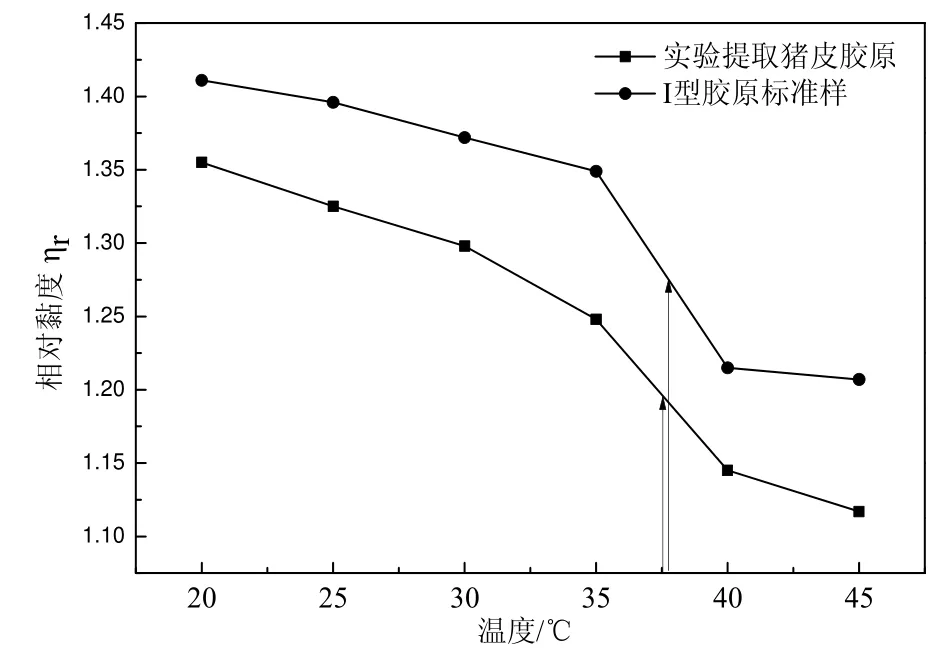
图4 实验提取的猪皮胶原和I型胶原标准样热变性温度曲线
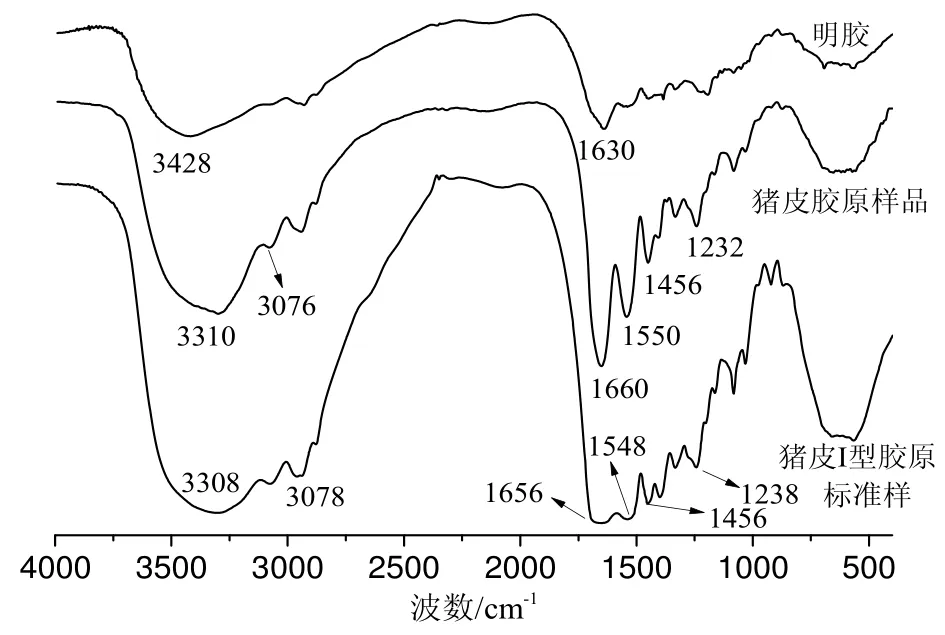
图5 明胶、猪皮胶原样品及猪皮I型胶原标准样的红外光谱
2.5 FT-IR分析
图5是明胶、猪皮胶原样品及猪皮I型胶原标准样的红外光谱曲线。从图中可以看出,实验提取胶原特征吸收谱带:1660cm-1,1550cm-1分别是酰胺Ⅰ带中酰胺C=O的伸缩振动峰和酰胺Ⅱ带中N-H弯曲振动峰[28-29],在3310cm-1和3076cm-1处分别是酰胺A带和酰胺B带吸收峰。1456~1232 cm-1附近的吸收峰是胶原具有完整的三股螺旋结构的特征峰[30-31],从图5可以看出实验提取的猪皮胶原和标准I型胶原在此处均有吸收峰;而明胶是胶原热变性的产物,其在1446~1232cm-1基本无吸收峰,说明三股螺旋结构已经被破坏,这进一步说明实验提取的胶原是I型胶原且保持了完整的三股螺旋结构。
2.6 特性黏度
图6是实验提取的猪皮胶原和I型胶原标准样在不同质量浓度下黏度的变化曲线。从图中可见,两者胶原黏度都随质量浓度的增大而增大,基本呈线性关系,I型胶原标准样和实验中用酸酶结合法提取的胶原的特性黏度分别为5.746dL/g和4.0230dL/g。其中,实验提取胶原的特性黏度比文献[32]中用热水抽提法提取的胶原的变性产物明胶特性黏度大,但又比文献[15]中用酸法提取的罗非鱼皮胶原的特性黏度小,说明不同提取方法及胶原来源的不同对胶原的黏度有一定的影响。
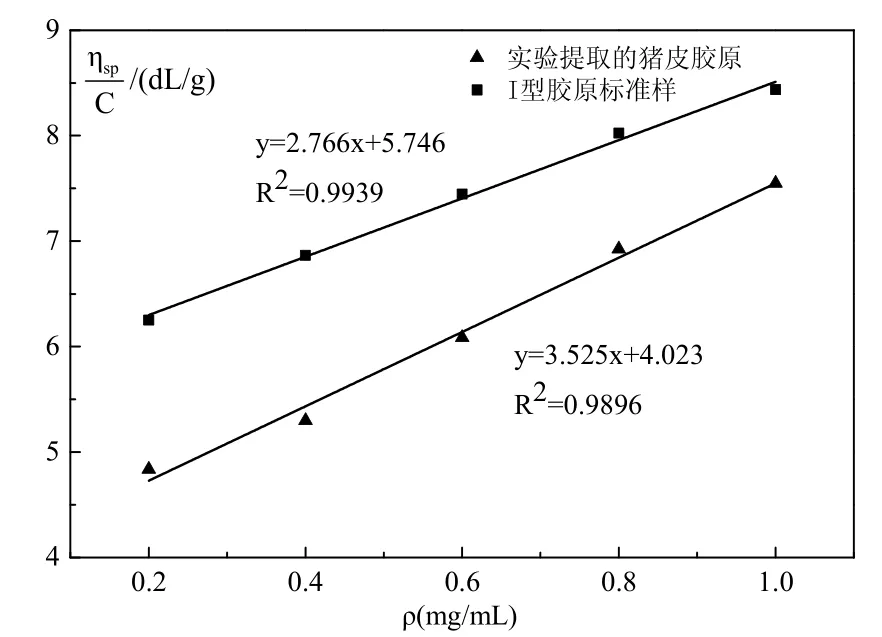
图6 实验提取的猪皮胶原和I型胶原标准样的特性粘度
4 结论
(1)利用正交优化法得出醋酸和胃蛋白酶相结合方法提取猪皮胶原的最佳工艺为:料液比1:4、m胃蛋白酶:m猪皮=1:80、pH值2~3、温度4℃、时间60h,在此工艺条件下胶原提取率约为18.87%。
(2)实验提取的胶原在230nm处有紫外特征吸收峰,说明实验提取的胶原是猪皮I型胶原。在280nm处有弱吸收峰,说明该胶原中含有一定量的像色氨酸和苯丙氨酸等具有苯环共轭双键的氨基酸,说明纯度还可以进一步提高。红外图谱进一步说明了该胶原是I型胶原,且保持了完整的三股螺旋结构。
(3)实验提取胶原变性温为37.5℃,在37-39℃范围内,符合I型胶原特性。荧光光度法和黏度法结果表明,实验提取胶原pI=6.0左右,与I型胶原pI=5.3很接近,进一步佐证了提取物是猪皮I型胶原。
[1] Quereshi S,Mhaske A,Raut D,et al. Extraction and partial characterization of collagen from different animal skins[J].Record Res. Sci. Technol,2010,2:28-31.
[2] 刘龙天.胶原蛋白三螺旋结构及热稳定性的研究[D].北京:北京协和医学院&中国医学科学院,2009.
[3] Mario Hiram UM,Joe Luis AM,Maribel PJ,et al. Jumbo squid (Dosidicus gigas) mantle collagen:extration,characterization,and potential application in the prepation of chitosan-collagen biofilms[J].Bioresourece Technol,2010,101:4212-4219.
[4] Leah CA,Erin Z,Bernardo PR,et al.Review:Guide to collagen characterization for biomaterial studies[J].J Biomed Materials Res.Part B:Applied Biomaterials,2008,87(B):264-285.
[5] Chi HL,Anuj S,Yugyung L.Biomedical applications of collagen[J].International Journal of Pharmaceutics,2001,221(1-2):1-22.
[6] Cliche S,Amiot J,Avezard C,et al. Extration and characterization of collagen with or without telopeptides from chicken skin[J].Poultry Sci,2003,82:503-509.
[7] 蓝蔚青,李燕,周培根.猪皮胶原蛋白的提取与应用浅析[J].肉类研究,2006,(3):44-48.
[8] Singh P,Benjakul S,Maqsood S,et al.Isolation and characterisation of collagen extracted from the skin of striped catfish (Pangasianodon hypophthalmus)[J].Food Chem,2011,124:97-105.
[9] 王学川,任龙芳,强涛涛,等.胶原蛋白的研究进展及其在化妆品中的应用[J].日用化学工艺,2005,35(6):388-392.
[10] Liu HY,Zhao L,Guo SD,et al.Modification of fish skin collagen film and absorption property of tannic acid[J].Food Sci Technol,2014,51(6):1102-1109.
[11] Park SH,Song TJ,Tae SB,et al. Comparative analysis of collagens extracted from different animal sources for application of cartilage tissue engineering[J].International J Precision Eng and manuf,2012,13(11):2059-2066.
[12] Maeda M,Tanis,Sano A,et al. Microstructure and release characteristics of the minipellet,a collagen based drug delivery system for controlled release of protein drugs[J].J Controlled Release,1999,62(3):313-324.
[13] Ramshsw JAM,Werkmeister JA,Glatteur V. Collagen based biomaterials[J].Biotechnol Rev,1995,13:336-382.
[14] 李贺,郑庚修,王秋芬,等.生物医学材料胶原蛋白的研究进展(II)-胶原的性质及其在生物医学领域中的应用[J].中国皮革,2006,35(3):27-31.
[15] 杨贤庆,张帅,郝淑贤,等.罗非鱼皮胶原蛋白的提取条件优化及性质[J].食品科学,2009,30(16):106-110.
[16] 傅燕凤,沈月新,杨承刚,等.淡水鱼鱼皮胶原蛋白的提取[J].上海水产大学学报,2004,13(2):146-150.
[17] Keiji Y,Mariko T,Daiki H,et al.Prepation and dynamic viscoelasticity characterization of alkali-solubilized collagen from shark skin[J].J Agric Food Chem,2000,48(3):685-690.
[18] Ka JL,Hee YP,YEON K K,et al. Biochemical characterization of collagen from the starfish asterias amurensis[J].J Korean Soc Apply Biol Chem,2009,52(3):221-226.
[19] Peck LK,Mat DM.Isolation and characterization of collagen from the skin of malaysian catfish (hybrid clarias sp.)[J].J Korean Soc Applied Biol Chem,2013,56:441-450.
[20] Liu HY,Li D,Guo SD. Extration and properties of gelatin from channel catfish (letalurus punetaus) skin[J].LWT-Food Sci and Technol,2008,41(3):414-419.
[21] 周玉惠,叶正涛,肖立芳,等.猪皮胶原蛋白的提取及其结构表征[J].武汉:湖北大学,2008.
[22] JEONG HS,Jayachandran V,KIim SK. Isolation and characterization of collagen from marine fish (Thunnus obesus)[J].Biotechnol and Bioprocess Eng.2013,18:1185-1191.
[23] Wu GP,Wang XM,Lin LP,et al.Isolation and characterization of pepsin-solubilized collagen from the skin of black carp (Mylopharyngdon piceus)[J].Advances in Biosci and Biotechnol,2014,5:642-650.
[24] 陈培基,李来好,李刘冬.小杂鱼脱脂技术的研究[J].湛江海洋大学学报,2003,23(4):21-22.
[25] Duan Rui,Zhang JJ Konno K,et al. Analysis and improvement of stability of pepsin-solubilized collagen from skin of carp (Cyprinus carpio)[J].Chemical Papers,2012,66 (7):636-641.
[26] 唐世华,张宁.荧光光度法研究明胶等电点[J].明胶科学与技术,2000,20(2):69-73.
[27] Jia YJ,Wang HB,Wang HY,et al.Biochemical properties of skin collagens isolated from black carp(Mylopharyngodon piceus)[J].Food Sci and Biotechnol,2012,21:1585-1592.
[28] Manning MC.Use of infrared spectroscopy to monitor protein structure and stability[J]. Expert Rev Proteomics,2005,2(5):731-743.
[29] Chang MC,Tanaka J.FT-IR study for hydroxyapatite/collagen nanocomposite cross-linked by glutaraldehyde [J].Biomaterials,2002,23(24):4811-4818.
[30] Pati F,Datta P,Adhikkari B,et al.Collagen scaffolds derived from fresh water fish origin and their biocompatibility [J].Biomed.Mater Res.Part A,2012,100A:1068-1079.
[31] Guzzi Plepis AMD,Goissis G,DAS-GUPTA D K.Dielectric and pyroelectric characterization of anionic and native collagen [J].Polym Eng Sci,1996,36:2932-2938.
[32] 钱曼,武贤壮,邱承光,等.热力法和酶解法提取鱼鳞胶原蛋白的工艺及性质研究[J].食品工业科技,2007,10(28):70-72.
Structural Protein-Extraction and Characterization of Physcial and Chemical Properties of Porcine Skin Collagen
QIAO En-nan1,ZHANG Chuan-jie1,2,YAN Chao1,LIU Yun1,CUI Li1,ZHU Ping1,2
(1 School of Chemistry and Chemical Engineering,Wuhan Textile University,Wuhan Hubei 430073,China;2 Key Laboratory of Green Processing and Functional Textiles of New Textile Materials of Ministry of Education,Wuhan Textile University,Wuhan Hubei 430073,China)
In this paper,collagen was extracted from porcine skin with the combination method of acetic acid and pepsin,using extraction yield of collagen as an index to optimize the extracting conditions,the chemical structure,the denaturation temperature,the characteristics of the viscosity,the physical and chemical properties such as isoelectric point of the extract were characterized by ultraviolet spectrum,infrared spectrum,viscosity method and fluorescence spectrum analysis method. The results indicated that the optimum conditions of extracting collagen as follow: the mass ratio of pepsin to porcine skin with a ratio of material to liquid of 1:4 (m/V) under the condition of 4℃ for 60 hours,the mass ratio of pepsin to porcine skin with a ratio of 1:80 (mg/g),pH value was 2 to 3,under the condition of the process,collagen yield was about 18.87%. The structure of the extract was type I collagen and denaturation temperature,isoelectric point and intrinsic viscosity were 37.5℃,6.0 and 4.0230dL/g,respectively.
porcine skin; pepsin; intrinsic viscosity; isoelectric point
TS201.12
A
2095-414X(2016)03-0058-06
朱平(1957-),男,教授,楚天学者,研究方向:天然高分子功能材料.
国家自然科学基金(51403160).
