慢性盆腔疼痛综合征与免疫介质关系的研究进展
2016-08-03孙凯强孙颖浩
纪 涛,孙凯强,孙颖浩
(1.第二军医大学长海医院泌尿外科,上海 200433;2.第二军医大学海医系学员队,上海 200433)
·综述·
慢性盆腔疼痛综合征与免疫介质关系的研究进展
纪涛1,孙凯强2,孙颖浩1
(1.第二军医大学长海医院泌尿外科,上海200433;2.第二军医大学海医系学员队,上海200433)
摘要:慢性盆腔疼痛综合征(CPPS)是男科常见疾病,其发病机制未明,缺乏特性新诊断依据。CPPS的发生发展与免疫介质息息相关。T淋巴细胞、细胞因子、细胞趋化因子以及肥大细胞等在CPPS的发生发展中具有重要作用。对免疫介质的深入研究可能对探明CPPS的病因、发病机制,开发特异性生物标志物以及新的免疫抑制剂有重要意义。
关键词:慢性盆腔疼痛综合征;T淋巴细胞;细胞因子;细胞趋化因子;肥大细胞
慢性盆腔疼痛综合征(chronic pelvic pain syndrome,CPPS)是常见的男科疾病,其患病率比细菌性前列腺炎高约8倍[1]。其发病机制未明,病因学复杂,缺乏客观的、特异性的诊断依据,存在广泛争议。近年来,免疫学相关研究表明,多机制的免疫反应异常在CPPS的发生发展和病程演变中发挥着重要的作用,患者的前列腺液或精浆或组织和血液中可出现某些免疫介质水平变化,日益受到重视,可为CPPS的诊断和免疫抑制剂的研发提供新的方案[2]。本文就与相关免疫介质的关系研究进展做一综述。
1T淋巴细胞
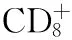

因此,选择性地抑制效应性T淋巴细胞而保留调节性T细胞的免疫疗法可能在对抗自身抗体产生和抑制炎症方面较有希望[6]。
1.2辅助性T细胞辅助性T细胞(helper T cells,Th)可分为Th1、Th2细胞等,Th1细胞通过分泌干扰素(interferonγ,IFN-γ)等促进细胞免疫,Th2细胞通过分泌白细胞介素4(interleukin 4,IL-4)等调节体液免疫。Th1/Th2失衡与机体免疫反应相关,与许多疾病发病和转归相关[7]。在CPPS患者前列腺按摩液、精液等中,T淋巴细胞表现大量浸润[8]。MOTRICH等[9]研究发现,T淋巴细胞多由前列腺抗原(prostate specific antigen,PSA)呈递产生,尤其IFN-γ产生的Th1细胞在外周血中特异性升高,并且与PSA含量相关。LIU 等[10]研究发现,CAP/CPPS患者Th1细胞数明显升高,Th1/Th2平衡向Th1方向变化,表明Th1细胞在CAP/CPPS的发生中可能其重要作用。但是,由于体内细胞因子网络调节复杂,需要充分认识细胞因子作用的多样性和复杂性。
2细胞因子
从上世纪八十年代开始,开展了很多细胞因子与CPPS患者的相关性研究。患者前列腺按摩液和精液等标本中促炎因子,如白介素-1β(interleukin 1β,IL-1β)、TNFα、IL-6、IL-8和免疫球蛋白A(immunoglobulin A, IgA)等明显上升,而炎性调节因子如IL-2R等明显下降。
2.1促炎因子IL-1β可以促进粘附分子表达,诱导单核细胞、T淋巴细胞等从血管渗出,从而浸润前列腺组织。此外IL-1β还可以诱导IL-8的合成和环氧化酶2(cyclooxygenase 2,COX-2)的基因表达,引起众多生物学效应[11]。THF-α多由巨噬细胞分泌,可增加粘附分子的表达,释放白三烯、前列腺素等炎症递质,在CPPS发生发展中起重要作用。NADLER等[12]发现,CPPS患者IL -1β检出率为90%,且与TNF-α存在相关性。HE等[13]同样证实TNF-α水平明显升高,且与白细胞计数存在相关性。EUGENE等[14]对NF-kB转基因大鼠注射IL-1β后,发现大鼠前列腺组织中的NF-kB上调,可能与进一步前列腺组织的破坏有关。
IFN-γ主要由活化的T淋巴细胞产生,可以诱导多种组织细胞相容性复合物2类(major histocompatibility complex 2,MHC)抗原的表达,协助巨噬细胞发挥吞噬作用。MOTRICH等[15]对IFN-γ信号级联放大转录因子缺失的小鼠进行前列腺甾体结合蛋白免疫注射后,IHN-γ含量较低,而且前列腺未见明显炎性浸润和改变。说明IFN-γ在CPPS动物模型的免疫功能中起到重要作用。
2.2抗炎因子IL-6主要由内皮细胞和单核巨噬细胞产生,能激活和诱导T、B淋巴细胞分化。PAULIS等[16]发现,CP患者EPS中IL-6水平较对照组高,且与国立卫生研究所慢性前列腺炎症状指数(National Institutes of Health Chronic Prostatitis Symptom Index,NIH-CPSI)相关。JOHN等[17]研究表明,CPPS患者精浆中IL-6水平明显升高,并与疼痛的缓解相关。
IL-10是细胞因子合成抑制因子,为重要的抗炎性细胞因子。IL-10主要由Th2产生,能够下调T细胞的增殖,抑制Th1细胞产生多种炎症因子和介质,减弱炎性反应。MILLER等[18]发现CP患者前列腺按摩液(prostatic secretion,PS)中IL-10明显增高,在IL-10 mRNA出现后,TNF-α和IL-1基因表达下调。HE等[13]进一步发现,IL-10与NIH-CPSI评分具有相关性,可作为治疗效果评估的指标。
3细胞趋化因子
两种细胞趋化因子与CPPS的疼痛症状发生发展息息相关。巨噬细胞趋化性和激活因子1(monocyte chemotactic protein 1,MCP1)又称趋化因子配体2(chemokine C-C motif ligand 2,CCL2)可趋化单核细胞和嗜碱性粒细胞,渗透和浸润入组织内,参与多种疾病的发病机制,包括类风湿性关节炎、主动脉瘤、冠心病等。巨噬细胞炎性蛋白α(macrophage inflammation protein 1α,MIP1α),又称趋化因子配体3(chemokine C-C motif ligand 2,CCL3),参与促炎反应,并且在多数风湿免疫性疾病中高表达。
DESIREDDI等[19]研究表明,两种炎症趋化因子在CPPS患者EPS中都明显增高,并且MIP1α与NIH-CPSI疼痛得分相关,MCP1与白细胞计数正相关,说明两种炎症趋化因子在CPPS的发展中作用并不相同。近年QUICK等[20]采用CPPS的大鼠EAP模型,尝试探索CCL2和CCL3作为生物标记物的可能性。他们评估了趋化因子的来源、性质、动力学研究以及免疫浸润的表型,发现第5天和第20天CCL2的mRNA水平明显上升,第30天CCL3的mRNA水平也有所提高,而且前列腺上皮细胞CCL2和CCL3表达量最高。
4肥大细胞
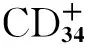
研究表明,CPPS患者EPS中肥大细胞数量和肥大细胞纤维蛋白溶酶含量显著增加[23]。然而,肥大细胞基因敲除的Kitw-sh、Kitw-shSash大鼠疼痛症状轻度减轻,而且炎症浸润没有差异[24],说明肥大细胞虽然在CPPS的发生发展中起到重要作用,但是疼痛还可能由其他炎性介质引起。MURPHY等[25]研究表明,肥大细胞纤维蛋白溶酶可能通过蛋白酶激活受体信号通路完成对慢性炎症和疼痛的调节。
在CPPS的疼痛机制研究中,肥大细胞可能通过神经生长因子(nerve growth factor,NGF)快速调节外周神经的敏感性[26]。NGF可与肥大细胞表面的TrkA受体结合,使周围组织降解,反馈性地增加了疼痛的敏感性。周围组织以及神经损伤后,再生过程将释放大量NGF[27]。因此,有研究表明,在CPPS患者的精液中,NGF水平明显上升,并且与疼痛程度线性相关[28]。
5总结与展望
CPPS是一种病因未明的综合征,发展过程中伴随着免疫介质的调节。过去研究集中于细胞因子等免疫调节机制,如今趋化因子、炎性因子转录基因以及肥大细胞的作用日益受到重视。进一步的研究炎性细胞、因子的水平和相关基因的表达,对明确CAP/CPPS的病因和发病机制,诊断的生物标记物以及免疫抑制剂的发展都具有重要意义。
参考文献:
[1] PONTARI M, GIUSTO L. New developments in the diagnosis and treatment of chronic prostatitis/chronic pelvic pain syndrome[J]. Curr Opin Urol, 2013, 23(6): 565-569.
[2] WAGENLEHNER FM, VAN TILL JW, MAGRI V, et al. National Institutes of Health Chronic Prostatitis Symptom Index (NIH-CPSI) symptom evaluation in multinational cohorts of patients with chronic prostatitis/chronic pelvic pain syndrome[J]. Eur Urol, 2013, 63(5): 953-959.
[3] FUJIO K, OKAMURA T, SUMITOMO S, et al. Regulatory T cell-mediated control of autoantibody-induced inflammation[J]. Front Immunol, 2012, 3:28.
[4] 贾增胜,李令勋,殷德俊. 大鼠慢性非细菌性前列腺炎模型中调节性T淋巴细胞表达的变化及意义[J]. 中华泌尿外科杂志, 2013, 34(8): 622-626.

[6] RODRIGUEZ-PINTO D, NAVAS A, BLANCO VM, et al. Regulatory T cells in the pathogenesis and healing of chronic human dermal leishmaniasis caused by Leishmania (Viannia) species[J]. PLoS Negl Trop Dis, 2012, 6(4): e1627.
[7] ZHANG HL, ZHENG XY, ZHU J. Th1/Th2/Th17/Treg cytokines in Guillain-Barre syndrome and experimental autoimmune neuritis[J].Cytokine Growth Factor Rev,2013,24(5):443-453.
[8] KOUIAVSKAIA DV, SOUTHWOOD S, BERARD CA, et al. T-cell recognition of prostatic peptides in men with chronic prostatitis/chronic pelvic pain syndrome[J]. J Urol, 2009, 182(5): 2483-2489.
[9] MOTRICH RD, MACCIONI M, MOLINA R, et al. Presence of INFgamma-secreting lymphocytes specific to prostate antigens in a group of chronic prostatitis patients[J]. Clin Immunol, 2005, 116(2): 149-157.
[10] LIU HH, XIA XY, WU YM, et al. [Detection of peripheral blood Th1/Th2 cell ratio in patients with chronic abacterial prostatitis/chronic pelvic pain syndrome][J]. Zhonghua Nan Ke Xue, 2006, 12(4): 330-332, 336.
[11] ZIELINSKI CE, MELE F, ASCHENBRENNER D, et al. Pathogen-induced human TH17 cells produce IFN-gamma or IL-10 and are regulated by IL-1beta[J]. Nature, 2012, 484(7395): 514-518.
[12] NADLER RB, KOCH AE, CALHOUN EA, et al. IL-1beta and TNF-alpha in prostatic secretions are indicators in the evaluation of men with chronic prostatitis[J].J Urol,2000,164(1):214-218.
[13] HE L, WANG Y, LONG Z, et al. Clinical significance of IL-2, IL-10, and TNF-alpha in prostatic secretion of patients with chronic prostatitis[J]. Urology,2010,75(3):654-657.
[14] VYKHOVANETS EV, SHUKLA S, MACLENNAN GT, et al. Il-1 beta-induced post-transition effect of NF-kappaB provides time-dependent wave of signals for initial phase of intrapostatic inflammation[J]. Prostate,2009,69(6):633-643.
[15] MOTRICH RD, VAN ETTEN E, BAEKE F, et al. Crucial role of interferon-gamma in experimental autoimmune prostatitis[J]. J Urol,2010,183(3):1213-1220.
[16] PAULIS G, CONTI E, VOLIANI S, et al. Evaluation of the cytokines in genital secretions of patients with chronic prostatitis[J]. Arch Ital Urol Androl, 2003, 75(4): 179-186.
[17] JOHN H, MAAKE C, BARGHORN A, et al. Immunological alterations in the ejaculate of chronic prostatitis patients: clues for autoimmunity[J]. Andrologia, 2003, 35(5): 294-299.
[18] MILLER LJ, FISCHER KA, GORALNICK SJ, et al. Interleukin-10 levels in seminal plasma: implications for chronic prostatitis-chronic pelvic pain syndrome[J]. J Urol, 2002, 167(2 Pt 1): 753-756.
[19] DESIREDDI NV, CAMPBELL PL, STERN JA, et al. Monocyte chemoattractant protein-1 and macrophage inflammatory protein-1alpha as possible biomarkers for the chronic pelvic pain syndrome[J]. J Urol, 2008, 179(5): 1857,1862.
[20] QUICK ML, MUKHERJEE S, RUDICK CN, et al. CCL2 and CCL3 are essential mediators of pelvic pain in experimental autoimmune prostatitis[J]. Am J Physiol Regul Integr Comp Physiol, 2012, 303(6): 580-589.
[21] WALKER ME, HATFIELD JK, BROWN MA. New insights into the role of mast cells in autoimmunity: evidence for a common mechanism of action?[J]. Biochim Biophys Acta, 2012, 1822(1): 57-65.
[22] KIM DY, JEOUNG D, RO JY. Signaling pathways in the activation of mast cells cocultured with astrocytes and colocalization of both cells in experimental allergic encephalomyelitis[J]. J Immunol, 2010, 185(1): 273-283.
[23] RIVERO VE, IRIBARREN P, RIERA CM. Mast cells in accessory glands of experimentally induced prostatitis in male Wistar rats[J]. Clin Immunol Immunopathol, 1995, 74(3): 236-242.
[24] PICONESE S, COSTANZA M, MUSIO S, et al. Exacerbated experimental autoimmune encephalomyelitis in mast-cell-deficient Kit W-sh/W-sh mice[J].Lab Invest,2011,91(4):627-641.
[25] MURPHY SF, SCHAEFFER AJ, THUMBIKAT P. Immune mediators of chronic pelvic pain syndrome[J]. Nat Rev Urol, 2014, 11(5): 259-269.
[26] BALI KK, VENKATARAMANI V, SATAGOPAM VP, et al. Transcriptional mechanisms underlying sensitization of peripheral sensory neurons by granulocyte-/granulocyte-macrophage colony stimulating factors[J]. Mol Pain, 2013, 9: 48.
[27] THACKER MA, CLARK AK, MARCHAND F, et al. Pathophysiology of peripheral neuropathic pain: immune cells and molecules[J]. Anesth Analg, 2007, 105(3): 838-847.
[28] WATANABE T, INOUE M, SASAKI K, et al. Nerve growth factor level in the prostatic fluid of patients with chronic prostatitis/chronic pelvic pain syndrome is correlated with symptom severity and response to treatment[J]. BJU Int, 2011, 108(2): 248-251.
(编辑何宏灵)
收稿日期:2015-05-15修回日期:2015-09-14
通讯作者:孙颖浩,教授.E-mail:sunyh@medmail.com.cn
作者简介:纪涛(1985-),男(汉族),学士学位,讲师,泌尿外科方向.E-mail:kuailejito2010@163.com 孙凯强(1993-),男(汉族),本科在读,海军临床医学专业.E-mail:15721570551@163.com.系共同第一作者。
中图分类号:R69
文献标志码:A
DOI:10.3969/j.issn.1009-8291.2016.01.019
