原发性高草酸尿Ⅲ型1例报告并文献复习
2016-08-03周乐卿张励鸣宁本翔张一凡孙西钊
周乐卿,王 强,张励鸣,宁本翔,张一凡,孙西钊
(1 南京大学医学院附属鼓楼医院泌尿外科,江苏南京 210008; 2 南京中医药大学第一临床学院,江苏南京 210029)
·临床研究·
原发性高草酸尿Ⅲ型1例报告并文献复习
周乐卿1,王强2,张励鸣1,宁本翔1,张一凡1,孙西钊1
(1 南京大学医学院附属鼓楼医院泌尿外科,江苏南京210008; 2 南京中医药大学第一临床学院,江苏南京210029)
摘要:目的总结1例儿童原发性高草酸尿Ⅲ型(PH Ⅲ)病例,提高对该病的认识。方法采集该患儿病史,总结其临床特点,了解其结石成分,对其进行代谢评估并进行基因分析;对患儿父母HOGA1基因直接测序并分析突变位点;对患儿进行密切随访;对该疾病进行文献综述。结果患儿HOGA1基因IVS2+1G>T、c.345G>T、c.345G>A杂合突变;其母携带IVS2+1G>T、c.345G>T杂合突变,其父携带c.345G>A杂合突变;患儿为HOGA1基因复合杂合突变,其3个突变位点尚未见文献报导。嘱患儿大量均匀饮水,低草酸饮食,正常钙饮食,限制动物蛋白的摄入。予枸橼酸氢钾钠升高尿枸橼酸,予以氢氯噻嗪降低尿钙。随访半年,患儿尿草酸水平较前基本持平,尿钙水平下降至正常范围,尿枸橼酸水平较前上升,肾功能在正常范围内。泌尿系B超提示结石无明显增大。结论PH III发病年龄早,结石成分常为以二水草酸钙为主的混合性含钙结石,一般不伴肾功能损害;基因分析为确诊该病无创而有效的手段,患者父母基因分析对确诊该病有帮助。早期诊断与干预对防止疾病的进一步发展有重要作用。
关键词:原发性高草酸尿;HOGA1基因;泌尿系结石;基因分析;结石成分
原发性高草酸尿(primaryhyperoxaluria,PH)是一种因乙醛酸代谢异常导致尿草酸排泄增加的罕见常染色体隐性遗传病。国外流行病学调查发现,其患病率不到百万分之三[1]。PH共分为3型,Ⅰ型是由于AGT基因缺陷导致丙氨酸乙醛酸转氨酶缺乏引起。Ⅱ型则主要是由于GRHPR基因缺陷引起乙醛酸还原酶活性降低所致。以往将非PHⅠ、PHⅡ的原发性高草酸尿者定义为PHⅢ,2010年BELOSTOTSKY等[2]首次提出HOGA1基因突变会导致高草酸尿,PHⅢ的定义亦随之改变。PHⅢ的患病率约占PH的10%,仅次于PHⅠ。截止目前,国外仅百余例患者确诊为PHⅢ,国内尚未见PHⅢ报导,本文系国内首例确诊为PHⅢ的病例,现报道如下。
1病例报告
1.1病史患儿男,2岁8个月,10个月时确诊为“双肾结石”,尔后多次发生泌尿系感染。1岁时患儿CT检查提示右肾结石8~9cm,左肾结石7~8cm(图1),于外院先后行“右侧、左侧经皮肾镜(percutaneousnephrolithotomy,PNCL)术”,术后有结石残余(最大2mm)。术后结石成分分析:二水草酸钙、一水草酸钙。术后B超监测发现双肾结石有增多、增大趋势。患儿近3个月尿镜检出现结晶阳性,故于2015年4月7日因“双肾多发结石”入住我院。家族史:患儿父母非近亲结婚,其母系及父系3代内无相同病史,父亲有“胆结石”病史。
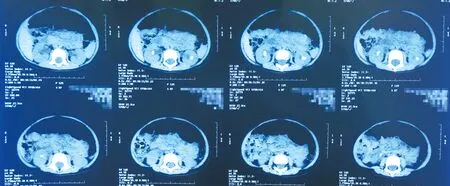
图1患儿术前CT所见(双肾结石,右肾积水)
1.2查体及辅助检查发育正常,营养中等,智力正常,身高94cm,体重16kg。腹部无压痛及反跳痛,双肾区叩痛,两侧肾区皆可见长约1cm手术疤痕,未发现其他阳性体征。辅助检查:B超示:右侧肾集合系统管壁见1~2枚增强小光点,最大直径约1~2mm;左侧见2~3枚增强小光点,最大直径2mm;膀胱充盈差,膀胱壁稍毛糙。血尿酸285μmol/L,血肌酐22μmol/L(正常儿童血肌酐30~100μmol/L,此患儿血肌酐低,考虑为患儿入院前已行水化疗法,大量饮水导致血肌酐稀释所致),血尿素氮4.76mmol/L,皆在正常范围内。查随机尿pH6.5,尿钙0.9mmol/L,尿肌酐885.9μmol/L(尿钙/尿肌酐=0.36)。患儿行5次24h尿检测,结果见表1。以上检查结果提示患儿存在:①高草酸尿:尿草酸平均为64.42mg/24h[即1.98mmol/(1.73m2·24h),正常<0.5mmol/(1.73m2·24h)]。②持续性高钙尿:尿钙平均为3.2mmol/24h[即8mg/(kg·24h),正常<4mg/(kg·24h)]。③尿酸正常:尿尿酸平均为2645.6μmol/24h(即444.5mg/24h,正常<750mg/24h)。④尿枸橼酸正常:尿枸橼酸平均为185.76mg/24h(正常>150mg/24h)。⑤患儿无L-甘油酸尿。进一步询问病史,可排除肠源性、食源性高草酸尿可能。结合患儿病史、临床表现、上述生化检查结果及结石成分分析结果,提示PHⅢ可能性大(多以二水草酸钙为主要成分),进一步行基因分析。
表1患儿5次24h尿液评估结果
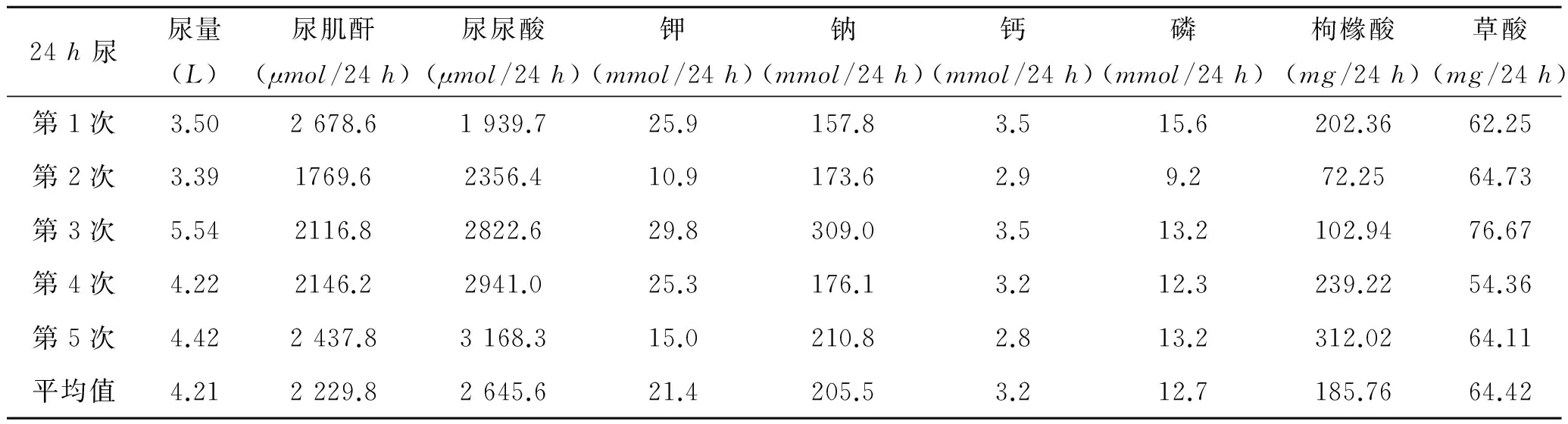
24h尿尿量(L)尿肌酐(μmol/24h)尿尿酸(μmol/24h)钾(mmol/24h)钠(mmol/24h)钙(mmol/24h)磷(mmol/24h)枸橼酸(mg/24h)草酸(mg/24h)第1次3.502678.61939.725.9157.83.515.6202.3662.25第2次3.391769.62356.410.9173.62.99.272.2564.73第3次5.542116.82822.629.8309.03.513.2102.9476.67第4次4.222146.22941.025.3176.13.212.3239.2254.36第5次4.422437.83168.315.0210.82.813.2312.0264.11平均值4.212229.82645.621.4205.53.212.7185.7664.42
注:其中尿草酸、尿枸橼酸采用离子色谱法检测(Metrohn-883型离子色谱仪,淋洗条件7.0mmol/LNa2CO3和10.0mmol/LNaOH,流速为0.7mL/min)。
1.3基因分析未发现有效的AGXT、GRHPR基因突变,可排除PHⅠ、PHⅡ。患儿HOGA1基因分析见表2、图2。可以看出,患儿存在HOGA1基因IVS2+1G>T(剪切位点)、c.345G>T(p.115A>A)、c.345G>A(p.115A>A)杂合突变。以上3个位点的基因突变在PHⅢ中尚未见报导。患儿父母亦行HOGA1基因非编码区IVS2+1和编码区345位点测序,结果见表3、表4。可以看出,患儿母亲为HOGA1基因中IVS2+1G>T(剪切位点)、c.345G>T(p.115A>A)突变携带者。患儿父亲为HOGA1基因中c.345G>A(p.115A>A)突变携带者。因此,患儿为HOGA1基因复合杂合突变导致PHⅢ发生,符合常染色体隐性遗传病特征。
表2患儿HOGA1基因分析结果

基因染色体位置核酸改变氨基酸改变杂合/纯合与疾病相关性相关性说明基因功能或关联疾病表型HOGA1chr10:99361748IVS2+1G>T剪切位点杂合较高突变在经典剪切位点上原发性高草酸尿3型chr10:99361747c.345G>Tp.115A>A杂合可能相关mRNA剪切可能会受影响chr10:99361747c.345G>Ap.115A>A杂合可能相关mRNA剪切可能会受影响
注:来源于北京德易东方转化医学研究中心
NCBI参照序列
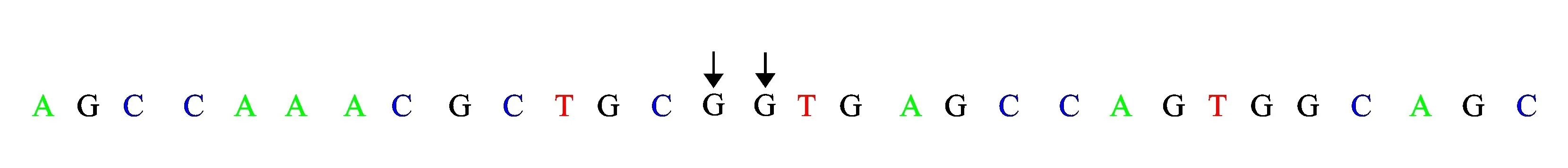

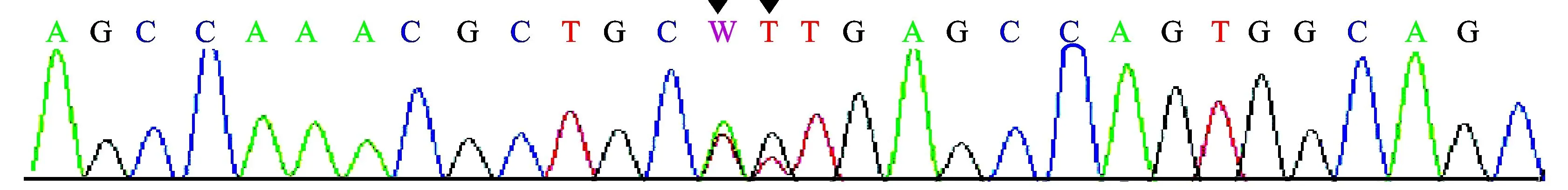
W代表A或T。
相关文献或数据库:未见报道。
图2患儿HOGA1基因分析结果(北京德易东方转化医学研究中心)
表3患儿父母HOGA1基因非编码区IVS2+1位点测序

姓名基因突变类型核酸突变氨基酸突变突变影响患者之父HOGA1-IVS2+1正常--患者之母HOGA1杂合IVS2+1G>T剪切位点突变在经典剪切位点上
注:来源于北京德易东方转化医学研究中心
表4患儿父母HOGA1基因编码区345位点测序
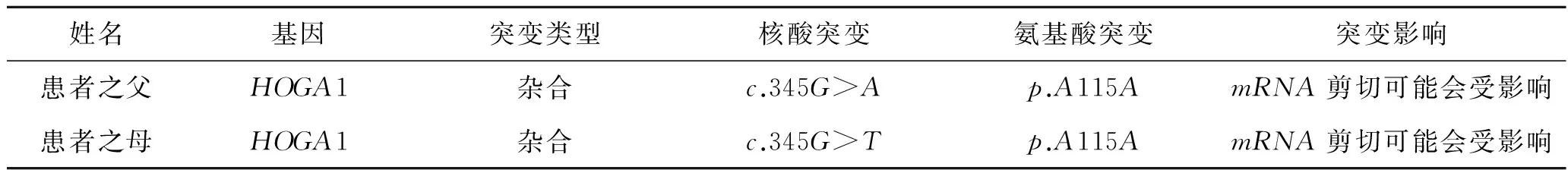
姓名基因突变类型核酸突变氨基酸突变突变影响患者之父HOGA1杂合c.345G>Ap.A115AmRNA剪切可能会受影响患者之母HOGA1杂合c.345G>Tp.A115AmRNA剪切可能会受影响
注:来源于北京德易东方转化医学研究中心。
1.4诊断与治疗诊断:原发性高草酸尿Ⅲ型(PHⅢ)。治疗:嘱患儿大量均匀饮水(>3L/d)(可选用患儿喜欢的果汁、汤汁等,建议定时饮用,以增强其依从性),低草酸饮食,正常钙饮食,限制动物蛋白(尤其是动物皮)的摄入。予以枸橼酸氢钾钠(2.5g,tid)升高尿枸橼酸水平,予以氢氯噻嗪(12.5mg,bid)降低尿钙。
1.5随访随访计划:①每3个月监测一次血常规、尿常规、血电解质,防止发生泌尿系感染及长期服用利尿剂所引起的电解质紊乱。②每3个月监测一次尿草酸、尿钙、尿枸橼酸,观察尿草酸是否下降,并根据尿钙、尿枸橼酸水平调整氢氯噻嗪、枸橼酸氢钾钠用量。③每3个月监测一次肾功能及泌尿系B超,以观察肾内残余结石生长情况及有无新发结石、肾钙质沉积症等。④根据患儿情况及随访结果,调整随访间隔。
随访结果:共随访了半年(2次),患儿血常规、尿常规、血电解质、肾功能基本在正常范围内。患儿尿草酸水平较前基本持平,尿钙水平下降至正常范围,尿枸橼酸水平较前上升。泌尿系B超提示右侧肾集合系统管壁仍见1~2枚增强小光点,左侧2~3枚增强小光点,大小较前无明显增长,双侧输尿管未见扩张及结石。
2讨论
2010年,BELOSTOTSKY等[2]首次提出DHDPSL基因(后命名为HOGA1基因)突变是PHⅢ发生的起点。HOGA1基因位于10号染色体长臂24区(10q24),编码肝脏及肾脏线粒体内4-羟基-2酮戊二酸醛缩酶(HOGA1酶)[3]。研究发现,HOGA1基因片段中导致PHⅢ发生的最常见的突变位点为c.700+5G>T、c.944-966del.AGG[2]。
目前认为HOGA1基因突变导致线粒体内HOGA1酶活性失常,是PHⅢ出现高草酸尿的核心机制[4-6]。BELOSTOTSKY等[6]的假说认为:HOGA1酶为肝脏及肾脏线粒体内催化4-羟基-2酮戊二酸转换为乙醛酸的关键酶,HOGA1基因突变导致线粒体内HOGA1酶活性降低,使得线粒体内4-羟基-2酮戊二酸蓄积,蓄积的4-羟基-2酮戊二酸由线粒体转移至胞质,被胞质内一种类似于HOGA1的酶分解成乙醛酸;而在胞质内由于乳酸脱氢酶活性很强,使得乙醛酸迅速被氧化成草酸,从而使得尿草酸升高[6]。然而该假说尚未被完全证实。
PHⅢ表现为持续性的高草酸尿(>1mmol/1.73m2/24h),但通常尿草酸水平较PHⅠ、PHⅡ低[3,7-8]。PHⅢ患者尿钙和尿尿酸水平较PHⅠ、PHⅡ患者高,常表现为持续性或间歇性的高钙尿和(或)高尿酸尿[7]。本例患儿有高草酸尿、持续性高钙尿,无高尿酸尿,符合以上描述。此外,约50%患者出现轻度的羟乙酸尿[2]。PHⅢ发病年龄常较PHⅠ、PHⅡ早,平均发病年龄为2岁[9],50%在5岁前出现泌尿系结石,但随着年龄增长PHⅢ病程趋于缓和[9],肾钙质沉积症少见,终末期肾病(end-stagerenaldisease,ESRD)及多系统损害至今尚未见报道,为PH中症状最轻一型[10]。本例半年随访肾功能在正常范围,B超示结石未继续增长,提示患儿预后相对良好。PHⅢ患者由于存在高钙,故患者尿草酸钙(CaOx)的饱和度(βCaOx>12)常较PHⅠ(βCaOx<12,正常状态βCaOx<8,相对单位)的高,但PHⅢ却未见ESRD病例[3]。BERND[3]认为,PHⅢ或许存在其他未知的机制能保护肾脏,避免发展成ESRD。
儿童罹患肾结石或成人反复发作的肾结石,且排除继发性原因(如肠源性或食源性原因等导致的高草酸尿)出现持续性的高草酸尿者,应考虑到原发性高草酸尿的可能。若患者有间歇性(或持续性)高钙尿、高尿酸尿,无L-甘油酸尿应高度怀疑PHⅢ的可能。结石成分以二水草酸钙为主的混合性结石则更指向这一诊断[11]。此外,PITT等[12]提出随机尿4-羟基谷氨酸(4OHGlu)升高,可作为PHⅢ的参考诊断。PHⅢ患者尿4OHGlu/尿肌酐为6.5~98μmol/mmol,正常对照组则<4.2μmol/mmol。PHⅢ的确诊则需基因检测,排除AGXT、GRHPR基因突变,若发现纯合HOGA1基因突变或HOGA1基因复合杂合突变,则可确诊为PHⅢ。患者生物学父母为HOGA1基因突变的携带者可以佐证这一诊断。若基因检测仍不能确诊者,可行肝活检分析HOGA1酶活性,以及HOGA1基因mRNA和蛋白表达水平,若发现线粒体内HOGA1酶活性降低,可确诊[1,13]。
PHⅢ缺乏特异性的治疗方法,一些常规的预防结石复发的方法对PHⅢ同样适用。水化:每日饮水量需3~4L,可减少结晶体在集合系统内的聚集。低草酸饮食:限制摄入富含草酸的食物,如菠菜、蕹菜、韭菜、木耳、浓茶和巧克力等。减少羟脯氨酸的摄入:由于羟脯氨酸为4-羟基-2酮戊二酸的前体物质,在肝脏及肾脏线粒体内羟脯氨酸能迅速转变为4-羟基-2酮戊二酸,从而增加PHⅢ患者尿草酸水平。羟脯氨酸主要存在于动物的皮内,因此限制动物的蛋白(尤其是动物皮)摄入对防治PHⅢ有重要价值。有文献提出可用中性磷酸盐治疗PHⅢ,可能与降低尿钙有关,具体机制不明[2]。由于PHⅢ患者存在间歇性高钙尿,因此可以使用噻嗪类利尿剂降低尿钙。另外,常用的防石药物如枸橼酸盐、镁剂等,能抑制结晶聚集与生长,对预防PHⅢ患者结石复发也有一定作用。由于PHⅢ有一定的自限性,预后较好,无ESRD报导,故无需透析、肝肾移植等治疗。
PHⅢ虽为常染色体隐性遗传病,但MONICO等[9]发现两例HOGA1基因突变的杂合子,他们同样有轻度的高草酸尿(0.46~0.8mmol/1.73m2/24h)。他们同时还发现3例HOGA1基因突变的杂合子虽然不伴有高草酸尿,却发生泌尿系结石。基于以上事实,他认为杂合子对HOGA1酶的合成可能存在一定的影响,也可能HOGA1基因突变导致泌尿系结石尚存在其他未知的途径。目前关于PHⅢ发生的机制仍有许多问题悬而未解,有待进一步研究。
总之,PHⅢ为一种因HOGA1基因突变导致相应酶的功能异常,使得尿草酸排泄增加的罕见常染色体隐性遗传病,其具体的致病机制仍不十分明了。该病具有发病年龄早、常伴有高钙尿、不损害肾功能、预后良好等临床特点。结石成分为以二水草酸钙为主的混合性结石,这是其另一重要特点。PHⅢ的确诊则需基因分析,仍不能确诊者则需肝脏穿刺活检。PHⅢ无特异性治疗方法,常规预防结石复发的方法对防治PHⅢ有一定的疗效。
参考文献:
[1]HOPPEB.Anupdateonprimaryhyperoxaluria[J].NatRevNephrol, 2012, 8(8): 467-475.
[2]BELOSTOTSKYR,SEBOUNE,IDELSONGH,etal.MutationsinDHDPSLAreResponsibleForPrimaryHyperoxaluriaTypeIII[J].AmJHumGenet, 2010, 87(3): 392-399.
[3]HOPPEB.Theenzyme4-hydroxy-2-oxoglutaratealdolaseisdeficientinprimaryhyperoxaluriatypeIII[J].NephrolDialTransplant, 2012, 27(8): 3024-3026.
[4]WILLIAMSEL,BOCKENHAUERD,VAN’THOFFW,etal.Theenzyme4-hydroxy-2-oxoglutaratealdolaseisdeficientinprimaryhyperoxaluriatype3 [J].NephrolDialTransplant, 2012, 27(8):3191-3195.
[5]RIEDELTJ,JOHNSONLC,KNIGHTJ,etal.Structuralandbiochemicalstudiesofhuman4-hydroxy-2-oxoglutaratealdolase:implicationsforhydroxyprolinemetabolisminprimaryhyperoxaluria[J].PlosOne, 2011, 6(10).
[6]BELOSTOTSKYR,PITTJJ,FRISHBERGY,etal.PrimaryhyperoxaluriatypeIII-amodelforstudyingperturbationsinglyoxylatemetabolism[J].JMolMed(Berl), 2012, 90(12): 1497-1504.
[7]CELLINIB,OPPICIE,PAIARDINIA,etal.Molecularinsightsintoprimaryhyperoxaluriatypeipathogenesis[J].FrontBiosci(LandmarkEd), 2012, 17: 621-634.
[8]CRAMERSD,FERREEPM,LINK,etal.Thegeneencodinghydroxypyruvatereductase(GRHPR)ismutatedinpatientswithprimaryhyperoxaluriatypeII[J].HumMolGenet, 1999, 8(11): 2063-2069.
[9]MONICOCG,ROSSETTIS,BELOSTOTSKYR,etal.PrimaryHyperoxaluriaTypeⅢgeneHOGA1 (formerlyDHDPSL)asapossibleriskfactorforidiopathiccalciumoxalateurolithiasis[J].ClinJAmSocNephrol, 2011, 6(9): 2289-2295.
[10]BECKBB,BAASNERA,BUESCHERA,etal.NovelfindingsinpatientswithprimaryhyperoxaluriatypeIIIandimplicationsforadvancedmoleculartestingstrategies[J].EurJHumGenet, 2013, 21(2): 162-172.
[11]JACOBDE,GROHEB,GEβNERM,etal.KidneyStonesinPrimaryHyperoxaluria:NewLessonsLearnt[J].PlosOne, 2013, 8(8).
[12]PITTJJ,WILLISF,TZANAKOSN,etal. 4-hydroxyglutamateisabiomarkerforprimaryhyperoxaluriatype3 [J].JIMDRep, 2015, 15: 1-6.
[13]WILLIAMSEL,BAGGEA,MUELLERM,etal.PerformanceevaluationofSangersequencingforthediagnosisofprimaryhyperoxaluriaandcomparisonwithtargetednextgenerationsequencing[J].MolGenetGenomicMed, 2015, 3(1): 69-78.
(编辑何宏灵)
收稿日期:2015-09-08修回日期:2015-12-02
通讯作者:孙西钊,主任医师,教授,博士研究生导师.
作者简介:周乐卿(1988-),男(汉族),硕士.研究方向:泌尿系结石. E-mail:zhouleqing168@sina.com
中图分类号:R696.5
文献标志码:A
DOI:10.3969/j.issn.1009-8291.2016.04.010
Primary hyperoxaluria type Ⅲ in one patient and literature review
ZHOU Le-qing1, WANG Qiang2, ZHANG Li-ming1, NING Ben-xiang1, ZHANG Yi-fan1, SUN Xi-zhao1
(1.DepartmentofUrology,AffiliatedDrumTowerHospitalofMedicalCollegeofNanjingUniversity,Nanjing210008; 2.FirstClinicalMedicalCollege,NanjingUniversityofTraditionalChineseMedicine,Nanjing210029,China)
ABSTRACT:ObjectiveTo summarize the clinical data of a child with primary hyperoxaluria type Ⅲ (PH Ⅲ) so as to improve the understanding on this disease. MethodsThe medical records of this child were collected, his clinical characteristics were summarized, and the stone composition and metabolism were evaluated. The mutant site of HOGA1 gene of the child’s parents was sequenced. The child was closely followed up and relevant literatures were review. ResultsIVS2+1G>T, c.345G>T and c.345G>A heterozygous mutation in HOGA1 gene were detected in the child. HOGA1 gene analysis showed his mother had IVS2+1G>T and c.345G>T heterozygous mutation, and his father had c.345G>A heterozygous mutation. The child had compound heterozygous mutation of HOGA1 gene, while the three mutations had not been reported in the literatures. The child was instructed to drink large amounts of liquid, eat low-oxalate and normal calcium diet, and limit intake of animal protein. Potassium sodium hydrogen citrate was used to increase urinary citrate level, and hydrochlorothiazide was used to reduce urinary calcium level. After a follow-up of 6 months, urinary oxalate level essentially flatted compared with the previous level, urinary calcium level dropped to normal range, urinary citrate level increased than before, and renal function was within the normal range. Urinary B ultrasound indicated that stones had no significant increase. ConclusionsPH Ⅲ has an early onset. The stone composition is mixed calcium stones with calcium oxalate dehydrate, which is not associated with renal dysfunction generally. Genetic analysis is a non-invasive and effective means for the diagnosis. The genetic analysis of the patients’ parents is helpful for the diagnosis. Early diagnosis and intervention have an important role in preventing further development of the disease.
KEY WORDS:primary hyperoxaluria; HOGA1 gene; urinary calculus; gene analysis; stone composition
E-mail:sunxizhaonj@163.com
