褪黑素对糖尿病性勃起功能障碍大鼠的神经保护作用及可能的机制研究
2016-08-03雷洪恩杨璧铖辛钟成侯建全
惠 宇,周 峰,雷洪恩,杨璧铖,辛钟成,侯建全
(1.苏州大学附属第一医院泌尿外科,江苏苏州 215006;2.北京大学第一医院男科中心,北京 100034)
·基础研究·
褪黑素对糖尿病性勃起功能障碍大鼠的神经保护作用及可能的机制研究
惠宇1,周峰1,雷洪恩2,杨璧铖2,辛钟成2,侯建全1
(1.苏州大学附属第一医院泌尿外科,江苏苏州215006;2.北京大学第一医院男科中心,北京100034)
摘要:目的探讨褪黑素(melatonin,MT)对糖尿病性勃起功能障碍大鼠的神经保护作用及可能机制。方法28只SD大鼠腹腔注射链脲佐菌素建立糖尿病模型,8周后,糖尿病(diabetes mellitus, DM)大鼠随机分为DM组和MT组,分别每天腹腔注射磷酸盐缓冲液(PBS)和MT。另外12只正常大鼠为N组,每天腹腔注射PBS。治疗4周后,检测各组大鼠阴茎海绵体内压、平均动脉压、阴茎背神经(dorsal penile nerve,DPN)和盆神经节(major pelvic ganglion,MPG)病变情况。对阴茎海绵体纤维化情况、丙二醛含量、超氧化物歧化酶活性、p38和p-p38水平也进行了测定。结果DM组糖尿病大鼠勃起功能明显下降,DPN和MPG发生了明显的神经退行性病变,同时阴茎海绵体内胶原蛋白沉积增多,氧化应激和p-p38蛋白水平升高。褪黑素治疗显著提高了糖尿病大鼠的勃起功能,改善DPN和MPG神经病变,减少胶原纤维沉积并且降低了氧化应激与p-p38蛋白水平。结论MT治疗可以有效提高糖尿病大鼠的勃起功能,改善阴茎背神经、盆神经节病变,减轻阴茎纤维化情况。其机制可能是通过降低糖尿病大鼠阴茎内氧化应激水平以及抑制p38MAPK信号通路。
关键词:勃起功能障碍;糖尿病;褪黑素;神经保护作用;抗氧化;p-p38
勃起功能障碍(erectiledysfunction,ED)和糖尿病(diabetesmellitus,DM)都是棘手的健康问题,DM是ED的危险因素,约50%的男性DM患者会发生ED[1]。糖尿病性勃起功能障碍(diabetesmellitusinducederectiledysfunction,DMED)的机制复杂,涉及到内皮损伤、神经病变、微血管及纤维肌肉的改变等。DM容易发生微血管病变,引起神经缺血导致周围神经和自主神经症状。持续高血糖状态可以诱导产生过量的氧自由基,进一步影响神经、平滑肌和内皮功能[2]。因而DMED症状往往比非糖尿病性ED更严重,需要更积极的治疗[1]。褪黑素(melatonin,MT)主要由松果体分泌,具有抗氧化、抗炎及免疫调节等多种生物功能。近来,MT在神经保护方面的作用受到了越来越积极的关注[3]。糖尿病性神经病变在DEMD的发生发展中起着重要的作用,因此减少神经氧化应激损伤、促进恢复神经功能不失为治疗DMED的良好策略[4]。本实验在建立DMED大鼠模型基础上给予MT治疗,观察MT干预治疗对糖尿病性勃起功能障碍大鼠神经病变及相关信号通路的影响,以探讨MT改善糖尿病勃起功能障碍的机制。
1材料与方法
1.1实验试剂与仪器MT,链脲佐菌素(streptozotocin,STZ)(美国Sigma公司),水合氯醛(苏州大学实验动物中心提供),总蛋白提取试剂盒、Masson染色试剂盒(南京凯基生物科技发展有限公司),OCT冰冻包埋剂(美国Sakura公司),抗神经型一氧化氮合酶(neuronalnitricoxidesynthase,nNOS)、抗神经丝蛋白(neurofilament,NF)、抗p38及p-p38抗体(美国Abcam公司),抗GAPDH抗体(北京中杉金桥生物技术有限公司),抗兔荧光二抗(美国InvitrogenLife公司),超氧化物歧化酶(superoxidedismutase,SOD)及丙二醛(malondialdehyde,MDA)试剂盒(上海碧云天生物技术有限公司),MP150多导电生理仪(美国Biopac公司),光学显微镜及荧光显微镜(德国Leica公司)。
1.2实验动物分组及处理本实验取8周大Sprague-Dawley(SD)大鼠40只,体质量275~300g,由苏州大学实验动物中心提供。随机选12只大鼠作为正常对照(N组),其余28只大鼠禁食后腹腔注射STZ(60mg/kg)造糖尿病模型,3d后检测血糖确认25只大鼠成模。8周后,随机分为糖尿病组(DM组,n=12)和MT治疗组(MT组,n=13),N组和DM组给予每天腹腔注射磷酸缓冲盐溶液(10mL/kg),MT组每天腹腔注射MT(10mg/kg)。治疗4周后10%水合氯醛麻醉,测定勃起功能,处死并取材。
1.3海绵体内压(intracavernouspressure,ICP)与平均动脉压(meanarterialpressure,MAP)测定10%水合氯醛麻醉大鼠后,备皮消毒,通过下腹正中切口,暴露盆神经节和阴茎海绵体神经,打开阴茎部皮肤暴露大鼠阴茎,暴露左侧颈总动脉,穿刺阴茎和颈总动脉,与MP150电生理仪连接。电极刺激阴茎海绵体神经,参数为20Hz、0.2ms、1.5mA,刺激50s,测量ICP及MAP。
1.4超氧化物歧化酶(superoxidedismutase,SOD)和丙二醛(malondialdehyde,MDA)检测用总蛋白提取试剂盒提取阴茎组织蛋白,喹啉酸法进行蛋白定量。SOD活性用黄嘌呤氧化法显色,在450nm测定吸光度来定量检测SOD。MDA含量通过硫代巴比妥酸法显色,在535nm测定吸光度来定量检测MDA。操作步骤均严格遵照试剂盒说明进行。
1.5免疫荧光将阴茎组织及盆神经节在PBS配制的4%多聚甲醛中固定4h,随后浸入30%蔗糖4 ℃过夜。用OCT包埋后切成5μm厚冰冻切片,按组别编号。PBS清洗3次,用0.3%Triton-100及1%羊血清通透封闭30min,加入一抗为nNOS抗体(浓度1∶400)和NF抗体(1∶500),4 ℃孵育过夜。PBS清洗3次,加入荧光二抗AlexaFluor594避光反应80min,清洗后DAPI染细胞核,封片,在荧光显微镜下观察,结果用Image-ProPlus6.0分析。
1.6Masson染色阴茎组织用4%多聚甲醛固定,脱水、透明、石蜡包埋后,切成4μm厚石蜡切片。常规脱蜡至水,Masson复合染液染色5min,0.125%醋酸水溶液清洗2次,随后用5%磷钨酸染色5min,清洗后亮绿染色5min,醋酸水洗2次。梯度乙醇脱水,二甲苯透明封片,用光学显微镜观察记录,结果用Image-ProPlus6.0分析。
1.7蛋白免疫印迹法(Westernblot)测定提取各组阴茎组织总蛋白,BCA法检测蛋白浓度。将样品和Marker加入10%浓度的十二烷基磺酸钠-聚丙烯酰胺凝胶中电泳分离,随后电转移到聚偏二氟乙烯滤膜上,用含5%牛奶TBST封闭2h,加入一抗nNOS(1∶400)、p38(1∶1 000)、p-p38(1∶1 000)和GAPDH(1∶20 000)在4℃过夜。复温1h,TBST清洗3次,加入二抗常温反应1h,随后清洗3次,加入发光液用C-digit仪器进行电化学发光,ImageJ图像分析软件分析条带的整合密度值(IntegratedDensity)。
1.8统计分析采用SPSS19.0软件进行数据分析,进行正态性和方差齐性的检验,结果表示为平均值±标准差,两组间的比较采用t检验的方法,以P<0.05差异具有统计学意义。
2结果
2.1动物情况DM组及MT组各有1只大鼠死亡,予以剔除,N组大鼠无死亡情况。表1示各组初始体重及初始血糖均无显著差异(P>0.05)。与N组相比,DM组和MT组大鼠的终末体重均显著降低(P<0.05),DM组和MT组大鼠的终末血糖均显著升高(P<0.05),DM组与MT组之间无显著差别(P>0.05)。
表1各组大鼠体重、血糖变化
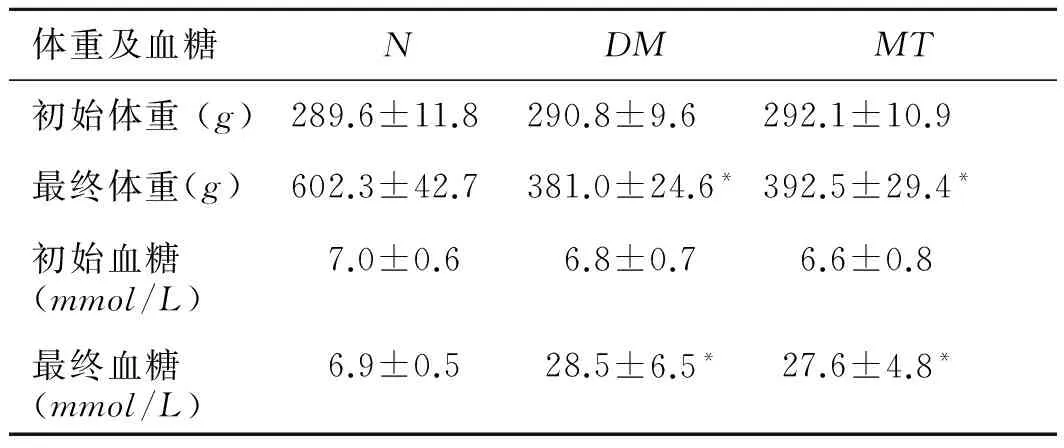
体重及血糖NDMMT初始体重(g)289.6±11.8290.8±9.6292.1±10.9最终体重(g)602.3±42.7381.0±24.6*392.5±29.4*初始血糖(mmol/L)7.0±0.66.8±0.76.6±0.8最终血糖(mmol/L)6.9±0.528.5±6.5*27.6±4.8*
与N组相比,*P<0.05。
2.2ICP/MAP检测结果图1示DM组大鼠最大ICP值与ICP/MAP值均显著低于N组大鼠(P<0.05),MT治疗后ICP及ICP/MAP显著升高(P<0.05),MT组大鼠最大ICP与ICP/MAP值仍低于N组大鼠(P<0.05)。
2.3褪黑素治疗对DMED大鼠阴茎海绵体SOD及MDA的影响图2示DM组大鼠阴茎海绵体内SOD活性显著低于N组大鼠(P<0.05),MT治疗后,SOD活性得到了显著的提高(P<0.05),仍没有达到N组大鼠水平(P<0.05)。DM组大鼠阴茎海绵体中MDA含量显著高于N组大鼠(P<0.05),MT治疗后,MDA含量明显降低(P<0.05)。MT组大鼠阴茎海绵体中MDA含量仍高于N组大鼠(P<0.05)。
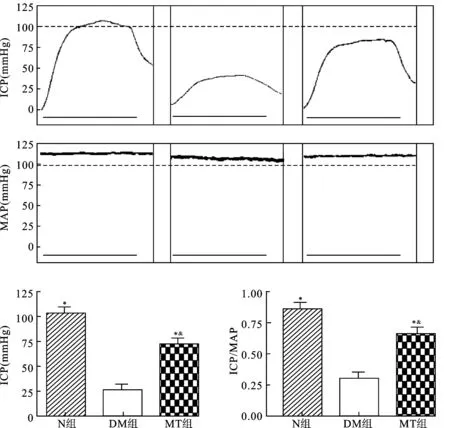
图1各组大鼠ICP及ICP/MAP
与DM组相比,*P<0.05;与N组相比,&P<0.05。
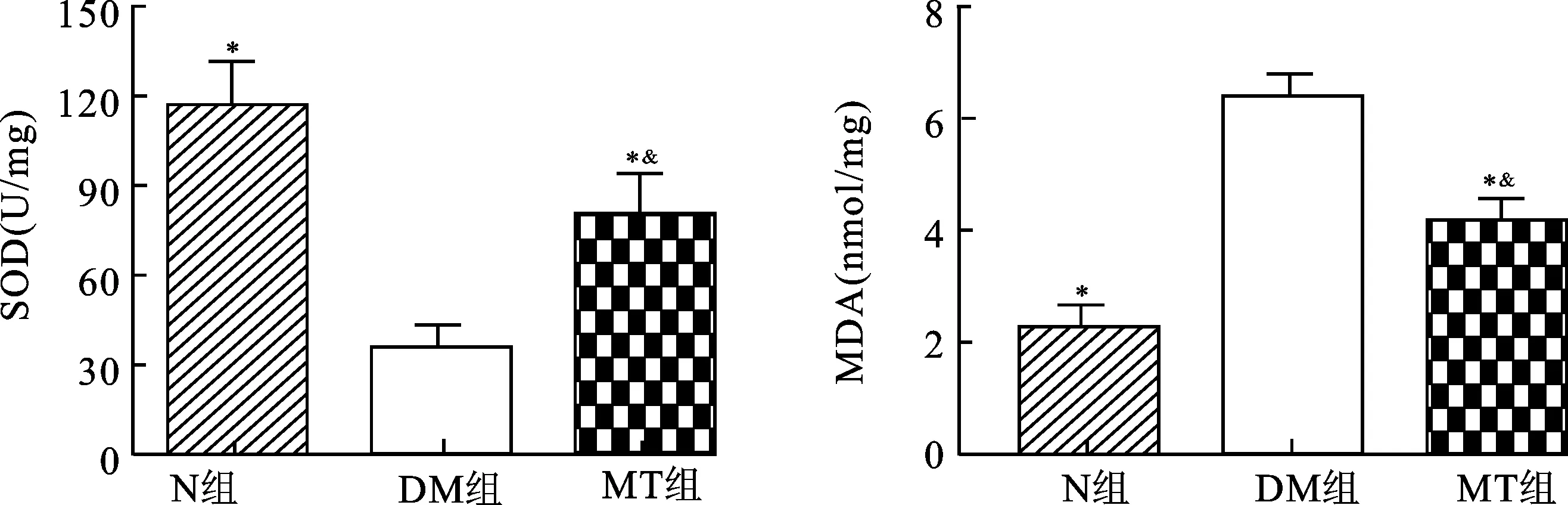
图2 各组大鼠阴茎SOD及MDA含量
2.4褪黑素治疗对DMED大鼠阴茎背神经nNOS、NF含量及盆神经节nNOS阳性细胞数的影响图3为各组大鼠阴茎蛋白免疫印迹及免疫荧光结果,显示DM组大鼠阴茎背神经(DPN)的nNOS阳性表达较N组大鼠明显减少(P<0.05),MT治疗可以显著提高DMED大鼠阴茎背神经nNOS的表达(P<0.05)。图4免疫荧光结果显示DM组大鼠阴茎背神经NF阳性纤维数及盆神经节nNOS阳性细胞数与N组大鼠相比均明显下降(P<0.05),MT治疗能显著增加大鼠阴茎背神经NF(P<0.05)及盆神经节中nNOS阳性数(P<0.05),MT组大鼠这些指标均没有恢复到N组大鼠的水平(P<0.05)。
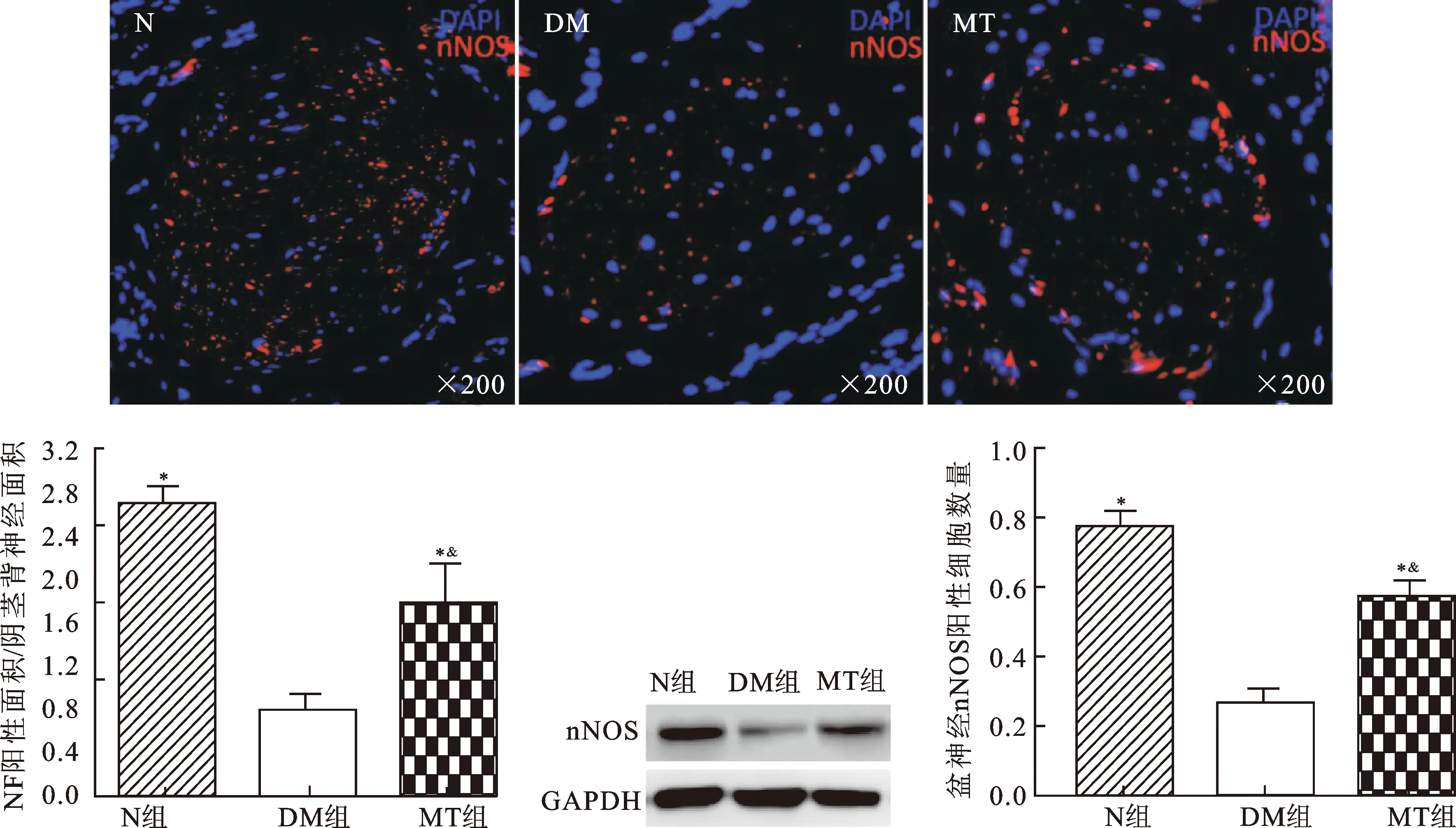
图3各组大鼠阴茎nNOS表达情况
与DM组相比,*P<0.05;与N组相比,&P<0.05。
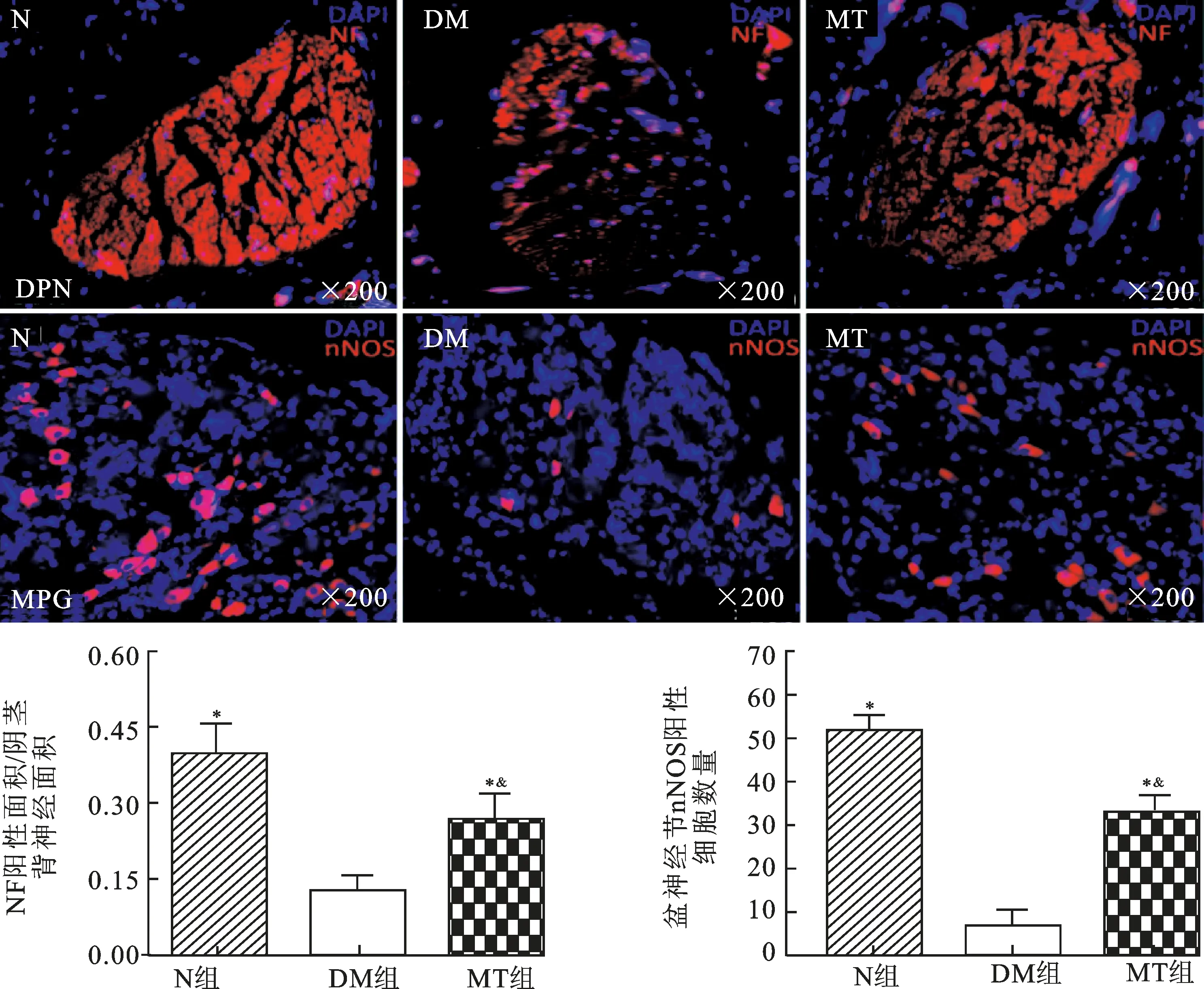
图4 各组大鼠阴茎背神经NF及盆神经节nNOS阳性表达情况
2.5褪黑素治疗对DMED大鼠阴茎海绵体胶原纤维沉积的影响图5为各组大鼠阴茎Masson染色,结果显示DM组大鼠阴茎海绵体平滑肌与胶原纤维比例与N组大鼠相比明显下降(P<0.05),MT治疗能够显著增加DMED大鼠海绵体平滑肌与胶原纤维比例(P<0.05),MT组大鼠阴茎海绵体平滑肌与胶原纤维比例低于N组大鼠(P<0.05)。
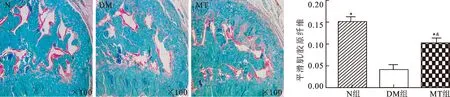
图5各组阴茎MASSON染色
与DM组相比,*P<0.05;与N组相比,&P<0.05。
2.6褪黑素治疗对DMED大鼠阴茎p38MAPK通路的影响图6蛋白免疫印迹结果显示DM组糖尿病大鼠阴茎p-p38水平较N组大鼠明显升高(P<0.05),MT治疗能显著降低p-p38水平(P<0.05),MT组大鼠阴茎p-p38水平仍高于N组大鼠(P<0.05)。
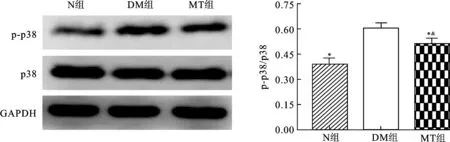
图6各组大鼠阴茎p38及p-p38蛋白表达情况
与DM组相比,*P<0.05;与N组相比,&P<0.05。
3讨论
阴茎海绵体神经末梢及内皮细胞释放的一氧化氮(nitricoxide,NO)可以刺激环磷酸鸟苷(cyclicguanosinemonophosphate,cGMP)产生,cGMP的积累会舒张海绵体平滑肌,促进血液供应,导致勃起[5]。DM可以通过多种病理生理途径导致ED,包括神经病变、肌肉结构功能改变以及内皮功能紊乱等。其中神经病变是DM患者发生ED的重要促成因素。糖尿病可以导致选择性神经退行性病变,降低神经元型一氧化氮合酶(neuronalnitricoxidesynthase,nNOS)的活性,从而使NO释放减少,影响阴茎海绵体肌肉的舒张,形成勃起功能障碍,因此氮能神经的完整性对于维持阴茎正常勃起十分重要。我们的前期研究表明诱发糖尿病3个月后,大鼠阴茎背神经丛nNOS阳性纤维数减少,盆神经节出现粗面内质网高度扩张,线粒体肿胀、空泡变性,线粒体嵴溶解断裂及溶酶体减少等神经退行性改变[6]。也有研究发现糖尿病大鼠阴茎背神经丛的神经病变可能同时发生在细胞体及轴突,糖尿病前期发生的多为神经功能性改变,而随着病程延长更容易发生氮能神经不可逆的结构改变[7]。本实验中,我们选取检测阴茎背神经及大鼠盆神经节来反映DMED大鼠的神经退变情况。免疫荧光结果显示DM组糖尿病大鼠阴茎背神经及盆神经节均发生不同程度退行性改变,阴茎背神经nNOS及神经丝蛋白表达量均明显减少,盆神经节nNOS阳性细胞数减少,勃起功能显著降低,提示糖尿病性神经退行性病变影响勃起功能。
褪黑素(MT)是一种松果体分泌的胺类激素,具有抗氧化、抗炎及免疫调节等多种生物功能。MT能直接进入细胞或者细胞器清除自由基,来保护细胞核DNA和胞质蛋白,也可以间接刺激增强抗氧化酶的活性和相关基因的表达来发挥抗氧化作用。而氧化应激被认为是神经退行性病变的病理生理机制[4]。在本实验中,DMED大鼠阴茎海绵体内SOD活性显著降低,而MDA含量显著增高,提示阴茎海绵体发生了氧化损伤,MT治疗后SOD活性显著升高,并且MDA含量减少,说明MT治疗在阴茎海绵体内产生了有效的抗氧化作用。这与先前报道的MT治疗可以部分改善糖尿病性勃起功能障碍大鼠阴茎氧化应激状态的结果一致[8]。我们还观察到MT治疗显著增加了糖尿病大鼠阴茎背神经nNOS及神经丝蛋白含量,恢复了大鼠盆神经节nNOS阳性细胞数量。这些结果表明,褪黑素治疗在DMED大鼠神经退变中起到了良好的神经保护与恢复作用。
另外,MT可以抑制氧化应激所激活的多种通路,包括p38丝裂原活化蛋白激酶(p38mitogen-activatedproteinkinase,p38MAPK)和哺乳动物雷帕霉素靶向基因(mammaliantargetofrapamycingene,mTOR)通路等[9]。p38MAPK是MAPKs超家族的重要成员,其广泛分布于生物体内,能被诸多细胞应力激活包括氧化应激、糖尿病高血糖及炎症等[10]。p38MAPK信号通路在糖尿病神经退行性病变中也起着重要的作用,p38磷酸化为p-p38参与了糖尿病及多种并发症的形成过程[11]。也有研究表明p-p38激活与糖尿病性氮能神经血管功能障碍密切相关,并且这种功能障碍能够被p38MAPK信号通路抑制剂所部分逆转[12]。在本实验中,Westernblot结果显示DMED大鼠阴茎p-p38水平显著升高,表明糖尿病及其氧化应激状态可以刺激p38MAPK信号通路激活,这可能是糖尿病发生神经退变及血管并发症的机制。有意义的是褪黑素治疗后,DMED大鼠阴茎p-p38水平下降,提示褪黑素可能通过抑制p38MAPK信号通路改善糖尿病性神经退行性病变。
我们前期在DMED大鼠模型中观察到了阴茎海绵体平滑肌减少、胶原纤维沉积的现象,这可能与阴茎海绵体转化生长因子β1(TGF-β1)水平升高有关[13]。阴茎平滑肌及胶原蛋白比例失调是DMED发生的重要因素,糖尿病性神经退行性病变可以影响平滑肌细胞的舒张,p38MAPK信号通路的激活也可以使多种致纤维化细胞因子增多,这些因素可能会加重阴茎海绵体纤维化[14]。因此抑制p38MAPK通路、恢复神经功能有可能改善胶原纤维沉积。本实验中,Masson染色结果显示,与N组正常大鼠相比,DM组糖尿病大鼠阴茎海绵体平滑肌与胶原蛋白比例明显下降,阴茎海绵体纤维化加重。褪黑素治疗后平滑肌与胶原蛋白比例显著上升,提示褪黑素治疗能够改善阴茎纤维化,保护阴茎平滑肌的结构,这些结果进一步支持了褪黑素抑制DMED大鼠阴茎p38MAPK通路,并发挥了良好的神经保护作用。
褪黑素虽然能够显著提高DMED大鼠的勃起功能,但其恢复效果并没有完全达到正常组大鼠水平,糖尿病高血糖并没有得到治疗,可能对DMED大鼠产生持续性损伤,因此褪黑素合并胰岛素控制血糖治疗会是更好的治疗DMED的途径[15]。本实验证明褪黑素治疗显著改善DMED大鼠阴茎背神经及盆神经节病变,有效减轻阴茎胶原蛋白沉积,其机制可能是通过抗氧化作用及抑制p38MAPK信号通路。
参考文献:
[1]WALSHTJ,HOTALINGJM,SMITHA,etal.Menwithdiabetesmayrequiremoreaggressivetreatmentforerectiledysfunction[J].IntJImpotRes,2014,26(3):112-115.
[2]LONGT,LIUG,WANGY,etal.TNF-alpha,erectiledysfunction,andNADPHoxidase-mediatedROSgenerationincorpuscavernosuminhigh-fatdiet/streptozotocin-induceddiabeticrats[J].JSexMed,2012,9(7):1801-1814.
[3]JENWITHEESUKA,NOPPARATC,MUKDAS,etal.Melatoninregulatesagingandneurodegenerationthroughenergymetabolism,epigenetics,autophagyandcircadianrhythmpathways[J].IntJMolSci,2014,15(9):16848-16884.
[4]HOSSEINIA,ABDOLLAHIM.Diabeticneuropathyandoxidativestress:therapeuticperspectives[J].OxidMedCellLongev,2013,2013:168039.
[5]THORVEVS,KSHIRSAGARAD,VYAWAHARENS,etal.Diabetes-inducederectiledysfunction:epidemiology,pathophysiologyandmanagement[J].JDiabetesComplications,2011,25(2):129-136.
[6]BAIGY,ZHOUF,HUIY,etal.EffectsofIcarisideIIoncorpuscavernosumandmajorpelvicganglionneuropathyinstreptozotocin-induceddiabeticrats[J].IntJMolSci,2014,15(12):23294-23306.
[7]CELLEKS,FOXWELLNA,MONCADAS.Twophasesofnitrergicneuropathyinstreptozotocin-induceddiabeticrats[J].Diabetes,2003,52(9):2353-2362.
[8] 李小鑫,邱雪锋,解吕中,等. 褪黑素抗氧化治疗糖尿病大鼠阴茎勃起功能障碍的研究[J]. 现代泌尿外科杂志,2013,18(5):471-474.
[9]KIMBALLSR,ABBASA,JEFFERSONLS.Melatoninrepressesoxidativestress-inducedactivationoftheMAPkinaseandmTORsignalingpathwaysinH4IIEhepatomacellsthroughinhibitionofRas[J].JPinealRes,2008,44(4):379-386.
[10]ZARUBINT,HANJ.Activationandsignalingofthep38MAPkinasepathway[J].CellRes, 2005,15(1):11-18.
[11]PURVEST,MIDDLEMASA,AGTHONGS,etal.Aroleformitogen-activatedproteinkinasesintheetiologyofdiabeticneuropathy[J].FASEBJ,2001,15(13):2508-2514.
[12]NANGLEMR,COTTERMA,CAMERONNE.Correctionofnitrergicneurovasculardysfunctionindiabeticmousecorpuscavernosumbyp38mitogen-activatedproteinkinaseinhibition[J].IntJImpotRes,2006,18(3):258-263.
[13]ZHOUF,XINH,LIUT,etal.EffectsoficarisideIIonimprovingerectilefunctioninratswithstreptozotocin-induceddiabetes[J].JAndrol,2012,33(5):832-844.
[14]MAOZM,WANYG,SUNW,etal.Effectsandmechanismsofhuangkuicapsuleamelioratingrenalfibrosisindiabeticnephropathyratsviainhibitingoxidativestressandp38MAPKsignalingpathwayactivityinkidney[J].ZhongguoZhongYaoZaZhi,2014,39(21):4110-4117.
[15] 陈翔. 褪黑激素与勃起功能障碍[J]. 中国男科学杂志,2015,29(3):66-68.
(编辑王玮)
收稿日期:2015-10-24修回日期:2015-4-25
基金项目:国家自然科学基金(No.81300478),江苏省自然科学基金(No.BK20130269),江苏省卫生厅医学科研项目(No.H201312),苏州市科学发展计划项目(No.SYS201450)
通讯作者:侯建全,教授、主任医师.E-mail:xf192@163.com
作者简介:惠宇(1989-),男(汉族),医师,医学硕士,研究方向:泌尿外科(男科).E-mail:huiyfishing@126.com
中图分类号:R698.1
文献标志码:A
DOI:10.3969/j.issn.1009-8291.2016.04.018
Neuroprotective effects and the possible mechanism of melatonin on erectile dysfunctionin streptozotocin-induced diabetic rats
HUI Yu1, ZHOU Feng1, LEI Hong-en2, YANG Bi-cheng2, XIN Zhong-cheng2, HOU Jian-quan1
(1.DepartmentofUrology,FirstAffiliatedHospitalofSoochowUniversity,Suzhou215006; 2.MolecularBiologyLaboratoryofAndrologyCenter,FirstHospitalofPekingUniversity,Beijing100034,China)
ABSTRACT:Objective To explore the neuroprotective effects and possible mechanism of melatonin (MT) on erectile dysfunction in streptozotocin-induced diabetic rats. MethodsA total of 28 SD rats received intraperitoneal injection of streptozotocin. After 8 weeks, the determined diabetic rats were randomly divided into 2 groups: DM group (which received intraperitoneal injection of phosphate buffer solution (PBS) daily), and MT group (which received MT injection). Another 12 normal rats served as controls and received PBS treatment daily. After 4 weeks, intracavernous pressure (ICP), mean arterial pressure (MAP), pathological changes in penis and major pelvic ganglion (MPG) were measured in all rats. Malondialdehyde (MDA), superoxide dismutase (SOD), p38 and p-p38 levels in penis were detected. ResultsDiabetic rats showed significant decreases of erectile function accompanied with serious neuropathy in dorsal penile nerve (DPN) and MPG; meanwhile, collagen deposition, oxidative stress and p-p38 levels in penis were elevated. Melatonin treatment partially but significantly improved the erectile function, ameliorated neuropathy in DPN and MPG, decreased collagen deposition, oxidative stress and p-p38 levels in diabetic rats. ConclusionsMelatonin treatment can improve erectile function, ameliorate neuropathy and fibrosis in diabetic rats. The underlying mechanism may involve regulating oxidative stress and inhibiting p38MAPK signaling pathway.
KEY WORDS:erectile dysfunction; diabetes mellitus; melatonin; neuroprotective; antioxidation; p-p38
