黄芩素对阿尔茨海默病大鼠早期脑组织蛋白表达谱的影响
2016-08-01王文潇卫东锋张占军程卫东
王文潇 卫东锋 张占军 程卫东

摘要:目的 观察黄芩素对阿尔茨海默病(AD)大鼠发病早期认知功能和皮层、海马组织蛋白表达谱的影响,探讨其作用机制。方法 实验大鼠随机分为对照组、模型组、黄芩素组,每组12只。黄芩素组大鼠予黄芩素药液灌胃,模型组和对照组大鼠予等量生理盐水灌胃。灌胃体积均为2 mL,连续10 d。利用Morris水迷宫评估治疗效果,并运用双向凝胶电泳技术对脑组织蛋白进行分离,考马斯蓝染显色,应用PDQuest8.0软件对双向电泳图谱进行差异分析,通过MALDI-TOF-MS/MS和数据库查询鉴定差异明显的蛋白质点,并利用String在线分析软件对差异表达蛋白进行生物信息学分析。结果 黄芩素可显著缓解β-淀粉样蛋白(Aβ)1-40导致的认知功能减退。黄芩素作用下,位于大鼠大脑皮层和海马组织的8种蛋白表达水平变化明显。质谱鉴定结果显示,差异蛋白涉及4种生物学功能,与神经传导关系最为密切,其中3种蛋白与其他蛋白存在相互作用关系。结论 黄芩素对AD大鼠早期认知功能损伤的改善作用与其能够调节神经传导相关蛋白的表达相关。
关键词:阿尔茨海默病;β-淀粉样蛋白;黄芩素;神经传导;蛋白组学;学习记忆;大鼠
DOI:10.3969/j.issn.1005-5304.2016.08.016
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2016)08-0059-05
阿尔茨海默病(Alzheimers disease,AD)是一种危害老年人健康、影响老年人生活质量的神经退行性疾病。自20世纪90年代起我国步入老龄化社会,AD发病率逐年增高[1]。其主要临床表现为记忆下降与认知功能障碍,病理学表现有脑细胞外β-淀粉样蛋白(β-amyloid protein,Aβ)沉积形成的神经炎性斑(neuritic plaques,NP)与脑细胞内高度磷酸化的tau蛋白形成神经元纤维缠结(neurofibrillary tangles,NFTs)[2]。目前,由于AD病因不明,现有西药只能缓解症状而不能针对病因进行治疗,新药的研发又处于瓶颈期难以突破。药用植物学逐渐成为近年来的研究热点。因此,从传统中草药中寻找对AD有疗效的活性单体是一项具有广阔前景与实际意义的工作。黄芩(Radix Scutellariae)为唇形科植物黄芩Scutellaria baicalensis Georgi的干燥根。《神农本草经》载黄芩有“诸热黄胆,肠泄痢,逐水,下血闭,恶疮疽蚀火疡”功效。现代药理研究表明,黄芩不仅有传统的抗菌、抗炎等功效,还可作用于神经系统。黄芩水提物对脑出血大鼠血脑屏障损伤有一定的治疗和保护作用[3]。黄芩中具有生物活性的黄酮类物质黄芩素可通过抗细胞凋亡、抗氧化等机制起到神经保护作用[4]。本实验旨在利用蛋白组学技术对比黄芩素治疗前后AD模型大鼠脑组织皮层及海马组织蛋白表达谱的差异,利用双向凝胶电泳(2-DE)、MALDI-TOF-MS/MS、数据库查询和生物信息学分析技术研究由Aβ1-40和黄芩素治疗所导致的大鼠大脑皮层和海马的差异蛋白,从亚细胞蛋白水平寻找证据,为黄芩素作为治疗AD的临床药物提供更充分的实验依据。
1 实验材料
1.1 药物
黄芩素,瑞士Fluka Bio Chemika公司,溶于生理盐水,用NaOH溶液将pH值调至10。
1.2 动物
雄性SPF级SD大鼠36只,4月龄,体质量250~300 g,北京华阜康生物科技股份有限公司,许可证号SCXK(京)2009-0015。饲养于北京中医药大学东方医院实验中心SPF级动物实验室,温度(22±2)℃,相对湿度(55±5)%,人工光照时间为明暗各12 h。
1.3 主要试剂与仪器
Aβ1-40,美国Sigma-Aldrich公司,实验前将其用无菌生理盐水稀释至10 mg/mL,4 ℃孵育48 h至Aβ1-40多聚体,4 ℃冰箱保存备用。0.25%TrypsinEDTA(美国Gibco公司),六氟异丙醇[阿拉丁试剂(中国)有限公司];二甲基亚砜(DMSO,北京索莱宝科技有限公司)。IPG缓冲液、蛋白酶抑制剂,美国Sigma公司;Morris水迷宫DMS-3,中国医学科学院药物所;CLASS100型超净工作台,珠海造鑫企业有限公司;MilliQ超纯水系统,Millipore公司;IX71型倒置荧光相差显微镜、BX-60型倒置荧光相差显微镜数码相机,日本Olympus公司;JY92-2D超声波细胞破碎机,宁波新芝公司;ELX80酶标仪,美国Bio-Tek公司;1/1000A2005型精密电子天平,德国Saitorius公司;5415D型低温高速多功能离心机,德国Eppendorf公司。
2 实验方法
2.1 分组
实验大鼠随机分为对照组、模型组、黄芩素组,每组12只。
2.2 造模
参照文献[5]方法,大鼠腹腔注射1%戊巴比妥钠40 mg/kg麻醉,麻醉后利用脑立体定向仪固定大鼠头部,分离骨膜暴露头骨,按照大鼠脑立体定位图谱,选择双侧海马CA1区为注射靶区,用牙科钻打开颅骨,用5 μL微量进样器显微注射,5 min内缓慢匀速注入4 μL Aβ1-40多聚体并留针5 min,缝合伤口。
2.3 给药
造模后4 d开始灌胃给药,参照文献[6-7]及前期实验基础,黄芩素组每日予黄芩素80 mg/kg灌胃,模型组和对照组每日予等量生理盐水灌胃。灌胃体积均为2 mL,连续10 d。
2.4 Morris水迷宫实验
造模给药结束后,应用Morris水迷宫对大鼠的空间学习和记忆能力进行评价。水迷宫直径150 cm,高50 cm,恒温23 ℃。水池被平均分为4个象限,在其中一个象限中央放置距离水面2 cm、直径15 cm的圆形平台。正式测试前进行连续5 d的可视平台实验,平台位于目标象限并使其顶部高于水面2 cm,记录大鼠找到平台的逃避潜伏期和总路线。再进行定位巡航实验,目标象限为第三象限,平台位于水面下2 cm,实验连续进行5 d,大鼠从除目标象限外的任一点入水,测定大鼠找到平台的逃避潜伏期和搜索距离。
2.5 双向凝胶电泳
2.5.1 蛋白质样品制备与纯化 水迷宫测试结束后,将各组大鼠断头处死,冰上去除颅骨后,迅速取出脑组织,分离出皮层及海马组织,精确称重。将各组大鼠皮层和海马组织放入组织匀浆器中,加1.5 mL双向电泳组织裂解液[含7 mol/L尿素、2 mol/L硫脲、4%CHAPS、40 mmol/L Tris、65 mmol/L DTT和0.5%(V/V)Bio-Lyte,pH 3~10],匀浆处理,冰上静置裂解20 min,液氮反复冻融3次,加RNase 50 ?g/mL、DNase 200 ?g/mL,4 ℃放置10 min,冰水混合物中进行超声破碎(100 W,工作3 s,间歇2 s,15个循环),8000 r/min离心10 min×2次,去除未溶解杂质,再以12 000 r/min离心10 min,吸取上清液即为总蛋白溶液。采用Bradford法测定提取的蛋白质浓度,分装后-70 ℃冰箱贮存备用或直接用于双向电泳。
2.5.2 双向电泳 2-DE参照Bio-Rad双向电泳指南进行,沿聚焦盘边缘缓慢加入300 μL含1 mg蛋白质样品的水化上样缓冲液(7 mol/L尿素,2 mol/L硫脲,4%CHAPS,65 mmol/L DTT,0.5%两性电解质,0.001%溴酚蓝),将胶条胶面朝下放入聚焦槽内,并覆盖2 mL矿物油,设置程序后进行第一向等电聚焦。待胶条平衡30 min后进行第二向SDS-PAGE电泳。电泳结束后取出凝胶进行考马斯亮蓝G-250染色。
2.5.3 凝胶图像分析 应用透射扫描仪对凝胶扫描获取凝胶图像,以对照组为参考胶,采用PDQuest8.0图像分析软件对凝胶图谱依次进行点检测、背景消减、标准化、匹配、建立平均凝胶,结合人工校正进行凝胶图像分析。选取图谱中蛋白点体积相对变化量大于2倍且P<0.05的蛋白点作为差异蛋白点。
2.6 差异蛋白质谱分析
将凝胶上差异明显的10个蛋白点通过切胶、脱色、酶解、萃取等操作制备蛋白样品。将样品放入API4800串联飞行时间质谱仪MALDI-TOF-MS/MS中分析,采用正离子模式和自动获取模式进行数据采集,选择强度最大的10个峰进行二级质谱鉴定,得到PMF指纹图谱。应用GPS3.6和Mascot2.1软件进行质谱数据分析和蛋白鉴定。
2.7 差异表达蛋白相互作用图谱分析
将差异明显8个蛋白上传至String9.05蛋白-蛋白相互作用关系在线分析软件(http://www.string-db.org),通过调节可信度和附加节点参数,获得差异表达蛋白的相互作用图谱,筛选中心节点蛋白。
3 统计学方法
采用SPSS17.0统计软件进行分析。计量资料以—x±s表示,方差齐性者采用方差分析,组间比较采用LSD检验。P<0.05表示差异有统计学意义。
4 结果
4.1 大鼠Morris水迷宫测试结果
水迷宫定位巡航实验结果显示,与对照组比较,模型组大鼠第4日逃避潜伏期明显延长,差异有统计学意义(P<0.05);与模型组比较,黄芩素组第4日逃避潜伏期明显缩短,差异有统计学意义(P<0.05)。可视平台实验结果显示,各组大鼠逃避潜伏期无明显变化(P>0.05)。结果见表1。
4.2 大脑皮层和海马组织蛋白双向凝胶电泳图谱分析结果
各组均进行了2-DE凝胶分析,并用考马斯亮蓝G-250染色增加凝胶图像质量,模型组与黄芩素组差异蛋白体积至少相差2倍且P<0.05才被认为差异表达明显,见图1。
4.3 双向凝胶电泳图谱差异蛋白点分析结果
模型组和黄芩素组大脑皮层与海马组织蛋白的2-DE图谱经PDQuest软件分析,将2组差异明显的3个蛋白点2-DE图谱放大显示,见图2。
4.4 差异蛋白点质谱鉴定结果
选取其中差异较为明显的可能为关键功能蛋白的10个蛋白点进行质谱分析,通过检索NCBI数据库,共有8个蛋白得到成功鉴定,见表2。差异蛋白涉及4种生物学功能,其中与神经传导关系最为密切,还与其他功能如抗细胞凋亡、抗氧化应激等相关。
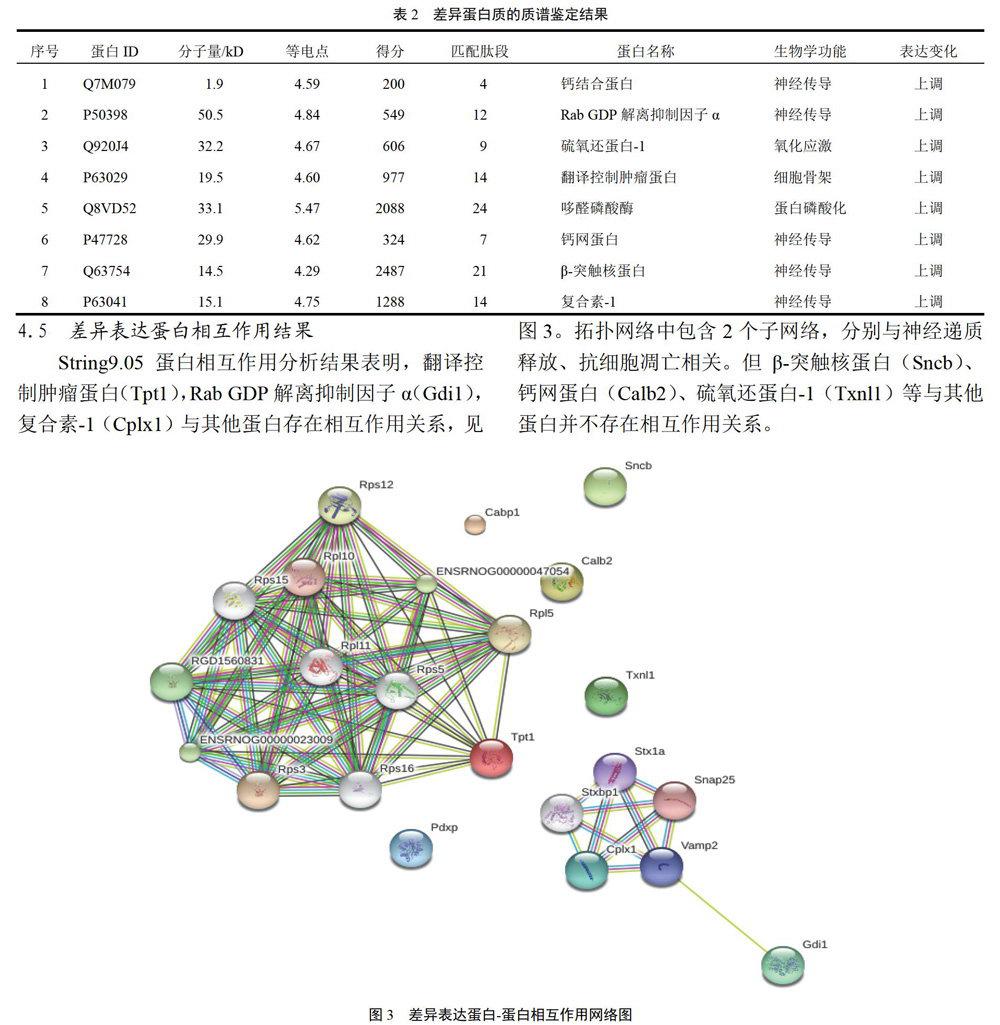
4.5 差异表达蛋白相互作用结果
String9.05蛋白相互作用分析结果表明,翻译控制肿瘤蛋白(Tpt1),Rab GDP解离抑制因子α(Gdi1),复合素-1(Cplx1)与其他蛋白存在相互作用关系,见图3。拓扑网络中包含2个子网络,分别与神经递质释放、抗细胞凋亡相关。但β-突触核蛋白(Sncb)、钙网蛋白(Calb2)、硫氧还蛋白-1(Txnl1)等与其他蛋白并不存在相互作用关系。
5 讨论
AD是老年期最常见的痴呆类型,是一种以进行性认知功能障碍和行为损害为特征的中枢神经系统退行性疾病。目前FDA批准AD治疗药物主要有胆碱酯酶抑制剂安理申和NMDA受体非竞争性拮抗剂美金刚,但其不能阻止疾病进展,也无法恢复已受损的认知功能。黄芩作为传统中医药在临床常被用于治疗中风、感染性疾病、高血压等疾病[8]。黄芩素是其中最主要的类黄酮提取物之一,已有研究表明,黄芩素可通过抑制氧化应激来减少细胞凋亡,同时减少对超氧化物歧化酶、丙二醛的激活来减轻Aβ25-35导致的神经病理学改变和认知功能损伤[9-10]。
AD发病机制的主流观点是具有神经毒性的Aβ1-40沉积于脑内引起脑损伤。因此,本实验利用Aβ1-40制备具有AD病理学特征的大鼠模型。利用Morris水迷宫实验评估造模是否成功、黄芩素的治疗效果,发现Aβ对大鼠的空间学习与记忆功能的损伤较大,黄芩素可显著改善这种损伤。本实验利用蛋白组学研究方法成功鉴定出黄芩素治疗AD大鼠模型大脑皮质和海马组织8种蛋白表达上调,是黄芩素预防和治疗AD的直接靶标。
本研究验证的蛋白可能与以下机制相关:Gdi1主要通过调节Rab小G蛋白的神经递质释放起到神经保护作用[11]。Sncb上调可通过抑制α-Synuclein聚集改善神经元变性,缓解神经退行性病变[12]。黄芩素上调Calb2可能作为载体蛋白的内质网分子伴侣使淀粉样蛋白保持溶解状态,从根源上减少Aβ沉积[13-14]。Trx-1作为体内重要的抗氧化蛋白,可通过清除过量氧自由基,修复过氧化的巯基蛋白,调节转录因子活性,抑制细胞凋亡以及调控胞内氧化还原平衡,发挥对神经元的保护作用[15]。Cplx1是突触前结构中重要的神经递质释放调节蛋白,Tannenberg等[16]发现AD患者脑中Cplx1显著下降,Cplx1的治疗机制可能与改变突触可塑性有关[17]。Tpt1在癌细胞和其他分裂活跃细胞中表达水平较高[18],而在脑等停止分裂的组织中低表达[19]。以往研究在对AD死者尸检时发现,一些区域的脑细胞中翻译控制肿瘤蛋白(TCTP)水平下降,细胞凋亡增加,故黄芩素可能是通过上调TCTP发挥抗细胞凋亡作用保护神经元。
综上所述,本实验利用蛋白组学研究方法检测黄芩素治疗AD大鼠模型大脑皮质和海马组织蛋白,发现黄芩素可上调神经保护相关的靶蛋白,作用机制可能与神经传导、氧化应激、细胞骨架等有关。但黄芩素对AD治疗作用及其分子机制仍需要进一步研究,以深入探讨其神经保护机制,为黄芩素作为AD治疗药提供实验依据。
参考文献:
[1] 于大林,肖军.阿尔茨海默病的流行病学调查现况[J].实用医院临床杂志,2011,8(3):152-155.
[2] BLENNOW K, DE LEON M J, ZETTERBERG H, et al. Alzheimer's disease[J]. Lancet,2006,368(9533):387-403.
[3] SHIN J W, KANG H C, SHIM J, et al. Scutellaria baicalensis attenuates blood-brain barrier disruption after intracerebral hemorrhage in rats[J]. Am J Chin Med,2012,40(1):85-96.
[4] 周锡钦,梁鸿,路新华,等.中药黄芩主要黄酮类成分及其生物活性研究[J].北京大学学报(医学版),2009,41(5):578-584.
[5] SHAERZADEH F, M0TAMEDI F, MINAI-THRANI D, et al. Monitoring of neuronal loss in the hippocampus of Ab-injected rat:autophagy, mitophagy, and mitochondrial biogenesis stand against apoptosis [J]. Neuromol Med,2014,16(1):175-190.
[6] KIM Y O, LEEM K, PARK J, et al. Cytoprotective effect of Scutellariabaicalensis in CA1 hippocampal neurons of rats after global cerebral ischemia[J]. J Ethnopharmacol,2001,77(2/3):183-188.
[7] GAO Y, LU J, ZHANG Y, et al. Baicalein attenuates bleomycin- induced pulmonary fibrosis in rats through inhibition of miR-21[J]. Pulm Pharmacol Ther,2013,26(6):649-654.
[8] 宋琳莉,孟庆刚.黄芩的药理作用研究进展[J].中华中医药学刊, 2008,26(8):1676-1678.
[9] LIU C, WU J, GU J, et al. Baicalein improves cognitive deficits induced by chronic cerebral hypoperfusion in rats[J]. Pharmacol, Biochemistry Behav,2007,86(3):423-430.
[10] WANG S Y, WANG H H, CHI C W, et al. Effects of baicalein on beta-amyloid peptide-(25-35)-induced amnesia in mice[J]. Eur J Pharmacol,2004,506(1):55-61.
[11] ISHIZAKI H. Role of rab GDP dissociation inhibitor alpha in regulating plasticity of hippocampal neurotransmission[J]. Proc Natl Acad Sci USA,2000,97(21):11587-11592.
[12] YAMIN G, MUNISHKINA L A, Karymov M A, et al. Forcing nonamyloidogenic beta-synuclein to fibrillate[J]. Biochemistry, 2005,44(25):9096-9107.
[13] ERICKSON R R, DUNNING L M, OLSON D A, et al. In cerebrospinal fluid ER chaperones ERp57 and calreticulin bind β-amyloid[J]. Biochem Biophys Res Commun,2005,322(1):50-57.
[14] JOHNSON R J, XIAO G, SHANMUGARATNAM J, et al. Calreticulin functions as a molecular chaperone for the β-amyloid precursor protein[J]. Neurobiol Aging,2001,22(3):387-395.
[15] 赵丽娟,孙茂民.硫氧还蛋白与阿尔茨海默病的研究进展[J].中国医疗前沿,2010,5(1):18-21,23.
[16] TANNENBERG R K, SCOTT H L, TANNENBERG A E, et al. Selective loss of synaptic proteins in Alzheimer's disease:evidence for an increased severity with APOE varepsilon4[J]. Neurochem Int, 2006,49(7):631-639.
[17] 黄玲.SAMP8小鼠海马突触活性带蛋白complexin及syntaxin1含量与年龄相关性空间学习记忆损害的关系[D].合肥:安徽医科大学,2012.
[18] 吕素芳,郭广君,蔡永萍.翻译控制肿瘤蛋白(TCTP)研究进展[J].科学技术与工程,2006,6(4):424-428.
[19] ANDREE H, THIELE H, FAHLING M, et al. Expression of the human TPT1 gene coding for translationally controlled tumor protein (TCTP) is regulated by CREB transcription factors[J]. Gene,2006, 380(2):95-103.
