兽用青霉素钾(钠)含量的非随行标准高效液相色谱测定法
2016-07-31陈锡龙
陈锡龙
(贵州省兽药饲料监察所,贵州 贵阳 550003)
兽用青霉素钾(钠)含量的非随行标准高效液相色谱测定法
陈锡龙
(贵州省兽药饲料监察所,贵州 贵阳 550003)
为解决实践中检测青霉素钾(钠)样本数量多,次数频繁,需耗费大量的标准品造成资源浪费问题,建立兽用青霉素钾(钠)含量的非随行标准高效液相色谱测定法。以C18为固定相,0.5 mol/L磷酸二氢钾溶液(用磷酸调节pH值到3.5):醇:水=10:30:60为流动相A,0.5 mol/L磷酸二氢钾溶液(用磷酸调节pH值到3.5):甲醇:水=10:50:40为流动相B,A:B=30:70,流速为1.0 mL/min,柱温30℃,检测波长为225 nm。采用外标法定量计算含量。青霉素的线性范围为 20~1 000 μg/mL,回归方程为 Area=5.790 4 × Amt-30.007(n=5),相关系数大于0.999。在不更换色谱柱的情况下,使用该方法可以仅采集1次标准溶液的数据就能够对不同时间测量的青霉素样品进行定量,从而可以节约大量的检测成本。
青霉素钾(钠);含量;非随行标准;高效液相色谱;测定
目前,检测机构在使用高效液相色谱法测定化合物的含量时,几乎都是使用随行(或同行)标准来对其进行定性和定量。所谓定性和定量分析中的随行(或同行)标准,以下简称随行标准,就是在运行样品的同时,也运行一组已知浓度的标准溶液,通过比较未知样品色谱峰和标准溶液色谱峰之间的相对保留时间和峰面积的对应关系,从而达到对未知样品进行定性和定量的目的。随行标准分析方法似乎只是行业内一个约定俗成的惯例,其依据可能主要是进行定性定量时要求色谱条件与标准样品相同[1~3]。随行标准无疑能够满足这一条件,且有利于提高定性和定量的准确性及精度,但是它也有非常明显的缺点,就是需要耗费比较多的标准物质。因为许多标准物质在溶液状态下极不稳定,无法配成标准贮备液连续使用并保存较长的时间,检测结束之后标准溶液必须废弃。而标准物质价格昂贵,不仅在经济上是一个负担,对资源而言也是一种浪费,为此,提出了非随行标准测定化合物含量的概念,其假设前提为:在分析条件一定的条件下,标准样品和未知样品中待测组分的响应因子相同[4]。分析条件包括:同一台高效液相色谱仪,同一根色谱柱,相同的流动相比例,相同的柱温,相同的流速,相同的检测波长,相同进样体积,以及同一检测器且其灵敏度和响应正常等。提出非随行标准检测概念的目的,在于探讨使用已采集的标准溶液的基础数据对不同时间检测的待测组分进行定性和定量的可行性,有效降低检测成本。非随行标准检测方法要求仪器必须具有良好的稳定性,否则标准样品和未知样品的响应因子不相等,就无法进行准确定量[4],同时也要求仪器具备极佳的重复性才能够准确定性。随着高效液相色谱仪生产技术水平的提高,目前绝大多数商用高效液相色谱仪均具有良好的稳定性,可以满足非随行标准检测技术的要求。高效液相色谱仪由于使用了高压输流泵、全多孔微粒填充柱和高灵敏度检测器,实现了对样品的高速高效和高灵敏度的分离检测;使用六通阀进样装置可以保证进样的准确性和良好的重现性;自动进样器的使用可以连续调节进样量,进样重复性高[5]。
青霉素含量测定的方法文献报道比较多,有酸碱滴定法、碘量法、汞量法、紫外分光光度法、高效液相色谱法等。其中高效液相色谱法能较好地分离供试品中可能存在的降解产物、未除尽的原料及中间体等杂质而准确定量,具有快速、高效、选择性强、重现性好等特点[6]。选择青霉素作为研究对象,主要是青霉素的水溶液不稳定[7],且在检测实践中检品特别是青霉素钾(钠)数量比较多,检测较为频繁,需要耗费的标准品数量巨大,资源浪费问题突出,有建立非随行标准检测技术的必要性和紧迫性。用非随行标准检测方法对青霉素这类在溶液状态下不稳定的化合物具有可行性的话,那么该方法对于其他大多数较为稳定的化合物更应具有可行性,从而也具有较为广阔的推广应用前景和价值。
1 材料和方法
1.1 仪器和试药 Agilent 1260 infinity高效液相色谱仪(配紫外检测器),BP211D型电子分析天平(德国塞多利斯公司),青霉素对照品(中国兽医药品监察所,批号:K0251006,含量:92.2%),试验样品青霉素钾(上海公谊兽药厂,批号:140608;北京赛孚制药股份有限公司,批号:150101;江西省和光药业有限公司,批号:20141019),甲醇为色谱纯,水为双蒸水,其他试剂均为分析纯。
1.2 方法
1.2.1 色 谱 条 件[8,9]: 色 谱 柱:Zorbax SB C18(5 μm 4.6 × 250 mm,PN:880975-902,SN:USCL047272,LN:B12254),柱温为 30 ℃,流动相,0.5 mol/L磷酸二氢钾溶液(用磷酸调节pH值到3.5):甲醇:水=10:30:60为流动相A,0.5 mol/L磷酸二氢钾溶液(用磷酸调节pH值到3.5):甲醇:水=10:50:40为流动相B,A:B=30:70;流速为1.0 mL/min;检测波长为225 nm;进样体积为 10 μL。
1.2.2 对照品溶液的制备:精密称取青霉素对照品50 mg,置50 mL量瓶中,加水20 mL溶解,再加入0.01 mol/L KOH 0.5 mL 使溶液呈极微弱碱性,最后加水稀释并定容至刻度,混匀,即得浓度约为1.0 mg/mL的青霉素对照品溶液。
1.2.3 供试品溶液的制备:精密称取青霉素样品100 mg,置100 mL量瓶中,加水50 mL溶解,再加入0.01 mol/L KOH 1.0 mL 使溶液呈极微弱碱性,最后加水稀释并定容至刻度,混匀,即得浓度约为1.0 mg/mL的青霉素供试品溶液。
2 结果
2.1 色谱图 按上述色谱条件,精密量取青霉素对照品溶液和供试品溶液10 μL,注入高效液相色谱仪,记录色谱图。对照品溶液和供试品溶液色谱图见图1。
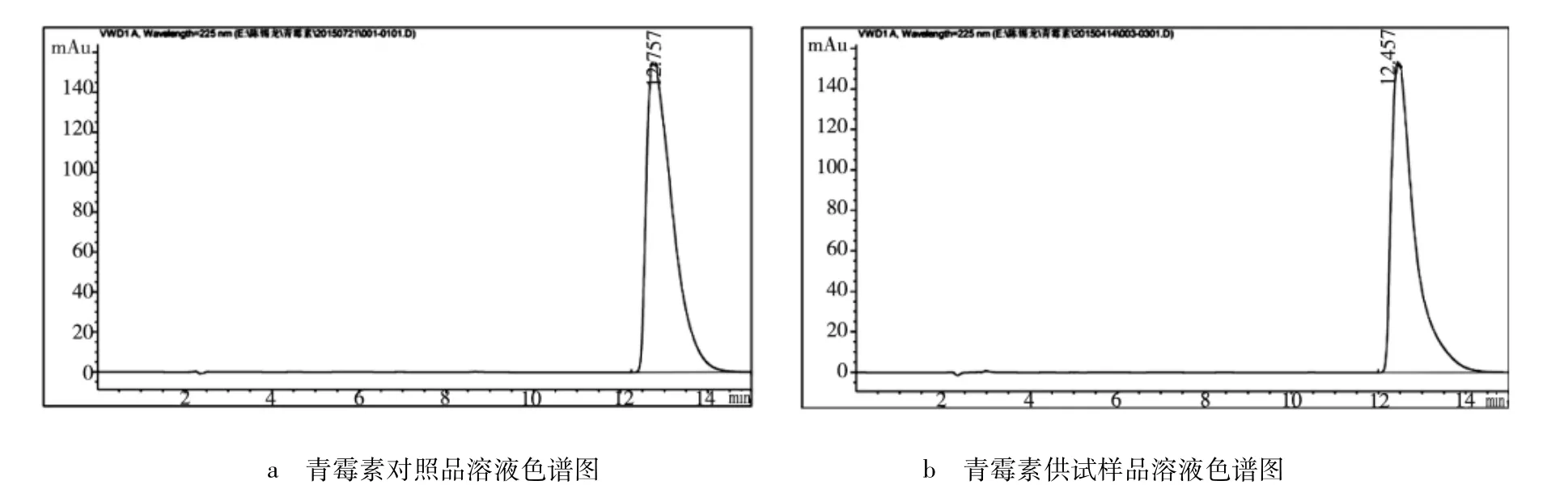
图1 青霉素色谱图
2.2 线性范围 精密量取1.0 mg/mL青霉素对照品溶液适量,分别置于10 mL容量瓶中,加水稀释至刻度,得含青霉素浓度分别为 20、100、200、500、1 000 μg/mL的对照溶液系列。精密吸取各对照溶液10 μL,注入液相色谱仪,记录色谱图。青霉素浓度在20~1 000 μg/mL范围内,色谱峰有良好的线性关系,回归方程为 Area=5.790 4 × Amt-30.007,相关系数等于0.999 8,标准曲线数据见表1。

表1 青霉素对照品溶液的标准曲线数据表
2.3 方法精密度 比较5批分别于不同日期测量的标准溶液的保留时间及单位浓度峰面积(每批2个平行,每个平行进样各2针),结果表明非随行标准检测方法具有良好的精密度,特别是单位浓度峰面积的相对标准偏差不大于1.5%[10],满足高效液相色谱检测方法对含量稳定性的要求。结果见表2。
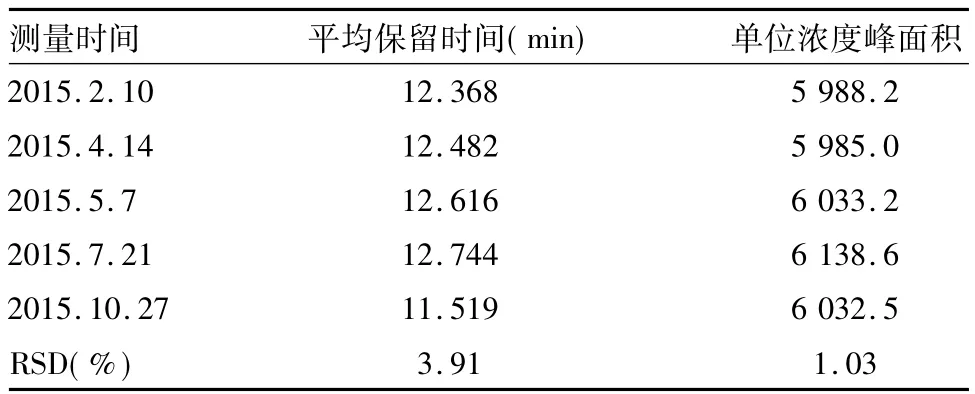
表2 方法精密度测量结果
2.4 室温下青霉素溶液的水解情况 取青霉素对照品100 mg,置100 mL容量瓶中,加水溶解后分别于0、10、20、40 h测定含量,计算单位浓度峰面积,结果:10、20、40 h单位浓度峰面积分别下降了2.16%、5.83%、36.47%。说明青霉素水溶液在24 h内相对稳定,其轻微水解及严重水解的色谱图见图2。
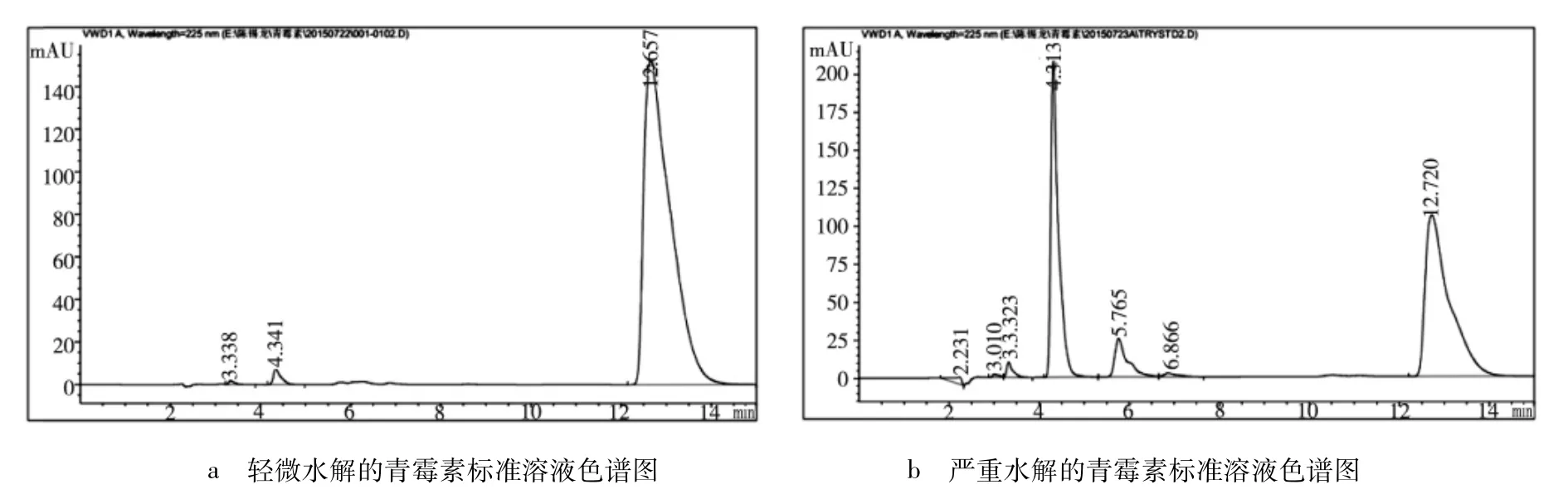
图2 青霉素标准溶液水解后的色谱图
2.5 微量酸碱对青霉素标准溶液降解情况的影响
分别取青霉素标准品100 mg,置100 mL容量瓶中,加一定量(约20 mL)的水溶解,再分别加浓度为0.01 mol/L的HCL或KOH溶液各1.00 mL,然后加水定容至刻度。立即上机测定,结果表明,加入少量酸碱的青霉素均会有分解。其中,加酸的青霉素含量下降约3.10%,且在相对保留时间约0.33处有一个很明显的较大的异物峰;而加碱的青霉素含量下降约1.10%,在相对保留时间约0.53处会出现1个较小的杂质峰。同时,加酸的青霉素会随着时间的推移加速分解,而加碱的青霉素含量在较长时间内则会保持在相对稳定的水平。另取3份样品,分别加碱处理后测定其单位浓度峰面积,约26 h再分别测定其单位浓度峰面积,结果,后者的单位浓度峰面积平均降低了1.89%。结果表明,青霉素在弱碱性溶液中24 h内有比较好的稳定性。加酸或加碱处理后的青霉素标准溶液色谱图见图3。

图3 加酸或加碱处理后的青霉素标准溶液色谱图
2.6 处理样品时水温对青霉素含量的影响 实验表明,用不同温度的少量水处理样品后,其含量测定结果也显示出一定的差别。实验时分别加1 mL 15、25、35、45、55℃的水溶解某一青霉素样品,然后立即加入室温下的蒸馏水稀释并定容后上机测定。结果发现,35、45、55℃的水溶解的样品其含量有比较明显的偏高,分别为106.9%、113.1%、105.1%,但45℃的水溶解的样品含量高得更多。
2.7 不同的流动相配制方法对青霉素保留时间的影响 第一种方法是先取100 mL pH=3.5的0.5 mol/L磷酸二氢钾溶液置1 000 mL容量中,然后加入300 mL甲醇(流动相A),或500 mL甲醇(流动相B),充分混匀后再加水定容至刻度,简称加水定容法;第二种方法是先取100 mL pH=3.5的0.5 mol/mL磷酸二氢钾溶液置1 000 mL容量中,然后加入600 mL水(流动相A),或400 mL水(流动相B),然后再加甲醇,充分混匀后加甲醇定容至刻度,简称加醇定容法;第三种方法是分别用量筒准确量取磷酸二氢钾溶液、甲醇和水,然后再将三者混匀,简称混容法。分别按A∶B=30∶70的比例注入流动相,待基线平稳后分别运行青霉素标准溶液,结果加水定容法青霉素色谱峰的保留时间约为14 min,加醇定容法为10 min,混容法则为12 min。原因主要是甲醇与水混合后,溶液的总体积会缩小,第一种配制法相当于增加了水相的比例,所以保留时间增加,第二法则相当于增加了有机相的比例,故保留时间减少。
2.8 青霉素溶液的降解规律 实验时,配制1份含青霉素为1.0 mg/mL的标准溶液并上机测定,每30 min进样1针,连续进样30次。结果发现,第一针进样的峰面积最大,以后各针的峰面积基本呈现递减的趋势,但并非是匀速的递减,而是先快后慢。基本上是样品溶解后的前3~5 h内会下降快一些,以后则相对稳定。结合上述2.4的结果,可以认为室温条件下,青霉素溶液的分解在24 h之内是一个比较缓慢且呈现出先快后慢并逐渐趋于相对平稳的过程。青霉素标准溶液色谱峰面积随测量时间变化情况见表3。

表3 青霉素标准溶液峰面积随测量时间变化
2.9 方法的应用 取3批注射用青霉素钾样品,按上述含量测定方法处理后测定其含量,结果分别为99.4%、98.8%和100.2%。
3 讨论与小结
3.1 色谱条件的优化。《中华人民共和国兽药典》中流动相 A∶B=70∶30,流速为 1.0 mL/min。以该色谱条件运行样品时,发现青霉素的出峰时间比较晚,运行一种样品大约需要40 min,把A∶B的比例调整为30∶70后,出峰时间为12 min左右,建议使用250 mm的C18柱检测时把流动相调整为A∶B=30∶70比较恰当。
3.2 样品及对照品溶液处理方法的优化。《中华人民共和国兽药典》和《中华人民共和国药典》中对青霉素样品及对照品的处理均是直接加水溶解并定容,但是由于青霉素在水溶液中不稳定,易分解,同时容易受到水中少量碳酸(来源于空气中的CO2)、容器中残留的酸碱(如洗涤剂)以及青霉素水解造成的含量下降等的影响,处理样品时可加入少量0.01 mol/L的KOH溶液,利于保持样品的稳定性。另外,容器中残留的少量水分及样品溶解不充分和及时可能导致青霉素溶解过程中产热不均从而造成样品局部温度不一致使含量测定出现偏差,称样时应注意保持容器干燥,溶解样品时应迅速及时。检验中,如果多次出现青霉素干燥品含量超过101.0%的情况,可考虑是由于标准样品和未知样品在处理过程中分别受到了少量碳酸和残留碱性洗涤剂的影响;如果样品平行不好,则可能是称样时容器未完全干燥或有残留酸碱物质以及样品溶解不迅速及时所致。
3.3 非随行标准含量测定法的要点是要保证色谱条件的一致性,色谱条件任何细微的变动均可能带来较大的偏差,容易导致定性上产生误判和定量上出现较大偏差。因此,采用非随行标准法测定含量时,要确保流动相配制、柱温、流速等保持一致。同时,应随时监测检测器的灵敏度和响应情况、色谱柱的柱效变化,并定期重新校正标准曲线。建议把非随行标准检测中,标准样品双样双平行首末次测量结果单位浓度峰面积的相对标准偏差不大于1.5%,作为判断是否需要重新校正标准曲线的依据,并以此作为判断仪器稳定性是否能够满足测量要求的标准。即只要有一种可信的方法证明仪器的稳定性满足要求,在此期间建立的所有非随行标准曲线均无需重新校正。需要强调的是更换色谱柱后应重新采集标准曲线数据并制作新的标准曲线,原因是同一类型的色谱柱,会由于生产厂家和生产批号不同而表现出不同的色谱分离特性[11],也即响应因子已经不一样了。
3.4 因青霉素溶液水解过程缓慢且有一定规律可循,故在使用《中华人民共和国兽药典》中的方法检测数量较多的青霉素样品时,为避免因水解产生的测量偏差,应注意适时重新运行标准样品溶液或插入质控样品,建议插入质控样品或重新运行标准样品溶液的间隔时间为3、6、6 h,并保证全部样品在24 h内检测完毕。这里的时间间隔从样品处理结束后立即上机测定时开始计算。当然,也可以酌情对样品进行分批处理和检测。
3.5 采用非随行标准方法进行测量时,由于色谱条件不可能完全一致,如不同时间配制的流动相其组成可能存在细微的差别,因而不可避免地会出现保留时间产生一定漂移的情况,虽然保留时间在一定范围内发生漂移对含量产生的影响可以忽略不计,但是定性的准确性会受到怀疑。因此,测量时最好插入已经准确定性的留存样品作为质控样品辅助定性,或者检测时使用二极管阵列检测器通过紫外光谱图进行定性。其次,色谱柱多次进样后会受到样品基质污染使柱效下降,此时应及时对色谱柱进行清洁和再生,以免影响含量测定的准确性。如果含量测量结果偏低同时又属于边缘数据时,应使用同行标准方法进行仲裁确认。
3.6 本研究建立了兽用青霉素钾(钠)含量的非随行标准高效液相色谱测定法,实验数据表明,本方法简单,精密度高,重现性好,能够有效控制兽用青霉素钾(钠)的质量,特别适合兽药生产企业进行内部质量控制,并可通过减少对标准品的使用有效降低检测成本,具有广阔的推广应用前景和价值。
[1]汪正范.色谱定性与定量(第二版)[M].北京:化学工业出版社,2007.
[2]陈智栋,何明阳.化工分析技术[M].北京:化学工业出版社,2010.160.
[3]符斌,李华昌.分析化学实验室手册[M].北京:化学工业出版社,2012.116.
[4]安捷伦科技(中国)有限公司.Agilent HPLC化学工作站标准操作培训教材[M].203~206.
[5]于世林.高效液相色谱方法及应用(第二版)[M].北京:化学工业出版社,2005.12~28.
[6]王炳强,张正兢.药物分析与检验技术[M].北京:化学工业出版社,2005,206~208.
[7]张嫒,黄利平,樊海斌.高效液相色谱法测定青霉素钠的含量[J].中国兽药杂志,2001,35(4):27~28.
[8]中国兽药典委员会.中华人民共和国兽药典(二部)[S].北京:中国农业出版社,2010.119~122.
[9]国家药典委员会.中华人民共和国药典(二部)[S].北京:中国医药科技出版社,2015.596~600.
[10]中国兽医药品监察所.兽药检验操作规程.2005.88.
[11]于世林.高效液相色谱方法及应用(第二版)[M].北京:化学工业出版社,2005.80.
Asynchronous Standard Determination of Content of Veterinary Benzylpenicillin Sodium or Potassium by HPLC
Chen Xilong
(Guizhou Provincial Supervisory Institute of Veterinary Drug and Feeds,Guiyang Guizhou 550003,China)
An HPLC method has been developed to determine the content of Veterinary Benzylpenicillin Sodium or Potassium through data of it’s sample and standard acquired asynchronously,using C18column as stationary phase,with a mobile phase of A:B=30:70(A:solution of 0.5 mol/L potassium dihydrogen phosphate with pH adjusted to 3.5 by phosphoric acid:methanol:water=10:30:60,and B:solution of 0.5 mol/L potassium dihydrogen phosphate with pH adjusted to 3.5 by phosphoric acid:Methanol:water=10:50:40),flow rate of 1.0 mL/min,column temperature of 30 degree Celsius,and wavelength of 225 nm.It was quantified by external standard method and the linear range of Benzylpenicillin was between 20 and 1 000 μg/mL.And the regression equation was Area=5.790 4 × Amt-30.007 with the correlation to be more than 0.999.It could be used for determining content of Benzylpenicillin Sodium or Potassium through standard data acquired only once with the same column so that can cut a plenty of costs during testing for much less use of standard substance.
Benzylpenicillin Potassium;Benzylpenicillin Sodium;Content;Asynchronous Standard;HPLC;Determination
S859.79+6
A
1007-1474(2016)01-0014-06
2015-10-19
陈锡龙(1969—),男,高级兽医师,贵州省畜牧兽医学会理事,从事兽药质量检验检测及相关研究工作。
E -mail:cxlofyjs@163.com
