茯砖茶“金花”菌的分离、鉴定及转化葛根产物研究
2016-07-29胡谢馨易有金柏连阳李高阳周红丽周金伟夏菠
胡谢馨,易有金*,柏连阳,李高阳,周红丽,周金伟,夏菠
茯砖茶“金花”菌的分离、鉴定及转化葛根产物研究
胡谢馨1,易有金1*,柏连阳2,李高阳3,周红丽1,周金伟1,夏菠1
1. 湖南农业大学食品科技学院 食品科学与生物技术湖南省重点实验室,湖南 长沙 410128;2. 湖南省农业科学院,湖南 长沙 410128;3. 湖南省农产品加工研究所,湖南 长沙 410128
摘要:为研究茯砖茶中“金花”菌是否能在葛根上生长,并进行生物转化,得到活性更高的发酵产物。从茯砖茶中分离出一株优势菌株 LS1,并进行鉴定;以野葛、粉葛、葛渣为底物进行固体发酵,以 DPPH自由基清除法比较发酵前后产物抗氧化活性,并测定了总黄酮含量及采用高效液相色谱法检测葛根素质量浓度。结果表明,LS1经形态学观察及ITS-5.8S rDNA序列分析,鉴定为冠突散囊菌Eurotium cristatum,GenBank登录号为 KR812327;野葛、粉葛、葛渣固体发酵后总黄酮和葛根素含量分别提高了 15.97%、12.33%、20.69%和20.48%、7%、20.29%。
关键词:“金花”菌;葛根;发酵;鉴定;抗氧化;葛根素
微生物转化是利用微生物代谢过程中产生的酶使底物进行有机反应[1],具有安全有效、低成本、低耗能等优点[2]。微生物特别是真菌具有非常强大的分解转化能力,并能产生丰富的次生代谢产物[3]。近年来已有大量研究证明,微生物转化葛根的可行性,例如米根霉、酵母混合菌发酵提取的葛根异黄酮含量明显高于传统提取方法[4];添加葛根的灵芝发酵产物对羟自由基和超氧阴离子的清除效果明显比单独灵芝发酵好[5];利用红曲霉转化葛根可使染料木素与葛根素含量得到提高[6]。冠突散囊菌(Eurotium cristatum)又名“金花”菌,是茯砖茶渥堆过程中的优势菌,具有多种医疗保健功能,如降脂减肥、抗氧化、抗菌、抗癌等,它可利用单宁与淀粉等物质作为碳源,分泌多种胞外酶,如多酚氧化酶、果胶酶、纤维素酶、蛋白酶等[7]。葛根中富含大量营养物质,可供冠突散囊菌利用,而通过其分泌的胞外酶又能使葛根中的成分发生改变。因此,本试验旨在分离能发酵葛根的“金花”菌,以DPPH自由基清除率为指标研究“金花”菌固体发酵葛根前后抗氧化活性的变化,测定发酵前后总黄酮含量及采用 HPLC法检测发酵前后葛根素含量,以期为“金花”菌的综合利用提供新的研究思路。
1 材料与方法
1.1 试验材料
茯砖茶:益阳安化茶厂2008年生产,砖茶样品外形均为方形,黑褐色,紧实,有“发花现象”,于室温下黑暗干燥密封保存待用。
葛根素标准品(中国食品药品检定研究所),色谱级甲醇(国药集团化学试剂有限公司),DNA提取试剂(天根生化科技有限公司),PCR MasterMIX(天根生化科技有限公司),Vc、抗氧化剂264(BHT)、芦丁(国药集团化学试剂有限公司),其他试剂均为分析纯。
培养基:马铃薯葡萄糖琼脂培养基(PDA)、马铃薯葡萄糖液体培养基(PDB)、察氏培养基(CA、CA20、CA70)[8]、固体发酵培养基(野葛 2.5 g,粉葛、葛渣 10 g,水10 mL),121℃灭菌备用。
葛根:野葛、粉葛购自老百姓大药房。
1.2 试验方法
1.2.1 “金花”菌的分离纯化
挑取茯砖茶上的金黄色闭囊壳接种于PDA培养基上,28℃恒温培养,待菌落生长进入旺盛期时,挑取菌丝作平板划线,重复3次纯化[9],并将其命名为LS1。
1.2.2 孢子悬浮液的制备
将菌种培养8 d后挑取适量孢子放入盛有100 mL无菌水和玻璃珠的三角瓶中,充分震荡摇匀,并稀释为浓度 4×106个·mL-1孢子悬浮液待用。
1.2.3 固体发酵
吸取1 mL孢子悬浮液接至固体发酵培养基上,28℃恒温培养。7 d后,采用醇提法[10],用95%乙醇超声萃取发酵物,弃其沉淀,上清液于 50℃旋转蒸发去除乙醇,挥发至恒重,野葛加蒸馏水稀释至25 mL,粉葛、葛渣稀释至100 mL,各提取液质量浓度为0.1 mg·mL-1。以未发酵样为对照,按照同样方法萃取。野葛、粉葛、葛渣发酵前后溶液分别命名为Y-1、Y-2,F-1、F-2,Z-1、Z-2。
1.2.4 分离菌株LS1的鉴定
(1)形态学鉴定
采用点值法[11],观察记录各培养基上菌落形态及生长情况。于光学显微镜下观察记录菌丝体及孢子形态特征。
(2)分子生物学鉴定
①菌株基因组 DNA的提取。参考Weiland[12]方法提取DNA样品备用。
②ITS-5.8S rDNA引物序列及PCR扩增。选用真菌通用引物 ITS1:5'-TCC GTA GGT GAA CCT GCG G-3',ITS4:5'-TCC TCC GCT TAT TGA TAT GC-3'进行PCR扩增,经1.5%琼脂糖凝胶电泳检测后委托长沙佳和生物技术公司测序。
③PCR扩增序列分析。将序列提交NCBI数据库,通过BLAST进行同源性搜索,并申请NCBI登录号。
④系统发育分析及系统发育树构建。在GenBank中索取与内生 LS1菌株同源性高的相似菌株ITS-5.8S rDNA序列,用MEGA 4.0软件进行序列分析,采用 Neighbor-Joining (N-J)法构建系统发育树。
1.2.5 DPPH清除自由基能力法测定抗氧化能力
参考陈雪[13]的方法,采用 DPPH清除自由基能力法比较底物发酵前后抗氧化活性,并以葛根素、BHT、Vc标准品为对照。将反应液摇匀,室温下避光静置30 min后于517 nm测定Ac、Ai、Aj所表示的样品吸光度,按下述公式计算清除率。
清除率=[1-(Ai-Aj)/Ac]×100%
以清除率为纵坐标,各供试物浓度为横坐标,建立回归方程,计算半数清除浓度IC50。
1.2.6 总黄酮含量测定
参考常飞[14]的方法,采用分光光度计法测定样品中总黄酮含量,以芦丁为标准,于510 nm 测定标准物质浓度与吸光度的对应关系,制备标准曲线。取待测样品于相同条件下测定其吸光度,根据标准曲线计算总黄酮含量。
1.2.7 葛根素HPLC检测
各提取液经 10 000 r·min-1离心后,取上清液100 μL甲醇稀释至1 mL,混匀,0.45 μm微膜过滤后,即为供试品溶液,HPLC检测葛根素含量。
(1)色谱条件
色谱柱ODS-C18柱(150 nm×4.6 mm,5 μm),流动相为甲醇-水(体积比25∶75),流速1 mL·min-1,检测波长250 nm,柱温28℃,进样量20 μL。
(2)标准曲线的绘制
称取葛根素标准品 5 mg,流动相溶解定容至 25 mL,配置成 0.2 mg·mL-1葛根素储备液。
(3)方法学考察
参考刘华金[15]的方法,重复性考察:取各处理组发酵液分别制备5份供试品溶液,测定峰面积,计算相对标准偏差(RSD);精密度考察:称取质量浓度 40 μg·mL-1标准品溶液,重复进样5次,测定峰面积,计算RSD;稳定性考察:称取同一供试品溶液于0、2、4、6、8、10、12、14、16 h内进样测定峰面积,计算 RSD;加样回收率考察:称取已知葛根素含量的发酵液5份,按其含量30%、60%、90%、120%、150%分别加入葛根素标准品,按供试品方法制备,测定葛根素含量。
1.2.8 统计分析
试验数据分析采用Excel 2003与SPSS统计软件完成,以SPSS中的LSD多重比较法进行差异显著性分析,结果用大小写字母标注分别表示在P<0.01与P<0.05水平上差异显著。
2 结果与分析
2.1 分离菌株LS1的鉴定
2.1.1 形态学鉴定
菌株 LS1在 CA培养基中生长较慢,在PDA、CA20培养基中生长速度中等,在CA70培养基中生长最快,并且只在PDA培养基中有黄褐色渗出物。LS1在各培养基中的颜色、生长速度变化较大,见图1。
光学显微镜下菌株 LS1呈现大量菌丝,有隔,且呈不对称分支;子囊果大量,呈球形,光滑,混生于菌丝中,小型,见图2。根据LS1菌落、显微形态特征,基于微生物经典鉴定法[16-17],初步判定该菌为子囊菌门散囊菌目发菌科散囊菌属真菌。
2.1.2 分子生物学鉴定
实验测得实验菌株1ITS-5.8S rDNA序列全长 588 bp,将序列输入生物技术信息网页(http://www.ncbi.nlm.nih.gov/BLAST)进行同源性比对,结果表明与冠突散囊菌 Eurotium cristatum同源性最高,相似性为100%。该结果与菌落和显微形态鉴定相符,进一步确定LS1菌属于子囊菌门散囊菌目发菌科散囊菌属冠突散囊菌Eurotium cristatum,并在NCBI上申请登录号为KR812327。
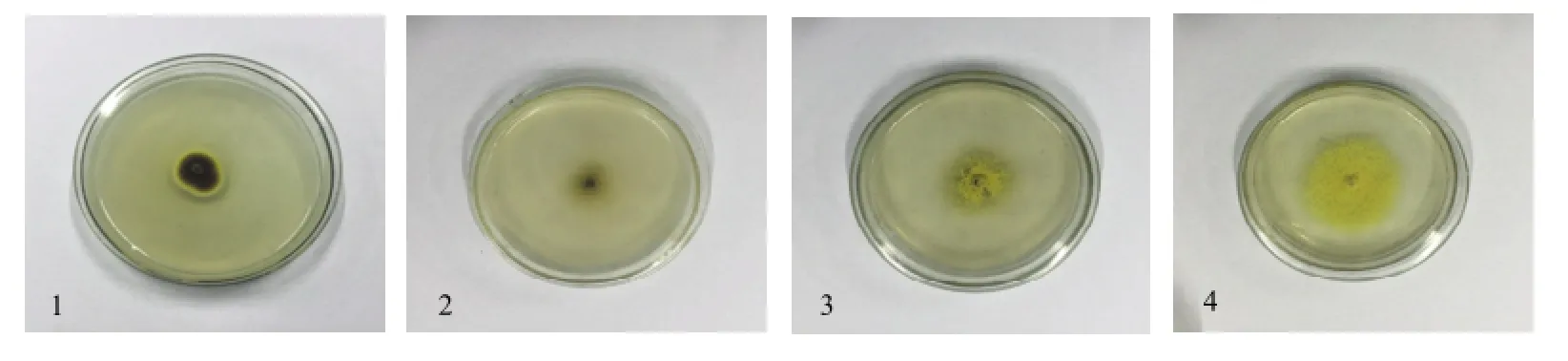
图1 LS1在PDA、CA、CA20、CA70培养基上的菌落形态Fig. 1 LS1 morphologic characteristics on PDA, CA, CA20, CA70 medium
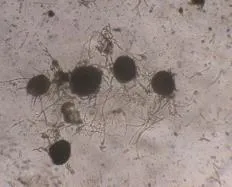
图2 LS1的显微形态Fig. 2 Mycelium microstructure of strain LS1
2.2 固体发酵
接种3 d后,“金花”菌开始生长,大量金黄色菌丝由培养基中心向四周蔓延,中间部分颜色较深,呈黄褐色,周围呈浅黄色;从第5天起,菌丝迅速布满了整个培养基,质地致密,同时培养基内部也布满了金黄色菌丝,并产生黑色孢子,菌落背面也有黄色菌丝体。LS1在野葛、粉葛、葛渣上生长较好。按1.2.3的方法萃取发酵产物。
2.3 不同底物发酵前后样品抗氧化活性
2.3.1 野葛发酵前后抗氧化活性
如图3所示,各处理对DPPH自由基的清除率随着浓度的升高而增大,表明浓度与DPPH自由基清除率间呈一定的量效关系。其中,抗氧化能力最强的为Vc,质量浓度为0.01 mg·mL-1时,对 DPPH自由基的清除率达到32.69%,而葛根素与抗氧化剂264(BHT)的抗氧化能力较差。当处理质量浓度为0.04~0.08 mg·mL-1时,野葛发酵后处理(Y-2)与 Vc间没有显著差异(P>0.05),但随着浓度的增加,Y-2的清除水平没有Vc提高得快。不同浓度下Y-2清除DPPH自由基的能力均大于野葛发酵前处理(Y-1),仅在质量浓度为0.10 mg·mL-1时二者间未达到显著差异,且在该浓度时Y-1与葛根素、BHT间均达到显著差异水平(P<0.05)。结果表明,5个处理抗氧化能力大小依次为Vc>Y-2>Y-1>BHT>葛根素。
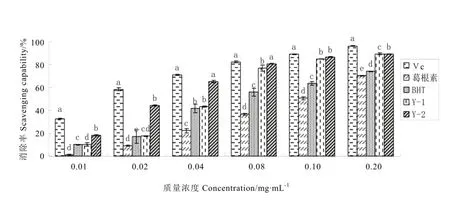
图3 野葛发酵前后对DPPH自由基清除效果比较Fig. 3 Fermentation effect of pueraria lobata in the wild on DPPH scavenging capability
2.3.2 粉葛发酵前后抗氧化活性
粉葛发酵前后对DPPH自由基的清除能力见图4。图4显示,粉葛发酵前(F-1)和发酵后(F-2)的抗氧化活性差异较大,在各浓度下对 DPPH自由基的清除能力均达到显著差异(P<0.05),但随着浓度的增加差异逐渐减小。F-1、F-2抗氧化能力明显大于葛根素与抗氧化剂264(BHT),在质量浓度大于0.08 mg·mL-1时,与BHT的清除率达到了显著差异(P<0.05);而在6种不同浓度下,F-2与葛根素的清除率均达到了显著差异(P<0.05)。综上所述,粉葛发酵前后与对照组抗氧化活性由强至弱依次为:Vc>F-1>F-2>BHT>葛根素。
2.3.3 葛渣发酵前后抗氧化活性
如图5所示,葛渣发酵前(Z-1)、发酵后(Z-2)均呈现出一定的抗氧化效果,且差异较大,在各浓度下对DPPH自由基的清除率均达到显著差异水平(P<0.05),在质量浓度为 0.02 mg·mL-1时,二者差异达到最大。但Z-1、Z-2清除能力比Vc、葛根素、BHT差,葛渣发酵前后与对照组抗氧化活性由强到弱依次为Vc>BHT>葛根素>Z-1>Z-2。
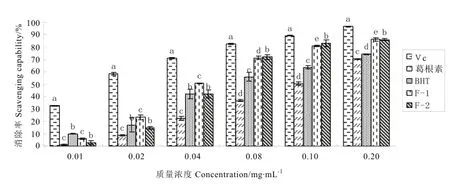
图4 粉葛发酵前后对DPPH自由基清除效果比较Fig. 4 Fermentation effect of pueraria lobata on DPPH scavenging capability
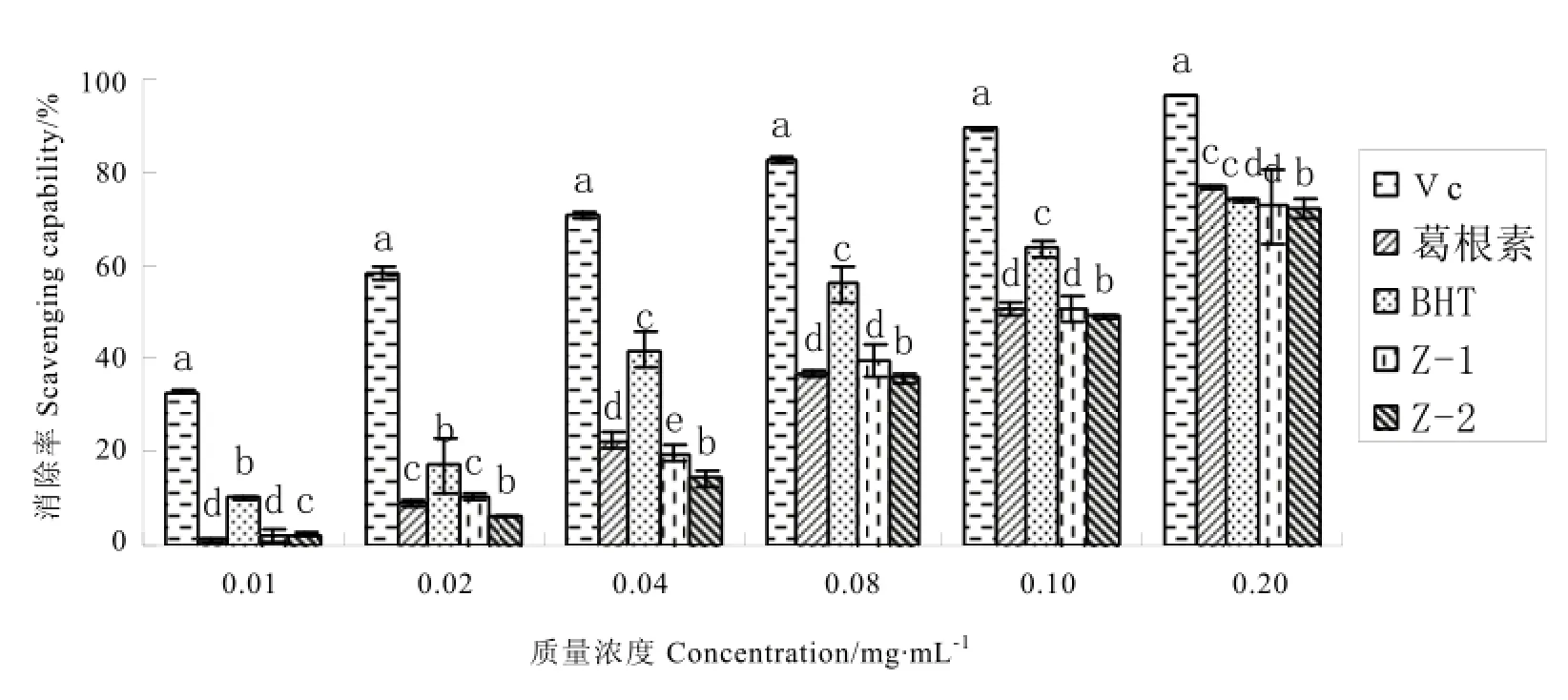
图5 葛渣发酵前后对DPPH自由基清除效果比较Fig. 5 Fermentation effect of pueraria lobata residue on DPPH scavenging capability
2.3.4 不同底物发酵前后样品清除DPPH自由
基IC50比较
计算不同底物发酵前后产物清除DPPH自由基的IC50值,6个样品与对照组对DPPH自由基的清除效果由强到弱依次为 Vc>Y-2> Y-1>F-1>F-2>BHT>葛根素>Z-1>Z-2(表1)。

表1 不同物质发酵前后清除DPPH自由基的IC50值Table 1 IC50 of different fermentation material
2.4 不同底物发酵前后样品总黄酮含量比较
3种底物发酵前后样品总黄酮含量检测结果如表2所示,相较于发酵前,野葛、粉葛与葛渣发酵后总黄酮含量分别提高了15.97%、12.33%、20.69%。
2.5 发酵前后葛根素HPLC检测
2.5.1 标准曲线绘制
质量浓度为0.2 mg·mL-1的葛根素标样HPLC色谱图见图6,标样线性回归方程为:
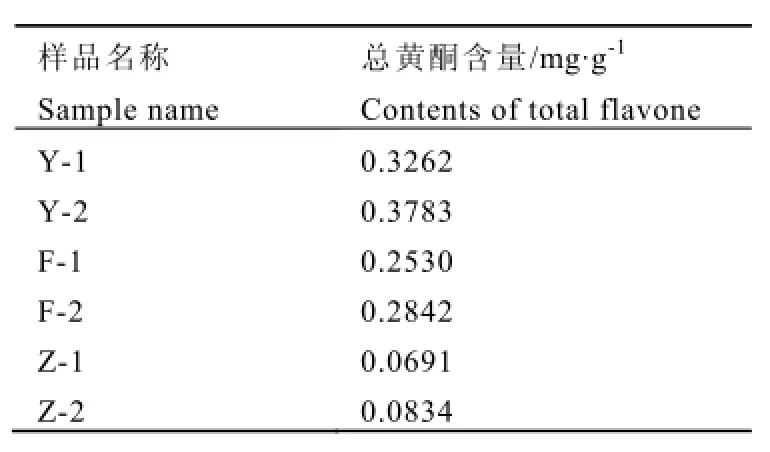
表2 不同底物发酵前后产物总黄酮含量Table 2 Total flavone content in different fermentation product
Y=102.7746X-113.7318(R2=0.9996),两者均在20~100 μg·mL-1范围内呈良好的线性关系。
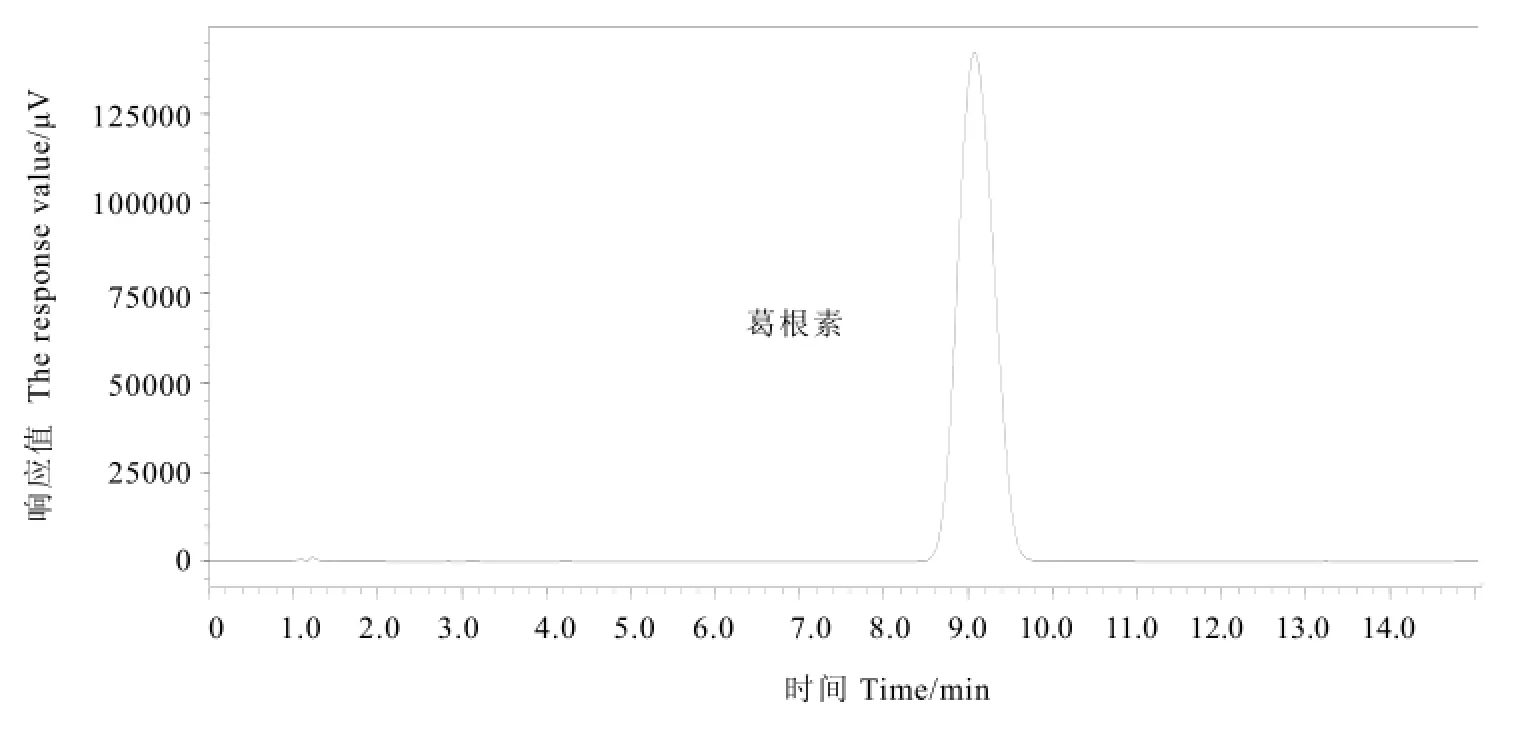
图6 葛根素标样HPLC图Fig.6 HPLC chromatogram of standard puerarin sample
2.5.2 方法学考察
(1)重复性:Y-1、Y-2、F-1、F-2、Z-1、Z-2中葛根素的RSD值分别为0.86%、0.72%、0.65%、0.60%、0.84%、0.92%,表明该方法重复性好。
(2)精密度:葛根素标样的 RSD值为0.88%,表明该方法精密度高。
(3)稳定性:Y-1、Y-2、F-1、F-2、Z-1、Z-2中葛根素的RSD值分别为1.12%、1.28%、1.09%、1.56%、1.34%、1.28%,表明供试品在16 h内稳定。
(4)加样回收率:葛根素在各样品中的加样回收率分别为 94.2%、98.5%、96.3%、92.8%、92.2%、91.9%,表明该方法回收率高,准确度高。
2.5.3 葛根素含量测定
取各发酵液按上述制备方法制备供试品溶液,按上述HPLC色谱条件平行进样3次,不同底物发酵前后色谱图如图7所示。由图可知,不同底物经“金花”菌 LS1发酵后,葛根素(保留时间 9.031 min)响应值升高,吸收峰面积均明显增加,产生了新的物质峰,说明“金花”菌 LS1具有转化葛根的能力,并提高了其最主要的异黄酮类物质葛根素的含量。根据峰面积及底物质量计算葛根素含量,其中野葛中葛根素含量最高,粉葛次之,葛渣最低,发酵后葛根素含量均有所提高,分别提高了20.48%、7.00%和20.29%。
3 讨论与展望
通过LS1在4种不同培养基上的菌落形态观察和显微观察,结合ITS-5.8S rDNA序列比对和系统发育树分析,鉴定 LS1菌株为冠突散囊菌Eurotium Cristatum,GenBank登录号为KR812327,丰富了冠突散囊菌的种质资源。
固体发酵结果表明,野葛、粉葛、葛渣均可以提供“金花菌”生长所需的全部营养成分,证实除茯砖茶外,“金花”菌也在其他植物上正常生长。目前大多数学者对“金花”菌的研究主要集中在鉴定命名及对茯砖茶风味品质的影响,在茶叶发酵外的其他植物领域研究甚少,笔者利用“金花菌”对葛根进行固体发酵,大大提高了该菌的研究潜力和价值。
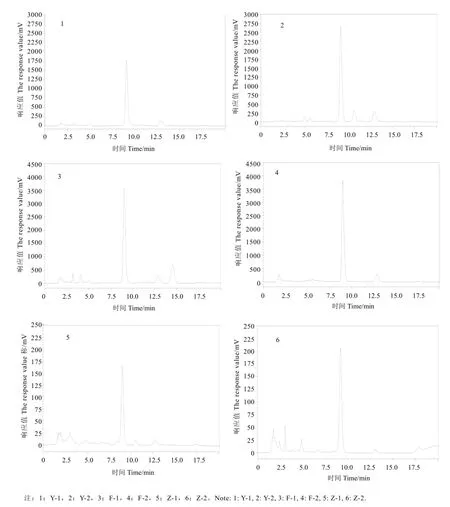
图7 不同发酵底物葛根素检测HPLC图Fig. 7 Chromatogram of different fermention product
通过测定发酵产物的抗氧化活性,表明发酵后产物均具有一定的抗氧化效果。利用HPLC法检测发酵前后供试品溶液中的葛根素含量,结果表明野葛的葛根素含量远高于粉葛,更适合用作提取。野葛、粉葛、葛渣通过发酵,葛根素含量均得到了不同程度的提高,一方面可能是因为菌丝体对葛根细胞壁的穿透作用可以提高其通透性,同时“金花”菌生长过程中产生的酶破坏了葛根细胞壁中的半纤维素和纤维素,二者协同作用可进一步提高葛根细胞壁的通透性[18];另一方面由于冠突散囊菌在代谢过程中产生的一系列酶,以葛根中存在的与葛根素结构相似的其他前提物质为原料,将其转变为葛根素,从而提高了活性成分的含量[6]。同时,以葛渣为底物进行固体发酵,不仅可以变废为宝,而且可以有效防止环境污染,提高其经济效益与社会效益。“金花”菌发酵葛根能提高产物中的活性成分含量,其具体转化途径还需进一步研究,此外,需要优化发酵条件以提高葛根素得率。
参考文献
[1]Loughlin W A. Biotransformation in organic synthesis [J]. Bioresource Technol, 2000, 74: 49-62.
[2]Zhan J X, Zhong J J, Dai J G, et al. Microbial transformation of sinenxan A, a rich constituent in callus cultures of taxus [J]. Acta pharmaceutica Sinica, 2003, 38(7): 555-558.
[3]唐燕红, 张日俊. 微生物在中草药添加剂中的应用研究进展[J]. 中国饲料, 2004(12): 20-21.
[4]刘改霞. 葛根异黄酮的发酵提取工艺及其抗氧化性研究[D]. 南京: 南京农业大学, 2010.
[5]张俊会. 葛根基质下食药用真菌深层液体发酵查无的抗氧化活性测定[D]. 保定: 河北大学, 2003.
[6]宋艳秋, 陈有为. 葛根的红曲霉转化产物化学成分分析[J].天然产物研究与开发, 2013, 25(11): 1525-1528.
[7]温琼英. 茯砖茶中主要微生物的研究[J]. 茶叶通讯,1986(4): 19-21.
[8]张琪, 污玉久, 张磊磊, 等. 两株具有将人参皂苷 Rg1转化为人参皂苷 F1活性的真菌鉴定[J]. 中国抗生素杂志,2010, 35(5): 395-398.
[9]黄婧. “金花”菌的分离鉴定及其对茶叶成分的生物转化[D]. 福州: 福建师范大学, 2013.
[10]曾祥群. 葛根总黄酮提取工艺[J]. 食品工业科技, 2000, 21(3):33-34.
[11]高宁. 盘龙参内生真菌的分离鉴定及其化学成分相关性的研究[D]. 哈尔滨: 黑龙江中医药大学, 2009.
[12]Weiland J. Rapid procedure for the extraction of DNA from fungal spores and mycelia [J]. Fungal genetics newsletter, 1997, 44: 60-63.
[13]陈雪. 不同类型茶叶抗氧化功能的比较研究[D]. 长沙:湖南农业大学, 2012.
[14]常飞, 段旭昌, 王倩倩. 不同干燥方法对葛根黄酮含量的影响研究[J]. 食品工业科技, 2014(35): 78-82.
[15]刘华金, 易有金, 杨建奎, 等. 转化白藜芦醇苷虎杖内生真菌的分离和鉴定[J]. 食品科学, 2012, 33(11): 172-179.
[16]齐组同. 中国真菌志: 曲霉属及其相关有性型: 第五卷[M]. 北京: 科学出版社, 1997: 139-142.
[17]Raper K, Fennell D, Austwick P. The genus aspergillus [M]. Baltimore: Willians&Wilkins Baltimore, 1965: 20-23.
[18]施英英, 夏黎明. 葛根渣固态发酵产异黄酮的研究[J]. 林产化学与工业, 2007, 27(1): 57-60.
中图分类号:TS272.5+4;Q949.32
文献标识码:A
文章编号:1000-369X(2016)03-268-09
收稿日期:2015-08-17
修订日期:2015-11-24
基金项目:国家科技支撑计划项目(2015BAD16B00、2015BAD16B01)、国家自然基金项目(31071738、31000827)、湖南省教育厅重点项目(15A082)。
作者简介:胡谢馨,女,硕士研究生,主要从事食品微生物方面的研究。*通讯作者:yiyoujin@163.com
Research on Separation, Identification and
Transformation Products Transformed Kudzu Root of ′Jinhua′ Fungus
HU Xiexin1, YI Youjin1*, BO Lianyang2, LI Gaoyang3, ZHOU Hongli1, ZHOU Jinwei1, XIA Bo1
1. Hunan Provincial Key Laboratory of Food Science and Biotechnology, College of Food Science and Technology, Hunan Agricultural University, Changsha 410128, China; 2. Hunan Academy of Agriculture Sciences, Changsha 410128, China; 3. Institute of Agro-product Processing Science and Technology, Hunan Provincial Academy of Agricultural Science, Changsha 410128, China
Abstract:In order to research whether the ′Jinhua′ fungus grow on and biotransformate kudzu root, get higher active fermentation products, one of advantages of strain was isolated from Fuzhuan Tea, named it as LS1. Pueraria lobata, its in the wild as the substrates in solid-state fermentation. DPPH radical scavenging capacities of fermentation products were investigated, making a determination of the contents of total flavone and fermentation products of puerarin were detected by high performance liquid chromatography. The result show that LS1 was identified preliminarily as Eurotium cristatum with GenBank accession number of KR812327 by morphological characteristics and the analysis of ITS-5.8S rDNA region. The contents of total flavone and puerarin were improved 15.97%、12.33%、20.69% and 20.48%、7%、20.29%, respectively.
Keywords:′Jinhua′ fungus, kudzu root, fermentation, identification, antioxidant activity, puerarin
