茶假眼小绿叶蝉抗联苯菊酯品系和敏感品系解毒酶活性及增效作用研究
2016-07-29李建宇史梦竹傅建炜王婷张志康
李建宇,史梦竹,傅建炜*,王婷,张志康
茶假眼小绿叶蝉抗联苯菊酯品系和敏感品系解毒酶活性及增效作用研究
李建宇1,史梦竹1,傅建炜1*,王婷1,张志康2
1. 福建省农业科学院植物保护研究所,福建 福州 350013;2. 湖南农业大学植物保护学院,湖南 长沙 410128
摘要:为了明确茶假眼小绿叶蝉(Empoasca vitis)对联苯菊酯代谢抗性相关的解毒酶,本研究采用室内生物测定和生化分析方法,比较了假眼小绿叶蝉抗联苯菊酯品系和敏感品系的 3种解毒酶活性差异,并分析了 3种增效剂对联苯菊酯的增效作用。解毒酶活性测定表明,茶假眼小绿叶蝉抗联苯菊酯品系羧酸酯酶(CarE)、细胞色素P450氧化酶O-脱甲基(PNOD)、谷胱甘肽-S-转移酶(GST)比活力都高于敏感品系,3种解毒酶活性分别为敏感品系的 2.09倍、4.34倍和 1.59倍。增效剂磷酸三苯酯(TPP)、增效醚(PBO)和顺丁烯二酸二乙酯(DEM)在茶假眼小绿叶蝉敏感品系中的增效比分别为1.04、1.09、1.00,而在联苯菊酯抗性品系中的增效比分别为 1.80、7.97、1.03。上述结果证明,羧酸酯酶和细胞色素 P450氧化酶活性的增强在茶假眼小绿叶蝉对联苯菊酯的抗性产生中起到了重要的作用。
关键词:茶假眼小绿叶蝉;联苯菊酯;抗性;解毒酶;增效作用
假眼小绿叶蝉(Empoasca vitis Göthe)以成虫和若虫吸取茶树芽叶汁液,导致茶芽叶生长迟缓,焦边、焦叶,严重影响茶叶的品质和产量[1-2]。由于假眼小绿叶蝉个体小、易隐蔽,且世代重叠严重,防治困难,目前仍以化学农药作为主要防治手段。其中,联苯菊酯是防治小绿叶蝉的主要药剂,它属拟除虫菊酯类仿生合成杀虫剂,具有触杀、胃毒等作用[3],对茶假眼小绿叶蝉成虫及若虫都具有较好的防治效果。但是,由于长期过度使用联苯菊酯防治,致使假眼小绿叶蝉对联苯菊酯产生了不同程度的抗性[4-5]。然而研究假眼小绿叶蝉对联苯菊酯的抗性机理的报道几乎没有。
在靶标抗性、穿透抗性及代谢抗性等多种昆虫的抗药性机制中,昆虫解毒酶代谢能力增强所导致的代谢抗性是昆虫对杀虫药剂产生抗性的重要机制之一[6],昆虫体内的解毒酶主要有多功能氧化酶、羧酸酯酶以及谷胱甘肽-S-转移酶等,与昆虫对有机氯类、有机磷类、氨基甲酸酯类、拟除虫菊酯类等多种杀虫剂的抗性普遍相关[7-9]。增效剂是一类无生物活性的化合物,能够抑制或削弱抗性昆虫体内解毒酶系对农药的解毒作用,提高药剂的生物活性,延缓抗药性,在抗药机理研究和抗性治理中有很重要的作用[10]。在杀虫药剂中添加适量的增效剂,可抑制害虫代谢酶活性,显著提高杀虫效果,对于减少杀虫剂的用量、降低杀虫剂的抗性风险以及害虫的抗药性治理均有重要意义。
鉴于联苯菊酯在茶假眼小绿叶蝉防治中的重要作用,本研究检测了茶假眼小绿叶蝉联苯菊酯抗性品系的酯酶、谷脱甘肽 S-转移酶和多功能氧化酶的活性,并测定了增效醚(PBO)、顺丁烯二酸二乙酯(DEM)和磷酸三苯酯(TPP)3种增效剂在茶假眼小绿叶蝉抗性品系中对联苯菊酯的增效作用,初步研究了茶假眼小绿叶蝉对拟除虫菊酯类杀虫剂联苯菊酯产生抗性的生化机理,以期为制定假眼小绿叶蝉田间抗性的延缓和治理方案,以及延长联苯菊酯制剂的使用寿命提供科学依据。
1 材料与方法
1.1 供试虫源及寄主
敏感品系:假眼小绿叶蝉于2012年9月采自福建省农业科学院植物保护研究所南通中试基地茶圃,未接触任何杀虫剂,继代饲养于该基地人工气候室30代以上,于2015年5月测定其对联苯菊酯的LC50为0.7084 mg·L-1。
抗性品系:2013年5年月釆自福建省建瓯市东峰茶园(LC50为33.4274 mg·L-1),在室内用联苯菊酯筛选了 25代,于 2015年 5月测定其对联苯菊酯的LC50为67.6722 mg·L-1(表1),抗性倍数达95.53倍。
室内饲养条件为:温度(26±1)℃,光照周期为 14 h光照、10 h黑暗,相对湿度70%~80%。饲养用茶枝采自福建省农业科学院植物保护研究所南通中试基地茶圃,该茶圃从未施用任何化学农药和肥料,仅人工除草、浇水。
1.2 试验仪器及药剂
TU-1900型紫外可见分光光度计(北京普析通用仪器有限公司)、数显三用恒温水浴锅(上海梅香仪器有限公司)、AG 5805型台式高速冷冻离心机(德国Eppendorf公司)、超低温冰箱(海尔集团)、MD/VersaMax酶标仪(美国Molecular Devices公司)。
2.5%联苯菊酯乳油(美国富美实公司);90%增效醚 PBO、97%顺丁烯二酸二乙酯DEM、99%磷酸三苯酯TPP(均购自Sigma-Aldrich公司);乙二胺四乙酸 EDTA (Biosharp生物科技公司);二巯基苏糖醇DTT(北京索莱宝(Solarbio)科技有限公司);苯基硫脲、对硝基苯甲醚、还原型辅酶ⅡNADPH(均购自 Aladdin-阿拉丁试剂(上海)有限公司)。
1.3 毒力测定
联苯菊酯对茶假眼小绿叶蝉的毒力测定参照NY/T 1154.14—2008方法(浸叶法)[11]并作部分改动:将未被药剂污染的新鲜茶枝剪成一腋一叶;茶枝浸药 15 s后取出并自然晾干;将晾干的茶枝插入保湿的花泥中,并置于50 mL(直径2.5 cm)的离心管中;之后将茶小绿叶蝉成虫转移至离心管中的茶叶片上,每管接入10头茶小绿叶蝉成虫,盖上通风的盖子,防止试虫逃逸。每处理5次重复,以清水处理为对照。48 h后检查死亡虫数,计算死亡率。死亡标准为轻触虫体后观察无任何动静或其他反应则视为死亡。
1.4 增效剂试验
3种增效剂PBO、TPP、DEM均采用丙酮溶解,选择对抗性和敏感品系茶假眼小绿叶蝉无致死作用的最高质量浓度 100 mg·L-1作为增效剂添加的最终浓度,配制不同浓度的联苯菊酯药液,按1.3中毒力测定的方法进行增效剂增效作用测定。
增效值用 Bradford[12]的方法计算,增效比(SR)=单一药剂对假眼小绿叶蝉的LC50值/药剂加增效剂处理的假眼小绿叶蝉的LC50值。
1.5 酶活性测定方法
1.5.1 细胞色素P450氧化酶活力测定
细胞色素 P450氧化酶(以对硝基苯甲醚为底物,PNOD)活力测定参考Rose等[13]的方法。每个品系取小绿叶蝉试虫 200头,冰浴匀浆,匀浆液为0.1 mol·L-1、pH 7.8磷酸缓冲液(含1 mmol·L-1EDTA、1 mmol·L-1DTT、1 mmol·L-1苯基硫脲、20%甘油)。10 000 g·min-1、4℃下离心40 min,取上清液在4℃下保存备用。在96孔酶标板中依次加入100 μL 2 μmol·L-1对硝基苯甲醚、10 μL 9.6 mmol·L-1的NADPH和90 μL酶液,酶促反应在 30℃下进行。用酶标仪在405 nm波长下记录光密度值,每隔25 s记录1次,共记录26次,数据记录与处理采用SOFTmaxPRO软件,取光密度值范围在0~0.2之间的数据计算反应速度,以反应速度表示酶活力(每毫克组织蛋白每分钟吸光值变化0.001作为一个酶活力单位U)。
1.5.2 谷胱甘肽-S-转移酶活力测定
谷胱甘肽-S-转移酶活力采用南京建成生物工程研究所的谷胱甘肽-S-转移酶测定试剂盒进行测定,测定方法参照试剂盒说明书。本试剂盒包括基质液、20 μmol·L-1GSH标准品以及试剂二、三、四。准确称取待测样本0.2 g,按照m(g)∶V(mL)=1∶9的比例加入生理盐水,冰水浴条件机械匀浆,2 500 g·min-1,离心10 min,取上清液待测。不同处理谷胱甘肽-S-转移酶活力的活性按照测定试剂盒说明书在测定管和对照管中分别加基质液、样本和试剂二后进行酶促反应,4 000 g·min-1,离心 10 min,取上清2 mL作显色反应。显色反应中空白管、标准管、测定管和对照管分别按说明书加入试剂二、标准品、试剂三和试剂四后混匀,室温静置15 min后,用分光光度计于412 nm波长处比色。将每毫克组织蛋白在37℃反应1 min,扣除非酶促反应,使反应体系中GSH浓度降低1 μmol·L-1为1个酶活力单位U。
1.5.3 酯酶活力测定
羧酸酯酶活力采用南京建成生物工程研究所的羧酸酯酶活性测定试剂盒进行测定,测定方法参照试剂盒说明书。本试剂盒中试剂一为提取液;试剂二为工作液。按照组织质量(g)与提取液体积(mL)为1∶5~10的比例,加入1 mL试剂一进行冰浴匀浆。15 000 g·min-1,4℃离心 30 min,取上清液待测。在 1 mL比色皿中加入 5 μL蒸馏水作为空白管,测定管则依次加入 5 μL上清液,然后上述管中分别加入 1 000 μL预热的试剂二,迅速混匀后用分光光度计于450 nm测定10 s和190 s光吸收值,计算酯酶活性。将每毫克组织蛋白在37℃反应,每分钟催化吸光值增加1,定义为1个酶活力单位U。
2 结果与分析
2.1 TPP、PBO和DEM对联苯菊酯的增效作用
表 1显示,联苯菊酯对茶假眼小绿叶蝉敏感品系和抗性品系的LC50分别为0.7084 mg·L-1和67.6722 mg·L-1。TPP、PBO和DEM在茶小绿叶蝉敏感品系中对联苯菊酯毒力的增效比分别为1.04、1.09、1.00,而在联苯菊酯抗性品系中的增效比分别为1.80、7.97、1.03(图1)。可见,TPP和PBO在茶小绿叶蝉联苯菊酯抗性品系中对联苯菊酯的毒力均有明显的增效作用,而DEM的增效作用不明显。
2.2 联苯菊酯抗性品系和敏感品系茶假眼小绿叶蝉的解毒酶活力差异
2.2.1 细胞色素P450氧化酶活性
对茶假眼小绿叶蝉联苯菊酯品系和抗性品系的细胞色素P450氧化酶活性进行测定,结果见图2。抗性品系和敏感品系的细胞色素P450氧化酶比活力分别为1.22 U·mg-1和0.28 U·mg-1,差异达显著水平(F=2281.94, P<0.0001);抗性品系的细胞色素P450氧化酶活性是敏感品系的 4.34倍,表明假眼小绿叶蝉对联苯菊酯的抗性形成可能与其细胞色素P450氧化酶活性的增加有关(图2)。
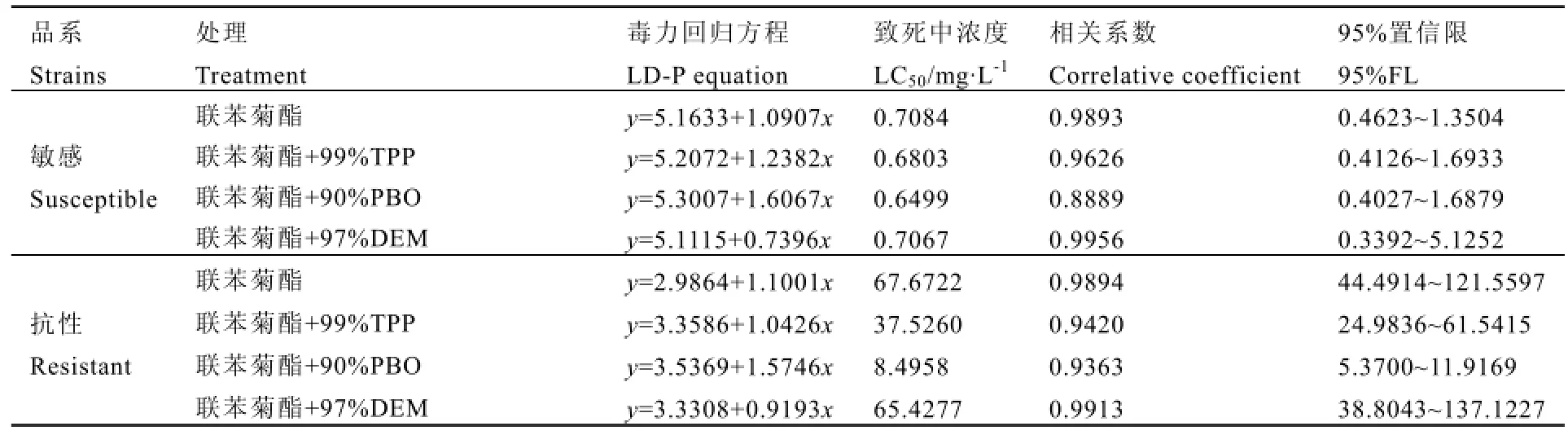
表1 TPP、PBO、DEM在假眼小绿叶蝉抗性和敏感品系中对联苯菊酯的增效作用Table 1 Synergistic effect of TPP, PBO and DEM in bifenthrin-resistant and susceptible strains of E. vitis
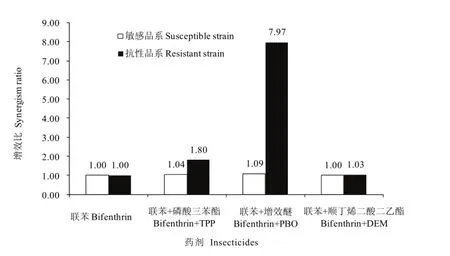
图1 TPP、PBO和DEM 3种增效剂对联苯菊酯的增效作用Fig. 1 Synergistic effect of TPP, PBO and DEM on bifenthrin
2.2.2 羧酸酯酶活性
由图3可以看出,假眼小绿叶蝉抗联苯菊酯品系和敏感品系的羧酸酯酶活力差异显著(F=15.35, P=0.0173),抗性品系的羧酸酯酶活性是敏感品系的 2.09倍。说明假眼小绿叶蝉对联苯菊酯的抗性形成与羧酸酯酶活性的增强也有一定的关系。
2.2.3 谷胱甘肽-S-转移酶活性
假眼小绿叶蝉抗联苯菊酯品系和敏感品系的谷胱甘肽-S-转移酶活力分别为 82.55 U·mg-1和51.81 U·mg-1(图4),抗性品系的
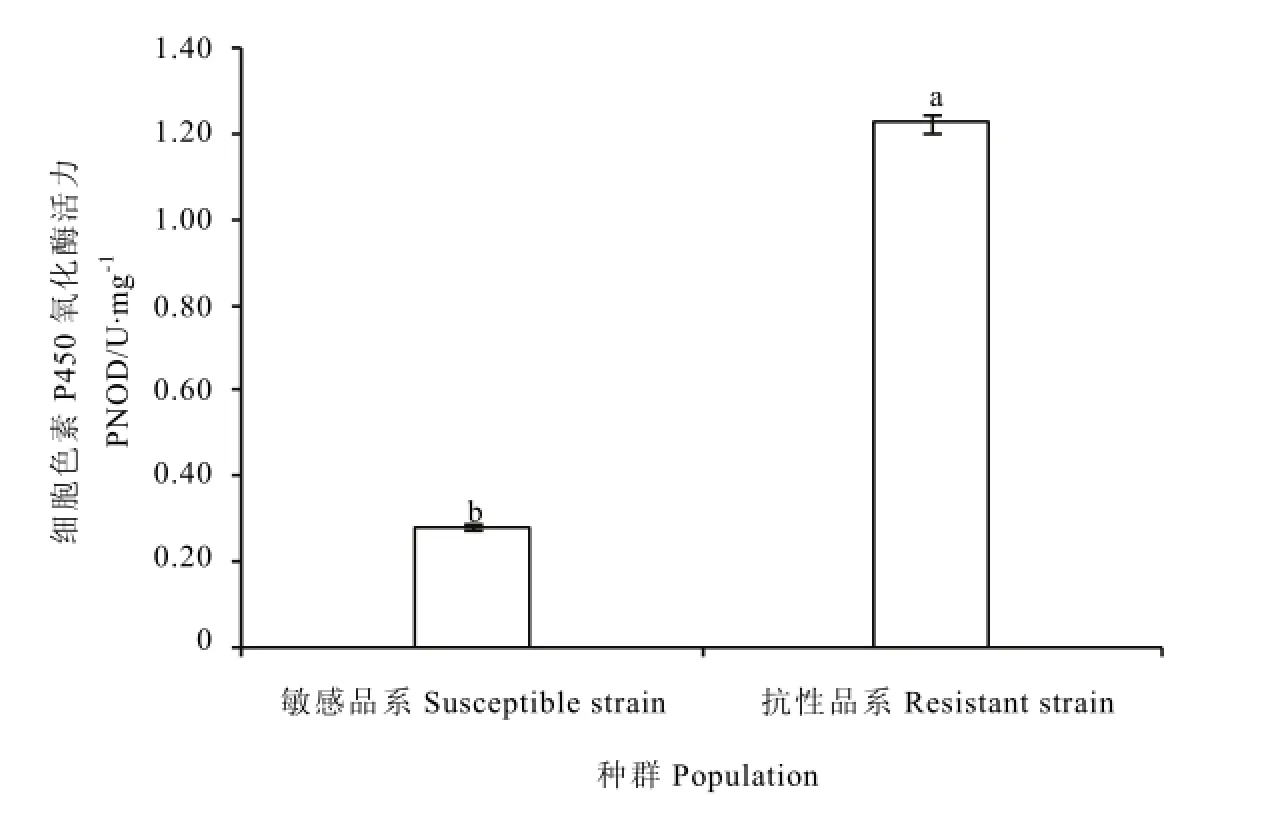
图2 假眼小绿叶蝉抗性和敏感品系细胞色素P450氧化酶活力比较Fig. 2 Comparison of Cytochrome P450 oxidase activities in E. vitis
图3 假眼小绿叶蝉抗性和敏感品系羧酸酯酶活力比较
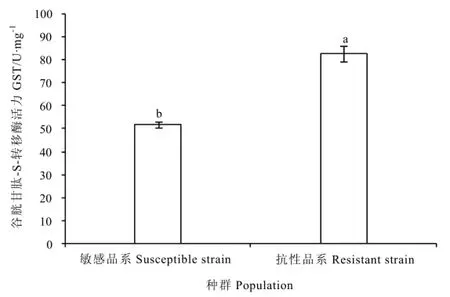
图4 假眼小绿叶蝉抗性和敏感品系谷胱甘肽-S-转移酶活力比较Fig. 4 Comparison of glutathione S-transferase activities in E. vitis
Fig. 3 Comparison of carboxylesterase activities in E. vitis谷胱甘肽-S-转移酶活性是敏感品系的 1.59倍(F=66.92, P<0.0001),表明假眼小绿叶蝉对联苯菊酯的抗性形成与谷胱甘肽-S-转移酶有一定关系,但是不同品系的活性差异不如细胞色素P450氧化酶活性和羧酸酯酶活性的差异大。
3 小结与讨论
本研究表明增效剂TPP、PBO和DEM在假眼小绿叶蝉敏感品系中增效作用不明显,而在联苯菊酯抗性品系中 TPP、PBO的增效作用较明显,DEM则增效不明显。由于TPP、PBO和DEM分别是羧酸酯酶、细胞色素P450氧化酶和谷胱甘肽-S-转移酶的抑制剂,因此,细胞色素P450氧化酶和羧酸酯酶的活性变化是假眼小绿叶蝉对联苯菊酯产生抗性的原因之一。
细胞色素 P450氧化酶通过酶活性的升高从而降低杀虫剂的杀虫效果,表现为昆虫对有机磷类、拟除虫菊酯类和新烟碱类杀虫剂产生抗性。这种抗性机制在关于小菜蛾 Plutella xyllostella[14]、烟粉虱Bemisia tabaci[15]、桃蚜Myzus persicae[16]的研究中均有报道。在杀虫剂的选择压力下,昆虫羧酸酯酶产生了相应的反应,导致抗性昆虫中羧酸酯酶活性有所增高。羧酸酯酶活性增高引起了褐飞虱 Nilaparvata lugens[17]、棉蚜Aphis gossypii[18-19]对有机磷杀虫剂抗性的产生。谷胱甘肽-S-转移酶是昆虫对外源有毒物质代谢途径中重要的酶系之一。Rumpf等[20]用氯氰菊酯亚致死剂量处理褐蛉幼虫后,发现其GST活性明显增加;小菜蛾对有机磷类杀虫剂产生抗药性的重要机制之一就是抗性品系小菜蛾体内GSTs的高活力[21]。本研究结果表明,茶假眼小绿叶蝉联苯菊酯抗性品系和敏感品系的细胞色素 P450氧化酶和羧酸酯酶活性差异显著,且PBO和TPP增效作用明显,说明这两种酶活性的变化与茶假眼小绿叶蝉对联苯菊酯的抗性有关。同时,抗性品系中茶假眼小绿叶蝉的谷胱甘肽-S-转移酶活力也有所增加,但DEM的增效作用不明显,因此,谷胱甘肽-S-转移酶与茶假眼小绿叶蝉抗性是否相关有待进一步验证。
本研究中对假眼小绿叶蝉解毒酶活性的测定是在短期药剂胁迫下进行的,因此要明确解毒酶是否参与了假眼小绿叶蝉对联苯菊酯的抗性,还需进一步深入系统地研究。
参考文献
[1]边磊, 孙晓玲, 陈宗懋. 假眼小绿叶蝉的日飞行活动性及成虫飞行能力的研究[J]. 茶叶科学, 2014, 34(3): 248-252.
[2]Pu X Y, Feng M G, Shi C H. Impact of three application methods on the field efficacy of a Beauveria bassiana-based mycoinsecticide against the false-eye leafhopper, Empoasca vitis (Homoptera: Cicadellidae) in the tea canopy [J]. Crop Protection, 2005, 24(2): 167-175.
[3]张聪, 刘慧刚, 章晓凤. 联苯菊酯对靶标生物及非靶标生物毒性的对映体差异[J]. 浙江工业大学学报, 2009, 37(4): 366-371.
[4]王念武, 徐金汉, 陈峥, 等. 不同茶园假眼小绿叶蝉抗药性比较[J]. 福建农林大学学报: 自然科学版, 2004, 33(2): 169-173.
[5]庄家祥, 傅建炜, 苏庆泉, 等. 福建省茶小绿叶蝉抗药性的地区差异[J]. 茶叶科学, 2009, 29(2): 154-158.
[6]邢剑飞, 刘艳, 颜冬云. 昆虫对拟除虫菊酯农药的抗性研究进展[J]. 环境科学与技术, 2010, 33(10): 68-74.
[7]沈晋良, 吴益东. 棉铃虫抗药性及其治理[M]. 北京: 中国农业出版社, 1995: 259-280.
[8]Zhu YC, Snodgrass GL. Cytochrome P450 CYP6X1 cDNAs and mRNA expression levels in three strains of the tarnished plant bug Lygus lineolaris (Heteroptera: Miridae)having different susceptibilities to pyrethroid insecticide [J]. Insect Molecular Biology, 2003, 12(1): 39-49.
[9]Li Xianchun, Schuler MA, Berenbaum MR. Molecular mechanisms of metabolic resistance to synthetic and natural xenobiotics [J]. Annual Review of Entomology, 2007, 52: 231-253.
[10]李春生. 增效剂对3种农药的增效作用及对甜菜夜蛾解毒酶活性的影响[D]. 重庆: 西南大学, 2006: 1-2.
[11]农业部农药检定所. NY/T 1154.14—2008. 农药室内生物测定试验准则 杀虫剂 第 14部分: 浸叶法 [S]. 北京: 中国农业出版社, 2011.
[12]Bradford MM. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 1976, 7(1/2): 248-254.
[13]Rose R L, Barbhaiya L, Roe R M, et al. Cytochrome P450-associated insecticide resistance and the development of biochemical diagnostic assays in Heliothis virescens [J]. Pesticide Biochemistry and Physiology, 1995, 51(3): 178-191.
[14]Bautista MA, Miyata T, Miura K, et al. RNA interference-mediated knockdown of a cytochrome P450,CYP6BG1, from the diamondback moth, Plutella xylostella,reduces larval resistance to permethrin [J]. Insect Biochemistry Molecular Biology, 2009, 39(1): 38-46.
[15]何玉仙, 黄建, 杨秀娟, 等. 烟粉虱对拟除虫菊酯杀虫剂的抗性机理[J]. 昆虫学报, 2007, 50(3): 241-247.
[16]Puinean AM, Foster SP, Denholm I, et al. Amplification of a cytochrome P450 gene is associated with resistance to neonicotinoid insecticides in the aphid Myzus persicae [J]. PLoS Genetics, 2010, 6(6): 1-11.
[17]Small GJ, Hemingway J. Molecular characterization of the amplified carboxylesterase gene associated with organophosphorus insecticide resistance in the brown planthopper Nilaparvata lugens [J]. Insect Molecular Biology, 2000, 9(6): 647-653.
[18]Cao CW, Zhang J, Gao XW, et al. Overexpression of carboxylesterase gene associated with organophosphorous insecticide resistance in cotton aphids, Aphis gossypii (Glover) [J]. Pesticide Biochemistry Physiology, 2008,90(3): 175-180.
[19]Pan Y, Guo H, Gao XW. Comparative study on carboxylesterase activity, cDNA sequence, and gene expression between malathion susceptible and resistant strains of the cotton aphid, Aphis gossypii [J]. Comparative Biochemistry Physiology Part B Biochemistry Molecular Biology, 2010, 152(3): 266-270.
[20]Rumpf S, Hetzel F, Frampton C. Lacewings (Neuroptera: Hemerobiidae and Chrysopidae) and integrated pest management: enzyme activity as biomarker of sublethal insecticide exposure [J]. Journal of Economic Entomology,1997, 90(1): 102-108.
[21]Fukami JI. Metabolism of several insecticides by glutathion S-transferase [J]. Pharmacology & therapeutics, 1980, 10(3): 473-514.
中图分类号:S571.1;S435.711
文献标识码:A
文章编号:1000-369X(2016)03-323-07
收稿日期:2015-11-04
修订日期:2016-01-19
基金项目:福建省自然科学基金(2013J01112)
作者简介:李建宇,男,助理研究员,主要从事农业昆虫与害虫防治、农药毒理与生物安全研究。*通讯作者:fjw9238@163.com
Activities of the Detoxifying Enzymes and Synergism in the Bifenthrin-resistant and Susceptible Strains of Tea Leafhopper, Empoasca vitis
LI Jianyu1, SHI Mengzhu1, FU Jianwei1*, WANG Ting1, ZHANG Zhikang2
1. Institute of Plant Protection, Fujian Academy of Agricultural Sciences, Fuzhou 350013, China;2. College of Plant Protection, Hunan Agricultural University, Changsha 410128, China
Abstract:Tea green leafhopper, Empoasca vitis, is the most serious pest in tea gardens. The detoxifying enzyme activities and synergism in the bifenthrin-resistant and susceptible leafhopper were measured via biochemical methods and bioassays to clarify their potential relationship to the resistance of tea leafhopper to bifenthrin. The detoxifying enzyme activity tests showed that the activities of carboxylesterase (CarE), Cytochrome P450-mediated O-demethylation activity toward p-nitroanisole (PNOD) and glutathione-S-transferase (GST) in the resistant strain were all higher than those in susceptible strain. The activities of the three detoxifying enzymes in bifenthrin-resistant strain were 2.09, 4.34 and 1.59 folds those of the susceptible strain respectively. Synergism tests showed that the synergist ratios of triphenyl phosphate (TPP), piperonyl buoxide (PBO) and diethyl maleate (DEM) were 1.04, 1.09,and 1.00 folds respectively in the bifenthrin-susceptible strain and 1.80, 7.97 and 1.03 foldsrespectively in the bifenthrin-resistant strain. These results indicate that CarE and PNOD play important roles in bifenthrin resistance oftea leafhoppers.
Keywords:Empoasca vitis, bifenthrin, resistance, detoxifying enzymes, synergism
