肾脏神经内分泌癌1例报告并文献复习
2016-07-29刘旸钟文麦新杨州陈康蓝创歆吴文起曾国华
刘旸 钟文 麦新 杨州 陈康 蓝创歆 吴文起 曾国华
·临床研究·
肾脏神经内分泌癌1例报告并文献复习
刘旸钟文麦新杨州陈康蓝创歆吴文起曾国华
510230 广州医科大学附属第一医院微创外科中心泌尿外科 广东省泌尿外科重点实验室
【摘要】目的通过分析肾脏神经内分泌癌(neuroendocrine carcinoma, NEC)的临床病理特征、免疫表型、治疗方式及预后,提高对该类肿瘤的认识和诊疗水平。 方法分析我科1例肾脏NEC的临床表现、病理特点及治疗方法并结合文献复习。结果患者表现为肉眼血尿伴腰痛。病理:肿瘤细胞中等大小,细胞核呈圆形、卵圆形,染色质为细颗粒状,肿瘤细胞排列呈小梁状、条索状,见菊形团样结构;免疫组化:CK(+)、EMA(+)、CD56(+)、Ki-67(80%)、CgA(-)、Syn(-)、CD99(-)、WT-1(-)、Vimentin(-)、NSE(-)。 结论肾脏NEC十分罕见,且临床表现与肾盂癌较为相似,其诊断主要根据病理学检查和免疫组化结果来做出判断。
【关键词】神经内分泌癌;肾脏;诊断;治疗
神经内分泌瘤(neuroendocrine tumors, NETs)是一类起源于肽能神经元和神经内分泌细胞的少见肿瘤,具有明显的神经内分泌分化功能和生物学行为。NETs可发生在全身的内分泌及非内分泌器官、组织,多位于消化道及肺部[1]。原发于肾脏的神经内分泌癌(neuroendocrine carcinoma, NEC)是肾脏恶性肿瘤中十分少见的一种类型,其在肾脏上皮恶性肿瘤中的比例不足1%[2-3]。我科于2015年确诊1例肾脏NEC,病理结果倾向小细胞癌。现结合文献复习,就该病主要病理特征、免疫学表型及治疗与预后方面进行探讨。
病例报告
患者,女,23岁。因“无明显诱因下出现右侧腰腹部疼痛伴肉眼血尿4月余”入院,呈阵发性酸痛,伴全程肉眼血尿,未诉其他不适。入院查体:腹部平软,未见膨隆及肿块,无压痛及反跳痛。右侧肋脊角轻度叩击痛,双侧输尿管行程无压痛,膀胱区充盈,无压痛,外生殖器及尿道无红肿异常。超声检查:右肾肾盂下份分离,内可见一大小约27 mm×24 mm的稍低回声病变,边界欠清,内部回声不均匀。因患者对造影剂过敏未做IVU检查。外院CT平扫+增强扫描(图1):右侧肾盂及下极肾盏内见占位性病变,边界欠清,呈浅分叶状,密度不均匀;增强扫描病灶轻-中度渐进性强化,右肾下极部分肾皮质受累。患者B超及CT检查考虑肾盂肿瘤,但CT平扫+增强扫描不同于典型的肾盂癌,不排除良性肿瘤可能,遂行输尿管软镜术病理活检(图2)。病理结果:镜检:肿瘤细胞中等大小,核圆形、卵圆形,染色质细颗粒状,瘤细胞排列呈小梁状、条索状,见菊形团样结构;免疫组化: CK(+)、EMA(+)、CD56(+)、Ki-67(80%)、CgA(-)、Syn(-)、CD99(-)、WT-1(-)、Vimentin(-)、NSE(-)。病理诊断:组织改变结合免疫组化结果符合NEC,倾向右侧肾小细胞NEC。由于肾脏NEC非常少见,为了排除胃肠道NEC以及是否合并转移瘤,进一步行PET-CT检查。PET-CT结果:右肾盂结节,糖代谢增高,符合肾盂恶性肿瘤;全身其余部位未见糖代谢增高灶。术前准备后,行腹腔镜下根治性右肾切除术,术中经后腹腔入路切除右肾;术中尽量游离输尿管至下段近膀胱处,但并不行膀胱袖状切除。
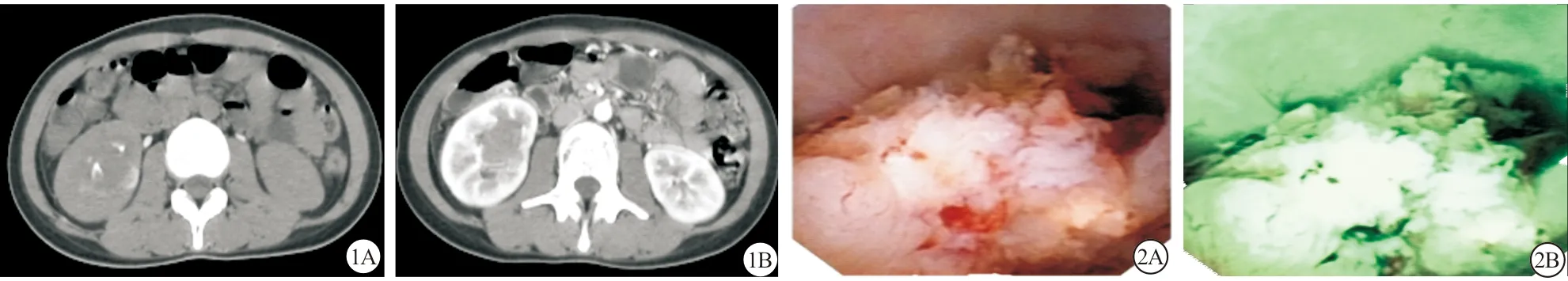
1A:平扫图像;1B:增强扫描图像;2A:镜下见肾盂输尿管连接部有一肿物突出,边界较平整,可见斑块状出血;2B:经输尿管软镜窄带成像术下肾肿物形态
图1CT平扫+增强扫描:右侧肾盂及下极肾盏内见占位性病变,边界欠清,呈浅分叶状,密度不均匀;右肾下极部分肾皮质受累
图2经输尿管软镜活检
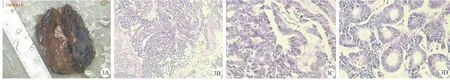
3A:术后大体标本,肿瘤侵犯髓质,未累积肾皮质,肾周脂肪组织未见癌;3B:肾盂肿物病理镜下图像(HE染色,×100);3C、3D:免疫表型CK(+)、EMA(+)、CD56(+)、Ki-67(80%)、CgA(-)、Syn(-)、CD99(-)、WT-1(-)、Vimentin(-)、NSE(-)(Envision二步法染色,DAB显色,×200)
图3右肾NEC病理活检结果
患者手术顺利,术后恢复良好,随访3个月,目前病情稳定,健侧肾脏未见转移病灶。最终病理结果:右肾NEC。肿瘤侵犯髓质,未累及肾皮质。肾周脂肪组织未见癌。脉管内见癌栓。输尿管末端未见癌。肿瘤细胞中等大小,核圆形、卵圆形,染色质细颗粒状,瘤细胞排列呈小梁状、条索状,见菊形团样结构(图3)。免疫表型CK(+)、EMA(+)、CD56(+)、Ki-67(80%)、CgA(-)、Syn(-)、CD99(-)、WT-1(-)、Vimentin(-)、NSE(-)。病理诊断:组织改变结合免疫组化结果符合NEC,倾向右侧肾小细胞NEC。
讨论
NETs是起源于不同器官神经内分泌细胞的一组异质性肿瘤,具有广泛的功能、形态及行为学特征。以往认为NETs是起源于内胚层神经内分泌细胞的肿瘤。然而最近的研究显示,少量的NETs来自神经外胚层[1-4]。NETs可以发生在任何组织或器官,既包括内分泌器官,也包括其他非内分泌器官和组织。我国的资料显示,NETs的好发部位主要以消化道(46.4%)及肺部(29.4%)最为多见[1],发生在泌尿系统的少见。在肾盂内证实有神经内分泌细胞存在,而肾实质内则未见[5]。
一、病理分型
神经内分泌肿瘤的病理学分类主要取决于肿瘤的解剖位置[5]。由于原发于肾脏的NEC极为罕见,其病理学分类主要参照了肺NEC的标准。根据其良恶性及分化程度可分为类癌、小细胞癌(small cell carcinoma, SCC)和大细胞神经内分泌癌(large cell neuroendocrine carcinoma, LCNEC)[6]。类癌,又称典型类癌,是肾脏NEC中分化较好且恶性度较低的一类。SCC及LCNEC均为肾脏NEC中分化程度较差、恶性度较高的类型。SCC约占肾脏上皮恶性肿瘤的1%[7]。可原发于肾实质或肾盂。SCC的肿瘤细胞通常具有较高的侵袭性,易发生早期转移。目前关于原发于肾实质的SCC报道不超过40例[8],SCC通常与肾脏其他类型的恶性肿瘤并存。有关LCNEC的报道更是不超过10例[6,9-10]。
二、发病机制
目前关于肾脏NEC的发病机制仍不清楚。一些理论认为NEC源于原始的全能干细胞,随后向神经内分泌方向分化。el-Naggar等[5]认为染色体3p21位点的杂合度消失是肾类癌发生的初始改变,而此变异也是其他肾脏肿瘤发生的起始因素。Romero等[11]回顾了56例肾类癌,其中合并马蹄肾的患者占17.8%,合并畸胎瘤的占14.3%,提示肾类癌的发生可能与先天畸形有关。也有部分学者认为,肾原发性肾类癌可能源于肾上皮化生或畸形上皮灶内的神经内分泌细胞[12-13]。肾SCC大多侵入肾盂且多与原位和乳头状尿路上皮癌共存,提示SCC可能起源于肾盂黏膜内具有多向分化潜能的多功能干细胞,而后向小细胞癌分化而来或由传统高级别的过渡细胞化生而来[3,10]。
三、临床特点
肾脏NEC的高发年龄为50~60岁。年龄因素与该病的进展程度与不良预后密切相关,超过40岁的患者诊断时,肾NEC往往分期较晚,预后较差。NEC未见性别倾向。临床上,多数肾脏NEC可无明显症状且进展缓慢,多由于体检偶然发现。少数肾类癌患者可表现出腰腹部疼痛、伴有血尿、便秘、发热、体重减轻等症状,男性患者可出现睾丸痛。约12.7%的患者可伴随内分泌综合征,如面色潮红、呼吸困难、腹泻等[14]。肾脏SCC多见于成年人,患者年龄多见于57~59岁,女性的发病率稍高于男性(56% vs 44% )[3,8,10]。腹部疼痛及血尿为肾脏SCC最常见的症状,而内分泌综合征症状则少见。肾SCC可原发于肾实质及肾盂,两者在生物学行为及预后上未见统计学差异[15]。LCNEC患者多表现为腰腹部疼痛或消化道症状,也可无明显症状[3]。本例患者主要表现为腰部疼痛伴血尿,无明显肾类癌的内分泌综合征表现。
四、影像学表现特征
肾NEC在影像学检查中缺乏特异性,常表现为较大的肿块,肾盂及肾周脂肪浸润明显,CT表现为边界清楚的实性肿物[15]。CT增强常表现为少血管或乏血管的肿瘤,强化不明显。可合并钙化,其中以类癌最常见,约见于26.5%的类癌[11]。尽管类癌的病灶在超声或CT下可有不同的形态,但在增强CT下均表现出轻度强化[16]。囊性变在NEC中较少见,该病有时亦可见局部淋巴结转移[17]。本例CT平扫+增强扫描示右侧肾盂见占位性病变,边界欠清,密度不均匀,肾轮廓无明显变化;增强CT示肿物轻度强化,右肾下极部分肾皮质受累,基本与之符合。由于NEC的CT表现与肾盂癌及肾癌较为相似,影像学上常难以鉴别。
五、病理学特征
1.大体标本:肾类癌肿瘤边界清晰,切面呈黄色或棕褐色,灶内可见少量出血、钙化和坏死。瘤体呈分叶状膨胀性生长,直径多较大,可见假性包膜[3,12]。原发于肾实质的SCC,肾盂黏膜往往较平滑。而原发于肾盂的SCC,肾盂表面多较粗不平,有时可见隆起的肿体。肾SCC肿瘤质地较软且脆,多呈白褐色,常侵犯肾周脂肪组织。局灶坏死及分叶在肾SCC及LCNEC较多见[6,8]。
2.镜下形态:类癌肿瘤细胞的典型表现为细胞小梁状或带状分布,有时可呈巢状或花环状方式生长。细胞为多边形,细胞质较均匀,细胞核呈圆形,胞内见圆形嗜酸性颗粒小体,细胞边界不清。有丝分裂少见。肾类癌细胞可偶见假乳头状结构,易与肾的上皮乳头状癌混淆。SCC细胞多由分化较差的小圆细胞或梭形细胞构成,细胞质较少,细颗粒状的染色质核仁不明显或缺乏。核分裂计数高,坏死和钙化多见。LCNEC细胞体积较大,细胞质中等或丰富,核染色质呈空泡状,核仁明显。胞内可见广泛坏死和多核巨细胞,核分裂多见。LCNEC具有典型的NEC生长方式,细胞多呈片状或巢状分布,可伴片状坏死[6]。肾SCC及LCNEC的镜下形态有时可与高级别的肾细胞癌或尿路上皮癌相似,仅靠病理镜检难以区分,易导致误诊。
3.免疫表型:免疫组织化学标志物是确诊肾NEC的主要依据。NEC的免疫组织化学标志物主要分为上皮性和神经内分泌两大类。上皮性标志物包括细胞膜抗原、白细胞共同抗原等,无特异性。而神经内分泌标志物包括CgA、Syn、NSE和CD56[6]。肾NEC不表达CD10、CK7、Ksp-cadherin等标志物。Syn几乎在所有的肾NEC中均有表达[11]。CgA在肾类癌的特异性阳性率为97%,而Syn诊断肾类癌的特异性高达100%[11]。70%~90%的NEC可表现为CgA(+)[6,18]。肾SCC和LCNEC至少表达神经内分泌标志物(Syn、CgA、NES和CD56)中的其中一种,但不表达CD10[18]。而肾细胞癌及尿路上皮癌则通常表达CD10。因此,神经内分泌标志物结合CD10可作为鉴别肾NEC与肾癌及尿路上皮癌的方法[11]。尽管CD56是一种特异性不高的抗体,但当其表达结果为阴性时,考虑肾SCC的可能性极小,因此也可作为一个有效的排除性标志物[8]。
六、治疗方式
对于局限性肾类癌及其他类型低分期的肾NETs,目前仍考虑肾脏切除联合区域淋巴结清扫作为首选的治疗方式[19]。对伴远处转移及分期较高的肾类癌,根治性切除及减瘤手术均不能使患者获益。对于伴肝转移的肾类癌患者,依托泊苷、顺铂及5-氟尿嘧啶等多种化疗均未能控制肿瘤的进展[20]。肾SSC及LCNEC的恶性度较高,通常就诊时已发生转移和扩散,从而失去了手术机会,患者的生存期均为数月至1年[7-8]。相反,有研究报道,单纯接受化疗患者比单纯接受手术治疗或化疗及手术联合治疗患者的存活率更高,治疗效果更好[21]。因此,化疗可考虑作为临床治疗肾脏SCC的首选方式,手术仅在需要解决局部症状时使用。近年来,小分子靶向药物如mTOR抑制剂依维莫司及酪氨酸激酶抑制剂舒尼替尼已被用作治疗分化良好的晚期胰腺NEC的新方式,然而其治疗肾NEC的具体疗效仍有待评估[1,19]。
七、预后
目前对于肾NEC患者的预后状况仍不明确。尽管肾类癌恶性度较低,但仍具有临床侵袭的可能性。以往的报道指出,45.6%的肾原发类癌伴有远处转移,肾类癌的转移风险与原发肿瘤的体积相关[9,19]。肾SCC恶性程度高,尽管行患侧肾根治性切除及淋巴结清扫,75%的患者仍在首诊后1年内死亡[7,22]。 LCNEC可能更具有侵袭性,预后状况更差,患者多在数月内死亡,多种手段联合的治疗方式依旧未能改善预后。
总之,原发于肾脏的NEC十分少见,临床诊断主要依靠病理形态及免疫表型。肾类癌的恶性度较低,但仍有转移风险,根治性手术为一线治疗方式,术后需严密复查。肾SCC及LCNEC恶性度较高,目前仍无明确有效的治疗手段,仅靠早期发现及治疗来提高生存率。
参考文献
[1]依荷芭丽·迟,姜文昌,杜丰,等. 神经内分泌瘤252例临床分析[J]. 中华肿瘤杂志,2013,35(1):67-70.
[2]Armah HB, Parwani AV. Primary carcinoid tumor arising within mature teratoma of the kidney: report of a rare entity and review of the literature[J]. Diagn Pathol,2007,2:15.
[3]韩冬艳,奚豪,朱延波,等. 肾脏神经内分泌癌1例并文献复习[J]. 临床与实验病理学杂志,2011,27(9):977-979.
[4]DeLellis RA. The neuroendocrine system and its tumors: an overview[J]. Am J Clin Pathol,2001,115 Suppl:S5-16.
[5]el-Naggar AK, Troncoso P, Ordonez NG. Primary renal carcinoid tumor with molecular abnormality characteristic of conventional renal cellneoplasms[J]. Diagn Mol Pathol,1995,4(1):48-53.
[6]刘定益,王健,唐崎,等. 肾原发性大细胞神经内分泌癌1例报告并文献复习[J]. 现代泌尿外科杂志,2013,18(1):63-65.
[7]La Rosa S, Bernasconi B, Micello D, et al. Primarysmall cell neuroendocrine carcinoma of the kidney: morphological, immunohistochemical, ultrastructural, and cytogenetic study of a case and review of the literature[J]. Endocr Pathol,2009,20(1):24-34.
[8]郭爱桃,黄恒,韦立新. 肾小细胞性神经内分泌癌的诊断与鉴别诊断[J]. 中华病理学杂志,2012,41(8):538-542.
[9]Ratnagiri R, Singh SS, Majhi U, et al. Large-cell neuroendocrine carcinoma of the kidney: Clinicopathologic features[J]. Indian J Urol,2009,25(2):274-275.
[10]Moukassa D, Leroy X, Bouchind'homme B, et al. Primary large cell neuroendocrine carcinoma of the kidney: morphologic and immunehistochemical features of two cases[J]. Ann Pathol,2000,20(4):357-360.
[11]Romero FR, Rais-Bahrami S, Permpongkosol S, et al. Primarycarcinoid tumors of the kidney[J]. J Urol,2006,176(6 Pt 1):2359-2366.
[12]Lane BR, Jour G, Zhou M. Renal neuroendocrine tumors[J]. Indian J Urol,2009,25(2):155-160.
[13]Mazzucchelli R, Morichetti D, Lopez-Beltran A, et al. Neuroendocrine tumours of the urinary system and male genital organs: clinical significance[J]. BJU Int,2009,103(11):1464-1470.
[14]黄恒,郭爱桃,韦立新,等. 肾原发性神经内分泌肿瘤6例临床病理分析[J]. 诊断病理学杂志,2012,19(5):348-351.
[15]卓越,徐婷,李健丁. 肾脏少见恶性肿瘤的 CT 表现[J]. 实用放射学杂志,2014,30(12):2024-2031.
[16]Resnick ME, Unterberger H, McLoughlin PT. Renal carcinoid producing the carcinoid syndrome[J]. Med Times,1966,94(8):895-896.
[17]王康,王之,赵泽华,等. 肾脏少见病变CT诊断(附4例误诊肾细胞癌的病例报道)[J]. 放射学实践,2008,23(6):657-660.
[18]夏青,刘冬耕,姜文奇,等. 肾脏神经内分泌肿瘤3例报告及文献复习[J]. 南方医科大学学报,2011,31(3):548-550.
[19]Korkmaz T, Seber S, Yavuzer D, et al. Primary renal carcinoid: treatment and prognosis[J]. Crit Rev Oncol Hematol,2013,87(3):256-264.
[20]Rodríguez-Covarrubias F, Gómez X, Valerio JC, et al. Carcinoid tumor arising in a horseshoe kidney[J]. Int Urol Nephrol,2007,39(2):373-376.
[21]Majhail NS, Elson P, Bukowski RM. Therapy and outcome of small cell carcinoma of the kidney: report of two cases and a systematic review of the literature[J]. Cancer,2003,97(6):1436-1441.
[22]Lane BR, Chery F, Jour G, et al. Renal neuroendocrine tumours: a clinicpathological study[J]. BJU Int,2007,100(5):1030-1035.
(本文编辑:熊钰芬)
通信作者:曾国华,E-mail:gzgyzgh@vip.tom.com
doi:10.3870/j.issn.1674-4624.2016.02.003
Corresponding author:ZENG Guo-hua,E-mail:gzgyzgh@vip.tom.com
(收稿日期:2016-02-19)
Neuroendocrine carcinoma of the kidney: 1 case report and review of the literature
LIUYang,ZHONGWen,MAIXin,YANGZhou,CHENKang,LANChuang-xin,WUWen-qi,ZENGGuo-hua.
DepartmentofUrology,MinimallyInvasiveSurgeryCenter,theFirstAffiliatedHospitalofGuangzhouMedicalUniversity.GuangdongKeyLaboratoryofUrology,Guangzhou510230,China
【Abstract】ObjectiveTo improve the knowledge, diagnosis and treatment of neuroendocrine carcinoma (NEC) in the kidney by analyzing the clinicpathological features, biological and immunohistochemical characteristic. MethodsThe clinical features, pathological characteristic and treatment of a case of NEC were summarized. ResultsThe main clinical features of this patient were gross hematuria with abdominal pain. Microscopic features: the renal tumor cells were medium-sized with circular to oval nuclei and fine granular nuclear chromatin. Renal carcinoid tumors typically present with a trabecular or ribbon-like growth pattern and the typical rosette-like structure can be seen inside the tumor cells. Immunohistochemical analysis: CK(+), EMA(+), CD56(+), Ki-67(80%), CgA(-), Syn(-), CD99(-), WT-1(-), Vimentin(-), NSE(-). ConclusionsRenal NEC is rare and its clinical manifestations are similar to that of renal pelvic carcinoma. The diagnosis of it is mainly based on the results of pathological examination and immunohistochemistry.
【Key words】Neuroendocrine carcinoma;Kidney;Diagnosis;Therapy
