气相色谱-质谱联用(GC-MS)法检测人体血液、尿液中大麻及其主要代谢物的含量
2016-07-27艾斯凯尔艾尔肯孙力扬努尔艾力塔依尔艾克拜尔热合曼
艾斯凯尔·艾尔肯, 孙力扬, 谢 辉, 王 华, 努尔艾力·塔依尔, 艾克拜尔·热合曼
(新疆医科大学基础医学院法医教研室, 乌鲁木齐 830011)
气相色谱-质谱联用(GC-MS)法检测人体血液、尿液中大麻及其主要代谢物的含量
艾斯凯尔·艾尔肯, 孙力扬, 谢辉, 王华, 努尔艾力·塔依尔, 艾克拜尔·热合曼
(新疆医科大学基础医学院法医教研室, 乌鲁木齐830011)
摘要:目的探讨气相色谱-质谱联用法在检测人体血液、尿液中四氢大麻酚(THC)、四氢大麻酚酸(THC-COOH)、大麻酚(CBN)、大麻二酚(CBD)的含量的应用价值。方法人体样本(血、尿)经水解后制成弱酸性水液,加入含氘代四氢大麻酚(THC-D3)和含氘代四氢大麻酚酸(THC-COOH-D3)试剂作为内标,固相萃取(SPE)方法提取生物样本中的四氢大麻酚(THC)、四氢大麻酚酸(THC-COOH)、大麻酚(CBN)、大麻二酚(CBD),与硅烷化试剂BSTFA(含1 % TMCS)进行衍生化后,采用气相色谱-质谱联用方法进行含量测定。结果血样:四氢大麻酚(THC)、大麻酚(CBN)、大麻二酚(CBD)、四氢大麻酚酸(THC-COOH)分别在10 ~80 ng/mL的范围内与峰面积呈良好的线性关系,相关系数(R2)>0.996 7,平均回收率为91.8%~97%,相对标准误差(RSD)为0.59%~1.8%。5例血样THC含量分别为12、19、13、30、23 ng/mL。3例血样CBN含量分别为43、47、56 ng/mL,2例血样CBN含量<40 ng/mL。2例血样CBD含量分别为55、60 ng/mL,3例血样CBD含量<50 ng/mL。4例血样THC-COOH含量分别为47、50、61、86 ng/mL,1例血样THC-COOH含量<10 ng/mL。尿样:四氢大麻酚(THC)、大麻酚(CBN)、大麻二酚(CBD)、四氢大麻酚酸(THC-COOH)分别在50~400 ng/mL的范围内与峰面积呈良好的线性关系,相关系数(R2)>0.997 4,平均回收率为93.1%~99.3%,相对标准误差(RSD)为0.27%~1.16%, 5例尿样中由于大部分THC酸化形成THC-COOH,因此没有THC或者浓度达不到最低检出限。1例尿样CBN含量为41 ng/mL,1例尿样CBN含量<40 ng/mL,3例尿样CBN含量<10 ng/mL。3例尿样CBD含量分别为71、56、50 ng/mL,1例尿样CBD含量<50 ng/mL,1例尿样CBD含量< 15 ng/mL。5例尿样THC-COOH含量分别为88.4、99、53、47、65 ng/mL。结论该方法简便、准确,可同时检测四氢大麻酚(THC)、四氢大麻酚酸(THC-COOH)、大麻酚(CBN)、大麻二酚(CBD)的含量。
关键词:GC-MS; 四氢大麻酚(THC); 大麻酚(CBN); 大麻二酚(CBD); 四氢大麻酚酸(THC-COOH)
大麻(Marijuana)又称火麻、胡麻,属荨麻目大麻科植物。大麻的化学成份非常复杂,大麻植物里检测分离的化学成分约420种。法庭科学主要对四氢大麻酚(THC)、大麻酚(CBN)、大麻二酚(CBD)以及主要代谢物四氢大麻酸(THC-COOH)进行定性和定量分析[1-2]。我国境内的自然环境尤其是边疆地区的地理、文化、生活习俗、宗教信仰等有所差异,吸毒大麻毒品国内毒情比较复杂,新疆地区的有关毒品犯罪、吸食活动也迅速蔓延且日益严重,已经成为了我国有关毒品犯罪活动最为严重的地区之一[3-4]。目前在科研研究和法庭科学最常用的人体血液、尿液中大麻及其代谢物的检测方法主要有植物学检验法、常规化学检验法、毛细管电泳法(CE)、薄层色谱法(TLC)、高效液相色谱法(HPLC)、气相色谱法(GC)、气相色谱-质谱法(GC-MS)、快速免疫检测法等[5]。但由于其成分半衰期以及代谢过程、代谢产物的差异,使检测灵敏度存在一定的差异[6],尤其是生物样本的前处理、提取等步骤尚未成熟。本研究对人体样本(血、尿)进行前处理时,加入含氘代四氢大麻酚(THC-D3)和含氘代四氢大麻酚酸(THC-COOH-D3)试剂作为内标,采用固相萃取(SPE)方法提取生物样本中的四氢大麻酚(THC)、四氢大麻酚酸(THC-COOH)、大麻酚(CBN)、大麻二酚(CBD),与硅烷化试剂BSTFA(含1% TMCS)进行衍生化后,采用气相色谱-质谱联用的测定方法检测样本中四氢大麻酚(THC)、 四氢大麻酚酸(THC-COOH)、大麻酚(CBN)、大麻二酚(CBD)的含量,现报道如下。
1材料与方法
1.1仪器与试药仪器:气相色谱/质谱联用仪 (气相色谱仪:AgiLent 7890A、安捷伦公司,质谱仪:Waters Quattro micro、Waters公司 );TDL-508型低速大容量离心机(上海安亭科学仪器厂);金坛XH-J多功能振荡器;氮吹仪(HGC-12A、天津恒奥); AB135-S型电子分析天平(METTLER TOLEDD,瑞典);色谱柱为安捷伦DB-5MS(AgiLent公司,美国);SPE固相萃取微型小柱(VARIAN公司,美国);玻璃内插管(0.1 mL,29 mm×5 mm,日本岛津);进样瓶(2.5 mL,AgiLent公司)。试药:大麻酚(Cerilliant公司,批号 171234-0207),大麻二酚(Cerilliant 公司,批号 171235-9907),四氢大麻酚(Cerilliant公司,批号 171236-200609),四氢大麻酚酸(Cerilliant公司,批号 EF082707-01),氘代四氢大麻酚(Cerilliant 公司,批号 EF082706-01),氘代四氢大麻酚酸标准品(Cerilliant公司,批号 FE011811),三甲基氯硅烷硅烷化试剂(BSTFA+TMCS,sigma公司,批号 FE082313),甲醇、乙醇、丙酮、乙酸乙酯、异丙醇均为色谱纯试剂,四氯酸、盐酸、氨水、二氯甲烷为分析纯试剂。
1.2标准品及内标的制备
1.2.1标准品的制备将液体状大麻酚(CBN 1 mg/mL)、大麻二酚(CBD 1 mg/mL)、四氢大麻酚(THC 0.1 mg/mL)、四氢大麻酚酸(THC-COOH 0.1 mg/mL)、含氘四氢大麻酚(THC-D3 0.1 mg/mL)以及氘代四氢大麻酚酸(THC-COOH-D3 0.1 mg/mL)标准品母液摇匀后,从大麻酚、大麻二酚母液中分别取1 μL置于空白安瓿瓶后,加入甲醇稀释至1 mL,配置浓度为1 ng/μL的大麻酚、大麻二酚标准品备用。从四氢大麻酚、四氢大麻酚酸母液中分别取10 μL置于空白安瓿瓶后,加入甲醇稀释至1 mL,配置浓度为1 ng/μL的四氢大麻酚、四氢大麻酚酸标准品备用。
1.2.2内标的制备从液体状含氘代四氢大麻酚(THC-D3 0.1 mg/mL)、含氘代四氢大麻酚酸(THC-COOH-D3 0.1 mg/mL)母液分别取1 μL,加入甲醇稀释200倍,配置浓度为5 ng/μL的内标溶液。
1.3样品的制备
1.3.1血样的制备血液样品取自于1名无任何毒品滥用史的志愿者,作为空白对照样,用于配制标准系列溶液;5名大麻吸食人员血液(均有3 a以上大麻滥用史)由某市公安局现场抽血提供,样品在-40℃冷冻保存。将待测血液(或空白或系列标准品溶液血液)用移液枪吸取2 mL置于10 mL塑料离心管中,每份样品中加入20 μL浓度为5 ng/μL内标溶液,第一份作为空白对照样保留,从第二份样品开始分别添加浓度为1 ng/μL的THC、THC-COOH、CBD、CBN标准品2、20、80、160 μL,使最终浓度分别为1、10、40、80 ng/mL,将储备好,震荡后置于-20℃冰冻1 h,混匀后在超声波仪器中超声振荡提取15 min, 4000 r/min离心15 min ;将上层转移至另一塑料试管中,加1 mL质量浓度为0.1 mol/mL,(pH=6)的磷酸缓冲溶液,加200 μL质量浓度为0.1 moL/mL的 KOH,pH值调到5~6;最后进行固相萃取。
1.3.2尿样的制备尿液样品取自于1名无任何毒品滥用史的志愿者,作为空白对照样,用于配制标准系列溶液;5名大麻吸食人员尿液(均有3 a以上大麻滥用史)由某市公安局现场取尿提供,样品在-40℃冷冻保存。将待测尿液(或加标空白尿液)用移液枪吸取2 mL置于塑料离心试管中,每份样品中分别加入40 μL浓度为5 ng/μL的含氘代四氢大麻酚、含氘代四氢大麻酚酸,第一份作为空白对照样保留,从第二份样品开始分别添加浓度为1 ng/μL的THC、THC-COOH、CBD、CBN标准品20、100、400、800μL,使最终浓度分别为10、50、200、400 ng/mL的一系列尿液标准品溶液;加入300 μL浓度为10 mol/mL的KOH,震荡;置于温度为60 ℃的恒温箱里20 min后,冷却;加入400 μL冰醋酸和3 mL浓度为0.05 mol/mL的磷酸后,震荡,用NaOH或0.05 mol/mL的磷酸来调节其酸碱度pH为4~5;加入5 mL磷酸缓冲溶液, 3 000 r/min离心10 min。最后进行固相萃取。
1.4固相微萃取和衍生化条件(1)活化SPE柱子:固相提取柱分别用2 mL CH3OH和2 mL浓度为0.05 mol/mL的H3PO4缓冲液活化。(2)在SPE柱子中填充样品:以1 mL/min流速将处理过的样品上柱。(3)洗涤SPE柱子:9 mL甲醇,3 mL(浓度0.05 mol/mL的磷酸与甲醇,体积比值为80∶20)混合液,抽干柱子约10 min,然后,加1 mL正己烷。(4)提取:用2 mL (己烷与乙酸乙酯为80∶20)混合液提到安瓿瓶。(5)用氮气吹干仪吹干溶剂。(6)衍生化:将洗提液氮吹仪吹干,加入BSTFA+TMCS(99:1)衍生化试剂30 μL,再用火焰关闭安瓿瓶,混合后置70 ℃烘箱中加热30 min进行衍生化。(7)检测:将衍生化的安瓿瓶打开,把内容液转移到带有200 μL内插管的自动进样瓶中,然后送GC-MS自动进样进行检测。
1.5气相色谱-质谱联用仪(GC-MS)检测条件气相色谱条件:色谱柱为安捷伦DB-5MS(30 m×0.250 mm×0.25 μm,柱子最高温度可达360℃)。载气:氦气,流速1.5 mL/min;气化室温度:280℃;柱温程序升温模式:70℃恒温保持2 min,以10℃/min 速度升到180℃,再以15℃/min 速度升到300℃,保持3 min。质谱条件:质谱条件:EI电离源,电子能量70 eV,离子源温度250℃。调谐方式为自动调谐,倍增电压1 073 V,发射电流100 μA,扫描范围40~550 m/z。
1.6方法学考察
1.6.1大麻主要有效成分的保留时间及特征性离子质荷比大麻酚、大麻二酚、四氢大麻酚、四氢大麻酚酸等有效成分有共价键电荷上的差别微弱,如果采用普通常温温度程序进行分离,以上几种成分色谱保留时间差距极微,即分离度较差, 按“1.5”项下色谱条件进行了优化, 4种成分具有良好的分离度(图1),大麻及其代谢物衍生化以后的质谱碎片(表1)。
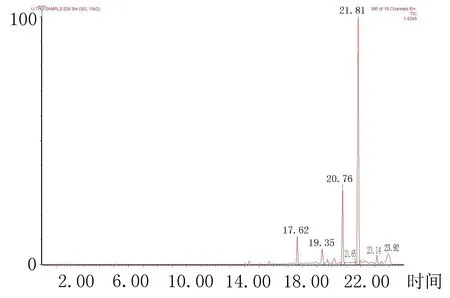
图1 大麻酚、大麻二酚、四氢大麻酚、四氢大麻酚酸等4种成分GC-MS总离子流图

表1 4种大麻主要有效成分特征性离子质核比以及保留时间
1.6.2线性关系的测定按照“1.3”项下方法对空白血、尿样中添加梯度质量浓度的标准品以及内标。以待测物峰面积和内标峰面积的比值对待测物质量浓度进行回归运算, 求得各个待测物的直线回归方程。血样:THC最低检出限(LOD)为1 ng/mL,最低定量限为10 ng/mL,相关系数(R2)为0.997 7;THC-COOH最低检出限(LOD)为1 ng/mL,最低定量限为10 ng/mL,相关系数(R2)为0.999 2; CBD的最低检出限(LOD)为15 ng/mL,最低定量限为50 ng/mL,相关系数(R2)为0.996 7;CBN最低检出限为20 ng/mL,最低定量限为40 ng/mL,相关系数(R2)为0.997 8。尿样:THC最低检出限(LOD)为10 ng/mL,最低定量限为50 ng/mL,相关系数(R2)为0.997 4;THC-COOH最低检出限(LOD)为1 ng/mL,最低定量限为10 ng/mL,相关系数(R2)为0.998 3;CBD的最低检出限(LOD)为15 ng/mL,最低定量限为50 ng/mL,相关系数(R2)为0.998 6;CBN最低检出限为20 ng/mL,最低定量限为40 ng/mL,相关系数(R2)为0.998 7,见表2、表3。

表2 血样线性关系及检出线以及确认定量线

表3 尿样线性关系及检出线以及确认定量线
1.6.3回收率和精密度试验血液:分别取空白血样2 mL共5组 ,按照样品处理项操作处理后衍生化,其测得的比值与加入量比较,重复以上实验步骤5次,测定平均含量计算其回收率及相对标准差。血液中大麻二酚、四氢大麻酚、大麻酚以及四氢大麻酚酸平均回收率分别为94.6%、91.8%、95.4%、97.0%, RSD值分别为1.80%、0.59%、1.40%、0.60%。尿液:分别取空白尿样2 mL共5组,按照样品处理项操作处理后衍生化,其测得的比值与加入量比较,重复以上实验步骤5次,计算其平均回收率及相对标准差。尿液中大麻二酚、四氢大麻酚、大麻酚以及四氢大麻酚酸平均回收率分别为95.6%、98.4%、93.1%、99.3%, RSD值分别为0.27%、0.38%、1.16%、0.31%,见表4。
2结果
2.1血样中大麻及其衍生物的含量对5例阳性血样,按照“1.3.1”项和“1.4”项进行了前处理和衍生化后,按照“1.5”项色谱柱条件进行GC-MS检测。由线性方程计算出四氢大麻酚(THC)、大麻二酚(CBD)、大麻酚(CBN)、四氢大麻酚酸(THC-COOH)的含量,含量大于最低检出限定性既检出,含量大于最低定量限既可以定量。5例阳性血样中THC的含量分别为12、19、13、30、23 ng/mL。3例血样CBN含量分别为43、47、56 ng/mL,2例血样CBN含量< 40 ng/mL。2例血样CBD含量分别为55、60 ng/mL,3例血样CBD含量<50 ng/mL。4例血样THC-COOH含量分别为47、50、61、86 ng/mL,1例含量<10 ng/mL,见表5。

表4 血液、尿液样本中方法回收率及相对标准差
表5吸食大麻者血样中THC、CBN、CBD与THC-COOH的含量/(ng/mL)

样品四氢大麻酚大麻酚大麻二酚四氢大麻酚酸112检出检出50219436047313检出558643056检出6152347检出检出
2.2尿样中大麻及其衍生物的含量测定对5例阳性尿样,按照“1.3.2”项和“1.4”项进行了前处理和衍生化后,按照“1.5”项色谱柱条件进行GC-MS检测。由线性方程计算出四氢大麻酚(THC)、大麻二酚(CBD)、大麻酚(CBN)、四氢大麻酚酸(THC-COOH)的含量,含量大于最低检出限定性既检出,含量大于最低定量限既可以定量。尿样中由于大部分THC酸化形成THC-COOH,因此没有THC或者达不到定量浓度。 1例尿样CBN含量为41 ng/mL,1例尿样CBN含量<40 ng/mL, 3例尿样CBN含量<10 ng/mL。3例尿样CBD含量分别为71、56、50 ng/mL, 1例尿样CBD含量<50 ng/mL,1例尿样CBD含量<15 ng/mL。5例尿样含量分别为88.4、99、53、47、65 ng/mL,见表6。
表6吸食大麻者尿样中THC、CBN、CBD与THC-COOH的含量/(ng/mL)

样品四氢大麻酚大麻酚大麻二酚四氢大麻酚酸1--7188.42--56993--50534-41-475-检出检出65
3讨论
四氢大麻酚(THC)、大麻二酚(CBD)、大麻酚(CBN)和大麻酚酸(THC-COOH)衍生物和氘化类似物产生的离子具有优异的分辨率和比较低的定量限。通过BSTFA+TMCS(99∶1)衍生化试剂衍生化后把最低检出限控制在2 ~20 ng/mL的范围内。为获得最佳的分析结果,保证对目标药物定性、定量的准确性,首先采用全扫描模式(full scan)获得待测物的离子,选择3个离子,再用离子选择扫描模式(sir scan)通过优化碰撞能量获得产物离子,最后采用优化的质谱参数在SIM模式对待测物的产物离子进行定性、定量分析[7]。经过优化,得到了较为理想的分析结果,并且优化之后通过对比衍生化前后的质核比、离子系数等参数达到了最佳检测灵敏状态[8-11]。色谱柱的选择直接关系到对本研究的成败,如果色谱柱选择得不成功,则会导致期处理、提取、衍生化阶段失败。由于大麻代谢物多部分属于弱极性物质,因此本方法选用安捷伦DB-5色谱柱[12]。气质联用仪定性定量的精确性和可信赖性主要被色谱峰分离的分离程度决定,而组分之间分离的效果与色谱柱温度密切相关[13-15]。本方法中大部样本分组分在170℃之后出峰,为让这一温度阶段的组分出峰更好,采用较大的升温速率(15℃/min)。本方法可同时分析THC、CBD、CBN 和THC-COOH, 延长尿液中THC-COOH的检测时限, 人体样本(血液、尿液)用量少, 特异性强, 灵敏度高, 线性范围宽,在滥用药物分析的实际案件中具有应用价值。
参考文献:
[1]白燕平,朱军.世界毒物学家学会第43届国际会议概述[J].刑事技术,2005,13(6):3-5.
[2]Moore C, Rana S, Coulter C, et al. Detection of conjugated 11-nor-Delta9-tetrahydrocannabinol-9-carboxylic acid in oral fluid[J].Anal Toxicol,2007, 31(4):187-194.
[3]艾尔肯·沙木沙克.新疆毒品犯罪现状及其防治对策探讨[J].犯罪研究, 2010,30(3):71-79.
[4]王莅,胡景敏.新疆地区药物滥用现状、影响因素及劳教管理措施[J].中国药物依赖性杂志,2008,17 (3):231-233.
[5]Lee D ,Milman G ,Schwop DM ,et al. Cannabinoid stability in authentic oral fluid after controlled cannabis smoking[J]. Clin Chem,2012,58(7):1101-1109.
[6]陆林,王曦,薛言学.中国药物滥用的过去,现在和将来[J].中国药物依赖性杂志,2009,18 (2):81-86.
[7]常颖, 郑珲,高利生.大麻概况及其气相分析方法综述[J].刑事技术,2011,19(1):35-38.
[8]张桂霞,王继芬,赵敬真. 毒物分析鉴定的评析及其在案件侦破中的应用[J].广东公安科技, 2005,22(2):19-22.
[9]向平,沈敏,沈保华,等.GC-MS同时分析头发中大麻酚类和9-四氢大麻酸[J].法医学杂志,2002,18(4):216-219.
[10]Scherer C, Wachterb U, Wudy SA.Determination of testosterone in human hair by GC-MS[J]. Analyst,1999,124(9):297-300.
[11]朱军 ,赵敬真,于忠山,等.GC和 GC/MS技术在毒品来源推断中的应用[J].中国法毒学杂志 ,2005,20(3):140-142.
[12]张丽敏.酶联放大免疫测试方法在毒品检测中的应用[J].中国药物滥用防治杂志,2005,11(6):361-362.
[13]魏万里.SPE-GC-MS/MS-SRM法快速检测尿液中12种常见毒品成分及代谢物[J]. 中国人民公安大学学报:自然科学版, 2012,18(3):27-31.
[14]Mateus M,Bergamaschi AL, Lan B. Impact of enzymatic and aLkaLine hydroLysis on CBD concentration in urine[J]. Anal Bioanal Chem.2013,405(14):4679-4689.
[15]Milman G ,Barnes AJ ,Lowe RH , et al. Simultaneous quantification of cannabinoids and metabolites in oral fluid by two-dimensional gas chromatography mass spectrometry [J]. Chromatography A. 2010,1217(9):1513-1521.
(本文编辑施洋)
基金项目:新疆维吾尔自治区科技厅科技支撑金项目(201133132); 乌鲁木齐市科技局科技计划项目(Y111310019)
作者简介:艾斯凯尔·艾尔肯(1989-),男(维吾尔族),在读硕士,研究方向:法医毒物学研究。 通信作者:艾克拜尔·热合曼(1963-),男,博士,副教授,研究生导师,研究方向:法医毒物学、新药研发研究,E-mail: 1050558470@qq.com。
中图分类号:R331
文献标识码:A
文章编号:1009-5551(2016)08-1020-06
doi:10.3969/j.issn.1009-5551.2016.08.021
[收稿日期:2016-03-05]
Detecting contents of Cannabis and its metabolites in human blood and urine by gas chromatography-mass spectrometry (GC-MS) method
Aisikaer Aierken, SUN Liyang, XIE Hui, WANG Hua, Nueraili Tayier, Aikebaier Reheman
(DepartmentofForensicMedicine,SchoolofPre-clinicalMedicine,XinjiangMedicalUniversity,Urumqi830011,China)
Abstract:ObjectiveTo investigate GC-MS methods value in the detection of contents of tetrahydrocannabinol (THC), THC acetic acid (THC-COOH), cannabinol (CBN) and cannabidiol (CBD) in human samples (blood,urine). MethodsHydrolized human urine and blood samples were made as solution of weak acid, adding deuterated THC (THC-D3) and deuterated THCA (THC-COOH-D3) as an internal standard reagent, using solid phase extraction (SPE) to extract THC, THC-COOH, CBN and CBD from the samples, after silylating agent BSTFA (containing 1% TMCS) derivatizing to determine the contents by GC-MS method. ResultsIn the blood samples, the contents of THC, THC-COOH, CBN and CBD had good linear relationship with their peak areas within 10-80 μg/L, in which correlation coefficient R2 was >0.9967, the average recovery rate was 91.8%-97% and the relative standard deviation (RSD) was 0.59%-1.8%. The contents of THC in 5 cases of blood sample were 12, 19, 13, 30, 23 μg/L respectively, the contents of CBN in 3 cases of blood were 43, 47, 56 μg/L respectively, the contents of CBN in 2 cases of blood were < 40 μg/L, the contents of CBD in 2 cases of blood were 55, 60 μg/L, the contents of CBD in 3 cases of blood were < 50 μg/L, the contents of THC-COOH in 4 cases of blood sample were 47, 50, 61, 86 μg/L respectively, and the contents of THC-COOH in 1 cases of blood sample was <25 μg/L. In the urine samples, the contents of THC, THC-COOH, CBN and CBD had good linear relationship with their peak areas within 50-400 μg/L, in which correlation coefficient R2 was >0.9974, the average recovery rate was 93.1%-99.3% and the relative standard deviation (RSD) was 0.27%-1.16%. Since most of the THC was acidized to THC-COOH, there was no THC or less than the limit of detection of THC in 5 cases of urine sample. The content of CBN in 1 cases of urine was 41 μg/L, the content of CBN in 1 cases of urine was < 40 μg/L, the contents of CBN in 3 cases of urine were < 20 μg/L, the contents of CBD in 3 cases of urine were 71, 56, 50 μg/L respectively, the content of CBD in 1 cases of urine was < 50 μg/L, the content of CBD in 1 cases of urine was < 15 μg/L, and the contents of THC-COOH in 5 cases of urine were 88.4, 99, 53, 47, 65 μg/L respectively. ConclusionThe method is simple and accurate, which could simultaneously detect the contents of THC, THC-COOH, CBN and CBD.
Keywords:GC-MS; tetrahydrocannabinol (THC); cannabinol (CBN); cannabidiol (CBD); THC acetic acid (THC-COOH)
