瞬时受体电位香草酸亚型1通道影响支气管哮喘大鼠气管平滑肌细胞增殖和炎症的研究
2016-07-27赵丽敏况红艳张罗献吴纪珍陈献亮张晓宇马利军
赵丽敏,况红艳,张罗献,吴纪珍,陈献亮,张晓宇,马利军
·论著·
瞬时受体电位香草酸亚型1通道影响支气管哮喘大鼠气管平滑肌细胞增殖和炎症的研究
赵丽敏,况红艳,张罗献,吴纪珍,陈献亮,张晓宇,马利军
目的探讨瞬时受体电位香草酸亚型1(TRPV1)通道对支气管哮喘大鼠气管平滑肌细胞增殖和炎症的影响。方法2013年6月—2014年6月,选取5~6周龄清洁级健康雄性SD大鼠60只,采用随机数字表法分为:正常对照组、支气管哮喘组、支气管哮喘+辣椒素(CAP)组、支气管哮喘+辣椒卓平(CPZ)组,每组15只。支气管哮喘组、支气管哮喘+CAP组、支气管哮喘+CPZ组大鼠制作支气管哮喘模型,支气管哮喘+CAP组大鼠给予含有0.01% CAP的饲料喂养,支气管哮喘+CPZ组大鼠给予含有0.01% CPZ的饲料喂养。病理学检查显微镜下找到完整肺内支气管横断面,计算管壁面积(WA)/管腔内周长(Pi)、支气管平滑肌面积(S)/Pi、支气管平滑肌细胞核数(N)/Pi,采用实时荧光定量反转录聚合酶链式反应(RT-qPCR)和Western blotting法检测气管平滑肌组织TRPV1、增殖细胞核抗原(PCNA)mRNA及其蛋白表达水平,酶联免疫吸附试验(ELISA)法检测大鼠气管平滑肌组织白介素(IL)-4、IL-5、IL-13表达水平。结果支气管哮喘组和支气管哮喘+CAP组大鼠气管WA/Pi、S/Pi、N/Pi高于对照组(P<0.05);支气管哮喘+CAP组大鼠气管WA/Pi、S/Pi、N/Pi高于支气管哮喘组(P<0.05);支气管哮喘+CPZ组大鼠气管WA/Pi、S/Pi、N/Pi低于支气管哮喘+CAP组(P<0.05)。支气管哮喘组和支气管哮喘+CAP组大鼠气管平滑肌组织TRPV1、PCNA mRNA及其蛋白、IL-4、IL-5、IL-13表达水平高于对照组(P<0.05);支气管哮喘+CAP组大鼠气管平滑肌组织TRPV1、PCNA mRNA及其蛋白、IL-4、IL-5、IL-13表达水平高于支气管哮喘组(P<0.05);支气管哮喘+CPZ组大鼠气管平滑肌组织TRPV1、PCNA mRNA及其蛋白、IL-4、IL-5、IL-13表达水平低于支气管哮喘和支气管哮喘+CAP组(P<0.05)。结论TRPV1、PCNA mRNA及其蛋白、IL-4、IL-5、IL-13在支气管哮喘大鼠气管平滑肌组织中高表达,阻断TRPV1通道后,气管平滑肌组织增生和炎症均明显减轻,提示TRPV1通道可能在支气管哮喘大鼠气管平滑肌细胞增殖和炎症形成中发挥重要作用。
支气管哮喘;瞬时受体电位通道;肌细胞,平滑肌;细胞增殖;炎症
赵丽敏,况红艳,张罗献,等.瞬时受体电位香草酸亚型1通道影响支气管哮喘大鼠气管平滑肌细胞增殖和炎症的研究 [J].中国全科医学,2016,19(21):2522-2527.[www.chinagp.net]
ZHAO L M,KUANG H Y,ZHANG L X,et al.Function of TRPV1 channel on the proliferation and inflammation in airway smooth muscle cells of asthmatic rat[J].Chinese General Practice,2016,19(21):2522-2527.
支气管哮喘是一种常见的慢性呼吸系统疾病,也是一种严重危害人类健康的疾病。由于支气管哮喘的发病机制尚未明确,目前的治疗只能达到控制症状的效果,因此,进一步明确支气管哮喘的发病机制、寻找更有针对性的治疗方法是目前国内外研究的热点[1]。气管重塑是支气管哮喘的重要病理特征,是支气管哮喘不可逆气流阻塞的病理基础[2]。气管平滑肌作为气管壁的主要组成成分,其细胞增殖是气管重塑的重要原因之一[3]。瞬时受体电位香草酸(TRPV)是细胞膜上重要的信号传导通路,对细胞的增殖和分化起着关键作用,尤其是瞬时受体电位香草酸亚型1(TRPV1)通道[4-5]。有研究发现,TRPV1对支气管收缩、蛋白分泌、气管黏膜水肿和炎性细胞趋化[6]以及咳嗽反射[7-8]等有重要的作用。另外研究发现,遗传缺失功能性TRPV1通道的儿童,其活动性支气管哮喘的风险较低[9]。但关于TRPV1通道在支气管哮喘气管平滑肌重塑中的作用目前尚未见报道。故本研究拟通过观察TRPV1 通道在支气管哮喘大鼠气管平滑肌组织的表达以及对气管平滑肌细胞增殖和炎症的影响,来阐明TRPV1通道在气管平滑肌细胞增殖中的作用和地位,为治疗支气管哮喘气管平滑肌重塑寻找新的靶点。
本研究创新点:
瞬时受体电位香草酸亚型1(TRPV1)通道影响支气管哮喘大鼠气管平滑肌细胞增殖和炎症的研究是在有关研究工作最新进展的基础上更深一步的研究,系细胞内生物信号传导研究领域和分子生物技术研究领域的前沿和交叉。在气管平滑肌细胞中,Ca2+内流的途径包括电压门控的Ca2+通道(VOCC)、受体操纵的Ca2+通道(ROC)和容量性Ca2+内流(CCE)。瞬时受体电位香草酸(TRPV)通道家族成员可能参与钙库操纵性通道(SOC)的构成,从而影响细胞内钙信号的调控。以往的研究均是观察Ca2+相关通道在神经系统、心血管系统方面的研究,在呼吸系统方面的研究较少,特别是关于TRPV1通道在支气管哮喘气管重塑中的研究,目前国内、外尚未见类似报道。本研究发现TRPV1通道和白介素(IL)-4、IL-5、IL-13在支气管哮喘大鼠气管平滑肌组织中高表达,阻断TRPV1通道后,气管平滑肌组织增生和炎症均明显减轻,提示TRPV1通道可能在支气管哮喘大鼠气管平滑肌细胞增殖和炎症形成中发挥着重要`作用。
1 材料与方法
1.1主要试剂与仪器TRIZOL试剂购于Gibco公司;Omniscript反转录酶、TRPV1引物(QT00193907)、内参β-actin引物(QT00193473)、聚合酶链式反应(PCR)试剂盒、SYBR GreenⅠ购于Qiagen(Valencia,CA);Taq酶购于Promega公司;TRPV1兔多抗(ab63083)、内参β-actin引物(ab75186)、羊抗兔辣根过氧化物酶(HRP)标记二抗(ab97069)购于Abcam公司(英国);增殖细胞核抗原(PCNA)兔多抗(sc-7907)购于Santa Cruz公司(美国);卵清蛋白(OVA)、辣椒素(capsaicin,CAP)、辣椒卓平(capsazepin,CPZ)购于Sigma公司(美国);酶联免疫吸附试验(ELISA)试剂盒购于Invitrogen公司(美国);含苯甲基磺酰氟(PMSF)的RIPA裂解液、BCA蛋白检测试剂盒购于武汉博士德生物工程有限公司。
主要仪器有定量荧光分光光度计(Spex AR-CM-MIC)、Bio-Rad PCR仪、Kodak Image station成像系统(美国)、Bio-Rad Mini V垂直电泳仪(GE公司)、Trans Blot仪(GE公司)、酶标仪(Bio-tek ELX800)等。
1.2支气管哮喘模型制作和实验分组2013年6月—2014年6月,选取5~6周龄清洁级健康雄性SD大鼠60 只,体质量180~200 g,采用随机数字表法分为:(1)对照组15只:大鼠给予正常饲料喂养,并以0.9%氯化钠溶液代替OVA进行致敏。(2)支气管哮喘组15只:大鼠给予正常饲料喂养,按文献[10-11]方法制成支气管哮喘模型,第1天每只大鼠腹腔注射含10 mg OVA和200 mg氢氧化铝的0.9%氯化钠溶液1 ml,同时腹腔注射百日咳杆菌疫苗1 ml(约6×109个菌株),第8天重复致敏1次,第15天开始激发。将大鼠置于特制玻璃容器内,用超声雾化器喷入含2% OVA的0.9%氯化钠溶液50 ml,激发30 min,3次/周,持续激发6周。激发后大鼠出现呼吸加快、烦躁、呛咳、轻度发绀等支气管哮喘发作症状。(3)支气管哮喘+CAP组15只:大鼠给予含有0.01% CAP的饲料喂养,造模同上,激发同上。(4)支气管哮喘+CPZ组15只:大鼠给予含有0.01% CPZ的饲料喂养,造模同上,激发同上。末次激发18~24 h内将大鼠处死。取左肺下叶,肺组织经4%多聚甲醛溶液固定96 h,石蜡包埋切片,苏木精-伊红(HE)染色和病理图像分析;取右肺气管平滑肌组织,0.9%氯化钠溶液中漂洗干净,置于1.5 ml EP管中,放入-80 ℃冰箱内保存,待行实时荧光定量反转录聚合酶链式反应(RT-qPCR)、Western blotting、ELISA检测。
1.3病理图像分析在显微镜下找到完整肺内支气管横断面,采用图像分析软件,测定管腔内周长(Pi)、管壁面积(WA)、支气管平滑肌面积(S)、支气管平滑肌细胞核数(N),将所测值用Pi标准化,分别以WA/Pi、S/Pi、N/Pi表示。
1.4RT-qPCR法检测气管平滑肌组织TRPV1、PCNA mRNA表达水平用TRIZOL试剂提取气管平滑肌组织总RNA,取100 ng RNA,用Omniscript反转录酶将RNA反转录为cDNA。以1 μl cDNA为模板行PCR扩增,RT-qPCR样品反应体系采用SYBR GreenⅠ,其最终的反应体系为25 μl。PCR条件为:95 ℃预变性2 min,95 ℃变性30 s,55 ℃退火30 s,68 ℃延伸1 min,共40 个循环;最后72 ℃延伸5 min。绘制TRPV1、PCNA和内参β-actin的荧光曲线和熔解曲线,并得到各自的荧光域值循环数(Ct值),采用相对定量法2-ΔΔCt进行计算。
1.5Western blotting法检测TRPV1、PCNA表达水平取气管平滑肌组织100 mg,用冰冻的磷酸盐缓冲液(PBS)冲洗1遍,滤纸吸干,剪碎后,加入预冷的含PMSF的RIPA裂解液1 ml,冰磨3 min,至不见组织碎块,4 ℃,10 000 r/min离心5 min(离心半径6.5 cm),取上清液,-80 ℃冻存。采用BCA法测定蛋白含量,绘制标准曲线,计算蛋白浓度。使用前各组蛋白分别取50 μg,十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)和蛋白印迹反应,半干法转膜。5%脱脂奶室温下摇动封闭后加入一抗(TRPV1、PCNA均按1∶1 000稀释),4 ℃孵育过夜,室温下漂洗后加入HRP标记二抗(1∶2 000稀释),摇床上孵育2 h,TBST充分漂洗后,用ECL发光剂荧光显色,曝光后X线片用凝胶图像分析软件扫描,并用Image J 4.0 software测定蛋白条带的吸光度(OD值)。结果均用实际值与内参β-actin的比值表示。
1.6ELISA法检测大鼠气管平滑肌组织匀浆上清液中白介素(IL)-4、IL-5、IL-13表达水平取右肺气管平滑肌组织,预冷的PBS冲洗后滤纸吸干,称重,剪碎后,加入9倍体积的PBS,冰磨2 min至不见组织碎块,4 ℃,3 000 r/min离心l5 min(离心半径6.5 cm),后取上清液,BCA法测定蛋白含量,-80 ℃冻存。参照ELISA试剂盒说明书检测IL-4、IL-5、IL-13表达水平。

2 结果
2.1病理学检查对照组大鼠肺组织病理切片显微镜下可见支气管及肺泡结构正常,支气管管腔光滑,无闭塞,黏膜下及血管周围组织未见炎性细胞浸润;支气管哮喘组大鼠肺组织可见细支气管黏膜皱襞明显增多、断裂,黏膜下及管壁可见大量的嗜酸粒细胞浸润,管腔内可见黏液栓,气管壁及气管平滑肌明显增厚;支气管哮喘+CAP组大鼠肺组织可见细支气管黏膜皱襞明显增多、断裂,黏膜下及管壁可见嗜酸粒细胞浸润,管腔内可见黏液栓,气管壁及气管平滑肌明显增厚;支气管哮喘+CPZ组大鼠肺组织可见少量的炎性细胞浸润,管壁无明显增厚,管壁黏膜光整,黏膜下胶原少,形态基本接近正常(见图1,本文彩色图片见本刊官网www.chinagp.net电子期刊相应文章附件)。4组大鼠气管WA/Pi、S/Pi、N/Pi比较,差异均有统计学意义(P<0.05);其中支气管哮喘组和支气管哮喘+CAP组大鼠气管WA/Pi、S/Pi、N/Pi高于对照组,差异均有统计学意义(P<0.05);支气管哮喘+CAP组大鼠气管WA/Pi、S/Pi、N/Pi高于支气管哮喘组,差异均有统计学意义(P<0.05);支气管哮喘+CPZ组大鼠气管WA/Pi、S/Pi、N/Pi低于支气管哮喘+CAP组,差异均有统计学意义(P<0.05,见表1)。

表1 4组大鼠气管WA/Pi,S/Pi,N/Pi比较
注:CAP=辣椒素,CPZ=辣椒卓平,WA=管壁面积,Pi=管腔内周长,S=气管平滑肌面积,N=气管平滑肌细胞核数;与对照组比较,aP<0.05;与支气管哮喘组比较,bP<0.05;与支气管哮喘+CAP组比较,cP<0.05
2.2各组大鼠气管平滑肌组织TRPV1、PCNA mRNA及其蛋白表达水平4组大鼠气管平滑肌组织TRPV1、PCNA mRNA及其蛋白表达水平比较,差异均有统计学意义(P<0.05);其中支气管哮喘组和支气管哮喘+CAP组大鼠气管平滑肌组织TRPV1、PCNA mRNA及其蛋白表达水平高于对照组,差异均有统计学意义(P<0.05);支气管哮喘+CAP组大鼠气管平滑肌组织TRPV1、PCNA mRNA及其蛋白表达水平高于支气管哮喘组,差异均有统计学意义(P<0.05);支气管哮喘+CPZ组大鼠气管平滑肌组织TRPV1、PCNA mRNA及其蛋白表达水平低于支气管哮喘组和支气管哮喘+CAP组,差异均有统计学意义(P<0.05,见表2、图2)。
2.3各组大鼠气管平滑肌组织IL-4、IL-5、IL-13表达水平4组大鼠气管平滑肌组织IL-4、IL-5、IL-13表达水平比较,差异均有统计学意义(P<0.05);其中支气管哮喘组和支气管哮喘+CAP组大鼠气管平滑肌组织IL-4、IL-5、IL-13表达水平高于对照组,差异均有统计学意义(P<0.05);支气管哮喘+CAP组大鼠气管平滑肌组织IL-4、IL-5、IL-13表达水平高于支气管哮喘组,差异均有统计学意义(P<0.05);支气管哮喘+CPZ组大鼠气管平滑肌组织IL-4、IL-5、IL-13表达水平低于支气管哮喘+CAP组,差异均有统计学意义(P<0.05,见表3)。
3 讨论
支气管哮喘是全球最常见的慢性疾病之一,表现为气管的高反应性、气管炎症和气管阻塞等。其发病率逐年增高并造成巨大的经济负担及社会负担,因此研究支气管哮喘的发生、发展及防治,已成为当前呼吸领域的前沿课题[1]。近年来气管重塑,又称气管重建或气管重构,被认为是支气管哮喘发病机制中的一个重要环节,在支气管哮喘发病机制和治疗中的作用越来越受到关注[12-13]。气管重塑是以气管壁细胞和分子的组成、数量和结构变化为特征的一系列慢性损伤和修复过程,主要表现为细胞外基质沉积、基底膜增厚、气管平滑肌增生和肥大等[14-15]。作为支气管哮喘的特征性病理变化,气管重塑是支气管哮喘慢性化、持续化、严重化的病理基础,是支气管哮喘存在的不可逆性气管阻塞的病理基础,也是激素抵抗性支气管哮喘的病理基础[16]。因此,支气管哮喘的治疗必须与防治气管重塑相结合,才是真正意义上的治疗和控制。气管平滑肌作为气管壁的主要组成部分,其过度增殖是支气管哮喘气管重塑的重要原因之一。故气管平滑肌细胞增殖的机制探讨是目前支气管哮喘气管重塑研究的热点。
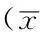
Table 2Comparison of expression level of TRPV1,PCNA mRNA and protein in airway smooth muscle tissue among four groups

组别只数TRPV1mRNAPCNAmRNATRPV1PCNA对照组151.1±0.11.0±0.21.0±0.11.0±0.2支气管哮喘组152.1±0.3a2.8±0.4a2.2±0.5a2.5±0.4a支气管哮喘+CAP组152.9±0.8ab3.6±0.7ab3.2±0.5ab4.3±0.7ab支气管哮喘+CPZ组151.1±0.2bc0.9±0.1bc1.1±0.2bc1.0±0.1bcF值9.52010.10512.43014.603P值0.0050.0040.0020.001
注:TRPV1=瞬时受体电位香草酸亚型1,PCNA=增殖细胞核抗原;与对照组比较,aP<0.05;与支气管哮喘组比较,bP<0.05;与支气管哮喘+CAP组比较,cP<0.05

Table 3Comparison of expression level of IL-4,IL-5,IL-13 in airway smooth muscle tissue among four groups

组别只数IL-4IL-5IL-13对照组1548.7±3.232.3±4.610.3±1.7支气管哮喘组15126.1±10.4a72.4±10.4a19.5±2.9a支气管哮喘+CAP组15156.2±12.7ab119.6±13.9ab29.4±4.0ab支气管哮喘+CPZ组1558.0±4.6bc35.1±6.9bc9.2±1.2bcF值36.25717.88111.989P值<0.0010.0010.002
注:IL-4=白介素4,IL-5=白介素5,IL-13=白介素13;与对照组比较,aP<0.05;与支气管哮喘组比较,bP<0.05;与支气管哮喘+CAP组比较,cP<0.05

注:TRPV1=瞬时受体电位香草酸亚型1,PCNA=增殖细胞核抗原
图2Western blotting法检测4组大鼠气管平滑肌组织TRPV1和PCNA的表达
Figure 2The protein expression of TRPV1 and PCNA in airway smooth muscle tissue of four groups by Western blotting

注:CAP=辣椒素,CPZ=辣椒卓平
图14组大鼠气管病理学检查(苏木精-伊红染色,×100,Bar=20 μm)
Figure 1The rat airway pathological examination of each group
Ca2+作为细胞内重要的第二信使,在体内一系列Ca2+依赖性的生理活动中具有重要作用,包括肌肉收缩、神经递质和激素的释放、基因转录、细胞的增殖和凋亡等。细胞内Ca2+的变化不仅是影响细胞生理功能的重要因素,而且也是多种受体激活后信号转导过程中的关键[17-18]。本课题组前期研究结果显示,气管平滑肌细胞内Ca2+稳态异常是气管平滑肌功能异常的重要机制[19]。细胞内Ca2+的变化依赖于Ca2+跨膜转运和细胞内钙库释放和再摄取Ca2+等过程的动态平衡。在气管平滑肌细胞中,Ca2+内流的途径包括电压门控的Ca2+通道(VOCC)、受体操纵的Ca2+通道(ROC)和容量性Ca2+内流(CCE)。由于VOCC阻断剂对支气管哮喘气管平滑肌的收缩功能和气管高反应性无明显作用[20],表明其他通道在气管平滑肌细胞Ca2+信号调控中具有主导地位。ROC是目前研究较多的离子通道,其中钙库操纵性通道(SOC)是最热门、最受重视的一个ROC亚型[21]。有研究发现,TRPV通道家族成员可能参与SOC的构成,从而影响细胞内钙信号的调控[22]。
TRPV通道是个超家族,目前已发现哺乳动物TRPV 通道家族有6个成员,可被分为3组:(1)TRPV1(vanilloid receptor 1,VR1)、TRPV2 (vanillod-like receptor1,VRL1)、TRPV4(OTRPC4); (2) TRPV3; (3) TRPV5(epithelial calcium channel 1/calcium transporter 2,ECaC1/CaT2)、TRPV6(ECaC2/CaT1)。TRPV各个亚型不同程度地分布在皮肤、神经系统、心血管系统和呼吸系统等[23-24]。TRPV1通道可被高温、细胞外低pH值、炎性因子、某些化学毒物等激活,对野香草分子(包括CAP)较敏感[25]。有研究发现,TRPV1通道对支气管收缩、蛋白分泌、气管黏膜水肿和炎性细胞趋化等有重要的影响。此外,TRPV1通道受体在慢性咳嗽患者中表达增加,原因可能是对慢性炎症的一种反应[26-27]。但关于TRPV1通道对支气管哮喘大鼠气管平滑肌细胞增殖和炎症的作用目前尚未见报道。 IL-4、IL-5和IL-13是重要的炎性递质,在支气管哮喘的发病中起着主要作用[28]。另外,长期的气管慢性炎症可加重气管重建[29]。 因此,本研究拟通过观察TRPV1 通道在支气管哮喘大鼠气管平滑肌的表达及对支气管哮喘大鼠气管平滑肌细胞增殖和IL-4、IL-5、IL-13表达水平的影响,来阐明TRPV1通道在支气管哮喘气管重建中的作用。
本研究发现,支气管哮喘大鼠气管平滑肌组织中TRPV1 mRNA及其蛋白表达水平明显高于对照组;同时,支气管哮喘大鼠气管平滑肌组织中PCNA mRNA及其蛋白表达水平及IL-4、IL-5、IL-13表达水平均明显高于对照组。TRPV1通道阻断剂CPZ干预的支气管哮喘大鼠,其气管重塑明显得到改善,且其气管平滑肌组织中TRPV1、PCNA mRNA及其蛋白表达水平及IL-4、IL-5、IL-13表达水平均明显下降。而TRPV1通道激动剂CAP有相反的作用。
综上所述,激活支气管哮喘大鼠气管平滑肌TRPV1通道,可增加细胞增殖和炎性反应,气管重塑加重;抑制支气管哮喘大鼠气管平滑肌TRPV1通道,可导致细胞增殖和炎性反应减弱,气管重塑减轻。因此,本研究推测,支气管哮喘大鼠气管平滑肌TRPV1通道表达的增加可能参与了支气管哮喘气管平滑肌细胞的增生、肥厚和炎症形成。此结果对于研究支气管哮喘的病理生理学改变及气管重塑有着重要的意义,并为临床防治支气管哮喘提供了一个新的方向。
作者贡献:赵丽敏、况红艳进行实验设计与实施、资料收集整理、撰写论文、成文并对文章负责;张罗献、吴纪珍、陈献亮、张晓宇进行实验实施、评估、资料收集;马利军进行质量控制及审校。
本文无利益冲突。
[1]GRAS D,BOURDIN A,CHANEZ P,et al.Airway remodeling in asthma:clinical and functional correlates[J].Med Sci(Paris),2011,27(11):959-965.
[2]RICCIO A M,DAL NEGRO R W,MICHELETTO C,et al.Omalizumab modulates bronchial reticularbasement membrane thickness and eosinophil infiltration in severe persistent allergic asthma patients[J].Int J Immunopathol Pharmacol,2012,25(2):475-484.
[3]TSURIKISAWA N,OSHIKATA C,TSUBURAI T,et al.Bronchial reactivity to histamine is correlated with airway remodeling in adults with moderate to severe asthma[J].J Asthma,2010,47(8):841-848.
[4]MARTIN E,DAHAN D,CARDOUAT G,et al.Involvement of TRPV1 and TRPV4 channels in migration of rat pulmonary arterial smooth muscle cells[J].Pflugers Arch,2012,464(3):261-272.
[5]LI S,BODE A M,ZHU F,et al.TRPV1-antagonist AMG9810 promotes mouse skin tumorigenesis through EGFR/Akt signaling[J].Carcinogenesis,2011,32(5):779-785.
[6]GUIBERT C,DUCRET T,SAVINEAU J P.Expression and physiological roles of TRP channels in smooth muscle cells[J].Adv Exp Med Biol,2011,704:687-706.
[7]SMIT L A,KOGEVINAS M,ANTJ M,et al.Transient receptor potential genes,smoking,occupational exposures and cough in adults[J].Respir Res,2012,13:26.
[8]PATBERG K W.The female preponderance to cough hypersensitivity syndrome:another clue pointing to the role of TRPV1 in cough[J].Lung,2011,189(3):257-258.
[9]CANTERO-RECASENS G,GONZALEZ J R,FANDOS C,et al.Loss of function of transient receptor potential vanilloid 1(TRPV1) genetic variant is associated with lower risk of active childhood asthma[J].J Biol Chem,2010,285(36):27532-27535.
[10]ZHAO L,ZHANG X,KUANG H,et al.Effect of TRPV1 channel on the proliferation and apoptosis in asthmatic rat airway smooth muscle cells[J].Exp Lung Res,2013,39(7):283-294.
[11]ZHAO L,WU J,ZHANG X,et al.The effect of Shenmai injection on the proliferation of rat airway smooth muscle cells in asthma and underlying mechanism[J].BMC Complement Altern Med,2013,13:221.
[12]AL-MUHSEN S,JOHNSON J R,HAMID Q.Remodeling in asthma[J].J Allergy Clin Immunol,2011,128(3):451-462.
[13]HAMID Q.Pathogenesis of small airways in asthma[J].Respiration,2012,84(1):4-11.
[14]AL HEIALY S,MCGOVERN T K,MARTIN J G.Insights into asthmatic airway remodelling through murine models[J].Respirology,2011,16(4):589-597.
[15]MOULTON D E,GORIELY A.Possible role of differential growth in airway wall remodeling in asthma[J].J Appl Physiol(1985),2011,110(4):1003-1012.
[16]HASSAN M,JO T,RISSE P A,et al.Airway smooth muscle remodeling is a dynamic process in severe long-standing asthma[J].J Allergy Clin Immunol,2010,125(5):1037-1045.
[18]WEI A C,LIU T,WINSLOW R L,et al.Dynamics of matrix-free Ca2+in cardiac mitochondria:two components of Ca2+uptake and role of phosphate buffering[J].J Gen Physiol,2012,139(6):465-478.
[19]ZHAO L M,XU Y J,ZHANG Z X,et al.The effect of passive sensitization on the activity and expression of KV channel in human bronchial smooth muscle cells[J].Chin Med J(Engl),2004,117(11):1630-1636.
[20]ZUYDERDUYN S,SUKKAR M B,FUST A,et al.Treating asthma means treating airway smooth muscle cells[J].Eur Respir J,2008,32(2):265-274.
[21]ZOU J J,GAO Y D,GENG S,et al.Role of STIM1 / Orai1-mediated store-operated calcium entry in airway smooth muscle cell proliferation[J].J Appl Physiol,2011,110(5):1256-1263.
[22]FIRTH A L,REMILLARD C V,YUAN J X.TRP channels in hypertension[J].Biochim Biophys Acta,2007,1772(8):895-906.
[23]EARLEY S.Vanilloid and melastatin transient receptor potential channels in vascular smooth muscle[J].Microcirculation,2010,17(4):237-249.
[24]VLACHOVA V.TRP channels:from understanding to action[J].Curr Pharm Biotechnol,2011,12(1):1-2.
[25]MILLER B A,ZHANG W.TRP channels as mediators of oxidative stress[J].Adv Exp Med Biol,2011,704:531-544.
[26]GRONEBERG D A,NIIMI A,DINH Q T,et al.Increased expression of transient receptor potential vanilloid-1 in airway nerves of chronic cough[J].Am J Respir Crit Care Med,2004,170(12):1276-1280.
[27]MITCHELL J E,CAMPBELL A P,NEW N E,et al.Expression and characterization of the intracellular vanilloid receptor(TRPV1) in bronchi from patients with chronic cough[J].Exp Lung Res,2005,31(3):295-306.
[28]O′BYRNE P M.Role of monoclonal antibodies in the treatment of asthma[J].Can Respir J,2013,20(1):23-25.
[29]JI X,LI J,XU L,et al.IL4 and IL-17A provide a Th2/Th17-polarized inflammatory milieu in favor of TGF-β1 to induce bronchial epithelial-mesenchymal transition(EMT) [J].Int J Clin Exp Pathol,2013,6(8):1481-1492.
(本文编辑:陈素芳)
Function of TRPV1 Channel on the Proliferation and Inflammation in Airway Smooth Muscle Cells of Asthmatic Rat
ZHAOLi-min,KUANGHong-yan,ZHANGLuo-xian,etal.
DepartmentofRespiratoryandCriticalCareMedicine,People′sHospitalofZhengzhouUniversity,HenanProvincialPeople′sHospital,Zhengzhou450003,China
ObjectiveTo observe how TRPV1 channel work on proliferation and inflammation in airway smooth muscle cells of asthmatic rat.MethodsFrom June 2013 to June 2014,60 healthy clean male SD rats which were five to six weeks old were selected and randomly divided into control group,bronchial asthma group,asthma+capsaicin(CAP) group and asthma+capsazepine(CPZ) group.Each group included 15 rats.Asthmatic models were established for bronchial asthma group,asthma+CAP group,asthma+CPZ group.Asthma+CPA group were fed with food which contains 0.01% CAP,asthma+CPZ group were fed with food which contains 0.01% CPZ.Intact cross section of bronchus were observed under microscope,the pipe wall area(WA)/lumen perimeter(Pi),ASM area(S)/Pi,ASM nuclei number(N)/Pi were caculated.TRPV1 and proliferating cell nuclear antigen(PCNA) mRNA and protein expression levels in airway smooth muscle tissue were measured by real-time fluorescent quantitative reverse transcription polymerase chain reaction(RT-qPCR) and Western blotting.Expression level of IL-4,IL-5 and IL-13 in airway smooth muscle tissue homogenate supernatant was measured by enzyme-linked immunosorbent adsorption test(ELISA).ResultsCompared with control group,rats in bronchial asthma group and asthma+CAP group had higher value in WA/Pi,S/Pi,N/Pi(P<0.05).Compared with bronchial asthma group,rats in asthma+CAP group had higher value in WA/Pi,S/Pi,N/Pi(P<0.05).Compared with asthma+CAP group,rats in asthma+CPZ group had lower value in WA/Pi,S/Pi,N/Pi(P<0.05).Compared with control group,bronchial asthma group and asthma+CAP group had higher expression level of TRPV1,PCNA mRNA and protein,IL-4,IL-5,IL-13 in airway smooth muscle tissue(P<0.05).Compared with bronchial asthma group,asthma+CAP group had higher expression level of TRPV1,PCNA mRNA and protein,IL-4,IL-5,IL-13 in airway smooth muscle tissue(P<0.05).Compared with bronchial asthma group and asthma+CAP group,asthma+CPZ group had lower expression level of TRPV1,PCNA mRNA and protein,IL-4,IL-5,IL-13 in airway smooth muscle tissue(P<0.05).ConclusionHigh expressions level of TRPV1,PCNA mRNA and protein,IL-4,IL-5 and IL-13 in airway smooth muscle tissue of asthmatic rats could be inhibited by TRPV1 channel antagonist.TRPV1 channel may play a crucial role in the development of proliferation and inflammation of airway smooth muscle tissue cell.
Bronchial asthma;Transient receptor potential channels;Myocytes,smooth muscle;Cell proliferation;Inflammation
国家自然科学基金资助项目(81100029)
450003河南省郑州市,郑州大学人民医院 河南省人民医院呼吸与危重症医学科
马利军,450003河南省郑州市,郑州大学人民医院 河南省人民医院呼吸与危重症医学科;E-mail:mlj0401@163.com
R 562.25
A
10.3969/j.issn.1007-9572.2016.21.007
2016-01-02;
2016-05-19)
注:赵丽敏、况红艳共同为第一作者
