蓝氏贾第鞭毛虫胞外核酸酶的表达纯化和活性鉴定
2016-07-27赵俊暕田喜凤刘晓莉周英斌李少东
王 沂,赵俊暕,余 源,田喜凤,李 冀,刘晓莉,周英斌,李少东,王 洋
蓝氏贾第鞭毛虫胞外核酸酶的表达纯化和活性鉴定
王沂1,赵俊暕1,余源2,田喜凤2,李冀2,刘晓莉2,周英斌2,李少东2,王洋2
1.华北理工大学附属医院检验科,唐山063000;2.华北理工大学生命科学学院,唐山063000
摘要:目的克隆、原核表达蓝氏贾第鞭毛虫(Giardia lamblia,贾第虫)的胞外核酸酶编码区,并对其蛋白产物进行活性鉴定。方法对贾第虫胞外核酸酶(GeNuc)蛋白进行生物信息学分析,根据分析结果以C2株贾第虫基因组DNA为模板扩增获得GeNuc去信号肽段编码区序列,双酶切连入原核表达载体pET-28a(+),将酶切和测序验证正确的重组质粒转化E.coli Rosetta(DE3),经IPTG诱导表达融合蛋白,SDS-PAGE及Western blot鉴定蛋白产物。Ni-NTA亲和层析纯化GeNuc蛋白,经复性后验证其对质粒DNA的水解能力。结果成功克隆了长约800 bp的GeNuc编码区并构建了原核表达载体pET-28a(+)-GeNuc,测序结果显示C2株GeNuc序列与WB株相同;在大肠杆菌中诱导表达获得了相对分子量约30.8 kDa的融合蛋白;复性后的纯化GeNuc蛋白具有降解双链DNA的能力,但活性较商品化DNaseⅠ低。结论证明了GeNuc的存在,为GeNuc抗体的制备及贾第虫致病机制的研究提供了实验材料。
关键词:蓝氏贾第鞭毛虫;胞外核酸酶;生物信息学;原核表达;活性鉴定
Supported by the National Natural Science Foundation of China (No. 31471954), and the Hebei Province Science Foundation for Youths (No. C2012401039)
蓝氏贾第鞭毛虫(Giardialamblia,简称贾第虫)属于动鞭毛纲、双滴虫目、六鞭毛科、贾第虫属,是一种全球分布的机会致病性原虫,被认为是目前已知的最原始真核细胞,也是生物学研究中重要的模式生物。贾第虫生活史简单,仅包括两个阶段,即具有感染能力的包囊和具有运动和繁殖能力的滋养体。人和哺乳动物通过摄入污染贾第虫包囊的食物或水感染,被吞食的包囊在十二指肠脱囊而成滋养体,滋养体寄生在十二指肠和空肠上部,以吸盘吸附在肠粘膜表面,与宿主竞争营养并机械性损伤肠粘膜,引起以腹痛、腹泻和吸收不良为主要表现的贾第虫病,在世界范围内具有很高的发病率[1]。儿童慢性贾第虫感染可引起发育障碍,而一些免疫力极度低下的人群,如AIDS患者,则有可能引起致命的腹泻,贾第虫也因此成为对人类健康影响最大的机会致病性寄生虫之一。
对WB株贾第虫基因组数据库分析发现,贾第虫基因组中存在编码胞外核酸酶的序列,但未经实验证实。胞外核酸酶是一种能够降解环境中DNA或RNA的酶类,广泛存在于从细菌到人类的多种原核和真核生物中,其中病原生物的胞外核酸酶目前研究相对较多,尤其是致病菌的胞外核酸酶。致病菌的胞外核酸酶主要为内切核酸酶,有的种类镶嵌在细胞膜上,有的则直接分泌到周围环境中。对于致病菌来说,胞外核酸酶可以用来调节生物被膜上DNA的含量,提供补救合成核苷酸的原料,还有可能参与对抗宿主的免疫应答[2-3]。
关于贾第虫能否产生具有生物学活性的胞外核酸酶,以及胞外核酸酶有何生物学意义,目前尚无相关报道。本研究克隆、原核表达了C2株贾第虫胞外核酸酶(GeNuc)蛋白,并对其活性进行了初步鉴定,证明了GeNuc的存在,为GeNuc生物学意义的研究奠定了基础。
1材料和方法
1.1材料C2株贾第虫,E.coliTOP10、Rosetta(DE3),原核表达载体pET-28a (+)均为本实验室保存。血液基因组提取试剂盒、琼脂糖凝胶回收试剂盒、T4 DNA连接酶购自天根公司;DNaseⅠ购自Promega公司;2×Pfu Master Mix购自近岸公司;限制性内切酶NcoⅠ、XhoⅠ购自NEB公司; DAB显色试剂盒购自中杉金桥;鼠源抗His-Tag抗体、HRP标记山羊抗小鼠IgG抗体、BCA 蛋白定量试剂盒购自康为世纪;Ni-NTA预装重力柱购自生工公司;引物合成及测序均由英潍捷基公司完成。
1.2方法
1.2.1GeNuc蛋白的生物信息学分析根据GenBank提供的WB株贾第虫GeNuc的蛋白序列(XP_001709720.1)进行生物信息学分析,SignalP 3.0 预测信号肽;TMHMM、TMpred、DAS-TMfilter服务器预测跨膜区;NetNGlyc 1.0 预测糖基化位点;InterPro服务器预测该蛋白的功能结构域;PredictProtein服务器分析GeNuc蛋白的二级结构;SWISS-MODEL服务器同源建模预测该蛋白的三维结构。
1.2.2GeNuc编码区的克隆和重组表达质粒构建根据GenBank中WB株贾第虫胞外核酸酶GeNuc(XM_001709668.1)编码区序列,结合SignalP 3.0信号肽预测结果,去除N端信号肽编码序列设计引物,上游引物(5′- CATGCCATGGGCAAAGA
GAGTCTAGTGAACTCG-3′)和下游引物(5′- CC
GCTCGAGACCACAGAGCGCTTGCTCG-3′),上下游引物序列中下划线部分分别为NcoⅠ和XhoⅠ酶切位点。采用改良TYI-S-33培养基按常规方法培养C2株贾第虫滋养体并收集虫体团块[4]。采用血液基因组提取试剂盒提取C2株贾第虫基因组DNA。以基因组DNA为模板PCR扩增GeNuc编码区,反应条件:94 ℃预变性5 min;94 ℃变性30 s,53 ℃退火40 s,72 ℃延伸1 min,共30个循环;72 ℃延伸10 min。琼脂糖凝胶回收试剂盒回收PCR产物。胶回收产物经限制性内切酶NcoⅠ和XhoⅠ酶切后,与经同样酶切的pET-28a(+)载体混合16 ℃连接反应6 h后转化E.coliTOP10感受态细胞,涂布50 μg/mL卡那霉素抗性平板筛选。阳性克隆扩大培养提质粒,经双酶切鉴定正确后送测序分析。
1.2.3重组蛋白的诱导表达和鉴定将验证正确的重组质粒转化E.coliRosetta(DE3),卡那霉素(50 μg/mL)和氯霉素(34 μg/mL)双抗平板筛选阳性克隆,接种单克隆于LB液体培养基中振荡培养过夜。次日1/100比例转接于含新鲜双抗的LB培养基中,37 ℃振荡培养至OD600≈0.6,加入终浓度0.5 mmol/L的IPTG,28 ℃诱导表达5 h,离心收集菌体,2×SDS上样缓冲液煮沸裂解获得全菌体蛋白。经SDS-PAGE和Western blot鉴定融合蛋白表达情况。Western blot以鼠源抗His-Tag单抗(1∶1 000)为一抗,HRP标记羊抗鼠IgG(1∶2 000)为二抗,DAB显色观察。
1.2.4GeNuc蛋白的纯化、复性和活性鉴定采用1.2.3的方法诱导500 mL菌液,收集菌体沉淀,重悬于碎菌缓冲液,超声破碎后离心收集沉淀。沉淀洗涤2次后用含8 mol/L尿素、10 mmol/L DTT的变性缓冲液4 ℃摇动过夜溶解包涵体。次日离心收集上清,用Ni-NTA亲和层析柱进行纯化,具体操作按说明书进行。纯化蛋白通过尿素浓度梯度(6、5、4、3、2、1、0.5 mol/L尿素溶液)从高至低4℃透析复性,最后用PBS透析,SDS-PAGE鉴定纯化结果,BCA蛋白定量试剂盒检测纯化蛋白浓度。将1 μg pET-28a(+)-GeNuc质粒与1 μg纯化复性GeNuc蛋白混合,采用商品化DNaseⅠ缓冲体系,按照DNaseⅠ说明书中单位定义条件于37 ℃反应10 min,琼脂糖凝胶电泳观察GeNuc水解DNA的能力。同时设商业化的DNaseⅠ消化及未经消化的质粒DNA分别作为阳性对照和阴性对照。
2结果
2.1GeNuc的生物信息学分析GeNuc的蛋白由272aa组成,分子量约30.78 kDa,SignalP 4.1服务器预测该蛋白N端信号肽包含13个氨基酸残基,去除信号肽分子量29.52 kDa。TMHMM、TMpred、DAS-TMfilter显示该蛋白无跨膜区。NetNGlyc 1.0显示该蛋白有2个可能的糖基化位点(Asn19、Asn143)。InterPro服务器预测GeNuc蛋白第58-220aa为一个内切核酸酶Ⅰ(Endonuclease I)功能域。PredictProtein服务器预测GeNuc蛋白(去除信号肽部分)的二级结构中以无规则卷曲为主,占全部氨基酸的71.81%,α螺旋、β折叠链所占比例分别为21.24%、6.95%。SWISS-MODEL服务器选取可信度(100%)和一致性(27.27%)最高,且具有对应PDB 数据的2pu3.1.A(低温嗜盐杀鲑弧菌内切核酸酶Ⅰ)作为模版进行GeNuc蛋白空间结构预测,其模建残基范围在29-223,包含了GeNuc的功能域全长(图1)。
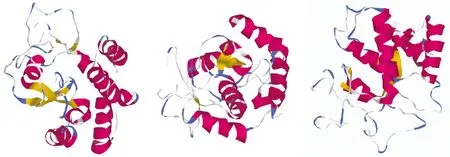
图1 SWISS-MODEL服务器由低温嗜盐杀鲑弧菌内切核酸酶Ⅰ蛋白建模的GeNuc蛋白三维模型
2.2GeNuc重组表达质粒的构建以贾第虫基因组DNA为模板扩增GeNuc编码区,PCR产物经琼脂糖电泳可见约800 bp的单一条带,与预期大小相符(图2 A)。将GeNuc和pET-28a(+)载体连接后转化E.coliTOP10,阳性克隆提取质粒进行双酶切验证,可见约790 bp和约5 400 bp两条带(图2B),与预期相符。测序结果证实C2株贾第虫GeNuc序列与GenBank提供的WB株GeNuc相同,将鉴定正确的重组质粒命名为pET-28a(+)-GeNuc。
2.3GeNuc融合蛋白的诱导表达和鉴定 以未经诱导的pET28a(+)-GeNuc/Rosetta(DE3)菌体裂解物为对照,SDS-PAGE观察IPTG诱导后重组蛋白表达情况,结果显示诱导菌可见分子量约30.8 kDa的目的条带,与预期大小相符,未诱导菌则无此条带(图3A)。Western blot结果显示,仅诱导菌在30.8 kDa大小处出现单一阳性条带(图3B)。
2.4GeNuc融合蛋白的纯化和活性鉴定采用Ni-NTA亲和层析柱从诱导菌包涵体中纯化GeNuc融合蛋白,经尿素梯度透析复性,SDS-PAGE鉴定纯化产物可见分子量30.8 kDa的单一目的蛋白条带(图4A),表明纯化效果良好。复性后的GeNuc蛋白1 μg消化1 μg的pET28a(+)-GeNuc质粒DNA,以1单位的商品化DNaseⅠ作为阳性对照,未消化质粒作为阴性对照,37 ℃反应10 min后电泳可见质粒DNA被GeNuc融合蛋白部分水解,而DNaseⅠ将质粒完全水解(图4B)。
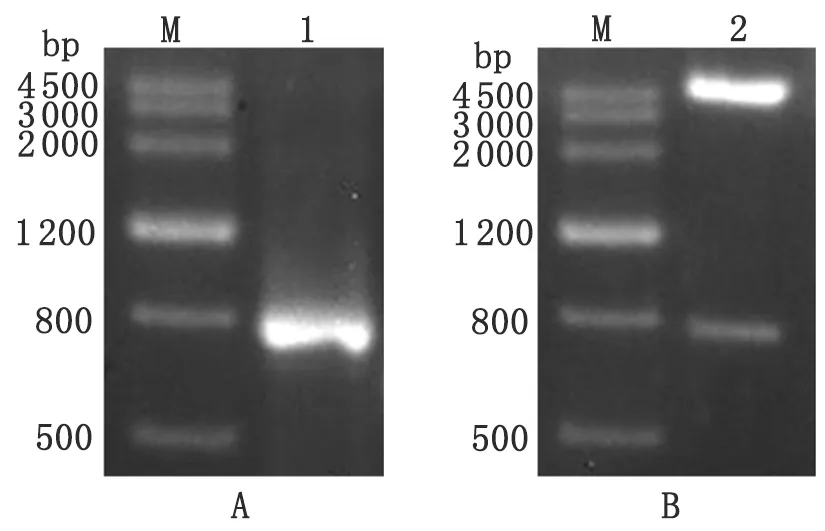
M:DNA marker; 1:PCR product; 2: Double digestion of recombinant plasmid
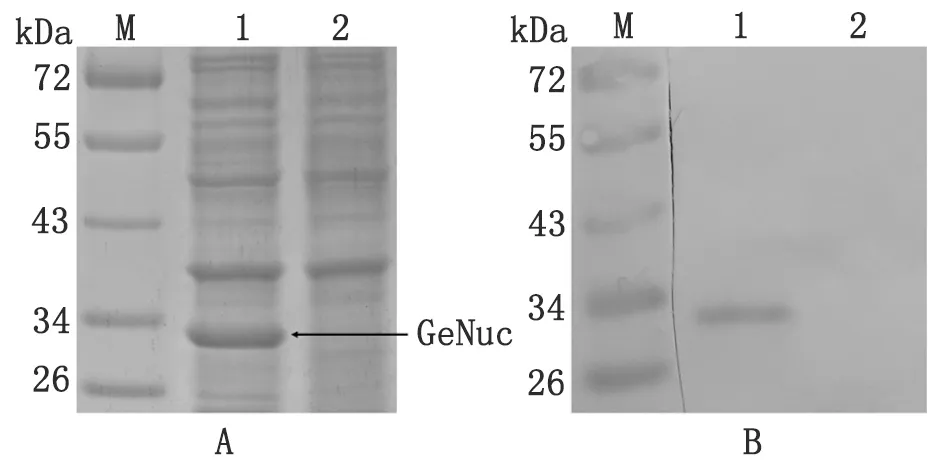
M: Standard protein marker; 1: Induced pET28a(+)-GeNuc/Rosetta(DE3); 2: Uninduced pET28a(+)-GeNuc/Rosetta(DE3).
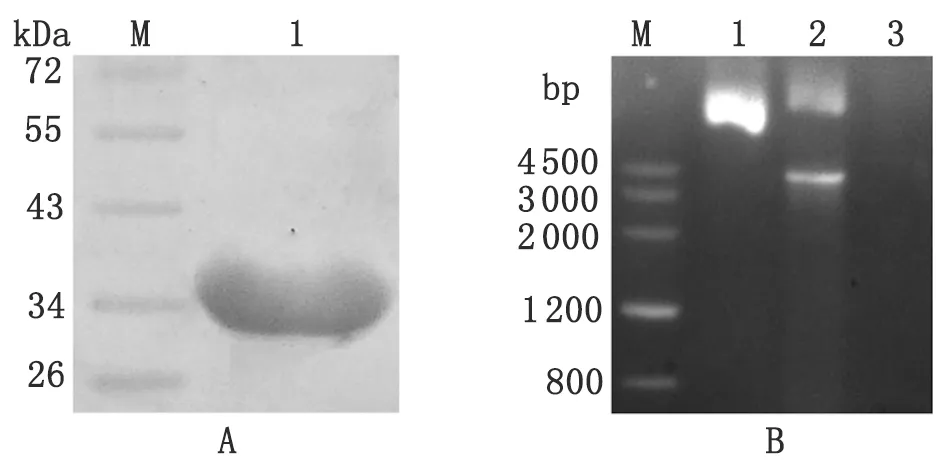
A: SDS-PAGE analysis of purified GeNuc fusion protein. M: DNA marker; 1: Purified fusion protein
3讨论
许多原虫基因组中都存在编码胞外核酸酶的基因序列,尤其是营寄生生活的原虫,目前相关研究比较多的是与贾第虫同属动鞭毛纲的利什曼原虫。在不同种类的利什曼原虫中发现了几种不同的胞外核酸酶,按照定位不同可以大致分成分泌型和膜结合型两大类,均属于I型核酸酶,该型酶同时具有核酸内切酶和3’核苷酸酶两种活性,可以降解的底物包括RNA、ssDNA、dsDNA[5-13]。目前认为利什曼原虫胞外核酸酶(Lnuc)主要有两方面功能。
一是营养作用,同其它原生动物一样,利什曼原虫和贾第虫均缺乏从头合成嘌呤的酶,因此只能利用吸收进来的核苷或嘌呤通过补救途径合成嘌呤核苷酸。LNuc可以降解利什曼原虫生存环境中,即宿主细胞中的核酸,同时发挥两种酶的活性将核酸降解成核苷,最后由虫体膜上的转运体将核苷转入虫体用于补救合成。根据生物信息学分析,GeNuc属于Ⅰ型内切核酸酶,只能降解dsDNA和ssDNA成为核苷酸,本身并不具备将核苷酸分解成能够吸收的核苷或碱基的能力[6-7,10-11]。但我们对贾第虫基因检索发现,贾第虫基因组中存在编码可能的5’核苷酸酶的基因,并且序列分析显示其编码产物具有信号肽且能够固定在细胞膜上,此外贾第虫还存在可能的嘌呤核苷磷酸化酶转运蛋白及嘌呤透酶,这些酶的协作可能帮助贾第虫在体外将核酸降解成嘌呤并转运至虫体内部。贾第虫滋养体生存的小肠中也存在宿主分泌的核酸分解代谢的一系列酶类,理论上说小肠寄生状态的贾第虫不会缺乏核苷、碱基之类的营养物质,那么贾第虫保留这样一套分解胞外核酸的酶系统是否具有营养方面的意义?对GeNuc基因进行敲除以及分析GeNuc在贾第虫发育不同阶段的表达情况将有助于解开这一问题。
LNuc的第二个功能是对抗宿主免疫的作用,主要是对抗宿主免疫细胞产生的胞外诱捕网(ETs)。ETs由包括中性粒细胞、嗜酸性粒细胞、单核细胞、肥大细胞在内的多种免疫细胞释放产生,由疏松化的染色质或线粒体DNA和多种蛋白质组成,ETs以DNA纤维网缠绕、限制病原生物移动,并通过DNA网状结构上附着的抗菌蛋白杀伤病原生物[14]。相比于普通脱颗粒杀伤方式,ETs介导的杀伤提高了局部抗病原物质的浓度,减少了其弥散造成的组织损害,是一种高效的抗病原固有免疫机制,各种细菌感染以及包括利士曼原虫在内的部分寄生虫感染均能诱导ETs的产生并受其杀伤和限制[15-18]。而病原生物的胞外核酸酶能够降解破坏ETs,这一现象最早在致病菌中发现,已知包括金黄色葡萄球菌、霍乱弧菌、化脓性链球菌、肺炎链球菌等在内的多种常见致病菌均能产生降解ETs的胞外核酸酶,对病原菌具有明显的保护作用[19-23]。
LNuc是目前唯一已被证实具有保护意义的寄生虫胞外核酸酶。在体外实验中,利什曼原虫能够凭借其表面锚定的LNuc以剂量和时间依赖性的方式破坏NETs,具有该酶活性的利什曼原虫较酶活性抑制的虫体生存率显著提高[13-14]。贾第虫是否能够诱导ETs生成目前尚无报道。早期的体外实验证实,中性粒细胞和单核细胞能够抑制贾第虫的粘附[24],并且中性粒细胞源性的抗菌肽和防御素对贾第虫有较强的杀伤作用[25]。但之后的研究显示,能够生成ETs的中性粒细胞、嗜酸性粒细胞在抗贾第虫免疫中所起的作用似乎比较有限,贾第虫可以通过干扰上皮细胞释放炎性因子抑制中性粒细胞的趋化作用[26],因此轻度的贾第虫感染通常没有明显的炎症反应。但严重的贾第虫感染时,贾第虫滋养体可以出现在上皮细胞内、固有层、粘膜下层及肌层,常会引起中性粒细胞和嗜酸性粒细胞在肠粘膜固有层和粘膜下层的浸润[27-28],这为ETs的形成创造了条件。GeNuc能否有效的对抗ETs仍有待进一步的体外和体内实验验证。
为了表达有活性的GeNuc,我们首先对该酶的蛋白序列进行了生物信息学分析,在克隆该酶编码基因时去掉了信号肽的编码序列,以防原核生物不能识别真核蛋白的信号肽剪切位点,残留信号肽干扰酶活性中心的形成。此外,鉴于贾第虫缺乏内含子的原始生物学特征,我们直接从贾第虫基因组DNA中克隆GeNuc基因,较从cDNA中克隆更为方便。最后酶活性的鉴定显示GeNuc活性较商品化DNaseⅠ要低,但这也有可能是实验中复性不到位、非最佳反应条件或者未去除His标签造成的,此外,原核表达系统缺乏糖基化修饰很可能也是一个重要的原因。该蛋白的详细酶学特征仍需进一步的实验进行鉴定。
参考文献:
[1]Adam, RD. Biology ofGiardialamblia[J]. Clin Microbiol Rev, 2001, 14(3): 447-475. DOI: 10.1128/cmr. 14.3.447-475.2001
[2]Kiedrowski MR, Crosby HA, Hernandez FJ, et al.StaphylococcusaureusNuc2 is a functional, surface-attached extracellular nuclease[J/OL]. PLoS One, 2014, 9(4):e95574. DOI: 10.1371/journal.pone.0095574
[3]Cho C, Chande A, Gakhar L, et al. Role of the nuclease of nontypeablehaemophilusinfluenzaein dispersal of organisms from biofilms[J]. Infect Immun, 2015, 83(3): 950-957. DOI: 10.1128/iai.02601-14
[4]Wang Y, Yang ZH, Wang Y, et al. Prokaryotic expression and antigenicity analysis of α-7.1 and α-11 giardin ofGiardialamblia[J]. Chin J Zoonoses, 2012, 28(5): 474-478. DOI: 10.3969/j.issn.1002-2694. 2012.05.017
王洋, 杨志宏, 王沂, 等. 蓝氏贾第鞭毛虫α-7.1、α-11贾第素的原核表达及抗原活性鉴定[J]. 中国人兽共患病学报, 2012, 28(5):474-478.
[5]Simon D, Simon HU, Yousefi S. Extracellular DNA traps in allergic, infectious, and autoimmune diseases[J]. Allergy, 2013, 68(4): 409-416. DOI: 10.1111/all.12111
[6]Campbell TA, Zlotnick GW, Neubert TA, et al. Purification and characterization of the 3’-nucleotidase/nuclease from promastigotes ofLeishmaniadonovani[J]. Mol Biochem Parasitol, 1991, 47(1): 109-117. DOI: 10.1016/0166-6851(91)90153-w
[7]Debrabant A, Ghedin E, Dwyer DM. Dissection of the functional domains of theLeishmaniasurface membrane 3’-nucleotidase/nuclease, a unique member of the class I nuclease family[J]. J Biol Chem, 2000, 275(21): 16366-16372. DOI: 10.1074/jbc.m908725199
[8]Farajnia S, Alimohammadian MH, Reiner NE, et al. Molecular characterization of a novel amastigote stage specific Class I nuclease fromLeishmaniamajor[J]. Int J Parasitol, 2004, 34(8): 899-908. DOI: 10.1016/j.ijpara.2004.03.005
[9]Joshi MB, Dwyer DM. Molecular and functional analyses of a novel class I secretory nuclease from the human pathogen,Leishmaniadonovani[J]. J Biol Chem, 2007, 282(13): 10079-10095. DOI: 10.1074/jbc. m610770200
[10]Lakhal-Naouar I, Ben Achour-Chenik Y, Boublik Y, et al. Identification and characterization of a newLeishmaniamajorspecific 3’nucleotidase/nuclease protein[J]. Biochem Biophys Res Commun, 2008, 375(1): 54-58. DOI: 10.1016/j.bbrc.2008.07.099
[11]Farajnia S, Rahbarnia L, Maleki Zanjani B, et al. Molecular cloning and characterization of P4 nuclease fromLeishmaniainfantum[J]. Enzyme Res, 2011, 2011: 970983. DOI: 10.4061/2011/970983
[12]Joshi MB, Hernandez Y, Owings JP, et al. Diverse viscerotropic isolates ofLeishmaniaall express a highly conserved secretory nuclease during human infections[J]. Mol Cell Biochem, 2012, 361(1-2): 169-179. DOI: 10.1007/s11010-011-1101-1
[13]Paletta-Silva R, Vieira DP, Vieira-Bernardo R, et al.Leishmaniaamazonensis: characterization of an ecto-3’-nucleotidase activity and its possible role in virulence[J]. Exp Parasitol, 2011, 129(3): 277-283. DOI: 10.1016/j.exppara.2011.07.014
[14]Guimaraes-Costa AB, DeSouza-Vieira TS, Paletta-Silva R, et al. 3’-nucleotidase/nuclease activity allowsLeishmaniaparasites to escape killing by neutrophil extracellular traps[J]. Infect Immun, 2014, 82(4): 1732-1740. DOI: 10.1016/j.exppara.2011.07.014
[15]Abi Abdallah DS, Lin C, Ball CJ, et al.Toxoplasmagondiitriggers release of human and mouse neutrophil extracellular traps[J]. Infect Immun, 2012, 80(2): 768-777. DOI: 10.1128/iai.05730-11
[16]Guimaraes-Costa AB, Nascimento MT, Froment GS, et al.Leishmaniaamazonensispromastigotes induce and are killed by neutrophil extracellular traps[J]. Proc Natl Acad Sci U S A, 2009, 106(16): 6748-6753. DOI: 10.1073/pnas.0900226106
[17]Silva LM, Caro TM, Gerstberger R, et al. The apicomplexan parasiteEimeriaarloingiinduces caprine neutrophil extracellular traps[J]. Parasitol Res, 2014, 113(8): 2797-2807. DOI: 10.1007/s00436-014-3939-0
[18]Munoz-Caro T, Silva LM, Ritter C, et al.Besnoitiabesnoititachyzoites induce monocyte extracellular trap formation[J]. Parasitol Res, 2014, 113(11): 4189-4197. DOI: 10.1007/s00436-014-4094-3
[19]Thammavongsa V, Missiakas DM, Schneewind O.Staphylococcusaureusdegrades neutrophil extracellular traps to promote immune cell death[J]. Science, 2013, 342(6160): 863-866. DOI: 10.1126/science.1242255
[20]Seper A, Hosseinzadeh A, Gorkiewicz G, et al.Vibriocholeraeevades neutrophil extracellular traps by the activity of two extracellular nucleases[J/OL]. PLoS Pathog, 2013, 9(9): e1003614. DOI:10.1371/journal.ppat. 1003614
[21]Chang A, Khemlani A, Kang H, et al. Functional analysis ofStreptococcuspyogenesnuclease A (SpnA), a novel group A streptococcal virulence factor[J]. Mol Microbiol, 2011, 79(6): 1629-1642. DOI: 10.1111/j.1365-2958.2011.07550.x
[22]Zhu L, Kuang Z, Wilson BA, et al. Competence-independent activity of pneumococcal enda mediates degradation of extracellular DNA and nets and is important for virulence[J/OL]. PLoS One, 2013, 8(7): e70363. DOI: 10.1371/journal.pone. 0070363
[23]Shan Q, Dwyer M, Rahman S, et al. Distinct susceptibilities of cornealPseudomonasaeruginosaclinical isolates to neutrophil extracellular trap-mediated immunity[J]. Infect Immun, 2014, 82(10): 4135-4143. DOI: 10.1128/iai.02169-14
[24]Crouch AA, Seow WK, Whitman LM, et al. Inhibition of adherence ofGiardiaintestinalisby human neutrophils and monocytes[J]. Trans R Soc Trop Med Hyg, 1991, 85(3): 375-379. DOI: 10.1016/0035-9203 (91)90297-c
[25]Aley SB, Zimmerman M, Hetsko M, et al. Killing ofGiardialambliaby cryptdins and cationic neutrophil peptides[J]. Infect Immun, 1994, 62(12): 5397-5403.
[26]Cotton JA, Bhargava A, Ferraz JG, et al.Giardiaduodenaliscathepsin B proteases degrade intestinal epithelial interleukin-8 and attenuate interleukin-8-induced neutrophil chemotaxis[J]. Infect Immun, 2014, 82(7): 2772-2787. DOI: 10.1128/iai.01771-14
[27]Muller N, von Allmen N. Recent insights into the mucosal reactions associated withGiardialambliainfections[J]. Int J Parasitol, 2005, 35(13): 1339-1347. DOI: 10.1016/j.ijpara.2005.07.008
[28]Ara jo NS, Mundim MJ, Gomes MA, et al.Giardiaduodenalis: pathological alterations in gerbils,Merionesunguiculatus, infected with different dosages of trophozoites[J]. Exp Parasitol, 2008, 118(4): 449-457. DOI: 10.1016/j.exppara.2007.10.007
DOI:10.3969/j.issn.1002-2694.2016.01.014
通讯作者:王洋,Email:konig718@163.com
中图分类号:R382.21
文献标识码:A
文章编号:1002-2694(2016)01-0065-05
Corresponding author:Wang Yang, Email: konig718@163.com
收稿日期:2015-02-26;修回日期:2015-09-27
Prokaryotic expression and characterization of Giardia lamblia extracellular nuclease
WANG Yi1,ZHAO Jun-jian1,YU Yuan2,TIAN Xi-feng2,LI Ji2,LIU Xiao-li2,ZHOU Ying-bin2,LI Shao-dong2,WANG Yang2
(1.DepartmentofClinicalLaboratory,NorthChinaUniversityofScienceandTechnologyAffiliatedHospital,Tangshan063000,China;2.CollegeofLifeSciences,NorthChinaUniversityofScienceandTechnology,Tangshan063000,China)
Abstract:For many pathogens, extracellular nuclease is requisite for salvaging exogenous nucleosides and defending against immune attack. By searching the genome of Giardia lamblia, we found a provisional extracellular nuclease coding sequence. To express G. lambia extracellular nuclease (GeNuc) in E. coli and characterize its activity, the provisional GeNuc protein sequence of G. lambia WB strain from GenBank was analyzed. The coding sequence of GeNuc without signal peptide was amplified by PCR from genome DNA of G. lamblia C2 strain. Sequencing result showed that GeNuc in C2 strain was identical to that in Giardia WB strain. The PCR product (800 bp in size) was cloned into prokaryotic expression vector pET-28a(+). The recombinant vector pET-28a(+)-GeNuc was transformed into E. coli Rosetta(DE3), then the recombinant GeNuc protein was expressed by IPTG induction. SDS-PAGE and Western blot using anti-His Tag antibody showed that the expressed product of GeNuc was a fusion protein about 30.8 kD. The GeNuc recombinant protein, which was purified by Ni-NTA affinity chromatography and renatured by dialysis, showed DNase activity by partially digesting plasmid DNA. The successful prokaryotic expression and characterization of GeNuc provide a prerequisite for antibody preparation and further approach of pathogenesis of Giardiasis.
Keywords:Giardia lamblia; extracellular nuclease; bioinformatics; prokaryotic expression; activity determination
国家自然科学基金(No.31471954)和河北省青年科学基金(No.C2012401039)联合资助
