1-硝基芘和苯并[a]芘对人肺上皮A549细胞的联合细胞毒性
2016-07-21蒋玉婷
尚 羽,周 倩,蒋玉婷
(上海大学环境与化学工程学院环境污染与健康研究所,上海200444)
1-硝基芘和苯并[a]芘对人肺上皮A549细胞的联合细胞毒性
尚羽,周倩,蒋玉婷
(上海大学环境与化学工程学院环境污染与健康研究所,上海200444)
摘要:1-硝基芘(1-nitropyrene,1-NP)是柴油车尾气中检测浓度最高的硝基多环芳烃.以1-NP为主体,人肺上皮A549细胞为研究对象,探讨了1-NP和苯并[a]芘(benzo(a)pyrene,B[a]p)的联合细胞毒性及其对DNA的损伤.联合染毒实验结果表明:当B[a]p和1-NP同时作用于A549细胞时,B[a]p能明显减弱由1-NP造成的细胞增殖抑制和细胞内活性氧簇(reactive oxygen species,ROS)水平升高,但对DNA的损伤与1-NP单独染毒组相近;利用B[a]p预染毒A549细胞24 h,能明显减弱由1-NP造成的细胞增殖抑制和ROS水平升高,但对DNA的损伤加剧.以上结果说明,1-NP和B[a]p联合作用可能是通过抑制ROS的生成来降低对细胞增殖的抑制,但所造成的对DNA损伤的加剧可能是通过其他的作用途径.
关键词:1-硝基芘;苯并[a]芘;大气颗粒物;DNA损伤;活性氧簇
近年来,大气颗粒物(particulate matter,PM)污染已经成为影响人类健康的重要环境因素[1-3].PM的来源复杂,包括工业排放、燃煤发电、机动车尾气、秸秆焚烧、道路和建筑工地扬尘等[4].有机物是PM的重要化学组分,而最受关注的,且会对健康产生影响的是多环芳烃(polycyclic aromatic hydrocarbons,PAHs)及其衍生物(如硝基多环芳烃、醌类有机物等).硝基多环芳烃(nitro-PAHs)广泛存在于大气、机动车尾气等环境介质中,可直接来源于化石燃料的不完全燃烧,也可由前体物经大气光化学反应的二次转化产生.Bonnefoy等[5]的研究发现,nitro-PAHs的致突变和致癌潜力可达其母体PAHs的10~100000倍.吸附于颗粒物表面的nitro-PAHs能随呼吸进入人体,并可能通过直接突变引起肺癌.
大气环境中的nitro-PAHs种类较多,其中1-硝基芘(1-nitropyrene,1-NP)是柴油车尾气中检测浓度最高的nitro-PAHs[6],对柴油车尾气颗粒的致突变性有重要影响[7].已有研究发现,1-NP可以促进人肺上皮A549细胞产生活性氧簇(reactive oxygen species,ROS),导致DNA损伤和细胞死亡[8],并诱导细胞因子分泌[9].苯并[a]芘(benzo(a)pyrene,B[a]p)是污染范围最广、致癌性最强的一种多环芳烃,是环境中多环芳烃类化合物的典型代表.因此,本工作以1-NP为主体,人肺上皮A549细胞为研究对象,探讨了1-NP和B[a]p的联合细胞毒性及其对DNA的损伤,并利用荧光探针的方法测定了细胞内产生的ROS水平.
1 材料与仪器
1.1主要材料和试剂
胎牛血清(奥地利PAA Laboratories GmbH公司),HAM’S/F-12培养基(赛默飞世尔生物化学制品(北京)有限公司),四甲基偶氮唑盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT,美国Life Science公司),琼脂糖、1-NP(>99%)和B[a]p(>95%)(美国Sigma-Aldrich公司),96孔、24孔及6孔培养板、35 mm培养皿以及75 cm2培养瓶(美国Corning公司),其他试剂(分析纯,上海国药集团化学试剂有限公司).
1.2仪器
CO2恒温细胞培养箱(德国LINGDE公司),iMark-680型酶联免疫检测仪(美国BIO-RAD公司),正置荧光显微镜(BX51型,日本Olympus公司).
2 实验方法
2.1细胞培养和染毒
(1)细胞培养.
人肺上皮A549细胞购自中国科学院细胞库.使用HAM’S/F-12培养基,于5%CO2,37◦C恒温恒湿条件下对细胞进行培养.当细胞生长2~3 d,单层细胞达到80%以上时,按1∶3的比例进行传代培养.
(2)染毒.
取对数生长期的细胞,按每孔3×103个细胞接种于96孔培养板,供MTT实验使用;按每孔5×104个细胞接种于6孔培养板或35 mm培养皿,供彗星实验、ROS测定使用.接种后于5%CO2,37◦C恒温恒湿条件下对细胞进行培养,令其贴壁生长.待细胞贴壁后,弃培养基,使用D-Hanks清洗两次,进行染毒.
1-NP单独染毒的条件如下:使用不同浓度(1,2,3,4,5µmol/L)的1-NP染毒24 h.
1-NP和B[a]p联合染毒的条件如下:①预染毒,使用B[a]p(5µmol/L)预染毒24 h后,弃上清液,使用D-Hanks清洗两次,再使用不同浓度1-NP继续染毒24 h;②混合染毒,待细胞贴壁(8~24 h)后,加入含有B[a]p,1-NP的2%胎牛血清培养液,在37◦C培养箱中培养24 h,之后弃去培养基,用D-Hanks清洗3次,并在37◦C,5%CO2培养箱中培养24 h后进行检测.设置3~6个平行样.
使用二甲基亚砜(dimethyl sulphoxide,DMSO)将1-NP和B[a]p配置成100 mmol/L的储备液,每次染毒时重新稀释至所需浓度.染毒时使用含2%胎牛血清的培养液稀释至所需浓度,并保持DMSO的浓度为0.1%(v/v).实验设置溶剂对照组(DMSO,0.1%)和空白对照组(HAM’S/F-12培养基,不含细胞).
2.2MTT实验
染毒结束后,每孔加入5 mg/mL MTT试剂10µL,混匀后,继续培养4 h;之后弃去培养液,加入DMSO溶液100µL,震荡10 min.用酶联免疫检测仪测定光密度D,波长为490 nm.细胞存活率的计算公式如下:

式中,S为细胞存活率,DE,DB,DC分别为实验组、空白对照组和溶剂对照组的光密度.
2.3彗星实验
彗星实验(comet assay),又称单细胞凝胶电泳(single cell gel electrophoresis,SCGE)分析,是一种快速检测单个细胞内DNA损伤的技术.在电泳过程中,DNA未受损的细胞其核DNA停留在核基质中,染色后呈现圆形的荧光团,无拖尾;DNA受损的细胞其DNA断链或碎片将向阳极迁移,形成拖尾.细胞核DNA损伤越重,表现为拖尾长度的增加和尾部荧光强度的增强.因此,通过测定DNA迁移部分的光密度或迁移长度就可定量测定单个细胞DNA的损伤程度.本研究采用了Tice等[10]提出的彗星方法,具体步骤可参考文献[8,11].使用分析软件CASP进行彗星数据分析,记录尾长(tail length)、头部(head)和尾部(tail)DNA的荧光强度,并将尾部DNA含量作为DNA损伤的定量指标[12],即
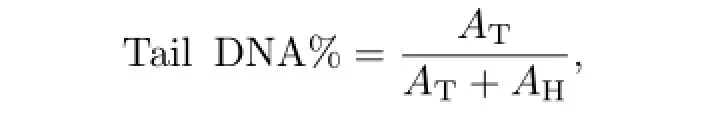
式中,AT为尾部DNA荧光强度,AH为头部DNA荧光强度.每个样本分析不少于80个细胞,
取其中位值,再取3~4个平行样的平均值.
2.4ROS测定
使用2’,7’-二氯荧光素二乙酸酯(2’,7’-dichlorofluorescein diacetate,DCFH-DA)作为荧光探针检测ROS水平.DCFH-DA本身没有荧光,且可以自由穿过细胞膜,在胞内可以被酯酶水解生成DCFH,而DCFH却不能穿透细胞膜,从而被装载到细胞内.细胞内的活性氧ROS可以氧化无荧光的DCFH,生成带有荧光的DCF.通过检测DCF的荧光强度即可指示细胞内活性氧的水平,具体步骤可参考文献[8,11].本实验用光密度值来表示ROS水平,并将所得结果与对照组作归一化处理.
2.5数据处理
数据的处理和计算采用Microsoft Office Excel 2007进行,数据以“平均值±标准差(X±SD)”的形式表示,各指标组间差异采用t检验法进行统计.
3 结果和讨论
3.1细胞存活率
1-NP和B[a]p的化学结构式如图1所示.图2为1-NP和B[a]p联合染毒条件下A549细胞的存活率,其中∗∗∗表示染毒组与溶剂对照组相比p<0.001;#和##分别表示1-NP单独染毒组与1-NP和B[a]p联合染毒组相比p<0.05和p<0.01.B[a]p的浓度选定为5µmol/L,在此浓度下B[a]p对A549细胞的存活率并无显著影响(数据略).由图2(a)可见,经5µmol/L B[a]p和不同浓度的1-NP联合染毒24 h,A549细胞的存活率与1-NP单独染毒24 h相比,有不同程度的上升,且在1-NP浓度为4和5µmol/L处,呈显著上升(p<0.01).由图2(b)可见,使用5µmol/L B[a]p预染毒24 h,再使用不同浓度的1-NP染毒24 h,B[a]p预染毒可使1-NP 对A549细胞的增殖抑制作用有所减弱,与1-NP单独染毒相比,细胞存活率略有上升,且在高剂量处呈显著上升(p<0.05).

图1 1-NP和B[a]p的化学结构式Fig.1 Chemical structures of 1-NP and B[a]p

图2 1-NP和B[a]p联合染毒条件下A549细胞的存活率Fig.2 Cell viability of A549 cells after treated with 1-NP and B[a]p
3.2DNA损伤
彗星照片显示,对照组A549细胞头部DNA致密,边缘光滑,没有明显的损伤;而染毒组和阳性对照组一样,拖尾明显,成扫帚状,且1-NP的浓度越高,拖尾现象越明显(图片略).图3为使用两种不同的混合染毒方式,1-NP和B[a]p对A549细胞DNA的损伤,其中∗∗和∗∗∗分别表示染毒组与溶剂对照组相比p<0.01和p<0.001,##表示1-NP单独染毒组与1-NP和B[a]p联合染毒组相比p<0.05.由图3(a)可见,经5µmol/L B[a]p和不同浓度的1-NP联合染毒24 h,可对A549细胞的DNA造成损伤,且随着1-NP浓度的增加,尾部DNA含量不断上升,呈显著的剂量-效应关系(p<0.01),与1-NP单独染毒组相比,DNA损伤程度有显著升高(p<0.01).由图3(b)可见,使用5µmol/L B[a]p预染毒24 h,再使用不同浓度的1-NP染毒24 h,也会对A549细胞的DNA造成损伤,但与1-NP单独染毒组相比,拖尾量并无显著差异(p>0.05).

图3 1-NP和B[a]p联合染毒对A549细胞DNA的损伤Fig.3 DNA damage of A549 cells after treated with 1-NP and B[a]p
3.3ROS生成
图4为1-NP和B[a]p联合染毒对A549细胞内ROS水平的影响(对比于对照组的100倍),其中∗和∗∗分别表示染毒组与溶剂对照组相比p<0.01和p<0.001,#为1-NP单独染毒组与1-NP和B[a]p联合染毒组相比p<0.01,tBHP为氧化剂叔丁基过氧化氢(tert-butyl hydroperoxide).由图4(a)可见,经5µmol/L B[a]p和不同浓度的1-NP联合染毒2 h后,A549细胞内的ROS水平随1-NP浓度的增加而不断升高,但与1-NP单独染毒2 h相比,却略有降低,且在1-NP浓度为5µmol/L处呈显著降低.由图4(b)可见,使用5µmol/L B[a]p预染毒24 h,再使用不同浓度的1-NP染毒2 h,B[a]p预染毒在某种程度上抑制了1-NP单独染毒后细胞内ROS的生成,且在1-NP浓度为4和5µmol/L处,ROS的产量呈显著下降(p<0.05).

图4 1-NP和B[a]p联合染毒对A549细胞内ROS水平的影响Fig.4 ROS formation of A549 cells after treated with 1-NP and B[a]p
4 结束语
MTT实验是评价外源性物质总体毒性的常用方法之一.本研究结果表明:对于经B[a]p(5µmol/L)预染毒后的A549细胞,1-NP对其增殖抑制作用呈显著降低;当B[a]p (5µmol/L)和不同浓度的1-NP同时作用于A549细胞时,1-NP对其增殖抑制作用也呈显著降低.本研究采用的彗星实验具有快速、简便、应用范围广和灵敏度高等优点,是检测细胞遗传毒性的常用方法之一.本研究使用的是强碱性电泳液(pH>13),通过尾部DNA的含量定量表征单个细胞DNA的损伤程度,是单链断裂、双链断裂和碱性不稳定位点的综合损伤结果.本研究结果显示,1-NP可对A549细胞造成显著的DNA损伤,且随着1-NP浓度的升高,DNA的损伤程度显著加深,并呈现剂量-效应关系(p<0.01).B[a]p(5µmol/L)预染毒24 h会使1-NP对A549细胞的DNA损伤加剧,具有统计学意义(p<0.05);当B[a]p (5µmol/L)和不同浓度的1-NP同时作用于A549细胞时,会加剧对A549细胞的DNA损伤,具有统计学意义(p<0.05).“氧化应激”是指机体的促氧化与抗氧化之间的不平衡状态.以促氧化效应为主、抗氧化剂被消耗,中间会产生大量的ROS,通常会导致生物大分子如DNA的损伤,亦会诱导细胞死亡.当B[a]p与1-NP联合染毒时,ROS水平低于1-NP单独染毒时,但仍显著高于对照组.
在本研究中,当B[a]p和1-NP同时作用于A549细胞时,降低了1-NP单独染毒时产生的ROS,使得急性毒性降低,细胞的增殖活性抑制减弱,但DNA的损伤明显高于1-NP单独染毒组.这可以理解为当B[a]p和1-NP同时作用于A549细胞时,B[a]p的毒性和1-NP同时占据A549细胞的结合位点,A549细胞对不同PAHs的代谢方式和代谢能力不同,导致其表现出不同的生物学效应.B[a]p对细胞的增殖在24 h内没有显著性差异,这可能是由于时间较短,还检测不到对细胞的增殖抑制,所以1-NP和B[a]p联合染毒时检测到的细胞存活率较1-NP单独染毒时更高.5µmol/L的B[a]p诱导A549细胞产生ROS的能力较弱,因为抢占位点的原因,降低了1-NP作用于A549细胞产生的ROS水平,从而使联合染毒产生的ROS低于1-NP单独染毒时产生的ROS.1-NP和B[a]p都具有遗传毒性,5µmol/L B[a]p的遗传毒性大于1-NP,1-NP和B[a]p联合染毒时,表现为B[a]p占突出优势,导致的DNA损伤大于1-NP单独染毒时.这也说明在1-NP和B[a]p联合染毒时,B[a]p起主导作用.
用B[a]p预染毒A549细胞,诱导细胞内的抗氧化物酶(如超氧化物歧化酶、过氧化氢酶等)活化,使细胞的抗氧化能力增强,对细胞形成保护作用,降低了1-NP产生的ROS,使得A549细胞存活率显著上升.用B[a]p预染毒A549细胞时,大量的B[a]p占据了有限的结合位点,但这种结合是不稳定的.因此,当B[a]p不存在,或与1-NP相比浓度特别低时,B[a]p所占据的有限的结合位点就会被1-NP所取代,表现为DNA损伤较1-NP单独染毒时加重,但不存在显著性差异.以上联合实验说明,1-NP作用于A549细胞导致的DNA损伤不仅是通过ROS攻击DNA所致,同时还有其他方式,如nitro-PAHs直接或其代谢后产物与DNA形成加合产物,但具体是哪一种方式,还需要进一步研究.
参考文献:
[1]POpE C A,BURNETT R T,THUN M J,et al.Lung cancer,cardiopulmonary mortality,and long-term exposure to fine particulate air pollution[J].The Journal of the American Medical Association,2002,287(9):1132-1141.
[2]HALONEN J I,LANKI T,YLI-TUOMI T,et al.Particulate air pollution and acute cardiorespiratory hospital admissions and mortality among the elderly[J].Epidemiology,2009,20(1):143-153.
[3]KAN H,LONDON S J,CHEN G,et al.Season,sex,age,and education as modifiers of the effects of outdoor air pollution on daily mortality in Shanghai,China:the public health and air pollution in Asia(PAPA)study[J].Environmental Health Perspectives,2008,116(9):1183-1188.
[4]P¨OsCHL U.Atmospheric aerosol:composition,transformation,climate and health effects[J]. Angewandte Chemie International Edition in English,2005,44(46):7520-7540.
[5]BONNEFOY A,CHIRON S,BOTTA A.Environmental nitration processes enhance the mutagenic potency of aromatic compounds[J].Environmental Toxicology,2012,27(6):321-331.
[6]王帮进,李怀建,占洁,等.大气气溶胶中硝基多环芳烃分析方法的建立及应用[J].环境科学学报,2011,31(8):1745-1749.
[7]KUCAb J E,PHILLIps D H,ARLT V M.Metabolic activation of diesel exhaust carcinogens in primary and immortalized human TP53 knock-in(Hupki)mouse embryo fibroblasts[J].Environmental and Molecular Mutagenesis,2012,53(3):207-217.
[8]尚羽,蒋玉婷,张玲,等.1-硝基芘和1,2-萘醌的联合细胞毒性和致DNA损伤[J].环境科学,2014,35:4345-4351.
[9]PARK E J,PARK K.Induction of pro-inflammatory signals by 1-nitropyrene in cultured BEAS-2B cells[J].Toxicology Letters,2009,184(2):126-133.
[10]TICE R R,AGURELLE E,ANDERsON D,et al.Single cell gel/comet assay:guidelines for in vitro and in vivo genetic toxicology testing[J].Environmental and Molecular Mutagenesis,2000,35(3):206-221.
[11]尚羽,张玲,范兰兰,等.大气颗粒物对A549和HUVEC的DNA损伤机制[J].上海大学学报:自然科学版,2013,19(4):411-416.
[12]范兰兰,尚羽,张玲.大气颗粒物对A549和HUVECs细胞的毒性作用[J].环境科学研究,2012,25(10):101-107.
E-mail:yushang@shu.edu.cn
中图分类号:R 994.6
文献标志码:A
文章编号:1007-2861(2016)02-0181-07
DOI:10.3969/j.issn.1007-2861.2016.01.008
收稿日期:2016-01-12
基金项目:国家自然科学基金资助项目(21107068,41561144007);上海大学长江学者和创新团队发展计划资助项目(IRT13078)
通信作者:尚羽(1982—),女,副研究员,博士,研究方向为大气污染物的区域污染特征和健康影响.
Combined effects of 1-nitropyrene and benzo(a)pyrene on cytotoxicity and DNA damage in human lung epithelial A549 cells
SHANG Yu,ZHOU Qian,JIANG Yuting
(Institute of Environmental Pollution and Health,School of Environmental and Chemical Engineering,Shanghai University,Shanghai 200444,China)
Abstract:Using human lung epithelial A549 cells,combined toxic effects of 1-nitropyrene (1-NP)and benzo(a)pyrene(B[a]p)were evaluated.The 1-NP caused a significantly concentration-dependent viability decrease,DNA damage and reactive oxygen species(ROS)generation.Compared with the groups treated with 1-NP alone,viability was significantly increased and ROS generation was significantly reduced in combined-treated groups with 1-NP and B[a]p.However,the DNA damage was significantly increased in the combinedtreated groups compared with the groups treated with 1-NP alone.These results suggested that 1-NP may mediate the cytotoxic effects through ROS generation,and pretreatment,with B[a]p may inhibit ROS generation induced by 1-NP,and thereby reducing the cell death in A549 cells.However mechanisms of DNA damage deserves further investigations.
Key words:1-nitropyrene(1-NP);benzo(a)pyrene(B[a]P);particulate matter;DNA damage;reactive oxygen species(ROS)
