层状Cu/ZnO/Al2O3催化剂的制备及其催化CO2加氢合成甲醇的性能
2016-07-21杨海艳张建明陈志文
肖 硕,高 鹏,杨海艳,夏 林,张建明,陈志文,王 慧
(1.上海大学环境与化学工程学院,上海200444;2.中国科学院上海高等研究院低碳转化科学与工程重点实验室,上海201203)
层状Cu/ZnO/Al2O3催化剂的制备及其催化CO2加氢合成甲醇的性能
肖硕1,2,高鹏2,杨海艳2,夏林2,张建明2,陈志文1,王慧2
(1.上海大学环境与化学工程学院,上海200444;
2.中国科学院上海高等研究院低碳转化科学与工程重点实验室,上海201203)
摘要:以尿素为沉淀剂,采用均相沉淀法成功制备了层状Cu/Zn/Al水滑石化合物.将前驱体材料经焙烧、还原后得到Cu/ZnO/Al2O3催化剂,并将其用于CO2加氢合成甲醇反应.采用X射线衍射(X-ray diffraction,XRD)、热重(thermogravimetric,TG)分析、扫描电镜(scanning electron microscope,SEM)、X射线荧光(X-ray fluorescence,XRF)分析、N2吸附、H2程序升温还原(H2-temperature program reduction,H2-TPR)、氧化亚氮(N2O)反应吸附、CO2程序升温脱附(CO2-temperature program desorption,CO2-TPD)技术对所制备的样品进行表征.结果表明,相对于传统共沉淀法,以尿素作为沉淀剂,通过均相沉淀法所制备的前驱体的结晶度更高、催化剂比表面积更大、金属Cu的分散度更好.另外,采用回流处理可以获得更好的效果.活性评估结果表明,O2转化率随金属Cu比表面积的增大而增加,而甲醇选择性则与催化剂表面碱性位的分布有关.因此,采用尿素回流处理均相沉淀法制备的Cu/ZnO/Al2O3催化剂的甲醇收率最高.
关键词:尿素水解;层状结构化合物;Cu/ZnO/Al2O3催化剂;CO2加氢;甲醇
CO2是自然界中大量存在的碳源化合物,将CO2加氢转化为甲醇既有助于解决CO2排放导致的环境问题,又能缓解化石燃料匮乏的危机.这是因为甲醇不仅是重要的化工原料,更是具有发展前景的非石油基清洁燃料.因此,CO2加氢转化这一过程在化工、能源、环保等方面具有重要意义[1].
工业上常以含有CO2的合成气为原料,采用Cu/ZnO/Al2O3催化剂进行甲醇合成[1-2],因此Cu/ZnO/Al2O3催化剂在CO2加氢合成甲醇反应中的作用机理也得到了广泛研究[3-7].高活性CO2加氢过程主要发生在金属Cu表面:一方面可降低H2解离的活化能;另一方面活性组分均匀分散可获得更多的表面缺陷[8-10].因此,活性组分Cu的分散在甲醇合成反应中起重要的作用.近年来,Gao等[11-14]利用类水滑石化合物衍生得到了高分散的Cu基催化剂,并在CO2加氢合成甲醇反应中表现优异.以层状结构的类水滑石为前驱体,利用类水滑石层板的限域作用可制备活性位高度分散的催化材料,其“表面网结构”可以控制催化活性组分高分散,其“表面阱结构”可以提高催化活性组分分散度的稳定性[15].通常采用共沉淀法制备水滑石化合物,但是该方法制得的材料的结晶度低且晶粒尺寸不均匀、易团聚,导致活性组分利用率不高[16-21].采用均相沉淀法则可以得到晶相结构更完整、晶粒尺寸更均一以及层状晶粒分散性更好的类水滑石材料[22-25].以尿素作为沉淀剂制备的样品,其杂质元素易被清洗,溶液内部的pH值可以始终保持一致,从而得到结晶度高、晶粒尺寸均一的类水滑石材料,进而提高衍生催化剂的比表面积[25-28].另外,pH值对类水滑石材料的合成也会产生很大影响,在碱性条件下有利于纯相类水滑石的形成[29].尿素分解过程会产生氨气,采用回流处理可以将生成的氨及时从反应体系中移除,从而使尿素得以充分分解,使反应体系保持较高的pH值.
本工作应用传统共沉淀法和均相沉淀法制备原子比为Cu2+∶Zn2+∶Al3+=1∶1∶1的前驱体材料,通过焙烧、还原得到Cu/ZnO/Al2O3催化剂,并用于CO2加氢合成甲醇反应,并对研究材料的物理化学性质进行了表征.本工作还研究了不同制备方法对前驱体材料、复合金属氧化物以及还原后催化剂的物理化学性质的影响,考察了催化剂的物理化学性质与反应性能之间的关系.
1 实验部分
1.1催化剂制备
实验所用试剂为分析纯的Cu(NO3)2·3H2O,Zn(NO3)2·6H2O,Al(NO3)3·9H2O,无水NaOH,Na2CO3以及尿素.将各种金属的硝酸盐按一定比例配制成一定浓度的混合盐溶液.以NaOH和Na2CO3的混合水溶液为碱溶液.在室温搅拌条件下,将混合盐溶液和碱溶液加入沉淀槽中,保持pH值为10.0±0.2.沉淀结束后,在搅拌状态下于60◦C老化15 h,经洗涤、过滤后,于80◦C干燥12 h,500◦C焙烧4 h.待温度降至室温后,将所得产物压片、破碎至40~60目.由此得到的Cu/ZnO/Al2O3催化剂记作cp-CZA.
将各种金属的硝酸盐与尿素按一定比例混合配制成一定浓度的混合溶液,在室温条件下搅拌溶解.将混合溶液加入烧瓶中,升温至100◦C后,恒温回流搅拌24 h.将沉淀物与0.05 mol/L的Na2CO3溶液混合搅拌24 h,经洗涤、过滤后,于80◦C干燥12 h,500◦C焙烧4 h.待温度降至室温后,将所得产物压片、破碎至40~60目.由此得到的Cu/ZnO/Al2O3催化剂记作re/hp-CZA.
另外,将上述金属硝酸盐与尿素的混合溶液加入四氟乙烯反应釜中,置于旋转烘箱内,待升温至100◦C后,恒温旋转24 h.将沉淀物与0.05 mol/L的Na2CO3溶液混合搅拌24 h,经洗涤、过滤后,于80◦C干燥12 h,500◦C焙烧4 h.待温度降至室温后,将所得产物压片、破碎至40~60目.由此得到的Cu/ZnO/Al2O3催化剂记作hp-CZA.
1.2催化剂表征
催化剂体相金属元素的含量由X射线荧光(X-ray fluorescence,XRF)分析仪测得,仪器型号为ZSX PrimusⅡ.
催化剂晶相结构的测定在RigakuUltima 4多晶X射线衍射(X-ray diffraction,XRD)仪上进行,以Cu Kα为激发源,2θ扫描范围为5◦~75◦.
催化剂BET比表面积的测定在美国麦克公司生产的Tristar 3020型多功能吸附仪上进行,以高纯氮为吸附质,于液氮温度下进行吸附.测试前,样品首先在200◦C真空中处理8 h.
采用德国NETZSCH公司的STA-449-QMS型热分析仪进行热重(thermogravimetric,TG)和微分热重(differential TG,DTG)分析.反应以空气作载气,空气流速为30 mL/min,催化剂用量约为10 mg,在100~750◦C温度范围内加热,升温速率为10◦C/min.
采用N2O化学反应吸附法测定还原后催化剂中金属Cu的比表面积(SCu)和分散度(DCu),催化剂用量为100 mg.首先,用流速为30 mL/min的5%H2/95%Ar(体积分数)在280◦C下还原2 h,然后降温至65◦C并用Ar吹扫30 min,再用流速为85 mL/min的10%N2O/90%N2(体积分数)进行化学吸附1 h,使得金属Cu完全被氧化成Cu2O.最后,用Ar将N2O吹扫干净并冷却至室温,并在280◦C的温度下采用脉冲纯H2进行还原.此时,金属Cu表面的Cu2O被脉冲H2所还原,记录此时的脉冲H2消耗量为H2消耗量,记作nH2.金属Cu表面的分散度和表面积分别采用下列方程进行计算:
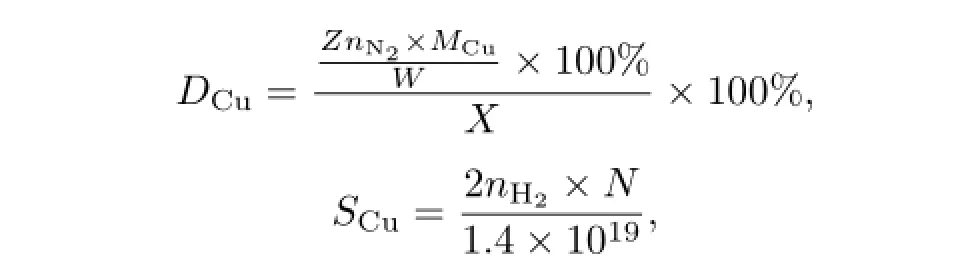
式中,DCu为金属Cu的分散度,W为催化剂的质量(g),MCu为Cu的相对原子质量(g·mol-1),SCu为单位质量催化剂所暴露的Cu的表面积(m2·g-1),N为阿伏伽德罗常数(6.02×1023),1.4×1019为每平方米Cu原子的个数.
催化剂的H2程序升温还原(H2-temperature program reduction,H2-TPR)实验在美国Micromeritics公司生产的Auto Chem 2920动态化学吸附仪上进行.操作条件如下:将样品(50 mg,40~60目)先在Ar吹扫下升温至150◦C并恒温1 h,以除去吸附在样品表面的其他杂质;待温度降至室温后,将气体切换成流速为30 mL/min的5%H2/95%Ar(体积分数)还原气,并以5◦C/min的速率升温至550◦C.采用热导检测器(thermal conductivity detector,TCD)记录H2的消耗情况.
催化剂的CO2程序升温脱附(CO2-temperature program desorption,CO2-TPD)分析在Auto Chem 2920动态化学吸附仪上进行.操作条件如下:先用流速为30 mL/min的H2在280◦C温度下将50 mg样品还原2 h;降温至50◦C后进行CO2吸附1 h;切换至流速为40 mL/min的Ar进行吹扫直至平衡,同时以10◦C/min的升温速率升温至550◦C.使用TCD记录CO2脱附曲线,采用CO2脉冲定量测定气体脱附量.
X射线光电子能谱(X-ray photoelectron spectroscope,XPS)测试是在Quantum 2000型X射线光电子能谱仪上进行.以Al Kα(hν=1 486.6 eV)为激发源,加速电压为12 kV,电流为4 mA,分析室真空度低于10-7Pa,以C(1s)的结合能(284.6 eV)为内标对其他样品元素的结合能进行校准.
采用德国ZEISS公司SUPRA 55型扫描电子显微镜(scanning electron microscope,SEM)观察样品形貌.测试过程中的加速电压为2 kV.对样品测试前,采用真空溅射技术镀金以改善样品的导电性能.
1.3催化剂评价
催化剂的活性测试在加压连续流动的不锈钢高压固定床反应器中进行,催化剂颗粒为40~60目,装填量为1.5 mL,并用同体积的40~60目石英砂稀释.在反应测试前,先在1 MPa下使用流速为80 mL/min高纯H2对催化剂进行还原,还原温度为280◦C,并在该温度下保持4 h.还原后,反应器冷却至反应温度,然后切换成流速为100 mL/min的原料气,所用原料气的摩尔比为H2∶CO2=3∶1,反应条件为T=170~250◦C,P=5.0 MPa,GHSV= 4 000 mL/(g/h),其中GHSV为气体小时空间速度(gas hourly space velocity).原料气经干燥、净化、压缩至实验所需要的压力,并通过质量流量计计量后进入反应器.反应液相产物由冷阱收集,尾气经计量后放空.反应过程中的气相与液相产物均使用气相色谱进行分析,为保证定态操作数据的可靠性,每次定态操作时间为24 h.根据所测得的反应尾气中各组分的含量,以碳原子的摩尔数计算CO2的转化率和产物中各物质的选择性.
2 结果与讨论
2.1前驱体材料的织构和结构性质
图1为各种前驱体材料的XRD谱图.可见,3个样品均具有类水滑石结构的特征峰,其中2θ=12◦,24◦和35◦的3个较强的尖锐衍射峰分别对应于层状结构的(003),(006)和(009)晶面的衍射,在2θ=60◦和61◦附近还可以观察到类水滑石化合物的(110)和(113)晶面的面内衍射峰[30].对于采用均相共沉淀法制备的前驱体材料,还可以观察到铜锌纤维矿的衍射峰,而采用回流法处理则几乎观察不到铜锌纤维矿的衍射峰.这说明以尿素作为沉淀剂,通过回流法制备样品有利于金属离子进入水滑石层板,形成纯相的类水滑石结构前驱体材料,进而使得该方法制备的样品结晶度较好.
图2为前驱体样品的SEM照片.可以看到,前驱体样品主要由生长良好的片状晶粒组成,表明已形成了层状结构,其中hp-CZA样品还能观察到棒状纤维结构的存在,这与XRD表征结果相吻合.从图中还可以观察到,cp-CZA样品具有清晰片状结构,但这些片状晶粒是不规则且密堆积的,而均相沉淀法和回流法制备的样品的尺寸与厚度均较大,分散性也更好.通过能谱(energy dispersive spectrometer,EDS)元素分布图也可以清晰地观察到,re/hp-CZA的前驱体样品中的Cu,Zn,Al元素的分散性较好[31].
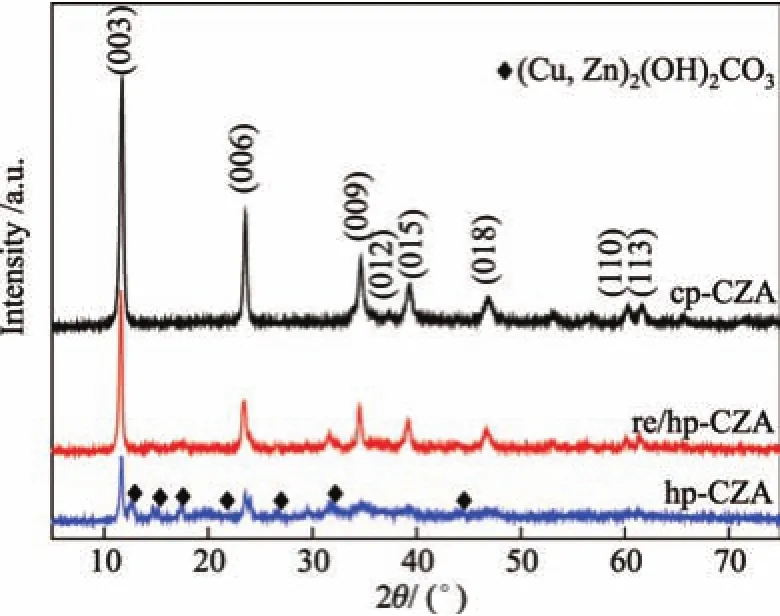
图1未焙烧的前驱体材料的XRD谱图Fig.1 XRD patterns of the uncalcined precursor materials

图2未焙烧的前驱体材料的SEM和EDS图Fig.2 SEM and EDS images of the uncalcined precursor materials
图3是采用不同制备方法制得的前驱体材料的TG-DTG曲线.传统类水滑石材料的热分解过程包括三个阶段.第一失重阶段发生在50~200◦C,对应于表面吸附和层间水分子的脱除.第二失重阶段发生在200~500◦C,对应于羟基基团的脱水和层间碳酸根离子的脱除;对于hp-CZA的前驱体样品则在低于500◦C观察到3个失重峰,这与铜锌纤维矿的分解有关.从图中还可以看出:hp-CZA与re/hp-CZA的水滑石前驱体失重峰温度高于cp-CZA,这表明均相沉淀法可以提高材料的热稳定性.第三阶段发生在更高温度(500~750◦C)处,还可以观察到一个明显的失重峰,这可以归结为稳定的含铜碳酸氧盐的分解.含铜碳酸氧盐是在类水滑石热分解的前两阶段形成的[11].
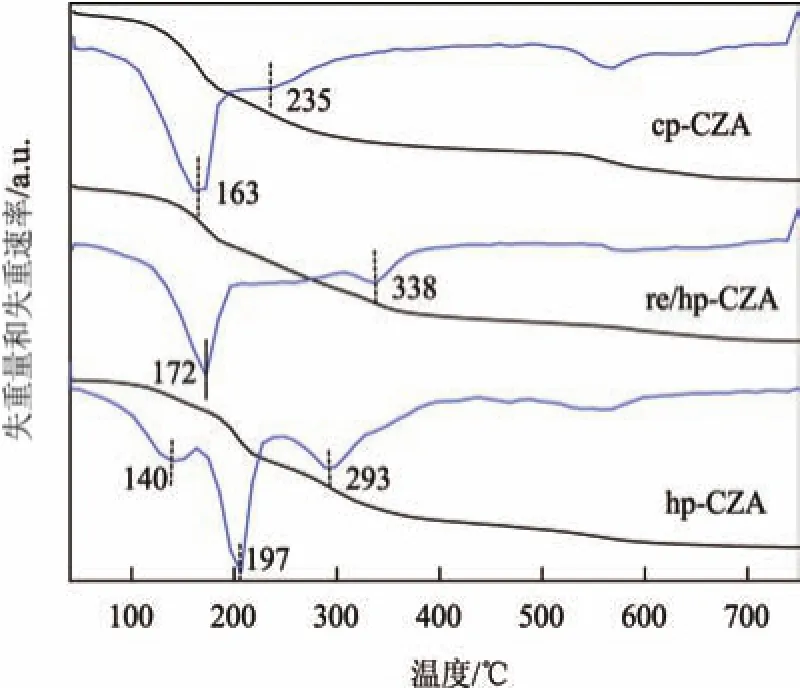
图3未焙烧的前驱体材料在空气中的TG-DTG曲线Fig.3 TG-DTG profiles of the uncalcined precursor materials in air
2.2焙烧后材料的织构和结构性质
由表1的XRF分析结果可以看到,3个焙烧后样品的Cu∶Zn∶Al原子比均接近1∶1∶1. 图4为500◦C焙烧后样品的XRD谱图.可见,图中已观察不到类水滑石的特征峰,所有样品可观察到宽化的衍射峰,这归结于结晶度较差的CuO晶相,并且这些衍射峰的强度与前驱体结构相关.在焙烧后的纯相类水滑石材料的XRD谱图中,CuO的衍射峰强度较低,且观察不到ZnO的晶相.这可能是由于ZnO高度分散在催化剂表面或以无定形的状态存在.然而,在hp-CZA样品的XRD谱图中还可清晰地观察到ZnO的衍射峰,其中以纯相类水滑石前驱体焙烧得到的复合金属氧化物中CuO的衍射峰更宽,表明以类水滑石衍生得到的CuO晶粒尺寸较小.本研究采用Scherrer公式计算了CuO的晶粒尺寸,发现cp-CZA与re/hp-CZA样品的CuO粒径尺寸显著小于hp-CZA样品(见表1).
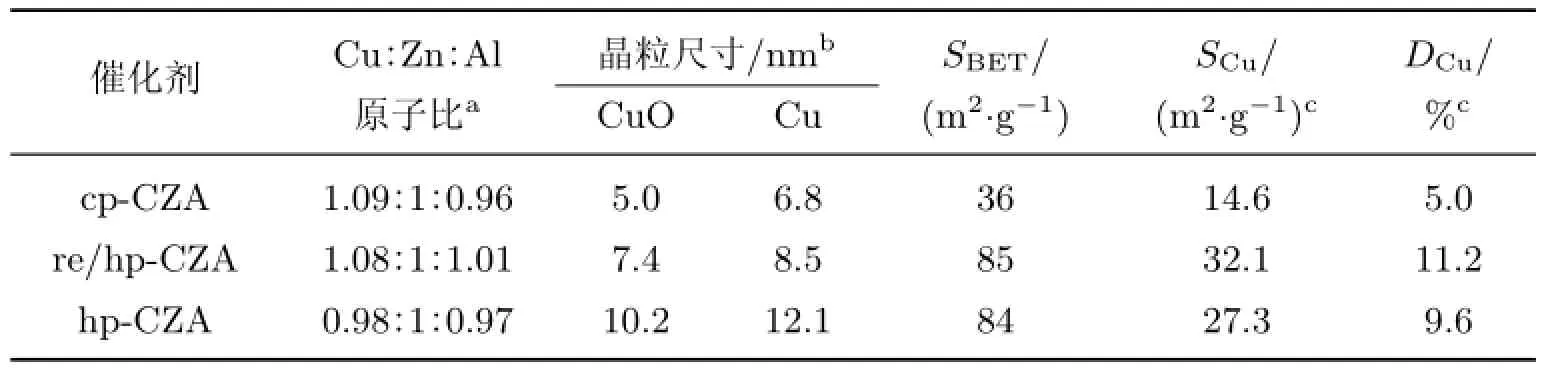
表1催化剂的组成与物理化学性质Table 1 Physicochemical properties and compositions of the catalysts
图5是焙烧后催化剂的SEM照片.可以观察到,焙烧后的样品形貌在热处理过程中被部分破坏,但仍然具有明显的层状结构特征,表明前驱体的形貌得到了保持.传统共沉淀法制备的cp-CZA样品在热处理过程中,层状结构坍塌更为明显,片层团聚现象更为严重,这是由cp-CZA前驱体热稳定性较差造成的.另外,hp-CZA的前驱体在经过焙烧以后仍能观察到棒状结构.
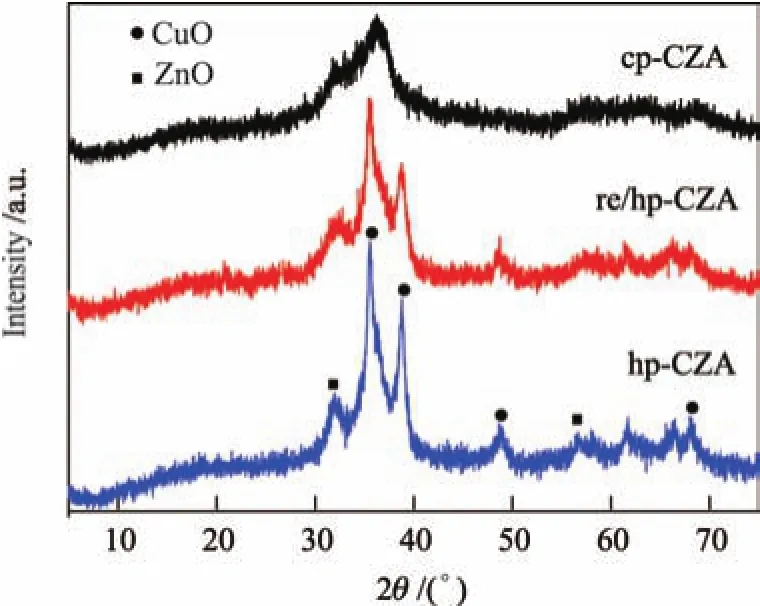
图4焙烧后催化剂的XRD谱图Fig.4 XRD patterns of the calcined catalysts

图5焙烧后催化剂的SEM照片Fig.5 SEM images of the calcined catalysts
焙烧后样品的物理化学性质列于表1中.可见,以尿素为沉淀剂,采用均相沉淀法可有效提高催化剂的BET比表面积(85 m2/g),re/hp-CZA和hp-CZA样品的比表面积是cp-CZA样品的2倍以上.这与SEM观察到的层状结构分散性有关,传统共沉淀法制得的样品层状结构明显堆积,而均相沉淀法则可以获得更加分散的片层结构,从而获得更大的比表面积.另外,均相沉淀法制得的前驱体热稳定性更好,这也是其比表面积更大的原因.
2.3还原后催化剂的织构性质
分别将焙烧后的3个样品在10%H2/Ar混合气体,280◦C条件下还原6 h,在1%O2/Ar混合气体,25◦C条件下表面钝化处理1 h.还原后样品的XRD谱图如图6所示.可见,所有样品还原后均在2θ=43.2◦处出现了金属Cu的衍射峰,衍射峰强度变化趋势类似于焙烧后的样品.纯相类水滑石前驱体得到的Cu基催化剂中金属Cu物种的衍射峰较宽,表明以类水滑石为前驱体得到的Cu纳米颗粒的离子尺寸更小,这与Scherrer公式计算得到的Cu颗粒尺寸的结果相一致(见表1).本研究还采用N2O化学吸附对Cu的比表面积和分散度进行了测试,发现二者均呈如下顺序变化:re/hp-CZA>hp-CZA>cp-CZA.这表明均相沉淀法可以获得更高的金属分散度,而采用回流处理效果更为显著.
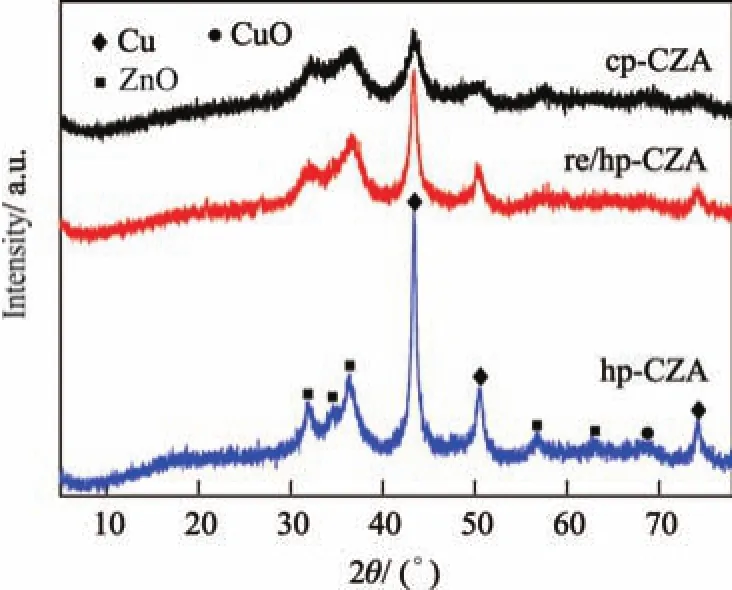
图6还原后Cu/ZnO/Al2O3催化剂的XRD谱图Fig.6 XRD patterns of the reduced Cu/ZnO/Al2O3catalysts
本研究采用XPS对还原后催化剂的表面化学状态进行了分析,结果如图7所示.可见,所有样品均在932.5和952.5 eV左右出现两个峰,分别为Cu0的Cu 2p3/2和Cu 2p1/2特征峰.而在942.0和962.0 eV左右Cu2+的卫星峰则几乎观察不到,这表明催化剂表面主要存在Cu0物种[32].在1 021 eV左右可观察到Zn 2p3/2的特征峰,表明Zn以Zn2+的形式存在于催化剂表面[11-12,32-33].另外,对于re/hp-CZA催化剂,在更高结合能处还可以观察到Cu 2p和Zn 2p的特征峰,表明一部分Cu和Zn物种结合能更强,即一部分金属Cu与ZnO的相互作用更强[32].前述的在均相沉淀过程中采用回流处理可以使水滑石更稳定,这可能是造成Cu与ZnO相互作用增强的原因.
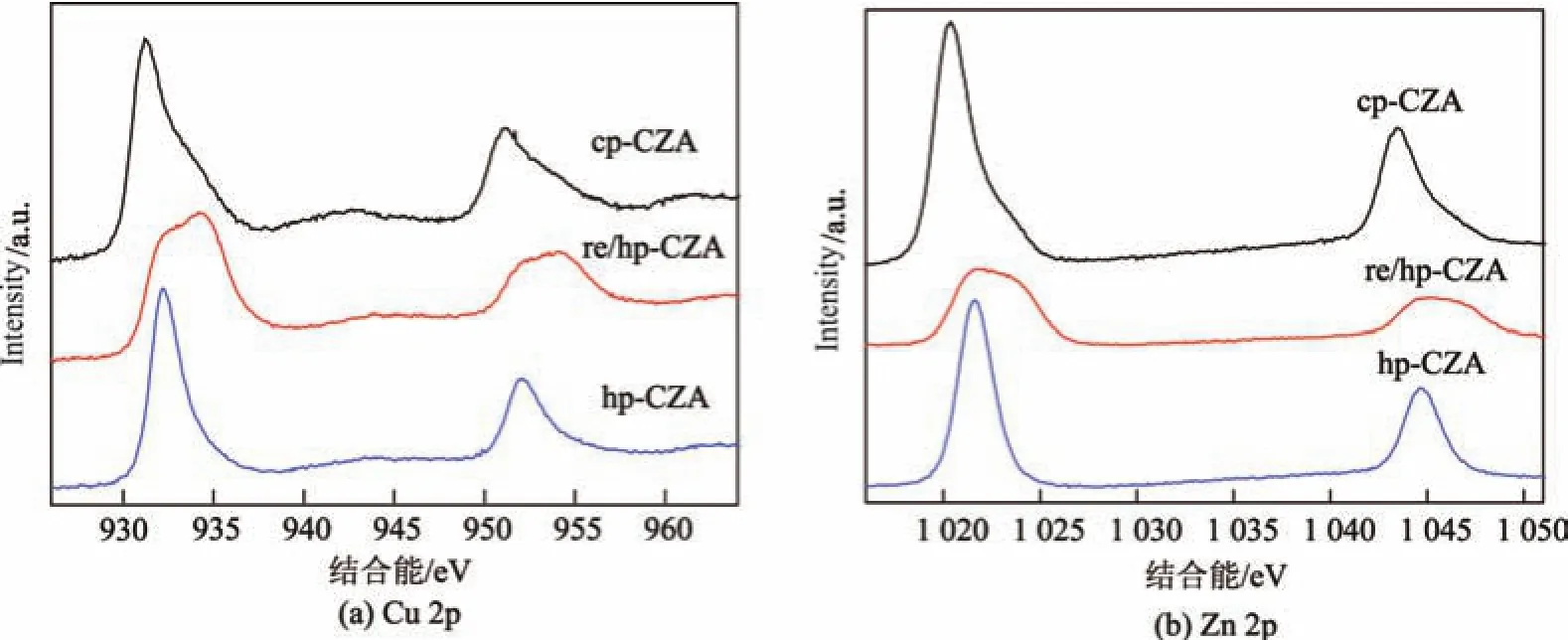
图7还原后催化剂的Cu 2p和Zn 2p XPS能谱Fig.7 Cu 2p and Zn 2p XPS of the reduced catalysts
2.4催化剂的还原性能
为了研究Cu/ZnO/Al2O3催化剂的还原行为,对催化剂进行了TPR表征,结果如图8所示.可见,所有样品在100~350◦C范围内呈现出还原峰.纯相类水滑石结构前驱体材料焙烧后得到的复合金属氧化物具有两个H2消耗峰,这是类水滑石衍生Cu基催化剂所特有的.因为Cu物种与其他金属氧化物的相互作用较强,所以其还原过程为两个阶段.每个还原峰的位置与其占总氢气消耗峰的比例如表2所示.整体来看,采用均相沉淀法制备的催化剂的还原温度更低,其中采用回流处理的re/hp-CZA样品的还原温度最低(第一个还原峰温度为212◦C),表明该样品的金属分散度更高[30-31],这与N2O化学吸附的表征结果相吻合.另外,hp-CZA催化剂的第一个还原峰的比例大幅降低(见表2),这是因为该样品前驱体中有很大比例的铜锌纤维矿,因此该物种衍生得到的催化剂仅呈现一个对称的还原峰.
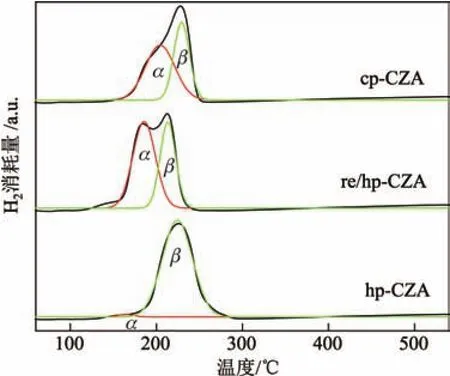
图8还原后Cu/ZnO/Al2O3催化剂的H2-TPR曲线Fig.8 H2-TPR profiles of the reduced Cu/ZnO/Al2O3catalysts
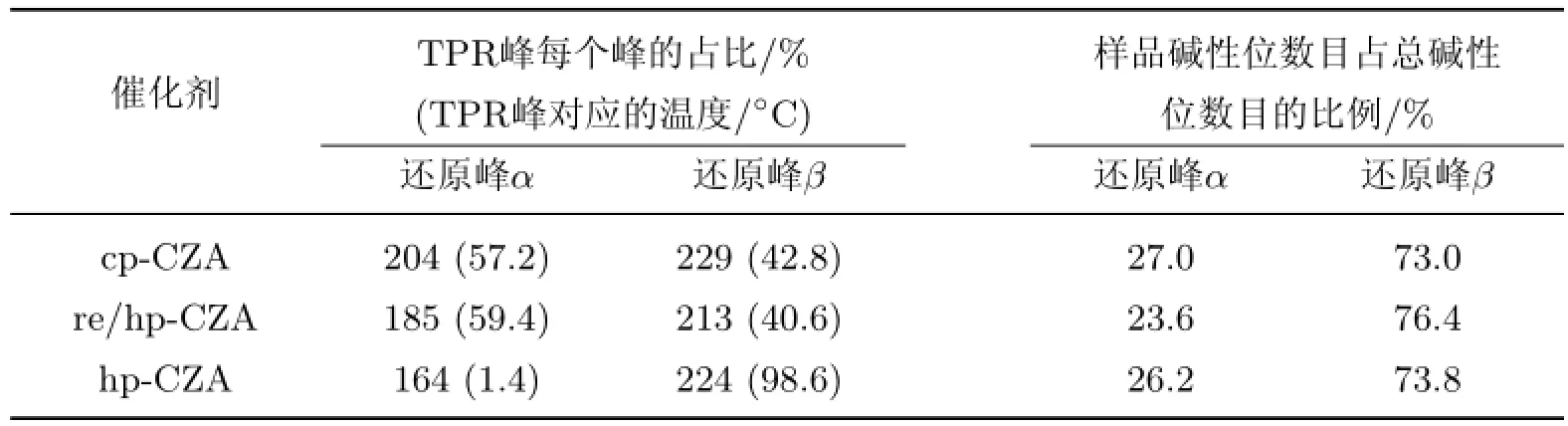
表2 Cu/ZnO/Al2O3催化剂H2-TPR表征和还原后的碱性位数目比例Table 2 H2-TPR results and distributions of basic sites over reduced Cu/Zn/Al catalysts
2.5催化剂的表面碱性
采用CO2-TPD对还原后催化剂表面的碱性进行了测试,结果如图9所示,其中两个Gauss峰分别代表弱碱性位(还原峰α)和强碱性位(还原峰β).样品各碱性位数目占总碱性位数目的比例如表2所示.相对于传统共沉淀法,均相沉淀法制得的Cu基催化剂表面的强碱位比例更高,而采用回流处理得到的催化剂表面的强碱性位比例最高.对于这3个样品,CO2脱附峰的位置变化不大,表明制备方法对催化剂表面各个碱性位的强度几乎没有影响.
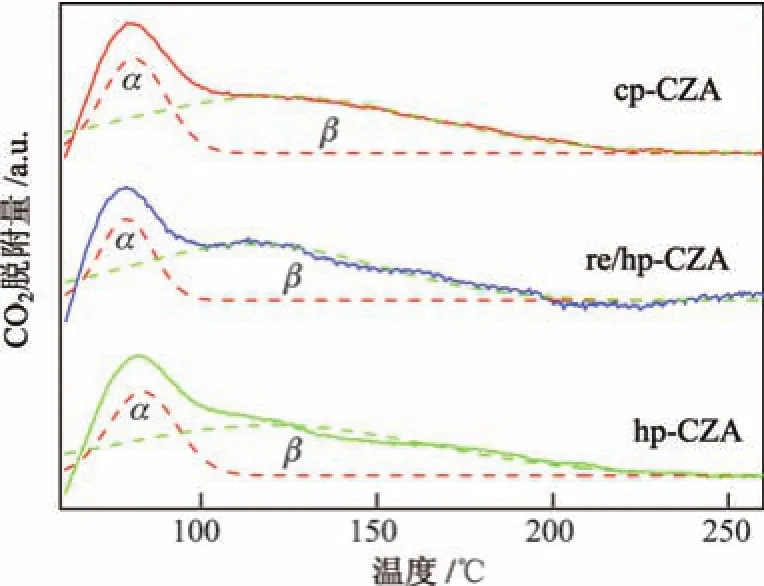
图9还原后Cu/ZnO/Al2O3催化剂的CO2-TPD曲线Fig.9 CO2-TPD profiles of the reduced Cu/ZnO/Al2O3catalysts
2.6催化剂的催化性能
CO2加氢合成甲醇的主要反应产物是甲醇、CO和水.表3列出了采用不同制备方法得到的Cu/ZnO/Al2O3催化剂的催化性能,其中gcat表示每克催化剂(反应条件为T=250◦C,P=5.0 MPa,GHSV=4 000 mL/(g/h),n(H2)∶n(CO2)=3∶1).结果发现:CO2转化率的变化趋势为re/hp-CZA>hp-CZA>cp-CZA,这与金属Cu的比表面积变化趋势是一致的;甲醇选择性的增加顺序为cp-CZA<hp-CZA<re/hp-CZA,这与催化剂表面强碱性位占总碱性位比例的变化趋势相同;采用均相沉淀法获得的催化剂甲醇收率更高,re/hp-CZA催化剂的反应性能更好.
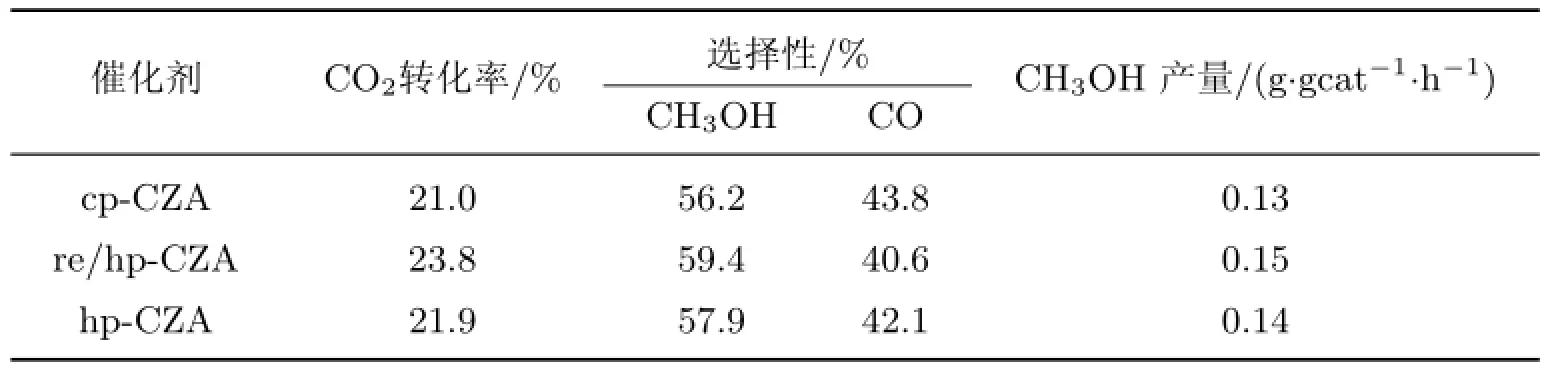
表3不同制备方法得到的Cu/ZnO/Al2O3催化剂的CO2加氢合成甲醇性能Table 3 Catalytic performances for methanol synthesis from CO2hydrogenation over Cu/ZnO/Al2O3catalysts on different preparation methods
3 结束语
通过与传统共沉淀法制备的催化剂对比得出,以尿素作沉淀剂,通过均相沉淀法制备的催化剂可显著提高前驱体的结晶度、金属Cu的分散度及比表面积.另外,采用尿素回流处理还可以获得更高的金属分散度,且在CO2加氢合成甲醇反应中表现出了非常好的反应性能.在T=250◦C,P=5.0 MPa,GHSV=4 000 mL/(g/h),H2∶CO2∶N2=73∶24∶3(摩尔比)条件下,CO2转化率、甲醇选择性、甲醇收率分别为23.8%,59.4%,0.15 g/(gcat·h).
参考文献:
[1]WANG H,GAO P,ZHAO T J,et al.Recent advances in the catalytic conversion of CO2to value added compunds[J].Science China Chemistry,2015,58(1):79-92.
[2]AREsTA M,DIbENEDETTO A,ANGELINI A.The changing paradigm in CO2utilization[J]. Journal of CO2Utilization,2013(3/4):65-73.
[3]PONTZEN F,LIEbNER W,GRONEMANN V,et al.CO2-based methanol and DME:efficient technologies for industrial scale production[J].Catalysis Today,2011,171(1):242-250.
[4]SUN Q,ZHANG Y L,CHEN H Y,et al.A novel process for the preparation of Cu/ZnO and Cu/ZnO/Al2O3ultrafine catalyst:structure,surface properties,and activity for methanol synthesis from CO2+H2[J].Journal of Catalysis,1997,167(1):92-105.
[5]BANsODE A,TIDONA B,VON ROHR P R,et al.Impact of K and Ba promoters on CO2hydrogenation over Cu/Al2O3catalysts at high pressure[J].Catalysis Science and Technology,2013,3:767-778.
[6]BATYREV E D,VAN DEN HEUVEL J C,BECKERs J,et al.The effect of the reduction temperature on the structure of Cu/ZnO/SiO2catalysts for methanol synthesis[J].Journal of Catalysis,2005,229:136-143.
[7]SLOCZYNsKI J,GRAbOwsKI R,KOZLOwsKA A,et al.Effect of Mg and Mn oxide additions on structural and adsorptive properties of Cu/ZnO/ZrO2catalysts for the methanol synthesis from CO2[J].Applied Catalysis A:General,2003,249:129-138.
[8]GUO X M,MAO D S,LU G Z,et al.The influence of La doping on the catalytic behavior of Cu/ZrO2for methanol synthesis from CO2hydrogenation[J].Journal of Molecular Catalysis A:Chemical,2011,345:60-68.
[9]BEHRENs M,STUDT F,KAsATKIN I,et al.The active site of methanol synthesis over Cu/ZnO/Al2O3industrial catalysts[J].Science,2012,336:893-897.
[10]HONG Z S,CAO Y,DENG J F,et al.CO2hydrogenation to methanol over Cu/ZnO/Al2O3catalysts prepared by a novel gel-network coprecipitation method[J].Catalysis Letters,2002,82(1):37-44.
[11]GAO P,LI F,ZHAO N,et al.Preparation of Cu/Zn/Al/(Zr)/(Y)catalysts from hydrotalcite-like precursors and their catalytic performance for the hydrogenation of CO2to methanol[J].Acta Physico-Chimica Sinica,2014,30(6):1155-1162.
[12]GAO P,LI F,ZHAN H J,et al.Influence of Zr on the performance of Cu/Zn/Al/Zr catalysts via hydrotalcite-like precursors for CO2hydrogenation to methanol[J].Journal of Catalysis,2013,298:51-60.
[13]GAO P,LI F,XIAO F K,et al.Preparation and activity of Cu/Zn/Al/Zr catalysts via hydrotalcite containing precursors for methanol synthesis from CO2hydrogenation[J].Catalysis Science and Technology,2012,2:1447-1454.
[14]GAO P,LI F,XIAO F K,et al.Effect of hydrotalcite-containing precursors on the performance of Cu/Zn/Al/Zr catalysts for CO2hydrogenation:introduction of Cu2+at different formation stages of precursors[J].Catalysis Today,2012,194:9-15.
[15]AN Z,HE J,DUAN X.Catalysts with catalytic sites highly dispersed from layered double hydroxide as precursors[J].Chinese Journal of Catalysis,2013,34(1):225-234.
[16]JIAO Y N,HOU W G.Effects of structural charges on points of zero charge and intrinsic surface reaction equilibrium constants of Zn-Al and Zn-Al-Fe hydrotalcite-like compounds[J].Colloid Surface A,2007,296:62-66.
[17]ZHANG L H,LI F,EVANs D G,et al.Structure and surface characteristics of Cu-based composite metal oxides derived from layered double hydroxides[J].Materials Chemistry and Physics,2004,87:402-410.
[18]ALEJANDRE A,MEDINA F,SALAGRE P,et al.Preparation and study of Cu-Al mixed oxides via hydrotalcite-like precursors[J].Chemistry of Materials,1999,11:939-948.
[19]ZHANG L H,ZHENG C,LI F,et al.Copper-containing mixed metal oxides derived from layered precursors:control of their compositions and catalytic properties[J].Journal of Materials Science,2008,43:237-243.
[20]LIU Y X,SUN K P,MA H W,et al.Cr,Zr-incorporated hydrotalcites and their application in the synthesis of isophorone[J].Catalysis Communications,2010,11:880-883.
[21]VELU S,SUZUKI K,OKAZAKI M,et al.Oxidative steam reforming of methanol over CuZnAl(Zr)-oxide catalysts for the selective production of hydrogen for fuel cells:catalyst characterization and performance evaluation[J].Journal of Catalysis,2000,194:373-384.
[22]MURCIA-MAsCAROs S,NAVARRO R M,GOMEZ-SAINERO L,et al.Oxidative methanol reforming reactions on CuZnAl catalysts derived from hydrotalcite-like precursors[J].Journal of Catalysis,2001,198:338-347.
[23]SHIsHIDO T,YAMAMOTO Y,MORIOKA H,et al.Production of hydrogen from methanol over Cu/ZnO and Cu/ZnO/Al2O3catalysts prepared by homogeneous precipitation:steam reforming and oxidative steam reforming[J].Journal of Molecular Catalysis A:Chemical,2007,268:185-194.
[24]MARIA T,GIOVANNI B,CLAUDIA C,et al.Cu/ZnO/Al2O3catalysts for oxidative steam reforming of methanol:the role of Cu and the dispersing oxide matrix[J].Applied Catalysis B:Environmental,2007,77:46-57.
[25]LIN Y K,SU Y H,HUANG Y H,et al.Efficient hydrogen production using Cu-based catalysts prepared via homogeneous precipitation[J].Journal of Materials Chemistry,2009,19:9186-9194.
[26]KOVANDA F,ROJKA T,BEZDICKA P,et al.Mixed oxides obtained from Co and Mn containing layered double hydroxides:preparation,characterization,and catalytic properties[J].Journal of Solid State Chemistry,2009,182:27-36.
[27]RAO M M,REDDY B R,JAYALAKsMI M,et al.Hydrothermal synthesis of Mg-Al hydrotalcites by urea hydrolysis[J].Materials Research Bulletin,2005,40:347-359.
[28]OGAwA M,KAIHO H.Homogeneous precipitation of uniform hydrotalcite particles[J].Langmuir,2002,18:4240-4242.
[29]KAZUFUMI N,IKUO A,DALIN L,et al.Effects of noble metal-doping on Cu/ZnO/Al2O3catalysts for water-gas shift reaction catalyst preparation by adopting“memory effect”of hydrotalcite[J]. Applied Catalysis A:General,2008,337:48-57.
[30]GAO P,ZHONG L S,ZHANG L,et al.Yttrium oxide modified Cu/ZnO/Al2O3catalysts via hydrotalcite-like precursors for CO2hydrogenation to methanol[J].Catalysis Science and Technology,2015,5:4365-4377.
[31]STEFANIE K,ANDREY T,STEFAN Z,et al.Cu-based catalyst resulting from a Cu,Zn,Al hydrotalcite-like compound:a microstructural,thermoanalytical,and in situ XAS study[J]. Chemistry:A European Journal,2014,20:3782-3792.
[32]BONURA G,CORDARO M,CANNILLA C,et al.The changing nature of the active site of Cu-Zn-Zr catalysts for the CO2hydrogenation reaction to methanol[J].Applied Catalysis B:Environmental,2014,152:152-161.
[33]GAO P,LI F,ZHAN H J,et al.Fluorine-modified Cu/Zn/Al/Zr catalysts via hydrotalcite-like precursors for CO2hydrogenation to methanol[J].Catalysis Communications,2014,50:78-82.
本文彩色版可登陆本刊网站查询:http://www.journal.shu.edu.cn
中图分类号:O 643
文献标志码:A
文章编号:1007-2861(2016)02-0218-13
DOI:10.3969/j.issn.1007-2861.2015.05.019
收稿日期:2016-01-11
基金项目:国家自然科学基金资助项目(11375111,21503260);中国科学院战略性先导科技专项基金资助项目(XDA02040602);上海市自然科学基金资助项目(14DZ1207600,15ZR1444500)
通信作者:陈志文(1962—),男,教授,博士生导师,研究方向为纳米材料的合成与性质.E-mail:zwchen@shu.edu.cn
Preparation of layered Cu/ZnO/Al2O3catalyst and its catalytic performance for CO2hydrogenation to methanol
XIAO Shuo1,2,GAO Peng2,YANG Haiyan2,XIA Lin2,ZHANG Jianming2,CHEN Zhiwen1,WANG Hui2
(1.School of Environmental and Chemical Engineering,Shanghai University,Shanghai 200444,China;2.Key Laboratory of Low-Carbon Conversion Science and Engineering,Shanghai Advanced Research Institute,Chinese Academy of Sciences,Shanghai 201203,China)
Abstract:Layered Cu/ZnO/Al2O3catalysts were prepared with ahomogeneous precipitation method using urea hydrolysis.The mixed oxides were then obtained by the calcination and reduction of precursors and tested for methanol synthesis from CO2hydrogenation.The prepared materials were characterized by X-ray diffraction(XRD),thermogravimetric(TG),scanning electron microscope(SEM),X-ray fluorescence(XRF),BET,H2-temperature program reduction(H2-TPR),N2O chemisorption,and CO2-temperature program desorption(CO2-TPD)techniques.Compared with the catalysts prepared by conventional co-precipitation method,the crystallinity degree of precursors,the BET specific surface area and dispersion of copper were increased with ahomogeneous precipitation method.This improvement was significant with reflux treatment during the homogeneous precipitation process.Evaluation of these catalysts for CO2hydrogenation to methanol revealed that the CO2conversion increased with increase of Cu specific surface area,and methanol selectivity was related to the proportion of strongly basic sites.Therefore,the maximum methanol yield was obtained over the Cu/ZnO/Al2O3catalyst prepared using ahomogeneous precipitation method with reflux treatment.
Key words:urea hydrolysis;layered structure compound;Cu/ZnO/Al2O3catalyst;CO2hydrogenation;methanol
