白屈菜花粉母细胞减数分裂的观察及其不同步性分析*
2016-07-21李国泰张益飒
李国泰,张益飒
(通化师范学院 生命科学学院,吉林 通化 134002)
白屈菜花粉母细胞减数分裂的观察及其不同步性分析*
李国泰,张益飒
(通化师范学院 生命科学学院,吉林 通化 134002)
摘要:以白屈菜为材料,采用压片和改良石碳酸品红染色制片法,观察花粉母细胞减数分裂过程及其减数分裂过程中各时期的不同步性的研究和分析.结果表明:(1)白屈菜的取材时间与其减数分裂存在着相关性,上午时段采取的白屈菜所观察到的减数分裂过程最佳;(2)对白屈菜的减数分裂观察中可得知存在减数分裂各时期的不同步现象,由此推断花粉的早熟和晚熟对其生殖会存在一定影响;(3)在所拍摄的白屈菜减数分裂图片中发现其染色体数目的不一致,因此推断有B染色体的存在.白屈菜的药用价值极为广泛,该实验的研究可为白屈菜药理作用,诱变培育及分子水平的进一步研究提供一定的理论依据.
关键词:白屈菜;减数分裂;花粉母细胞;染色体
白屈菜(Chelidonium Majus L.)[1]为罂粟科白屈菜属下的一个种,属于全草类.为多年生草本,别名:地黄连,土黄连,断肠草等.白屈菜含有多种化学成分,可分为生物碱与非生物碱.白屈菜性凉,味苦微辣,有毒.全草入药有镇痛,利尿,止咳,解毒等功效.主要针对胃痛,肠炎,慢性支气管炎,咳嗽,水肿以及毒蛇咬伤等.
目前国内外对于白屈菜的药理作用颇有研究[2],尤其对于抗肿瘤作用研究深入[3],体外实验也已证实白屈菜红碱对多种肿瘤细胞表现出细胞毒性[4].然而对白屈菜的引种驯化、人工栽培等方面的研究报道非常少. 对白屈菜的花粉母细胞减数分裂过程进行观察及其B染色体进行研究,旨在为白屈菜的引种驯化及相关细胞遗传学知识的深入研究提供科学依据和必要的素材.
1实验过程
1.1材料的获取
整株白屈菜及白屈菜花序取自通化师范学院周边.
1.2制片及摄影
以白屈菜的花药为材料采用压片法[5]制备永久装片,通过显微镜进行观察,用数码照相机进行显微摄影,得到白屈菜减数分裂各时期的图像后进行分析.
(1)取材.5~6月选取植株生长良好的白屈菜花序,于上午:9:00~10:30;下午:14:00~15:30;傍晚:17:00~18:30进行取材.
(2)固定.剪下发育适宜的花序,随即放入盛有卡诺固定液的小广口瓶中固定2~24h.
(3)解离及水洗.固定之后将材料取出用1mol/L的盐酸解离液进行解离6min,然后水洗三次.每次水洗5min.
(4)染色.用镊子取出花序放置在载玻片上,用解剖针剥离出一个花药.用胶头吸管取一滴改良石碳酸品红染液置于花药上进行染色5~10min.此时可连续取出几个花药,进行同样的染色处理.
(5)压片[6].取一干净的盖玻片,呈45°角将其慢慢放下,在盖玻片上覆以滤纸,用拇指均匀用力下压,使材料分散均匀,切勿将盖玻片压破或移动,然后进行显微镜观察,把材料良好并且细胞分散均匀的装片留用.
(6)永久装片的制备[7].把经过固定、解离、染色及压片制备好的临时装片进行冰冻、揭片、干燥后,用中性树胶封片,然后置于通风良好的环境中进行自然风干,切勿移动盖玻片的位置以免影响染色体观察,制备好的白屈菜永久装片装盒保存.
(7)显微摄影.把制备好的永久装片进行显微观察.先用40倍物镜进行观察,找到白屈菜减数分裂细胞的各个时期,再调至100倍油镜观察,通过调光、对焦用数码照相机进行拍摄,得到清晰的细胞分裂照片.
2结果及分析
把通过显微摄影得到的图片进行筛选分类,按白屈菜减数分裂的先后过程排序观察分析,具体如下.
2.1减数分裂I
通过显微摄影得到第一次减数分裂各时期图片,如图版I、图版II所示.

图版I 白屈菜花粉母细胞的减数分裂
(1)前期I(图版I-1).染色体从细变粗,从块状变成清晰可见的染色体,同时也是从长变短的动态过程.最显著的特征则是深色的染色质块逐渐变成棒状染色体[8].
细线期(图版II-1)细胞的特征是染色体呈现为细线状,另有念珠状的染色粒,每条染色体已含有两条染色单体,细胞核以及核仁变大[9].
偶线期(图版II-2)同源染色体进行配对,有联会现象出现.而每对联会的同源染色体则称为二价体,另外它含有4条染色单体,又可称为四分体.
粗线期(图版II-3)染色体凝聚缩短变粗,然后四分体的非姐妹染色单体之间发生DNA片断交换,产生了基因重组,然而不能进行配对的染色体称为单价体(或二联体).
双线期(图版II-4)染色体开始分离,另外的交叉点上保持有联系.
终变期(图版II-5),又叫浓缩期.二价体明显变短,向核周边移动,并且在核内均匀散开.由于双线期交叉常不止发生在一个位点,染色体形状表现出了多样性,有V形、X形、8字形.在终变期末,核仁开始消失,核膜破裂.
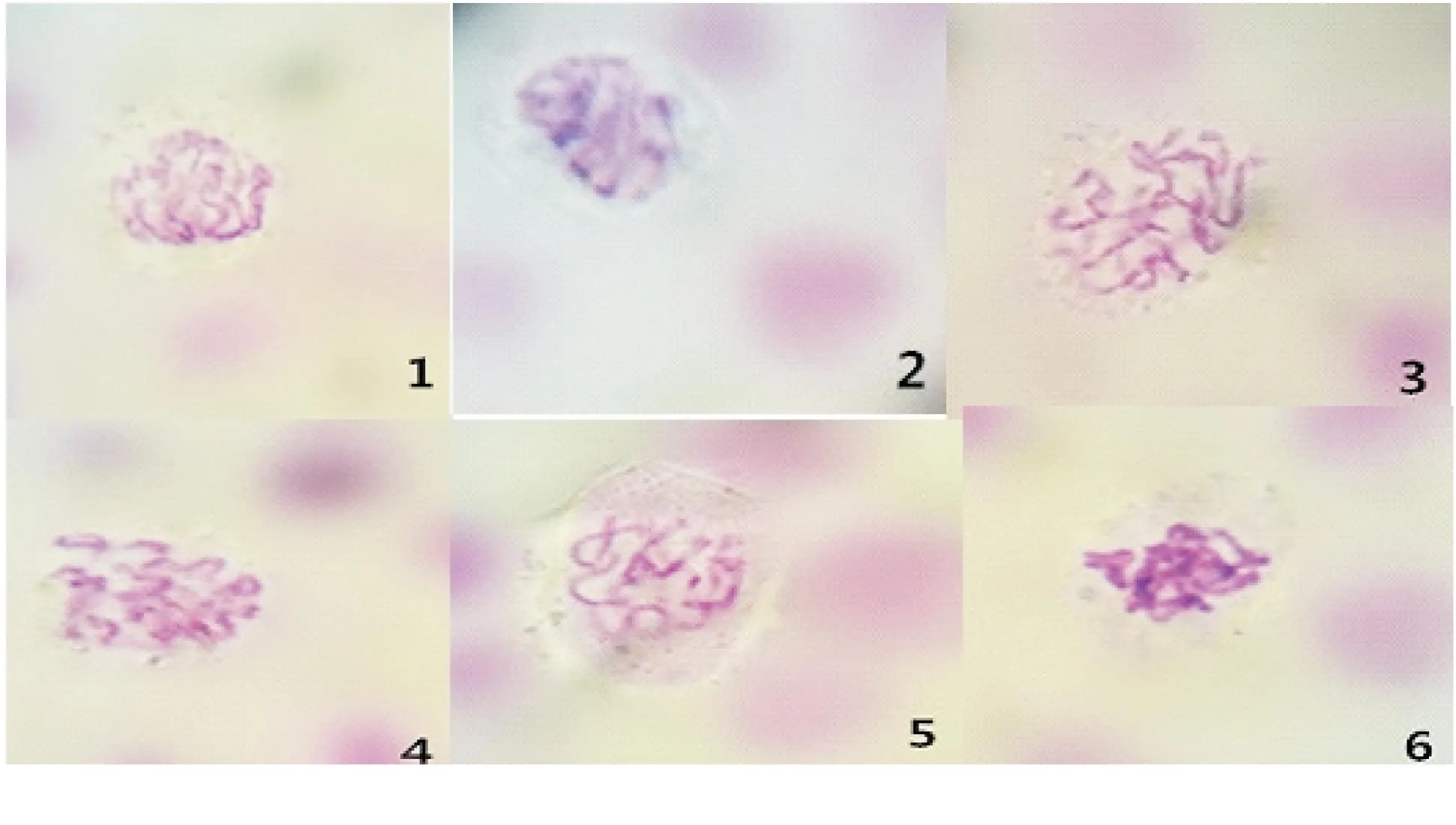
图版II 白屈菜减数分裂Ⅰ
(2)中期I(图版I-2).成对同源染色体向中央赤道板移动,而着丝点排列在赤道板两侧,细胞质中形成纺锤体,一侧的纺锤体与同一侧的两个着丝粒相连接.染色体整体外观如麻花状.
(3)后期I(图版I-3).每对联会的同源染色体称为二价体.二价体中的两条同源染色体分开,被一侧的纺锤丝牵引,然后随机地向两极移动.非同源染色体之间趋向同一极.
(4)末期I(图版I-4).染色体到达两极后,解旋成为细丝状,纺锤体逐渐消失,核膜重新建立,核仁形成并且进行胞质分裂,产生两个子细胞,其染色体数目减半,但姐妹染色单体并没有分开.
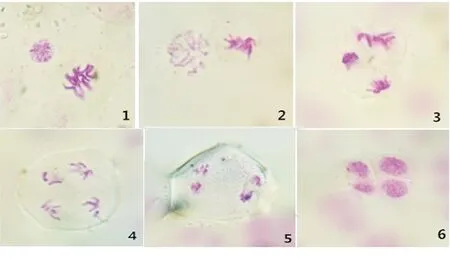
图版III 白屈菜减数分裂II
1.间期与中期Ⅱ;2.前期与中期Ⅱ;3.中期与后期Ⅱ;4.后期Ⅱ;5.末期Ⅱ;6.四分体
2.2减数分裂Ⅱ
通过显微摄影得到的第二次减数分裂的各时期图像如图版III.按细胞分裂前后顺序分析如下.
(1)前期Ⅱ(图版III 1,2).正常情况下,一般植物此时期应该是染色体散乱分布在细胞中,而后再次聚集,核膜及核仁消失,纺锤体[10]再次形成.但是观察到的白屈菜细胞的减数分裂前期Ⅱ中的两个子细胞分裂不同步,一个是前期Ⅱ特征,一个是中期Ⅱ特征.
(2)中期Ⅱ(图版III 2,3).正常情况下应该是两个子细胞染色体的着丝点排列在赤道板上,与减数分裂Ⅰ有所不同,此时不存在同源染色体.本实验的结果不同的是出现了一个子细胞是中期Ⅱ特征,一个子细胞是后期Ⅱ特征,也出现了分裂的不同步性.
(3)后期Ⅱ(图版III 3,4).染色单体的着丝粒分开,由纺锤丝牵引向两极移动,细胞分裂正常.
(4)末期Ⅱ(图版III 5,6).核膜和核仁重现,到达两极的染色体进入子细胞,而后形成四分体,细胞分裂正常.
2.3花粉母细胞分裂的不同步性分析
第一次减数分裂之后染色体数目减半,所以其产物为单倍体.减数分裂遗传物质重组,因为减数分裂前期长而且复杂,在白屈菜花粉母细胞减数分裂观察中可知,不同植株或同一植株不同花序的花粉母细胞减数分裂的速度具有明显的不一致性,尤其是减数第二次分裂,如本实验研究中的前期Ⅱ和中期Ⅱ出现了细胞分裂的不同步性.因此在白屈菜减数分裂的同一制片中能观察到不同的分裂相.
2.4观察到B染色体
在所拍摄的白屈菜减数分裂各个时期的照片中,对白屈菜染色体条数的多少作了研究及分析,其存在有2n=10;2n=12;2n=14等的情况,白屈菜染色体数目变异较大,对其或有待于进一步地研究,对此情况推断存在B染色体[11].B染色体也称为超数染色体,就是超出正常染色体数目的一类染色体,而在正常核型范围内的染色体则都称之为A染色体.因此,对白屈菜的染色体条数细致的分析还需进行更进一步的探究.
3讨论
在本实验中,制片所用的白屈菜花序的取材时间对实验的观察存在一定的影响,分不同的时间点(上午:9:00~10:30;下午:14:00~15:30;傍晚:17:00~18:30)对其进行采摘并准备实验,制片对其进行减数分裂观察发现,在上午所采摘的白屈菜的细胞减数分裂的较多,因此实验效果最佳.在实验过程中,挑选的花药好坏对实验的成功也存在一定相关性.首先,选取的花苞必须大而嫩,颜色最好呈现绿色而非黄色;然后,为能准确观察减数分裂现象,花苞必须处于鲜嫩期而不可是成熟期,成熟期花药中的细胞所呈现的减数分裂现象不易观察到.
在真核细胞中,花粉母细胞要经历两次核分裂和胞质分裂,最终分裂为四个单倍体细胞并发育成配子.在第一次减数分裂的粗线期非姐妹染色单体之间发生交叉、重组,每对同源染色体一般有至少一个交叉,但也存在三个或多个交叉,正是由于染色体的交叉、重组,使其遗传组成不同从而致配子遗传多样化,最后父本与母本的单倍体配子合成一个二倍体的合子.减数分裂是有性生殖中产生生殖细胞的最主要形式,同时也是发生交换以及重组的主要时期,另外减数分裂的同源染色体非姐妹染色单体之间的多种交换可能性也为生物的多样性提供了重要的物质基础.本实验中,对白屈菜花粉母细胞减数分裂的观察,大部分时期分裂都处于同步,少部分存在不一致,特别是第二次减数分裂,存在中期和后期同时进行的情况,这种不同步性[12]表现在不同植株或同一植株不同花序,从而存在早熟和晚熟现象,由此推断减数分裂时期的不同步性对其生殖存在一定的影响.
参考文献:
[1]周繇.中国长白山植物资源志[M].北京:中国林业出版社,2009.
[2]袁磊.白屈菜综合研究最新进展[J].安徽农业科学,2015,43(7):15-17.
[3]才玉婷,武蕾蕾,常乐.白屈菜药理作用研究进展[J].牡丹江医学院学报,2012,33(2):57-60.
[4]李静,田芳,李美艳.白屈菜提取物中生物碱的镇痛抗炎作用研究[J].中国实验方剂学杂志,2013,19(8):262-265.
[5]张文霞,戴灼华.遗传学实验指导[M].北京:高等教育出版社,2007.
[6]陈学好,陈艳萍.一种新的花粉压片染色法[J].生物学杂志,2001,18(1):36-37.
[7]杨晓伶,程舟.柑橘类植物染色体制片新技术[J].同济大学学报,2005,33(2):242-244.
[8]徐晋麟,赵耕春.基础遗传学[M].北京:高等教育出版社,2009.
[9]刘丽琴,谢江辉,李伟才.龙眼花粉母细胞减数分裂观察[J].果树学报,2011,28(5):820-824.
[10]刘梦豪,赵凯强,王雅栋,等.蝗虫精母细胞减数分裂各时期的识别[J].遗传学,2012,34(12):1628-1637.
[11]刘传虎,张秋平,姚家玲.龙须草核型分析和花粉母细胞减数分裂的细胞学研究[J].中国农业科学,2007,40(7):27-33.
[12]唐宇,吕淑霞,王桂香.黑芥与花椰菜体细胞杂种花粉母细胞的减数分裂不同步及染色体行为异常[J].基因组学与应用生物学,2009,28(6):1111-1116.
(责任编辑:陈衍峰)
DOI:10.13877/j.cnki.cn22-1284.2016.06.018
*收稿日期:2015-12-04
作者简介:李国泰,吉林梨树县人,副教授.
中图分类号:S563.3
文献标志码:A
文章编号:1008-7974(2016)03-0056-03
