VEGF-A、VEGF-C、VEGF-D与胃癌非新辅助治疗患者预后关系的Meta分析
2016-07-18鲁硕君秦艳茹常志伟
鲁硕君 秦艳茹 常志伟
(郑州大学第一附属医院 肿瘤科 河南 郑州 450042)
VEGF-A、VEGF-C、VEGF-D与胃癌非新辅助治疗患者预后关系的Meta分析
鲁硕君秦艳茹常志伟
(郑州大学第一附属医院 肿瘤科河南 郑州450042)
【摘要】目的通过Meta分析法探讨VEGF-A、VEGF-C、VEGF-D与胃癌非新辅助治疗患者预后的关系。方法利用数据库搜索相关文献,排除新辅助治疗病例,根据标准纳入、提取用于分析的生存数据,对危险度(HR)进行Meta分析,定量评估VEGF-A、VEGF-C、VEGF-D过表达与胃癌患者生存的关系。结果共纳入25篇文献。合并HR提示VEGF-A、VEGF-C过表达对总生存率(OS)和无病生存率(DFS)均有不利影响,合并HR及95%可信区间分别为1.37(1.13,1.67)、1.43(0.95,2.14);2.15(1.58,2.94),2.56(1.21,5.28)。结论VEGF-A、VEGF-C过表达是胃癌患者OS和(或)DFS的不良预后因子。
【关键词】血管内皮生长因子;胃癌;预后;Meta分析
胃癌是全球第4大常见肿瘤,在肿瘤相关死亡原因排名中位居第2。其流行病学有明显的地理差别,日本、中国、智利、远东、欧洲和俄罗斯为高发地区,而美国、澳大利亚、丹麦和新西兰发病最低。早期诊断、根治性手术、新辅助化疗、新化疗方案及靶向治疗的进展改善了胃癌预后,但总体来说,其术后5年生存率仍仅为20%~30%。目前公认的预后因素是其临床病理特征,包括肿瘤大小、分期和分级。但这并不能完全预测每个病例的临床结局。因此需要寻找更好的标志物,在临床诊断的同时能够识别出预后不良的病例。
血管生成是很多恶性肿瘤发生的关键过程。肿瘤的局部进展及远处转移都依赖于血管新生。本文着重探讨了其中关键的生物因子,血管内皮生长因子(VEGF),作为胃癌预后标志物的潜在可能性。VEGF家族由5种VEGF糖蛋白(VEGF-A,VEGF-B,VEGF-C、VEGF-D和VEGF-E)和血小板源性生长因子(PDGF-1,2)组成。VEGF-A及其受体是目前抗血管生成药物的主要靶点。VEGF-C和VEGF-D则主要与受体VEGFR-3结合,诱导淋巴管新生,促进淋巴结转移。
很多回顾性研究评价了胃癌VEGF过表达与预后的关系,并未得到一致结论。且大多未排除新辅助治疗对预后的影响,尚不明确这些分歧是因研究样本量的限制,或是出于样本自身的异质性。本文排除所有新辅助治疗病例,根据标准纳入文献进行Meta分析,定量回顾肿瘤组织中VEGF-A、C、D过表达对胃癌患者预后的影响。
1材料和方法
1.1检索策略和文献选择搜索电子数据库PubMed、CNKI、万方中2010年1月1日至2015年7月31日的所有文献。关键词包括:“gastric cancer(或‘stomach cancer’或‘gastric carcinoma’)” “VEGF”“vascular endothelial growth factor ”“prognosis” “胃癌”“血管内皮生长因子”和“预后”。同时回顾Cochrane图书馆的相关文章。利用纳入研究的参考文献用于完善搜索。
纳入标准:①研究样本为胃癌手术切除标本;②未接受术前新辅助治疗;③VEGF的表达通过IHC或RT-PCR检测;④提供生存率的信息;⑤同一作者在不同刊物上发表的由同一样本获得的结果,仅采用最新或最完整的文献。排除标准:①动物试验;②检测循环血或mRNA;③接受术前治疗;④仅有反应率;⑤缺少计算危险度(HR)及其95%CI的关键信息。
1.2数据提取及质量评价由2名研究员独立纳入文献,有分歧者经讨论一致决定,若不能达成一致,由第3名研究员参与讨论并投票决定。由2名研究员独立提取数据。提取数据包括作者、出版年份、病源、样本量、性别构成、年龄、分期、随访时间、VEGF类型、阳性率、阳性判定(临界值)和生存率数据。本文不对纳入文献进行质量评价,因为质量评价标准在观察性研究的Meta分析中的应用目前尚未得到普遍认可。
1.3统计方法所有数据按VEGF亚型A、C、D及总生存率(OS)、无病生存率(DFS)不同分为6组。用HR衡量VEGF过表达对生存率的影响。定量合并各组数据,以合并HR及95%CI判断结果有效性。若文献明确给出HR及95%CI,则采用原始数据。若不明确,则利用已知数据外推HR及95%CI,计算方法参考Parmar等(1998)、 Williamson等(2002)和Tierney等(2007)的文献。
用Peto法χ2检验判断HR的异质性,检验结果用统计量Q、P值和矛盾指数I2表示。P>0.10时认为HR具有同质性,采用固定效应模型分析;P≤0.10时认为存在异质性,采用随机效应模型分析。I2≤50%表明异质性尚可接受。合并HR>1提示相应VEGF亚型过表达是生存率的危险因素。95%CI覆盖1说明结果无统计学意义。森林图中,水平线表示95%CI;方块表示HR点估计,大小与文献权重成正比;菱形及垂直虚线表示总体估计,宽度即95%CI;垂直实线设定为无意义值(HR=1.0)。
发表偏倚用Egger及Begg法判断。截尾意义利用Egger法t检验(P<0.05表示存在发表偏倚)。所有的计算均应用软件Stata 12.0。
2结果
2.1文献选择和特征共纳入2010-2014年间发表的13篇文献。见表1。总计2 251例患者,每篇文献样本量55~452(中位样本量128);男性比例52.1%~87.5%(中位比例69.6%);平均年龄55~68岁(中位年龄60岁);肿瘤分期Ⅰ~Ⅳ期,其中Ⅰ~Ⅱ期所占比例0%~90.2%(中位比例47.4%)。中位随访时间53个月;VEGF过表达率5.6%~87.7%(中位54.2%)。
所有文献均报告了各亚型VEGF不同表达情况对胃癌患者生存率的预测价值。其中,8例明确VEGF过表达是不良预后因素,另外12例认为没有统计学意义。见表2。
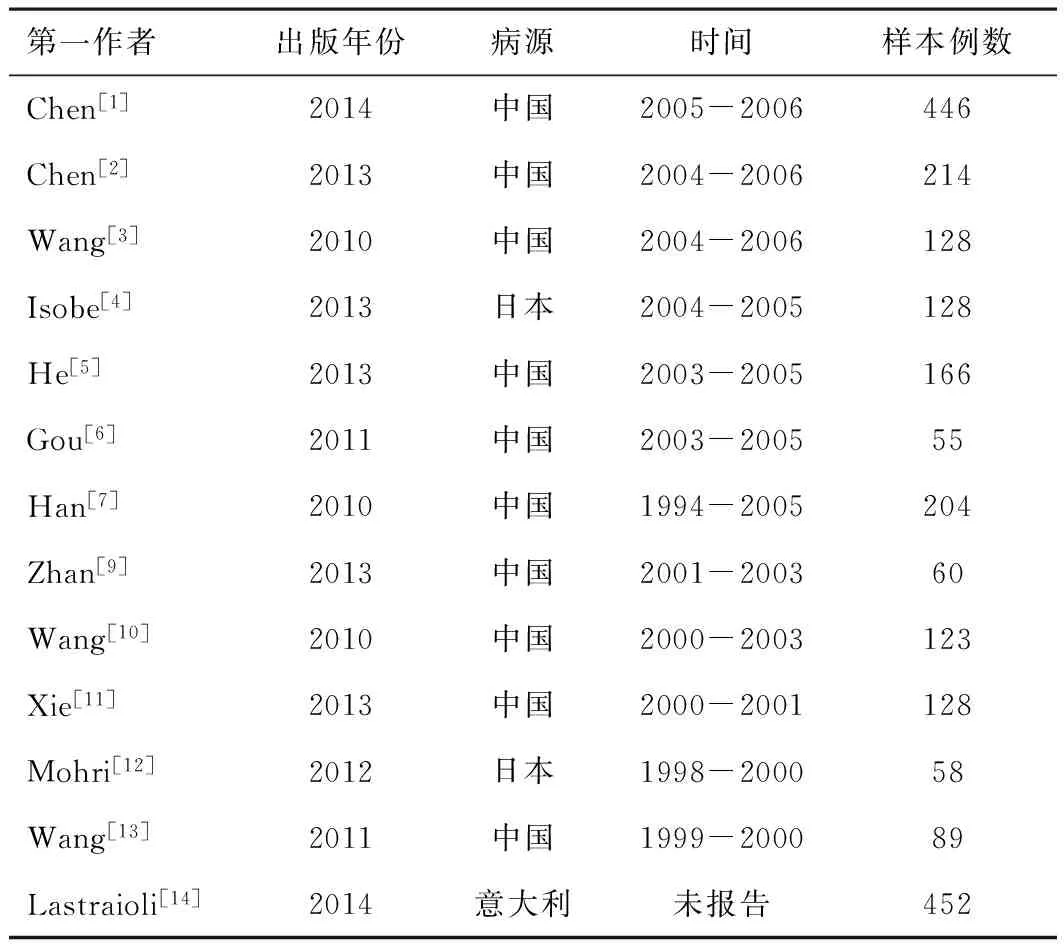
表1 纳入文献的主要特征

表2 纳入文献的主要数据
2.2Meta分析Meta分析的结果见表3,森林图见图1。说明VEGF-A过表达对OS有统计学意义,VEGF-C过表达对OS及DFS有统计学意义,但VEGF-C对DFS纳入文献较少,需谨慎分析。VEGF-D仅纳入1篇文献,无法进行分析。
2.3发表偏倚用Egger’s法和Begg’s法评估发表偏倚。OS按照VEGF亚型A、C不同,Egger’s法(Begg’s法)发表偏倚的P值分别为0.71(0.19)、0.50(0.11)。DFS按照VEGF亚型A、C不同,发表偏倚的P值分别为0.60(0.90)、0.32(-)。并用Egger’s法做漏斗图,均未发现明显偏倚。见图2。
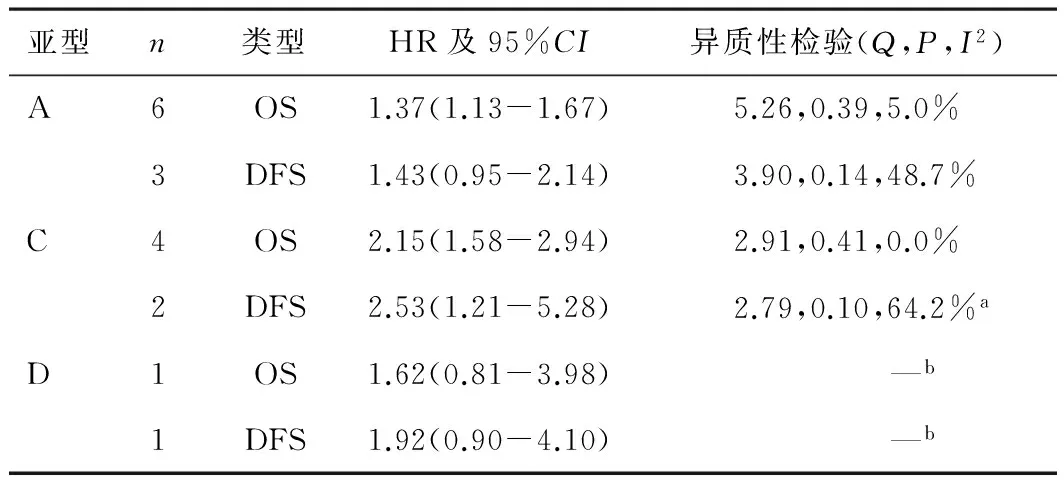
表3 HR及95%CI和异质性检验结果
注:a示P<0.1,异质性明显;b示样本量太小。
4讨论
VEGF家族成员分别参与促进人体内重要的两个生理活动,血管生成与淋巴管生成。当肿瘤细胞向血管形成表型转化的时候,肿瘤便开始发生、发展。VEGF-A可以是一种同源二聚体,也可以与VEGF-B或非VEGF因子(如胎盘生长因子PGF)形成异源二聚体。VEGF-A和B主要通过结合并激活血管内皮细胞上的受体VEGFR-1/Flt 1和VEGFR-2/KDR/Flk 1促血管生成。另一方面,作为VEGFR-2和VEGFR-3配体的VEGF-C和D主要参与促淋巴管生成及血管生成。
国内已有Meta分析讨论过VEGF过表达与头颈部鳞癌、肺癌、结肠癌和肝细胞癌的关系。1篇讨论VEGF与胃癌生物学行为的关系,1篇讨论VEGF-C与生物学行为及5年生存率的关系。但纳入文献仅限于亚洲,大多为中文文献,且生存率信息较少。另外,新辅助治疗能显著改善预后,而已有的Meta分析均未排除这个重要因素。本文排除新辅助治疗病例后纳入13篇文献,12篇来源于亚洲,1篇来源于非亚洲国家,共2 251例患者。Meta分析结果表示VEGF-A过表达对OS有统计学意义,VEGF-C过表达对OS及DFS有统计学意义。VEGF-D仅纳入1篇文献,无法进行分析,但原文结论提示其过表达对OS及DFS均无影响。

A:以VEGF-A的OS作森林图; B:以VEGF-A的DFS作森林图;C:以VEGF-C的OS作森林图;D:以VEGF-C的DFS作森林图。
图1森林图结果
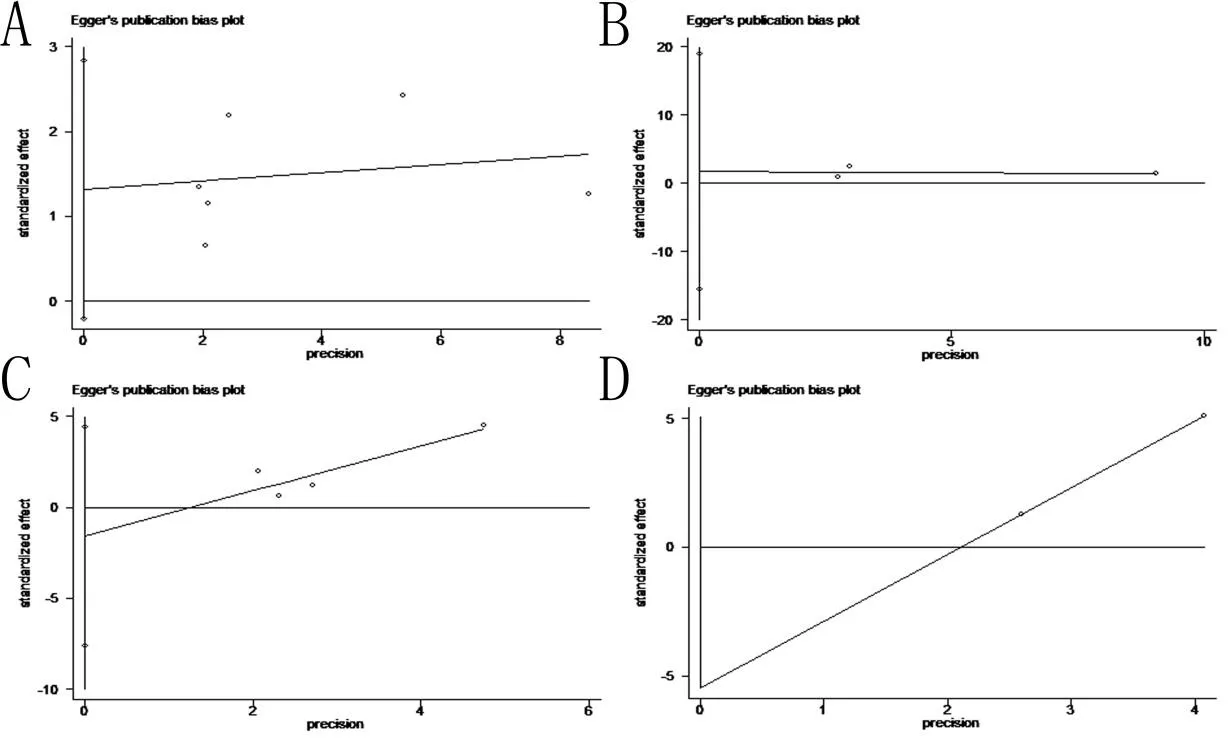
A:以VEGF-A的OS作漏斗图;B:以VEGF-A的DFS作漏斗图;C:以VEGF-C的OS作漏斗图;D:以VEGF-D的DFS作漏斗图。
图2漏斗图结果
随着肿瘤血管生成研究的深入,以及正性调节因子,血管内皮生长因子及碱性成纤维生长因子的发现,抗血管生成通路药物开始应用于临床。这些药物主要靶向VEGFR-2,如贝伐珠单抗、人源化抗VEGF-A单克隆抗体,以及索拉菲尼和舒尼替尼等小分子抑制物,却不能影响VEGF-D与VEGFR-3和(或)VEGFR-2的作用过程。因此直接阻滞或干扰VEGF-C信号通路可能是抑制肿瘤转移的有效方法,从而改善预后。
Meta分析中的异质性问题是十分复杂的,一个潜在的偏倚原因与HR外推法有关。如果文献未直接提供统计量HR及95%CI,则通过所给数据,如5年生存率,进行计算。如果依然不可行,则通过生存曲线计算,这个过程必然需要做一些删改。本文主要提取多因素生存分析数据及K-M生存曲线数据,结果未检测到异质性存在。此外,VEGF过表达的准确价值应当由合适的多因素分析来判断。由于样本量限制,已发表的Meta分析及本文均未对此项进行限制。发表偏倚对所有Meta分析来说都是一个重要问题,本文未检测到发表偏倚,获得的合并统计量接近于实际均值。但是,本文仅纳入英文和中文发表的文献,这可能引入语言偏倚。
综上,本文评价了VEGF-A、VEGF-C、VEGF-D过表达和非新辅助治疗胃癌患者预后之间的关系,VEGF-A过表达与较差的OS相关,VEGF-C过表达与较差的OS和DFS相关,是胃癌患者的不良预后因素。纳入文献均未检测到明显异质性及发表偏倚。当然,设计合理的前瞻性研究,以及完善的预后标志物标准化评估方案,有助于探索VEGF过表达与胃癌预后的关系。
参考文献
[1]Chen L,Shi Y,Yuan J,et al.HIF-1 alpha overexpression correlates with poor overall survival and disease-free survival in gastric cancer patients post-gastrectomy[J]. PLoS One,2014,9(3):90678.
[2]Chen J,Zhou S J,Zhang Y,et al.Clinicopathological and prognostic significance of galectin-1 and vascular endothelial growth factor expression in gastric cancer[J].World J Gastroenterol,2013,19(13):2073-2079.
[3]Wang X,Cao W,Mo M,et al.VEGF and cortactin expression are independent predictors of tumorrecurrence following curative resection of gastric cancer[J].J Surg Oncol,2010,102(4):325-330.
[4]Isobe T,Aoyagi K,Koufuji K,et al.Clinicopathological significance of hypoxia-inducible factor-1 alpha (HIF-1α) expression in gastric cancer[J].Int J Clin Oncol,2013,18(2):293-304.
[5]He W,Tang B,Yang D,et al.Double-positive expression of high-mobility group box 1 and vascular endothelial growth factor C indicates a poorer prognosis in gastric cancer patients[J]. World J Surg Oncol,2013,11:161.
[6]Gou H F,Chen XC,Zhu J,et al.Expressions of COX-2 and VEGF-C in gastric cancer:correlations with lymphangiogenesis and prognostic implications[J].J Exp Clin Cancer Res,2011,28(30):14.
[7]Han F H,Li H M,Zheng D H,et al.The effect of the expression of vascular endothelial growth factor (VEGF)-C and VEGF receptor-3 on the clinical outcome in patients with gastric carcinoma[J].Eur J Surg Oncol,2010,36(12):1172-1179.
[8]Zhan H,Liang H,Liu X,et al.Expression of Rac1,HIF-1α,and VEGF in gastric carcinoma:correlation with angiogenesis and prognosis[J]. Onkologie,2013,36(3):102-107.
[9]Wang X L,Fang J P,Tang R Y,et al.Different significance between intratumoral and peritumoral lymphatic vessel density in gastric cancer:a retrospective study of 123 cases[J].BMC cancer,2010,10:299.
[10]Xie L X,Zhai T T,Yang L P,et al.Lymphangiogenesis and prognostic significance of vascular endothelial growth factor C in gastro-oesophageal junction adenocarcinoma[J]. Int J Exp Pathol,2013,94(1):39-46.[11]Mohri Y,Miki C,Tanaka K,et al.Clinical correlations and prognostic relevance of tissue angiogenic factors in patients with gastric cancer[J]. Clin Oncol (R Coll Radiol),2012,24(9):610-616.
[12]Wang J,Yang S,Zhang H,et al.Aurora-A as an independent molecular prognostic marker in gastric cancer[J]. Oncol Rep,2011,26(1):23-32.
[13]Lastraioli E,Boni L,Romoli M R,et al.VEGF-A clinical significance in gastric cancers:immunohistochemical analysis of a wide Italian cohort[J].Eur J Surg Oncol,2014,40(10):1291-1298.
A meta-analysis: correlation of the prognosis with VEGF-A/C/D overexpression in gastric cancer
Lu Shuojun,Qin Yanru,Chang Zhiwei
(DepartmentofClinicalOncology,theFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052,China)
【Abstract】ObjectiveTo expore the correlation of the prognosis with VEGF-A/C/D overexpression in gastric cancer by Meta-analysis. MethodsRelevent literature was identified using data base and surviving data were collected. Meta-analysis of HR were performed to review the correlation of VEGF subtypes overexpression with survival of gastric cancer. ResultsThis Meta-analysis included 25 studys. Merged HR suggested that the overexpression of VEGF-A, VEGF-C had adverse effects on overall survival (OS) and disease free survival (DFS). Merged HR and 95% were 1.37(1.13, 1.67), 1.43(0.95, 2.14); 2.15(1.58, 2.94), 2.56(1.21, 5.28), respectively. ConclusionVEGF-A, VEGF-C were all associated with poor prognosis in gastric cancer.
【Key words】vascular endothelial growth factor;gastric cancer;prognosis;Meta-analysis
通讯作者:秦艳茹,E-mail:yanruqin@zzu.edu.cn。
【中图分类号】R 735.2
doi:10.3969/j.issn.1004-437X.2016.05.005
(收稿日期:2016-01-09)
