自噬对鼻咽癌细胞CNE2放疗敏感性的调节作用
2016-07-18李宝秀方喜生毛海波关明媚刘国龙
李宝秀 方喜生 张 敏 毛海波 关明媚 刘国龙
1 广州医科大学附属广州市第一人民医院肿瘤科(广州 510180) 2 广东药科大学公共卫生学院(广州 510310)
自噬对鼻咽癌细胞CNE2放疗敏感性的调节作用
李宝秀1方喜生1张敏2毛海波1关明媚1刘国龙1
1广州医科大学附属广州市第一人民医院肿瘤科(广州 510180) 2广东药科大学公共卫生学院(广州 510310)
【摘要】目的探讨自噬激活剂和自噬抑制剂分别对鼻咽癌细胞CNE2放疗敏感性的影响。方法利用RNA干扰技术使atg5基因沉默,构建自噬抑制细胞模型后,与雷帕霉素、氯喹分别处理的两组细胞一起,每天以X射线5Gy照射细胞,连续8天观察各组细胞的生长状况,并设置对照组。以MTT法及克隆集落形成法检测其细胞活力,用流式细胞仪分析其细胞周期。结果与对照组相比,其他三组细胞存活率、克隆形成率、照射后存活率均显著降低(P<0.05);细胞周期检测除对照组外其他三组细胞集中在G0/G1期,其他两个时期比G0/G1期相对较少。结论自噬抑制剂与激活剂和atg5沉默均能为CNE2放疗增敏,然而自噬激活剂的增敏效果好于其他,为增敏放疗提供实验依据,开辟新的放疗增敏途径。
【关键词】自噬鼻咽癌放疗敏感性雷帕霉素氯喹
自噬(autophagy)是一种细胞在能量缺乏、代谢等压力下的自我降解过程[1-2]。自噬不仅具有维持细胞自我稳态、促进细胞生存的作用,过度上调的自噬作用也可以引起细胞死亡,即“自噬性细胞死亡”[3]。放疗可诱导自噬,自噬对放疗敏感性的调节作用尚不清楚[4]。本研究通过体外实验干预鼻咽癌自噬后联合或单独放疗对鼻咽癌细胞的影响,明确鼻咽癌自噬现象与放疗的关系,为增敏放疗提供实验依据,开辟新的放疗增敏途径。
1材料与方法
1.1材料与仪器胎牛血清(Hyclone)、青霉素、链霉素、谷氨酰胺、雷帕霉素、氯喹、RPMI-1640培养基、MTT粉(上海生物工程技术服务有限公司)、DNA提取试剂盒、PCR试剂盒、质粒抽提试剂盒、RNAi试剂盒(亚诺法生技股份有限公司)、Rayto RT-6100C酶联免疫检测仪、PCR仪(ABI公司)、三气培养箱(SANYO公司)、激光共聚焦显微镜、直线加速器(西门子公司)、流式细胞仪分析。
1.2细胞及其培养人鼻咽癌细胞株CNE2由中山大学肿瘤防治中心提供;用加10%胎牛血清的RPMI-1640培养基(含10 μg/mL青霉素和10 μg/mL链霉素、2 mmol/mL谷氨酰胺)于36℃、7.5%CO2、95%空气(常氧)饱和湿度恒温培养箱培养;取对数生长期细胞进行试验。
1.3试验方法
1.3.1RNAi建模自噬相关基因atg5是自噬延长阶段的关键分子。atg5 RNAi包括质粒构建和质粒的转染与siRNA。①重组质粒构建:细胞基因 DNA抽离确定目的基因;设计特异性引物;PCR扩增相应片段;目的片段的回收纯化;酶切反应;连接反应;构建质粒;质粒转化;质粒小量提取;重组质粒测序鉴定;质粒大量提取。②质粒的转染与siRNA:在6孔板中每孔接种 1×105个CNE2鼻咽癌细胞于完全培养基中细胞生长至40%~60%融合期。取重组DNA 4 mg及脂质体10 mL转染细胞24 h后更换完全培养基继续培养。48 h后用选择性培基(G418浓度: 1~3 d为250 mg/L以后为550 mg/L)筛选抗性克隆18 d后挑单个克隆扩大培养建成稳定传代的atg5 RNAi转染细胞系。
1.3.2实验分组对照组、mTOR抑制剂雷帕霉素+放疗组、氯喹+放疗组及atg5 RNAi+放疗组。将处于对数生长期的CNE2细胞传代离心,调整细胞浓度为3×105个/mL,接种于96孔板中,90 μL/孔。4组处理分别为放疗组,雷帕霉素联合放疗组,氯喹联合放疗组及atg5 RNAi细胞联合放疗组。分组将细胞各取1×104个接种于24孔板内每隔24h消化3孔细胞计数每孔计数3遍取均值;放疗采用加速器6mv X光子线5Gy/次×1~2次。共记数8 d的细胞生长情况,以细胞数为纵坐标时间为横坐标绘出生长曲线。
1.3.3四唑盐(MTT)比色法检测细胞活力按细胞培养步骤操作Rayto RT-6100C酶联免疫检测仪上测定各孔490 nm波长处的吸光度A值。软琼脂集落形成:配制5 g/L的底层琼脂凝固后将含单细胞的3.3 g/L 顶层琼脂培养液接种于底层琼脂上每种细胞接种5皿接种密度为2.0×104细胞/平皿。在含7.5% CO2的37℃生化培养箱中培养15 d计算平均集落形成率。克隆形成率=克隆数/接种细胞数×100%,照射后存活率(SF)=照射后每孔集落形成数/对照组集落形成数×100%。
1.3.4流式细胞仪分析细胞周期取生长状态良好融合至70%~80%的各组细胞PBS洗涤两次,乙醇固定调节细胞浓度至1×109/L加入PI染液流式细胞仪分析细胞群体在细胞周期各个时相的分布比例。

2结果
2.1四组细胞自噬活性对放疗敏感性的影响对照组CNE2细胞存活率为98.23%,雷帕霉素、氯喹和atg5 RNAi组细胞存活率分别是37.8%、66.10%和58.32%,实验组CNE2细胞存活率低于对照组(F=32.06,P<0.001);对照组CNE2细胞克隆形成率为82.31%,雷帕霉素、氯喹和atg5 RNAi组细胞克隆形成率分别是17.84%、40.70%和39.98%,各实验组细胞克隆形成率均低于对照组(F=45.27,P<0.001);而CNE2细胞照射后的存活率(71.28%)也高于雷帕霉素、氯喹和atg5 RNAi组的照射后存活率(分别是28.54%、42.87%以及43.53%)(F=20.65,P<0.001)。见表1。雷帕霉素比氯喹和atg5基因沉默两组下降更明显,表明其能更有效提升CNE2放疗敏感性,见图1。
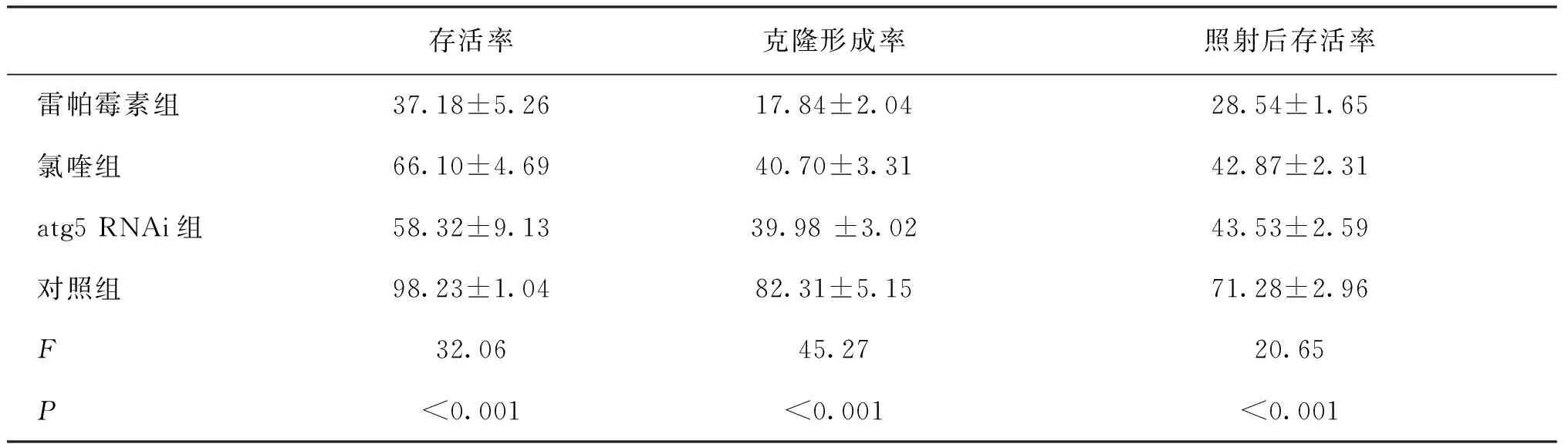
表1 不同处理的四组CNE2细胞放疗后存活率、克隆形成率和照射后存活率比较 %
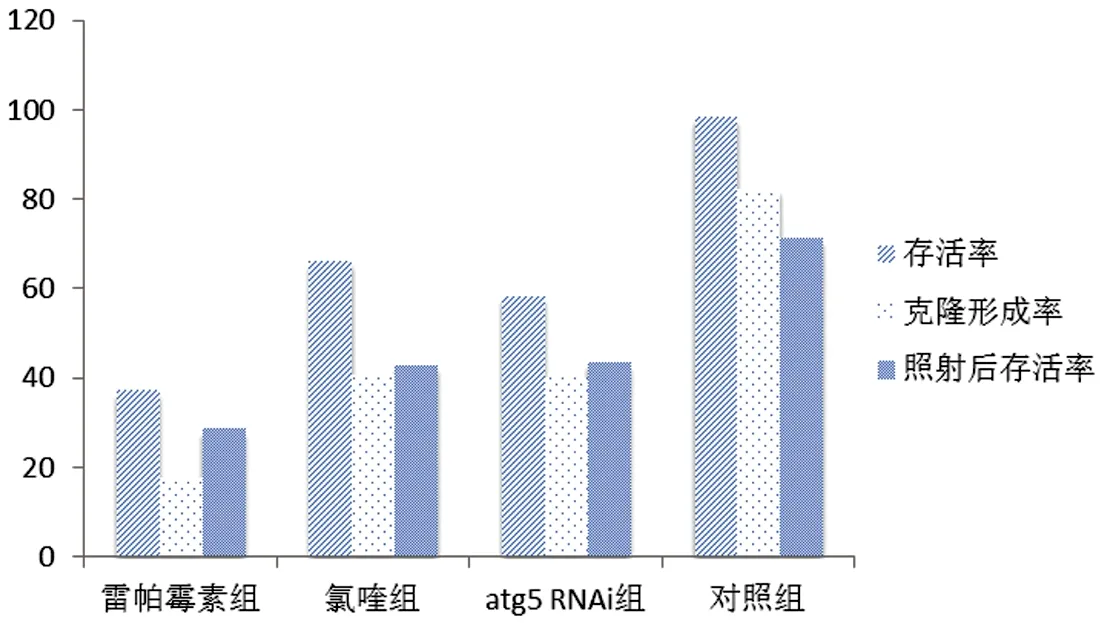
图1 四组CNE2细胞存活率、
2.2 各组细胞周期细胞分布情况 从G0/G1期到S期和G2/M期,各组细胞分布比例呈下降趋势(F=26.72,P<0.001);而不同组间细胞分布比例差别也有统计学意义(F=6.34,P=0.021);而时间与组别之间交互作用有统计学意义(F=5.51,P=0.032);雷帕霉素组不同时期下降速度最快,而对照组下降速率较慢。结果见表2及图2。
表2实验组和对照组细胞周期细胞分布比例 %
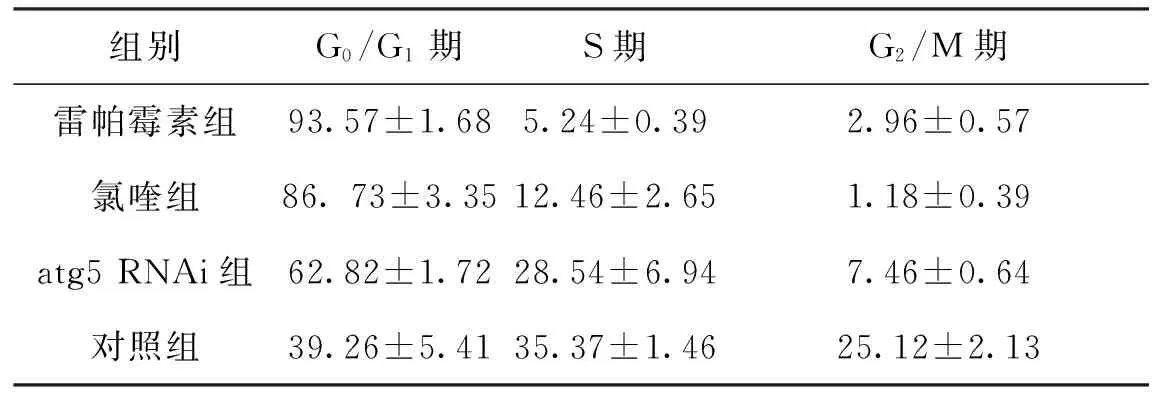
组别G0/G1期S期G2/M期雷帕霉素组93.57±1.685.24±0.392.96±0.57氯喹组86.73±3.3512.46±2.651.18±0.39atg5RNAi组62.82±1.7228.54±6.947.46±0.64对照组39.26±5.4135.37±1.4625.12±2.13
3讨论
鼻咽癌是我国常见癌症之一,全世界鼻咽癌病例中80%发生于我国。广东是全世界鼻咽癌发病率最高的地区,占全国的60%,因而鼻咽癌又称为“广东癌”[5-7]。放射治疗是鼻咽癌的主要治疗手段。Ⅰ-Ⅳ期鼻咽癌的5年生存率平均在50%左右,而中晚期者仅为20%~30%,20%的鼻咽癌经过以放射治疗为主的综合治疗后出现局部复发。鼻咽癌放疗后的局部复发和远处转移是病人死亡的主要原因,因此除了要改进放疗技术,应当从鼻咽癌发生发展的新分子机制和放射抵抗机制着手[8],目前自噬已经成为国际上生命科学研究的热点。
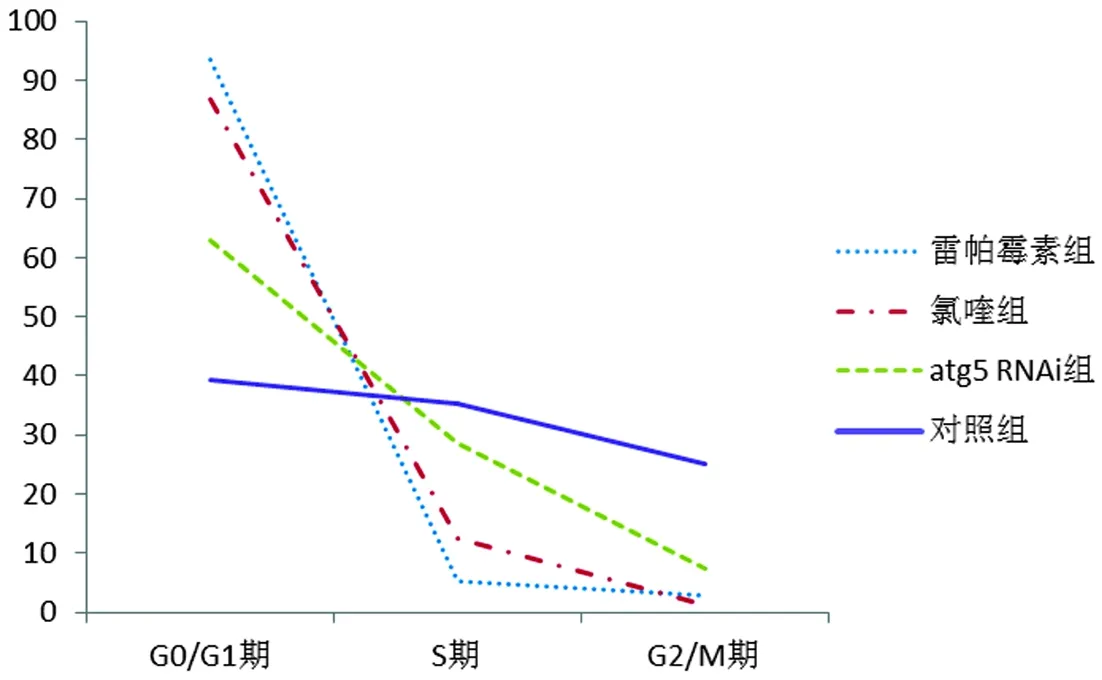
图2 实验组和对照组细胞周期细胞分布比例(%)
有研究表明,PmTOR是自噬启动阶段的关键分子,是一种丝氨酸/苏氨酸激酶,可感受细胞内氨基酸和ATP变化,控制细胞自噬[9]。PmTOR主要通过PI3K/AKT/mTOR途径抑制自噬,促进肿瘤发展:如胰岛素、生长因子等通过酪氨酸激酶受体,激活ClassⅠPI3K,使PIP被磷酸化为PIP3,后者激活AKT,活化的AKT可以磷酸化TSC2,增加具有mTOR结合活性的GTP-Rheb,使mTOR活性增强,抑制自噬的发生。从而雷帕霉素能抑制mTOR活性,因而促进细胞自噬[10]。在本研究中,雷帕霉素抑制mTOR活性强于其他组,且随时期的变化而迅速抑制到较低水平,与其他研究一致[9-10]。我们可以认为mTOR抑制剂雷帕霉素能通过促进自噬增强CNE2的放疗敏感性。
氯喹(Chloroquine,CQ)为4-氨基喹啉类,最初用来治疗疟疾,以后用途逐渐扩大。1951年,用于治疗类风湿关节炎,有一定效果。此药还可以用于肝阿米巴病、华支睾吸虫病、肺吸虫病、结缔组织病(盘状红斑狼疮及系统性红斑狼疮)及光敏性疾患如日盼红斑症等。近来的研究表明CQ通过抑制自噬、促进凋亡等机制逆转肿瘤放化疗抵抗及增加免疫治疗敏感性从而抗肿瘤[8,11]。而自噬相关基因atg5是自噬延长阶段的关键分子,atg5复合物对自噬泡的形成至关重要,是自噬过程中膜的延伸所必需的,而且LC3-II的形成依赖于atg12-atg5复合物,干扰atg5基因表达就可以阻滞自噬的形成[10]。有研究表明氯喹与核蛋白有较强的亲和力,喹啉环上带负电的7—氯基与DNA的鸟嘌呤上的2—氨基吸引,使氯喹插入到DNA的双螺旋之间,阻碍DNA复制与转录[12]。本研究也表明氯喹与核蛋白组均能抑制mTOR活性,其抑制效果两组接近。
虽然两组的抑制效果接近,但本研究表明氯喹的抑制速度要强于atg5 RNAi组。这可能是因为氯喹与核蛋白有较强的结合力,更容易通过喹啉环上带负电的7—氯基插入到DNA的双螺旋两股之间与DNA形成复合物,从而更快的阻止DNA的复制与RNA转录。有研究表明联合使用氯喹和atg5 RNAi可更近一步增强CNE2的放疗敏感性[13],但其机制有待进一步研究。
综上所述,本研究通过体外实验干预鼻咽癌自噬后联合或单独放疗对鼻咽癌细胞的影响,表明增强和抑制自噬作用对鼻咽癌细胞CNE2均能增加放疗敏感性,有效为增敏放疗提供了实验依据,开辟新的放疗增敏途径并阐明自噬的分子机制在鼻咽癌治疗中的作用,为针对自噬信号通路的靶向治疗手段的设计及放疗抗拒的克服提供实验依据。
参考文献:
[1] CHIARINI F, EVANGELISTI C, MCCUBREY JA, et al. Current treatment strategies for inhibiting mTOR in cancer[J]. Trends in pharmacological sciences,2015,36(2): 124-135.
[2] LEVERSON JD, ZHANG H, CHEN J, et al. Potent and selective small-molecule MCL-1 inhibitors demonstrate on-target cancer cell killing activity as single agents and in combination with ABT-263 (navitoclax)[J]. Cell death & disease, 2015, 6(1): e1590.
[3] PERRI F, PEZZULLO L, CHIOFALO MG, et al. Targeted therapy: A new hope for thyroid carcinomas[J]. Critical reviews in oncology/hematology, 2015, 94(1): 55- 63.
[4] MORTENSEN DS, PERRIN-NINKOVIC SM, SHEVLIN G, et al. Optimization of a series of triazole containing mammalian target of rapamycin (mTOR) kinase inhibitors and the discovery of CC-115[J]. Journal of medicinal chemistry, 2015, 58(14): 5599-5608.
[5] 南岩东, 姜华, 金发光, 等. S100A6 基因干扰对 A549 肺腺癌细胞生物学行为的影响[J]. 国际肿瘤学杂志, 2016, 43: 161-166.
[6] GALLO M, MICHELON F, CASTIGLIONE A, et al. Sorafenib treatment of radioiodine- refractory advanced thyroid cancer in daily clinical practice: a cohort study from a single center[J]. Endocrine, 2015, 49(3): 726-734.
[7] 成军. 现代细胞自噬分子生物学[M]. 北京: 科学出版社, 2011.
[8] SOLOMON VR, LEE H. Chloroquine and its analogs: a new promise of an old drug for effective and safe cancer therapies[J]. Eur J Pharmacol,2009,25;625(1-3):220-233.
[9] HIRATA Y, YAMAMOTO H, ATTA MS,et al. Chloroquine inhibits glutamate-induced death of a neuronal cell line by reducing reactive oxygen species through sigma-1 receptor[J]. J Neurochem,2011,119(4):839-847.
[10] DI CORATO R, BÉALLE G, KOLOSNJAJ-TABI J, et al. Combining magnetic hyperthermia and photodynamic therapy for tumor ablation with photoresponsive magnetic liposomes[J]. ACS nano, 2015, 9(3): 2904-2916.
[11] GUGLIELMELLI T, GIUGLIANO E, BRUNETTO V, et al. mTOR pathway activation in multiple myeloma cell lines and primary tumour cells: pomalidomide enhances cytoplasmic-nuclear shuttling of mTOR protein[J]. Oncoscience, 2015, 2(4): 382.
[12] ZOIS CE, KOUKOURAKIS MI. Radiation-induced autophagy in normal and cancer cells: towards novel cytoprotection and radio-sensitization policies[J]. Autophagy, 2009,5(4):442- 450.
[13] IKARI A, TAGA S, WATANABE R, et al. Clathrin-dependent endocytosis of claudin-2 by DFYSP peptide causes lysosomal damage in lung adenocarcinoma A549 cells[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 2015, 1848(10): 2326-2336.
The regulatory effects of autophagy to the CNE2 cells radio-sensitization
LiBaoxiu,FangXisheng,MaoHaibo,etal.
DepartmentofOncology,GuangzhouFirstPeople’sHospital,GuangzhouMedicalUniversity,Guangzhou510180,China
ZhangMin.
SchoolofPublicHealth,GuangdongPharmaceuticalUniversity,Guangzhou510310,China
【Abstract】ObjectiveThis study aimed to investigate the autophagy activators and inhibitors effects in nasopharyngeal CNE2 cells radiotherapy sensitization.MethodsAtg5 gene silencing by RNA interference technology, two groups of cell autophagy inhibition were built by rapamycin and chloroquine respectively. Then 5Gy x-ray irradiation of cells was taken every day, after 8 days in a row in each group of cell growth and setting a control group. The cell viability was clonaled colony formation by MTT method assay and cell cycle by flow cytometry analysis.ResultsThe three cell group survival rate, colony-forming rate and survival after irradiation were significantly lower (P<0.05) than the control group. Detection of cell cycle in addition to control three other groups concentrated in the G0/G1 period.That of two other periods was relatively fewer than that of the G0/G1 period. Conclusion Autophagy inhibitors, activators and atg5 silence improved the radio-sensitization to CNE2. The autophagy activator group improving the sensitivity was better than the others.This study provided evidence to sensitive radiotherapy, explored a new promising radiosensitization ways.
【Key words】Aotophagy; CNE2; Radio-sensitization;Rapamycin;Chloroquine
基金项目:2012年广东省科技计划基金(01078650166731031);2011年度广东省医学科研基金(A2011469) ;2011年度广州市医药卫生科技一般引导项目(201102A213075)
通信作者:刘国龙,E-mail:liugl@fimmu.com
DOI:10.3969/j.issn.1000-8535.2016.03.002
(收稿日期:2016- 03- 25)
