毛细管电泳分离氟西汀对映体
2016-07-18杨思文代语林何建波朱燕舞
杨思文,代语林,邓 宁,王 燕,何建波,朱燕舞
(合肥工业大学 化学与化工学院,安徽 合肥 230009)
毛细管电泳分离氟西汀对映体
杨思文,代语林,邓宁,王燕,何建波,朱燕舞
(合肥工业大学 化学与化工学院,安徽 合肥230009)
摘要:文章建立了在毛细管电泳中以离子液体三甲基羟乙基双三氟甲磺酰亚胺盐(HOEtN1,1,1NTF2)和羧甲基-β-环糊精(CM-β-CD)联用分离氟西汀对映体的毛细管电泳新方法。在检测波长为226 nm,高差为10 cm,进样10 s的条件下,考察了CM-β-CD的浓度、HOEtN1,1,1NTF2、背景缓冲液及其pH值、分离电压等实验条件对氟西汀对映体拆分的影响。获得了氟西汀对映体分离的最佳实验条件为:在15 mmol/L pH值为 8.5磷酸盐缓冲液中添加30 mmol/L HOEtN1,1,1NTF2和10 g/L CM-β-CD,分离电压为20 kV。在最佳实验条件下,氟西汀对映体在11 min内实现了基线分离,分离度为2.33。该方法操作简便、分析快速、分离效果好,适用于分离氟西汀对映体。
关键词:离子液体;羧甲基-β-环糊精;毛细管电泳;对映体分离;氟西汀
氟西汀(fluoxetine)为选择性5-羟色胺再摄取抑制剂(SSRIs),目前广泛应用于治疗抑郁症,属于第二代抗抑郁药[1]。氟西汀有一个手性中心,虽然R型和S型异构体药效相同,但R型比S型作用时间长3倍,并且可以预防偏头疼[2-3],所以基于原料药的质量控制及药效研究,对氟西汀对映体进行手性分离研究具有重要意义。
毛细管电泳法(capillary electrophoresis,CE)具有灵敏度高、分析快速、样品消耗小等优点,近几年在拆分药物对映体领域应用广泛。而羧甲基-β-环糊精(CM-β-CD)是毛细管电泳分离手性药物时常用的手性选择剂[4-5]。文献[6-7]利用手性选择剂CM-β-CD分离氟西汀对映体,通过CM-β-CD与氟西汀对映体产生疏水包络作用、氢键作用和离子间静电作用,分别在45 min和16 min内实现基线分离。由于离子液体具有导电性高、溶解性好及毒性小等特殊的理化性质,作为背景缓冲液添加剂广泛应用于高效毛细管电泳中[8-10]。但目前以离子液体和CM-β-CD联用拆分氟西汀对映体的研究不多。
本文采用离子液体三甲基羟乙基双三氟甲磺酰亚胺盐(HOEtN1,1,1NTF2)和CM-β-CD共同作为毛细管电泳背景缓冲液添加剂分离氟西汀对映体,考察了CM-β-CD的质量浓度、HOEtN1,1,1NTF2、背景缓冲液的浓度及其pH值、分离电压等条件对氟西汀对映体分离的影响,获得了分离氟西汀对映体的最佳电泳条件。实验结果表明:添加离子液体HOEtN1,1,1NTF2能提高氟西汀对映体的分离度;在最佳电泳条件下,氟西汀对映体在11 min内实现了基线分离,与文献[6]的研究结果相比,在HOEtN1,1,1NTF2和CM-β-CD共同作用下,氟西汀对映体分析时间缩短。
1试验部分
1.1仪器与试剂
配置高压电源的CL1020高效毛细管电泳仪、CL1020紫外检测器、HW-2000色谱工作站(北京彩陆科学仪器公司);TG328A分析天平(上海精密科学仪器有限公司);PHS-3CT酸度剂(上海雷磁仪器厂);SZ-93自动双重纯水蒸馏器(上海亚荣生化仪器厂);未涂层熔融石英毛细管柱(50 cm×50 μm,河北永年锐沣色谱器件有限公司)。
盐酸氟西汀(法国Patheon公司);三甲基羟乙基双三氟甲磺酰亚胺盐(上海成捷化学有限公司);羧甲基-β-环糊精(上海将来实业股份有限公司);十二水合磷酸氢二钠(Na2HPO4·12H2O)、磷酸、盐酸、氢氧化钠、硫脲,均为分析纯(国药集团化学试剂有限公司);实验用水均为二次去离子水。
1.2溶液的配制
(1)背景缓冲液(background electrolyte solution,BGE)的配制。用二次蒸馏水配制一定浓度的磷酸盐缓冲溶液,加入CM-β-CD和HOEtN1,1,1NTF2,用磷酸调节至所需的pH值。BGE使用前用孔径为0.45 μm的微孔滤膜过滤。
(2)样品溶液的配制。称取一定量的盐酸氟西汀用无水乙醇溶解,配制成1.0 g/L样品储备溶液,实验使用前将其稀释成0.20 g/L样品溶液,用孔径为0.45 μm的微孔滤膜过滤。
1.3试验方法
开机前,毛细管依次用1 mol/L的盐酸溶液冲洗5 min,水冲洗5 min,1 mol/L氢氧化钠溶液冲洗10 min,水冲洗5 min,BGE冲洗10 min。每2次进样之间毛细管用BGE冲洗3 min。
采用10 cm高差进样,进样时间为10 s,检测波长为226 nm。
2结果与讨论
2.1CM-β-CD质量浓度对拆分的影响
由于手性药物的手性中心在空间的取向不同,且CM-β-CD与手性药物形成配合物的稳定常数不同,因此可通过对映体电泳迁移速度差异的增加达到拆分目的[11-12]。本文考察了CM-β-CD质量浓度对手性分离的影响,在BGE含20 mmol/L pH值为8.5 Na2HPO4-H3PO4和30 mmol/L HOEtN1,1,1NTF2,分离电压为20 kV,检测波长为226 nm,进样时间为10 s的条件下,分离度随CM-β-CD质量浓度变化的情况如图1所示。从图1可以看出,当CM-β-CD的质量浓度从0 g/L增大到10 g/L时,氟西汀对映体的分离度逐渐增大,但是当CM-β-CD的质量浓度大于10 g/L时,氟西汀对映体的分离度开始减小,这是由于分离电流增大产生过度的焦耳热效应导致分离度下降。因此,选择缓冲液中添加CM-β-CD的最佳质量浓度为10 g/L。
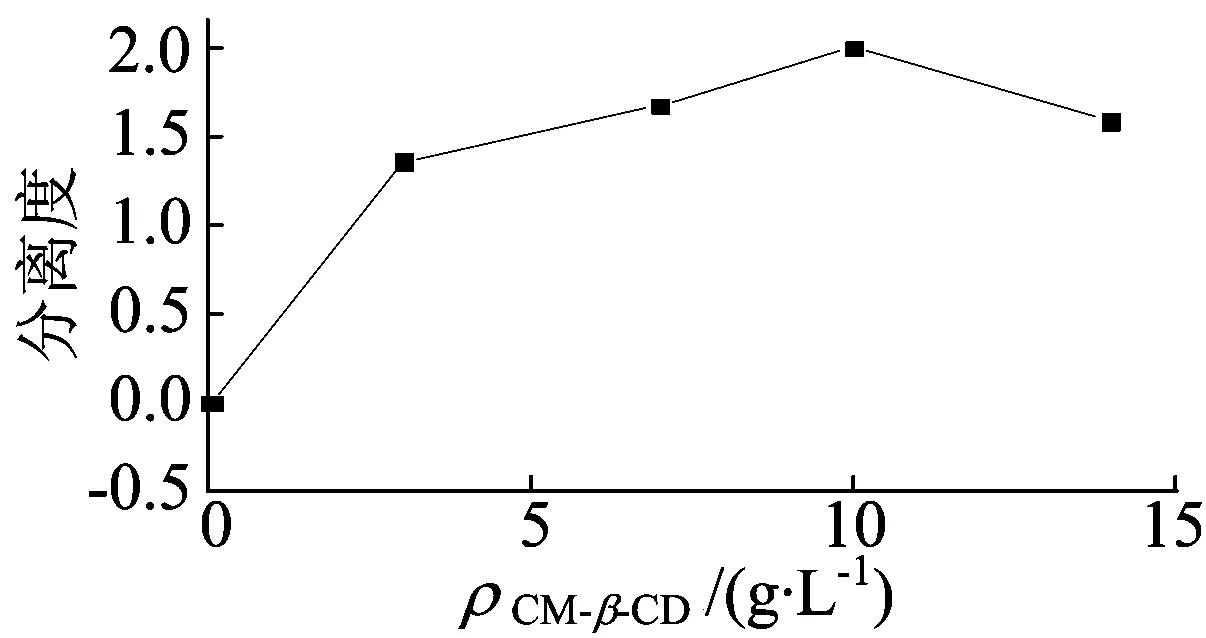
图1 CM-β-CD质量浓度对分离度的影响
2.2离子液体浓度对拆分的影响
本文考察了离子液体HOEtN1,1,1NTF2作为缓冲溶液的添加剂对氟西汀对映体的分离影响。在BGE含20 mmol/L pH值为8.5 Na2HPO4-H3PO4和10 g/LCM-β-CD,分离电压为20 kV,检测波长为226 nm,进样时间为10 s的条件下,加入离子液体前后分离氟西汀对映体的电泳谱图如图2所示,其中F1和F2代表氟西汀对映体的2个色谱峰。从图2可以看出,在不添加离子液体,单独使用CM-β-CD作为手性选择剂的情况下,氟西汀对映体未能实现基线分离。
在以30 mmol/L HOEtN1,1,1 NTF2和CM-β-CD共同作为背景缓冲液添加剂的情况下氟西汀对映体的分离图如图2所示。
从图2可以看出,背景缓冲液中加入离子液体HOEtN1,1,1NTF2提高了氟西汀对映体分离度,在该实验条件下,氟西汀对映体在8 min内实现了基线分离,分离度为2.00。实验可能的作用机理是离子液体HOEtN1,1,1NTF2可以促进手性药物与CM-β-CD之间的相互作用[13-14],使对映体在毛细管中的电泳行为差异变大,从而提高对映体的分离度。
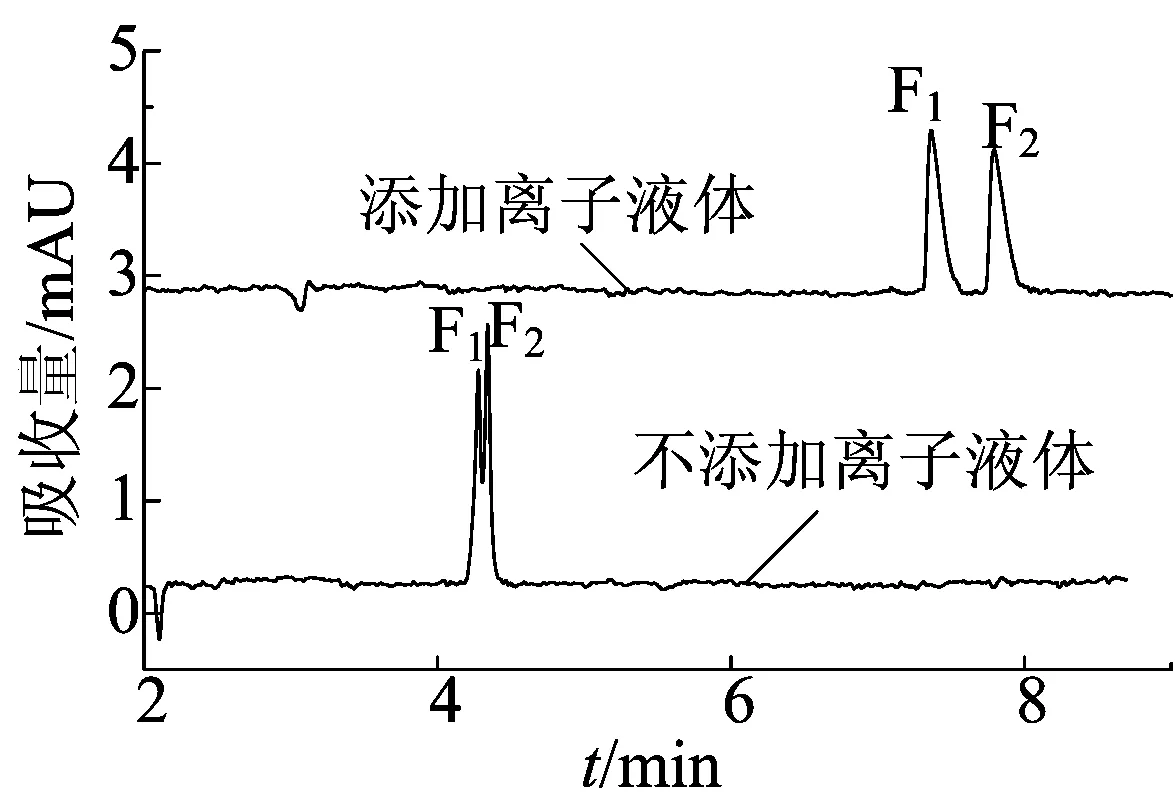
图2 氟西汀的分离谱图
在BGE含20 mmol/L pH值为 8.5 Na2HPO4-H3PO4和10 g/L CM-β-CD,分离电压为20 kV,检测波长为226 nm,进样时间为10 s的条件下,改变添加HOEtN1,1,1NTF2的浓度时,分离度随离子液体浓度的变化情况如图3所示。
由图3可看出,当HOEtN1,1,1NTF2的浓度从0 mmol/L增大到30 mmol/L时,氟西汀对映体分离度逐渐增大,这是由于离子液体HOEtN1,1,1NTF2可以提高对映体的分离度;但HOEtN1,1,1NTF2的浓度从30 mmol/L增大到40 mmol/L,氟西汀对映体的分离度呈下降趋势,这是由于离子液体浓度的增大,BGE离子强度增加,导致分离电流增大,由于焦耳热(Q)与分离电流(I)平方成正比例关系,所以分离电流增大导致焦耳热急剧增加,从而引起分离峰展宽,分离度降低。
因此,选择HOEtN1,1,1NTF2的最优浓度为30 mmol/L。
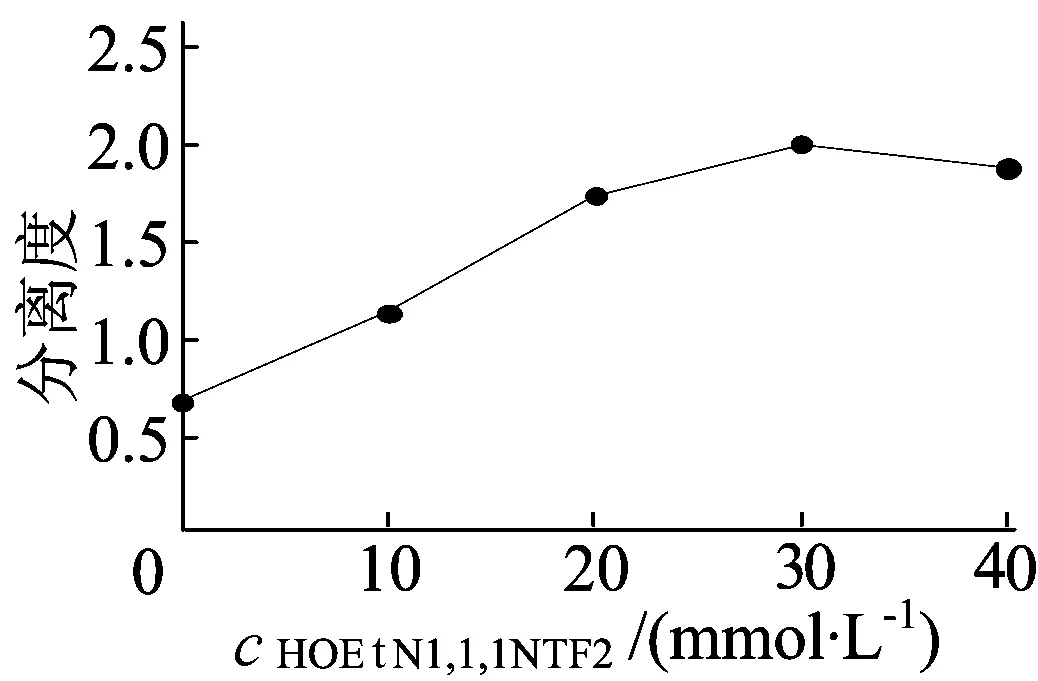
图3 离子液体浓度对分离度的影响
2.3背景缓冲液浓度对拆分的影响
背景缓冲液浓度是影响对映体分离度的主要参数之一。在BGE含pH值为 8.5 Na2HPO4-H3PO4和30 mmol/L HOEtN1,1,1NTF2及10 g/L CM-β-CD,分离电压为20 kV,检测波长为226 nm,进样时间为10 s的条件下,改变缓冲液浓度时,分离度随缓冲液浓度变化的情况如图4所示。
由图4可知,当缓冲液浓度从10 mmol/L增加到15 mmol/L时,氟西汀对映体分离度随着缓冲液浓度的增大而增大,但是当缓冲液浓度从15 mmol/L增加到30 mmol/L时,氟西汀对映体分离度呈下降趋势,这是由于缓冲液浓度过大,焦耳热影响严重,不利于分离。因此,选择最佳缓冲液浓度为15 mmol/L。
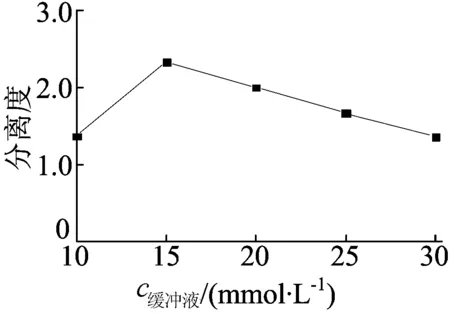
图4 缓冲液浓度对分离度的影响
2.4背景缓冲液pH值对拆分的影响
在毛细管电泳中,缓冲液pH值可影响电渗流的大小以及手性药物的荷电情况,从而影响对映体的分离[15]。实验考查了BGE含15 mmol/L Na2HPO4-H3PO4和30 mmol/L HOEtN1,1,1NTF2及10 g/L CM-β-CD,分离电压为20 kV,检测波长为226 nm,进样时间为10 s的条件下,缓冲溶液pH值从7.5增加到9.5时氟西汀对映体的分离情况如图5所示。由图5可知,对映体分离度随pH值的增大而减小,当缓冲液pH≤8.5时,氟西汀对映体可实现基线分离,当缓冲液pH≥9.0时,氟西汀对映体不能实现基线分离。由于色谱峰的迁移时间随着pH值的增大而减小,因此为了节省分析时间并保证实现基线分离,选择最佳缓冲液pH值为8.5,此时氟西汀对映体在11 min内即可获得基线分离。
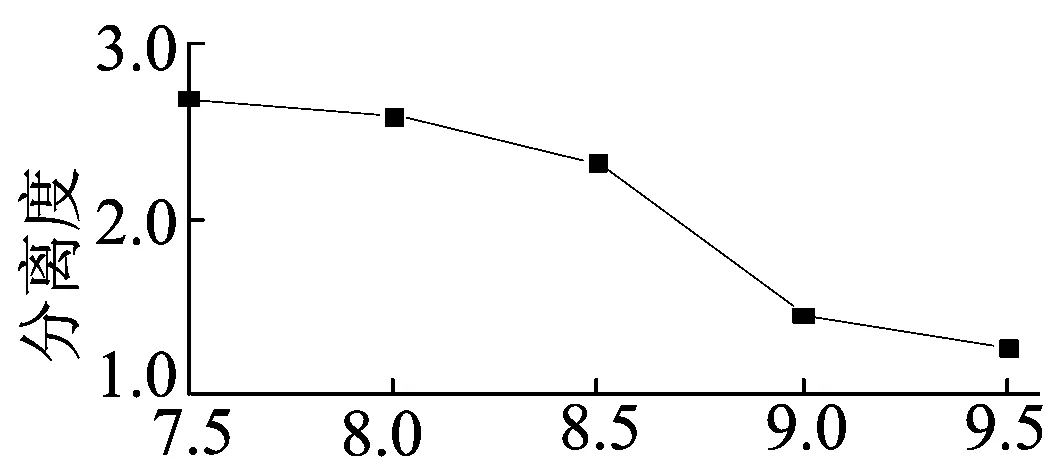
pH
2.5分离电压对拆分的影响
分离电压是影响柱效、分离度和迁移时间的重要因素。在BGE含15 mmol/L pH 值为8.5 Na2HPO4-H3PO4、30 mmol/L HOEtN1,1,1NTF2和10 g/L CM-β-CD,检测波长为226 nm,进样时间为10 s的条件下,分离度随着分离电压的变化情况如图6所示。

图6 分离电压对分离度的影响
从图6可以看出,分离电压从16 kV增大到20 kV时,氟西汀对映体的分离度逐渐增大,这是由于随着分离电压的增大,色谱峰迁移时间缩短,减小了色谱峰展宽;当分离电压从20 kV增大到24 kV时,虽然色谱峰的迁移时间进一步缩短,但是氟西汀对映体的分离度却明显下降,这是由于迁移时间缩短,手性药物与手性选择剂之间的作用时间减少,同时由于分离电压过高,焦耳热急剧增大,引起分离度下降。综合考虑,选择最佳分离电压为20 kV。
综上所述,毛细管电泳分离氟西汀对映体的最佳实验条件为:BGE含15 mmol/L pH值为 8.5 Na2HPO4-H3PO4、30 mmol/L HOEtN1,1,1NTF2和10 g/LCM-β-CD,分离电压20 kV,检测波长226 nm,高差10 cm,进样时间10 s。在最佳实验条件下氟西汀对映体分离的电泳谱图如图7所示,其中,T为电渗流标记物硫脲的色谱峰,F1和F2为氟西汀对映体的2个色谱峰。在最佳电泳条件下氟西汀对映体在11 min内实现了基线分离,分离度为2.33。

图7 氟西汀的电泳图
3结论
本文运用毛细管电泳法,以CM-β-CD和离子液体HOEtN1,1,1NTF2共同作为背景缓冲液添加剂,建立了氟西汀对映体手性拆分的毛细管电泳方法。考察了一系列实验参数对分离结果的影响,获得了氟西汀分离的最优电泳条件,即BGE含15 mmol/L pH值为8.5 Na2HPO4-H3PO4、30 mmol/L HOEtN1,1,1NTF2和10 g/LCM-β-CD,分离电压20 kV,检测波长226 nm,高差10 cm,进样时间10 s。
实验结果表明,背景缓冲液中添加离子液体HOEtN1,1,1NTF2可以提高氟西汀对映体的分离度,此结果为进一步提高手性分子对映体的分离效果提供了一种新的思路。对于其定量分析,可采用左旋或右旋对照品的标准加入法进行测定,但由于目前无法购买到相应的左右旋对照品,因此暂时无法进行该实验,需条件成熟后进一步考察。
[参考文献]
[1]Wong D T,Bymaster F P,Engleman E A.Prozac (fluoxetine,Lilly 110140),the first selective serotonin uptake inhibitor and an antidepressant drug:twenty years since its first publication[J].Life Sciences,1995,57(5):411-441.
[2]Fuller R W,Wong D T,Robertson D W.Fluoxetine,a selective inhibitor of serotonin uptake [J].Medicinal Research Reviews,1991,11(1):17-34.
[3]Fuller R W,Snoddy H D.Drug concentrations in mouse brain at pharmacologically active doses of fluoxetine enantiomers[J].Biochemical Pharmacology,1993,45(11):2355-2358.
[4]Gong Z S,Duan L P,Tang A N.Amino-functionalized silica nanoparticles for improved enantiomeric separation in capillary electrophoresis using carboxymethyl-β-cyclodextrin (CM-β-CD)as a chiral selector[J].Microchimica Acta,2015,182(7):1297-1304.
[5]Wang W,Lu J,Fu X,et al.Carboxymethyl-β-cyclodextrin for chiral separation of basic drugs by capillary electrophoresis[J].Analytical Letters,2001,34(4):569-578.
[6]李桦,罗维,肖登勇,等.卡替诺尔和氟西汀对映体的高效毛细管电泳分离[J].分析测试学报,2001,20(2):32-35.
[7]滕怀凤,李尚颖,刘慧颖.高效毛细管电泳法分离氟西汀和联苯苄唑的对映体[J].中国药房,2014,25(29):2756-2758.
[8]Su H L,Kao W C,Lin K W,et al.1-Butyl-3-methylimidazolium-based ionic liquids and an anionic surfactant:excellent background electrolyte modifiers for the analysis of benzodiazepines through capillary electrophoresis[J].Journal of Chromatography A,2010,1217(17):2973-2979.
[9]Li Libo,Du Hongwei,Yu Huan,et al.Application of ionic liquid as additive in determination of three β-agonists by capillary electrophoresis with amperometric detection[J].Electrophoresis,2013,34(2):277-283.
[10]Yu Jin,Zuo Lihua,Liu Hongjiao,et al.Synthesis and application of a chiral ionic liquid functionalized β-cyclodextrin as a chiral selector in capillary electrophoresis[J].Biomedical Chromatography,2013,27(8):1027-1033.
[11]Maruszak W,Trojanowicz M,Margasin′ska M,et al.Application of carboxymethyl-β-cyclodextrin as a chiral selector in capillary electrophoresis for enantiomer separation of selected neurotransmitters[J].Journal of Chromatography A,2001,926(2):327-336.
[12]Sabbah S,Scriba G K E.Separation of dipeptide and tripeptide enantiomers in capillary electrophoresis using carboxymethyl-β-cyclodextrin and succinyl-β-cyclodextrin:influence of the amino acid sequence,nature of the cyclodextrin and pH[J].Electrophoresis,2001,22(7):1385-1393.
[13]Zhou Zhiming,Li Xia,Chen Xiaoping,et al.Synthesis of ionic liquids functionalized β-cyclodextrin-bonded chiral stationary phases and their applications in high-performance liquid chromatography[J].Analytica Chimica Acta,2010,678(2):208-214.
[14]Huang Lu,Lin Jinming,Yu Lishuang,et al.Improved simultaneous enantioseparation of β-agonists in CE using β-CD and ionic liquids[J].Electrophoresis,2009,30(6):1030-1036.
[15]田晶晶,邓宁,何建波.高效毛细管电泳分离检测 5 种喹诺酮类抗生素[J].合肥工业大学学报:自然科学版,2009,32(8):1170-1172,1203.
(责任编辑闫杏丽)
Enantioseparation of fluoxetine by capillary electrophoresis
YANG Si-wen,DAI Yu-lin,DENG Ning,WANG Yan,HE Jian-bo,ZHU Yan-wu
(School of Chemistry and Chemical Engineering,Hefei University of Technology,Hefei 230009,China)
Abstract:A new method for chiral separation of fluoxetine enantiomers was established by using trimethyl-hydroxyethyl bis(trifluoromethylsulfonyl)imide(HOEtN1,1,1NTF2)and carboxymethyl-β-cyclodextrin(CM-β-CD). The influence of the concentration of CM-β-CD,ionic liquid and buffer solution,buffer pH and separation voltage on chiral separation was investigated under the conditions of the detection wavelength of 226 nm and the sampling time of 10 s. On the basis of experiments,the optimal enantioseparation conditions were confirmed as follows:30 mmol/L HOEtN1,1,1NTF2 and 10 g/L CM-β-CD were added into the 15 mmol/L Na2HPO4-H3PO4 buffer solution as the pH value of the buffer solution was 8.5 and the applied voltage was 20 kV. Under the optimal enantioseparation conditions,the baseline separation was achieved for fluoxetine enantiomers within 11 min,attaining the resolution of 2.33. The method is simple and rapid with distinct separation effect,which is proved to be useful for enantioseparation of fluoxetine.
Key words:ionic liquid;carboxymethyl-β-cyclodextrin(CM-β-CD);capillary electrophoresis;enantiomer separation;fluoxetine
收稿日期:2015-02-11;修回日期:2015-05-06
基金项目:国家自然科学基金资助项目(21102030)
作者简介:杨思文(1988-),女,安徽桐城人,合肥工业大学硕士生; 何建波(1965-),男,安徽太湖人,博士,合肥工业大学教授,博士生导师.
doi:10.3969/j.issn.1003-5060.2016.06.024
中图分类号:O657.8
文献标识码:A
文章编号:1003-5060(2016)06-0837-05
