线虫脂肪沉积中组织蛋白酶B的表达及功能研究
2016-07-18赵丽娟
赵丽娟,鲍 斌
(合肥工业大学 生物与食品工程学院,安徽 合肥 230009)
线虫脂肪沉积中组织蛋白酶B的表达及功能研究
赵丽娟,鲍斌
(合肥工业大学 生物与食品工程学院,安徽 合肥230009)
摘要:文章利用高糖/高胆固醇饮食诱导了线虫,油红O染色结果表明线虫脂肪沉积显著增加。为了研究组织蛋白酶B在诱导线虫过程中的作用,利用实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)研究了组织蛋白酶B同源基因的表达。选取其中的关键基因利用RNA干扰(RNA interference,RNAi)技术,研究其在线虫脂肪沉积中的作用。结果表明:在线虫脂肪沉积改变后,组织蛋白酶B同源基因表达随之改变;而利用RNA干扰组织蛋白酶B关键基因cpr-3的表达,线虫的脂肪沉积未受影响。因此,组织蛋白酶B同源基因可能参与线虫脂肪沉积改变后的生理变化,而未直接参与线虫脂肪沉积的调控。
关键词:组织蛋白酶B;线虫;脂肪沉积;基因表达
全球肥胖人群的比例正在迅速扩大,作为代谢疾病,肥胖与多种疾病相关,其中包括脂肪肝、心血管疾病、动脉粥样硬化甚至癌症等,正在严重威胁着人类健康[1-3]。秀丽线虫作为一种新兴的肥胖研究模型,越来越多地被运用到肥胖相关研究中[4]。作为肥胖研究模式生物,线虫研究基础成熟,具有生长周期短、个体较小、易于观察及遗传操作方便等优点[4]。哺乳动物中的多数基因在线虫中存在同源基因,哺乳动物中调控脂肪沉积以及相关代谢疾病的调节因子和代谢通路,在线虫中也得到了一定的证实[5]。由于遗传操作简单,线虫中已经构建了众多改变脂肪沉积的突变体,如tph-1、dhs-28、daf-2、rict-1[4,6]。突变的基因可能位于代谢通路的重要位置,如daf-2编码在哺乳动物中同源的胰岛素受体,在胰岛素通路中起重要作用[7]。
在肥胖发生过程中,脂肪沉积的增加与多个生理过程相互作用,受一系列代谢通路以及相关酶类的调节,脂肪沉积机理的研究一直是肥胖相关疾病研究的核心问题,减少脂肪细胞中脂质积累是一种重要的抵抗肥胖的手段[8]。组织蛋白酶是一类裂解肽键的蛋白水解酶,根据其催化中心不同可分为不同类型,包括组织蛋白酶B(cathepsin B)、组织蛋白酶D(cathepsin D)和组织蛋白酶L(cathepsin L)等[9]。研究表明,组织蛋白酶参与了肥胖及相关代谢疾病的发生和发展过程[10-13],比如降低组织蛋白酶L的表达可以有效抑制脂肪沉积的增加[9]。组织蛋白酶B是溶酶体内半胱氨酸内切蛋白水解酶,其作用非常广泛,参与机体多种生理、病理过程[14-15]。当前,对于组织蛋白酶B的研究主要是关于炎性、癌症[14],组织蛋白酶B在脂肪沉积中的作用还不清楚。
在线虫中存在多个与哺乳动物组织蛋白酶B同源的基因,包括cpr-1、cpr-2、cpr-3、cpr-4、cpr-5和cpr-6[16-19]。本文拟以秀丽线虫为研究对象,分析脂肪沉积改变过程中,组织蛋白酶B同源基因的表达变化及其在脂肪沉积中的可能作用。
1材料与方法
1.1材料
秀丽线虫购自国际线虫中心CGC;油红O购自Sigma公司;RNAiso Plus 试剂、Oligo d(T)18、dNTP、SYBR®Premix Ex TaqTMII试剂购自TaKaRa公司;M-MLV 逆转录试剂盒购自Invitrogen公司;氯化钠、蛋白胨、琼脂粉、硫酸镁、氯化钙、葡萄糖等均购自国药集团化学试剂有限公司。
1.2方法
1.2.1线虫培养基的配制
线虫生物培养基(nematode growth medium,NGM)的配制如下:1 L培养基中NaCl 3 g,蛋蛋白胨2.5 g,琼脂粉17 g,蒸馏水975 mL,121 ℃灭菌30 min后冷却至50~60 ℃,加过滤灭菌的1 mol/L MgSO4、CaCl2各1 mL、5 mg/mL 胆固醇1 mL、30 mg/mL链霉素1 mL以及25 mL K2HPO4/KH2PO4缓冲液。
高糖培养基5 mmol/L,每升培养基加5 mL葡糖糖(1 mol/L),高胆固醇培养基加3倍的胆固醇。RNA干扰(RNA interference,RNAi)培养基在加抗生素上有区别,分别为100 mg/mL氨苄青霉素、15 mg/mL四环素、0.4 mol/L诱导剂异丙基-β-D-硫代吡喃半乳糖苷(IPTG)各1 mL。
1.2.2线虫的培养
NGM培养基上加浓缩OP50菌液,37 ℃培养12 h,再将同步化后线虫接于培养基上20 ℃培养,显微镜下观察线虫的生长状况,线虫生长至成虫,即同步化后52 h后收取备用。
1.2.3线虫的 RNA干扰
溶菌肉汤(lysogeny broth,LB)液体培养基中加氨苄青霉素和四环素,然后接种含有L4440空载体以及含有能够合成cpr-3 dsRNA的HT115细菌,摇床上摇动12 h后再进行IPTG诱导。进行RNAi培养时,在RNAi NGM培养板上分别接种L4440菌与cpr-3干扰菌,37 ℃培养12 h。将同步化后线虫接于培养基上20 ℃培养,其余步骤与普通培养时相同。
1.2.4油红染色
培养至成虫的线虫,用M9洗下收集于EP管中,用M9洗2遍,冰上孵育10 min,10%的甲醛固定,-80 ℃保存备用。从超低温冰箱取出线虫反复冻融3次,最后一次于冰上融化。M9洗2遍,再用100%的1,2-丙二醇润洗2 min,加入0.5%油红染色于摇床上以200 r/min摇12 h,染色结束后吸出染液,加入85%的1,2-丙二醇。85%丙二醇于脱色摇床上摇晃5 min 3次,离心后移去,加入M9制片,于倒置显微镜下观察线虫脂肪沉积情况并拍照。拍照完成后吸净M9,加入200 μL无水乙醇,于脱色摇床摇晃15 min,使油红溶出。每管吸出150 μL至96孔板中,检测OD510[20]。
1.2.5类组织蛋白酶基因表达的检测
收集各组处理过的线虫,每组3 000条,用RNAiso Plus 试剂提取总RNA,取2 μg总RNA利用反转录酶试剂盒反转录成cDNA,并用实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)方法检测类组织蛋白酶相关基因的mRNA表达,各基因引物见表1所列。
以act-1作为内参照,分别计算各组2-ΔΔCt,用以表示各基因的mRNA相对表达量。实时荧光定量PCR的反应条件为退火温度60 ℃,重复40个循环。
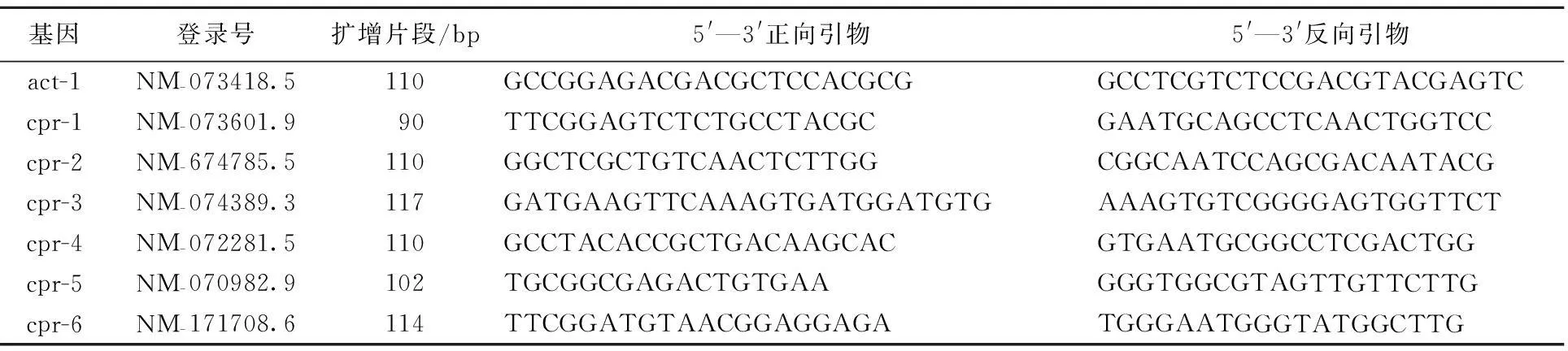
表1 实时荧光定量PCR的引物序列
1.2.6统计学处理
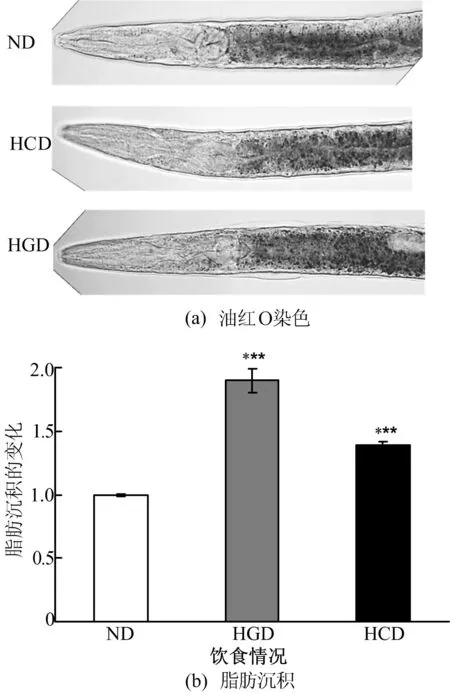
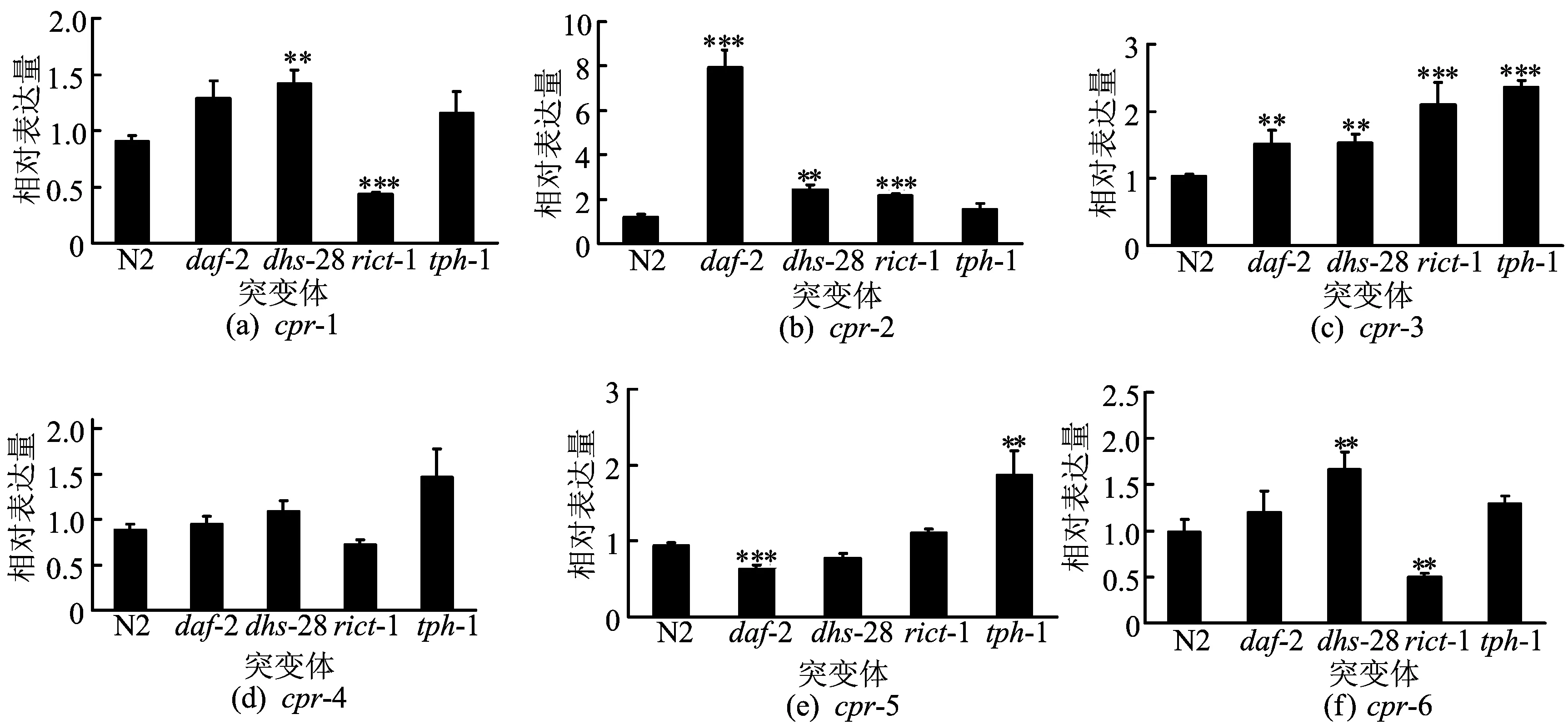
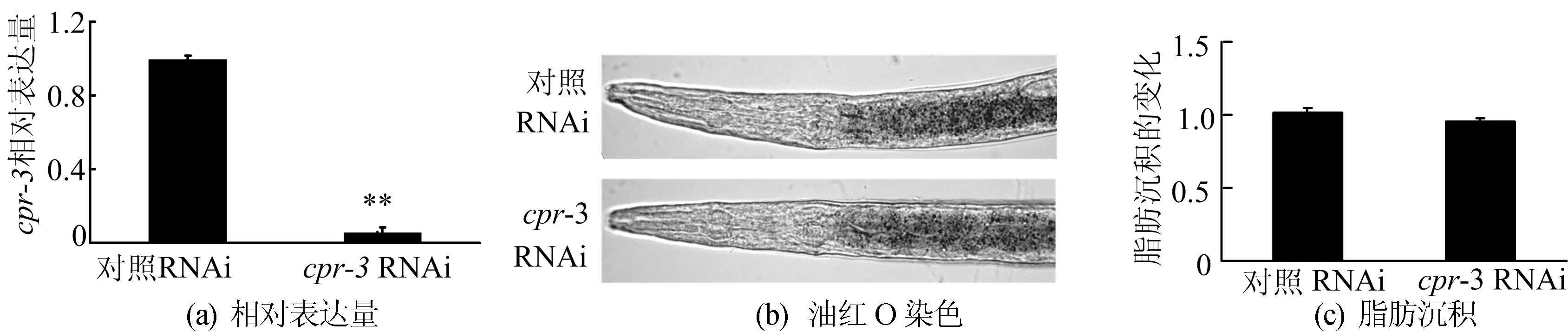
所有数据以“均数±标准差”表示(重复试验3次,每次试验每组2板线虫)。采用SPSS13.0统计软件,进行不同组之间的t检验,双侧P<0.05 为统计学意义的显著差异。**表示0.01 2结果分析 2.1类组织蛋白酶B基因mRNA的表达 在高糖/高胆固醇饮食诱导下,高浓度葡萄糖和胆固醇诱导对线虫脂肪沉积影响如图1所示。 ND—普通饮食 HGD—高葡萄糖饮食 HCD—高胆固醇饮食 由图1可看出,随着葡萄糖和胆固醇量的增加,线虫脂肪沉积显著增加。在脂肪沉积增加后线虫组织蛋白酶B基因mRNA的表达量也发生了变化,如图2所示。 基因 图2不同饮食N2线虫中类组织蛋白酶B相关基因的表达 由图1、图2可知,在高葡萄糖/高胆固醇饮食诱导下线虫脂肪沉积发生了显著变化,但是cpr-1、cpr-4以及cpr-6的表达量改变不明显;cpr-2在高胆固醇诱导下表达量显著升高,但在高糖诱导下表达没有显著改变;cpr-5的表达量在高糖诱导下显著升高,但不受高胆固醇诱导的影响;cpr-3在高糖和高胆固醇的诱导下表达量均显著升高。 由以上分析可知,本文利用高葡萄糖/高胆固醇饮食诱导脂肪沉积增加的模型,分析了组织蛋白酶B同源基因的表达变化,发现只有cpr-3的表达在2种饮食诱导的脂肪沉积增加过程中显著上升。 线虫中存在特定的突变体,其遗传背景改变后脂肪沉积增加,tph-1、dhs-28、daf-2以及rict-1突变体较野生型N2线虫脂肪沉积增加。本文利用实时荧光定量PCR检测这几种突变体的组织蛋白酶B同源基因的表达,如图3所示。 由图3可知,cpr-1在突变体dhs-28中表达量显著增加,但在突变体rict-1中表达量显著减少,在其他2个突变体中,较野生型表达量无变化;4种突变体中cpr-2的表达,除在tph-1突变体中无变化,其他3个突变体中均显著升高;与饮食诱导时相似,在检测的突变体中cpr-4的表达量均无显著变化;cpr-5的表达量虽然在突变体tph-1中显著上升,但在突变体daf-2中显著下降,其他2个突变体中的表达无显著变化;cpr-6在突变体dhs-28中表达量显著上升,突变体rict-1中表达显著降低,其他2个突变体中的表达无显著变化;cpr-3的表达量在4种突变体中均显著升高。因此,只有cpr-3的表达量在所有检测的脂肪沉积增加的突变体中,均显著升高。 图3 突变体线虫中类组织蛋白酶B相关基因mRNA的相对表达量 2.2RNAi对线虫脂肪沉积的影响 鉴于cpr-3的表达在所有脂肪沉积增加的模型中均显著增加,本文利用RNAi技术降低了cpr-3的表达,并研究其在脂肪沉积中的作用。对照组的RNAi饲喂L4440菌,即在HT115中转入空载质粒的大肠杆菌,其相对表达量结果如图4a所示,实时荧光定量PCR的结果表明,在RNA干扰后,cpr-3表达量显著下降,说明RNA干扰成功。 在cpr-3表达量下降后,本文利用油红O染色的方法检测了线虫的脂肪沉积情况,然而RNA干扰cpr-3后,线虫脂肪沉积与对照比较几乎无变化,如图4b、图4c所示。由图4b、图4c可看出,降低cpr-3表达量不能使脂肪沉积减少。因此,cpr-3表达的改变可能是线虫脂肪沉积改变的结果,而不是引起线虫脂肪沉积改变的原因。 图4 cpr-3表达量降低对线虫脂肪沉积的影响 3讨论 超重和肥胖是引起死亡的重要风险,肥胖的本质是脂质在脂肪细胞中过度积累,减少脂质积累可有效预防和治疗肥胖及其相关威胁机体健康的疾病[21]。对于肥胖及其相关疾病问题的研究,可以从个体、组织、细胞及分子等各个水平进行研究,但归根结底肥胖发生的分子机制研究是解决肥胖及相关疾病的根本。当前的研究发现,脂肪沉积过程伴随着一系列分子水平的改变,而且这些分子也可能反过来调节脂肪沉积。研究这些分子有利于预防和治疗肥胖及其相关疾病。 近年来研究表明,组织蛋白酶被认为是在癌症、免疫系统相关疾病中起作用的一类关键酶[22],组织蛋白酶类与肥胖及其相关疾病具有密切关系[5]。本实验以秀丽线虫为研究对象,研究组织蛋白酶B与线虫脂肪沉积的关系。实验结果显示,在高糖诱导线虫脂肪沉积增加时,cpr-3、cpr-5的表达量上升;高胆固醇诱导线虫脂肪沉积增加时,cpr-2、cpr-3的表达量升高;在饮食诱导线虫脂肪沉积试验中,其他基因的表达量与对照相比均无显著变化。在daf-2突变体中cpr-2、cpr-3表达量升高,cpr-5表达量下降;在dhs-28突变体中cpr-1、cpr-2、cpr-3、cpr-5表达量上升;在rict-1突变体中cpr-2、cpr-3表达量升高,cpr-1、cpr-6表达量下降;在tph-1突变体中cpr-2、cpr-3表达量升高,cpr-3、cpr-5表达量下降。cpr-3表达量在饮食诱导以及突变体线虫中均有显著的增加,可能是由于cpr-3是线虫中与脂肪沉积密切相关的关键组织蛋白酶B基因的存在。然而利用RNAi技术降低cpr-3的表达后,线虫脂肪沉积没有发生改变,这说明cpr-3表达的改变是线虫脂肪沉积变化的结果。 4结束语 本研究表明线虫脂肪沉积增加可以改变类组织蛋白酶B相关基因的表达,特别是cpr-3的表达显著升高,而RNAi降低cpr-3表达不能改变线虫的脂肪沉积。因此cpr-3表达的改变可能是线虫脂肪沉积改变的结果,而不是引起线虫脂肪沉积改变的原因。 [参考文献] [1]Kopelman P G.Obesity as a medical problem[J].Nature,2000,404(6778):635-643. [2]Schuster D P.Obesity and the development of type 2 diabetes: the effects of fatty tissue inflammation[J].Diabetes Metab Syndr Obes,2010,3:253-262. [3]Keast D R,O’Neil C E,Jones J M.Dried fruit consumption is associated with improved diet quality and reduced obesity in US adults: national health and nutrition examination survey,1999—2004[J].Nutrition Research,2010,31(6): 460-467. [4]Zheng J,Greenway F L.Caenorhabditis elegans as a model for obesity research[J].International Journal of Obesity,2011,36(2):186-194. [5]Baumeister R,Ge Liming.The worm in us:Caenorhabditis elegans as a model of human disease[J].Trends in Biotechnology,2002,20(4): 147-148. [6]Mullaney C,Ashrafi K. C.elegans fat storage and metabolic regulation[J].Biochimica Biophysica Acta,2009,1791(6):474-478. [7]Lee S J,Murphy C T,Kenyon C.Glucose shortens the life span of C.elegans by downregulating DAF-16/FOXO activity and aquaporin gene expression[J].Cell Metabolism,2009,10(5):379-391. [8]Ouchi N,Parker J L,Lugus J J,et al.Adipokines in inflammation and metabolic disease[J].Nat Rev Immunol,2011,11(2):85-97. [9]Yamade A,Ishimaru N,Arakaki R,et al.Cathepsin L inhibition prevents murine autoimmune diabetes via suppression of CD8(+)T cell activity[J].PLoS One,2011,5(9):e12894. [10]Soltysiak J,Skowron′ska B,Fichna P,et al.Neutrophil gelatinase-associated lipocalin and Cathepsin L as early predictors of kidney dysfunction in children with type 1 diabetes[J].Endokrynologia Polska,2014,65(6): 479-484. [11]Liu Jian,Ma Likun,Yang Jintian,et al.Increased serum cathepsin S in patients with atherosclerosis and diabetes[J].Atherosclerosis,2006,186(2):411-419. [12]Liu J,Sukhova G K,Yang J T,et al.Cathepsin L expression and regulation in human abdominal aortic aneurysm,atherosclerosis,and vascular cells[J].Atherosclerosis,2006,184(2):302-311. [13]贾小英,危当恒.组织蛋白酶L与动脉粥样硬化[J].中国动脉硬化杂志,2012,20(1):85-88. [14]卢士英,任洪林,柳增善,等.组织蛋白酶B研究进展[J].河北师范大学学报:自然科学版,2004,28(3):306-309. [15]郑媛媛,刘伟敬,刘华锋.溶酶体组织蛋白酶B和D调控细胞凋亡及炎性反应的研究进展[J].临床医学工程,2014,21(1):126-128. [16]Larminie C G,Johnstone I L.Isolation and characterization of four developmentally regulated cathepsin B-like cysteine protease genes from the nematode Caenorhabditis elegans[J].DNA Cell Biol,1996,15(1):75-82. [17]Britton C,Mckerrow J H,Johnstone I L.Regulation of the Caenorhabditis elegans gut cysteine protease gene cpr-1: requirement for GATA motifs[J].Journal of Molecular Biology,1998,283(1):15-27. [18]Ray C,McKerrow J H.Gut-specific and developmental expression of a Caenorhabditis elegans cysteine protease gene[J].Molecular and Biochemical Parasitology,1992,51(2):239-249. [19]Xu M,Liu Y B,Zhao L Y,et al.The lysosomal cathepsin protease CPL-1 plays a leading role in phagosomal degradation of apoptotic cells in Caenorhabditis elegans[J].Mol Bio Cell,2014,25(14):2071-2083. [20]Zhang S O,Box A C,Xu N,et al.Genetic and dietary regulation of lipid droplet expansion in Caenorhabditis elegans[J].Proc Natl Acad Sci U S A,2010,107(10):4640-4645. [21]李秀娟,沈君子,刘宁,等.降血脂益生菌对高脂血症小鼠血清TC和TG的影响[J].合肥工业大学学报:自然科学版,2008,31(12):2041-2043. [22]Turk V,Turk B,Turk D.Lysosomal cysteine proteases: facts and opportunities[J].The EMBO Journal,2010,20(17):4629-4633. (责任编辑闫杏丽) Study of expression and function of Cathepsin B in the process of fat storage in Caenorhabditis elegans ZHAO Li-juan,BAO Bin (School of Biotechnology and Food Engineering,Hefei University of Technology,Hefei 230009,China) Abstract:In this paper,Caenorhabditis elegans(C.elegans)were fed with high concentration glucose and cholesterol diet,and it was demonstrated that the fat storage increased dramatically by oil red O staining. In order to study the role of Cathepsin B Protease homologous genes in the fat storage process of C.elegans,their expression was investigated by quantitative reverse transcription-polymerase chain reaction(RT-PCR).The cpr-3 was proposed as a critical gene homologous to Cathepsin B Protease,and then the effect of selected critical genes on the fat storage in C.elegans was studied by RNAi technology. The results show that the altered expression of Cathepsin B Protease homologous genes maybe a result of the changed fat storage in C.elegans. However,there is no change of fat storage when cpr-3 is knocked down by RNAi. In consequence,homologous genes of Cathepsin B Protease do not directly regulate the fat storage,but may participate in the physiological and pathological processes after the increase of fat storage. Key words:Cathepsin B Protease;Caenorhabditis elegans(C.elegans);fat storage;gene expression 收稿日期:2015-02-11;修回日期:2015-04-10 基金项目:安徽省自然科学基金资助项目(1408085QC48) 作者简介:赵丽娟(1990-),女,安徽宿州人,合肥工业大学硕士生; doi:10.3969/j.issn.1003-5060.2016.06.026 中图分类号:Q493.5 文献标识码:A 文章编号:1003-5060(2016)06-0849-05 鲍斌(1983-),男,河北石家庄人,博士,合肥工业大学讲师,硕士生导师.