细胞穿透肽CCL融合蛋白的构建与表达
2016-07-16安艳芳王仲霞杨建业
刘 勇,安艳芳,王仲霞,杨建业,吴 君
(1南方医科大学深圳医院,广东 深圳 518101; 2 湖北医药学院附属人民医院,湖北 十堰 442000)
细胞穿透肽CCL融合蛋白的构建与表达
刘勇1,2,安艳芳2,王仲霞2,杨建业2,吴君2
(1南方医科大学深圳医院,广东 深圳518101; 2 湖北医药学院附属人民医院,湖北 十堰442000)
[摘要]目的评估细胞穿透肽CCL融合蛋白构建的可能性。方法将CCL6-PEP-6XHis构建至pABP质粒,然后提取pABP-CCL6-PEP质粒进行人胚肾HEK293细胞转染表达,以及CCL6-PEP-6XHis 蛋白层析纯化和检测。结果成功构建并纯化细胞穿透肽CCL融合蛋白。将CCL6-PEP-6XHis Tag 基因经PCR扩增、接入T 载体、克隆、培养,并提取质粒进行测序鉴定,所得序列与目的基因一致。成功将CCL6-PEP-6XHis基因构建至哺乳动物细胞表达载体pABP 中,经质粒提取和酶切鉴定,电泳结果显示,HindⅢ + XbaⅠ切出约430 bp的条带,符合预期,酶切鉴定正确。蛋白质印迹法(Western Blot)检测结果阳性,表明纯化得到的目标蛋白带有hisx6标签。结论细胞穿透肽CCL融合蛋白能够人工构建,并通过真核细胞进行表达。
[关键词]细胞穿透肽; CCL; 基因表达; 重组融合蛋白质
[Chin J Infect Control,2016,15(6):361-366]
由于多重耐药菌传播快,开发新的抗菌药物迫在眉捷,是重要的医学问题[1]。抗菌肽(antibacterial peptides)是广泛存在于动植物体内,具有一定抗菌谱的小分子肽,是哺乳动物抗感染防御中的重要成分,可参与先天免疫和炎性应答诸多方面,具有保守的信号转导通路[2-6]。CCL6是抗微生物肽(AMP)的重要一员,在肠道等器官大量分布,易于提取,是具有临床潜力的药物之一[7-8]。但CCL6由于分子小,易被蛋白酶降解,限制了其临床应用。利用新型技术提高抗菌肽的穿透力,是抗菌肽研究的热点和关键问题[7,9]。假设细胞穿透肽也可以促进抗菌肽的定位及提高局部浓度,从而可大幅度提高抗菌肽的体内外抗菌活性。本研究评估构建细胞穿透肽CCL6融合蛋白的可能性。
1材料与方法
1.1实验材料人胚肾HEK293细胞(ATCC,Catalog #CRL21573) 为本研究室保存。大肠埃希菌DH5α、质粒pSectagA、pEGFP2C1、哺乳动物细胞表达载体pABP、CD 293 TGE medium、(cat#CM-1156) BP fectin转染试剂购自北京百普赛斯生物科技有限公司,其他试剂均为国产分析纯。
1.2方法
1.2.1CCL6-PEP-6XHis基因密码子优化及合成在Pubmed上查询CCL6及PEP蛋白基因序列,利用Premier Primer软件进行密码子优化后,设计合成的CCL6-PEP-6XHis Tag基因,再根据目的基因设计引物进行聚合酶链反应(PCR)。切胶回收目的片段,将PCR 产物连入T 载体,挑取克隆进行培养,提取质粒进行测序鉴定。通过比对,获得正确的CCL6-PEP-6XHis 基因序列。
1.2.2质粒pABP-CCL6-PEP重组和酶切、测序鉴定CCL6-PEP基因片段以Hind Ⅲ和入XbaⅠ双酶切,并与同样酶切的pABP载体于14℃连接过夜, 连接产物转入50 μL Top10 感受态细胞,挑取4个单菌落过夜振荡培养后,提取质粒并进行酶切鉴定。反应均按常规方法操作,利用Primer软件设计添加含Hind Ⅲ和入XbaⅠ酶切位点的CCL6-PEP-6Xhis的产物引物,并利用所设计引物进行PCR。将PCR产物导入pABP HindⅢ + XbaⅠ酶切线性化载体,再将连接产物转入50 μL Top10 感受态细胞,接种平板过夜培养,挑取若干单菌落过夜振荡培养后,提取质粒;对所提质粒进行Hind Ⅲ + XbaⅠ酶切鉴定,并进行测序鉴定。
1.2.3CCL6-PEP-6XHis质粒制备与瞬时转染将鉴定正确的质粒转化到DH5a菌中,接种平皿挑取单菌落放大培养,并用DNA提取试剂盒制备转染用质粒DNA。将HEK293细胞以0.5×106cells/mL 接种密度接种至 3 L细胞培养反应器中,初始工作体积为1.2 L,培养温度37℃搅拌转速150 r/min。当活细胞密度达(1.5~2.0)×106cells/mL 时, 用0.8 L 的新鲜无血清/化学成分界定培养基(CD 293 TGE medium)稀释至终体积为2.4 L。活细胞密度稀释后15 h再度达到(1.5~2.0)×106cells/mL 时,用BP fectin作为转染试剂,以3 μL转染试剂/106细胞, 和1 μL DNA/106细胞的剂量转染细胞。转染复合物根据ACRO Biosystems 说明书进行,并在转染24 h后,以5%/5% (V/V) 比例加入Feed X Supplement补料, 并在转染24 h 和96 h后分别加入ACRO Biosystems 20 mmol/L 及4 mmol/L葡萄糖和谷氨酰胺浓缩液。整个细胞培养过程中,每天观察计数细胞,并在转染后收获HEK293细胞培养液。
1.2.4CCL6-PEP-6XHis蛋白的层析纯化和检测收集无血清细胞培养液,经低速离心去除细胞和细胞碎片,所得培养液上清采用0.45 μm滤膜过滤、澄清,去除细胞碎片颗粒,使用5 mL金属螯合亲和层析进行分离,依次采用40、100、250 和500 mmol/L咪唑阶段梯度进行洗脱,对洗脱物进行SDS-PAGE 电泳检测。然后使用Anti-hisx6 抗体对Peak4(峰4)进行蛋白质印迹法(Western Blot)检测。
2结果
2.1CCL6-PEP-6XHis基因密码子优化及合成经过Primer软件进行密码子优化后,需要合成的CCL6-PEP-6XHis Tag 基因见图1~2。针对该序列共设计18条引物(CCL6-01、02……18 )进行PCR扩增,切胶回收目的片段,连接PCR产物入T 载体,挑取若干克隆进行培养,并提取质粒进行测序鉴定,所得序列符合目的基因。

蓝色部分:mouse CCL6 序列;红色部分:PEP1 序列;黄色部分:6XHis Tag 序列

图2 CCL6-PEP-6XHis基因PCR产物电泳图
Figure 2Electrophoretogram of PCR product of CCL6-PEP-6XHis gene
2.2质粒pABP-CCL6-PEP 重组成功将CCL6-PEP-6XHis基因构建至哺乳动物细胞表达载体pABP 中。设计载体构建引物,设计的引物进行PCR 扩增。见表1、图3。
2.3细胞转导PCR产物导入pABP Hind Ⅲ + XbaⅠ酶切线性化载体,再将连接产物转入50 μL Top10 感受态细胞,接种平板过夜培养。隔夜培养平板培养出>100 个单菌落。见图4。

表1 设计载体构建引物
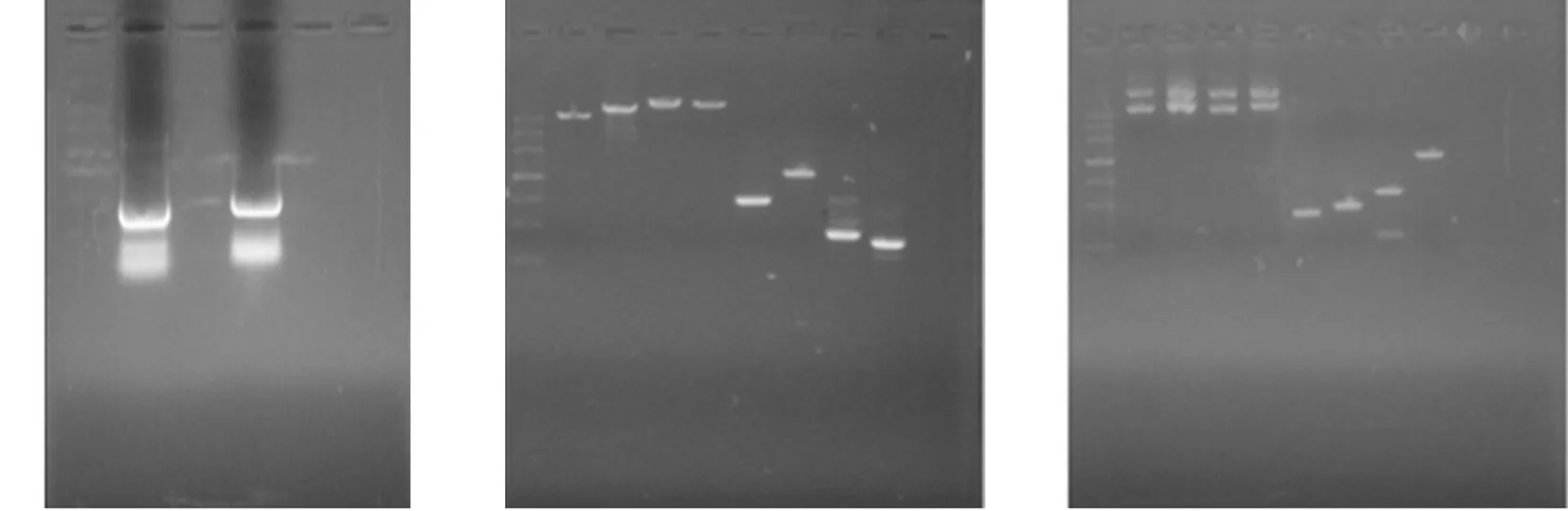
A:PCR粗产物;B:回收产物;C:酶切后产物
Figure 3Electrophoretogram of PCR product, extracted PCR product, and restriction enzyme-digested PCR product of pABP-CCL6-PEP gene
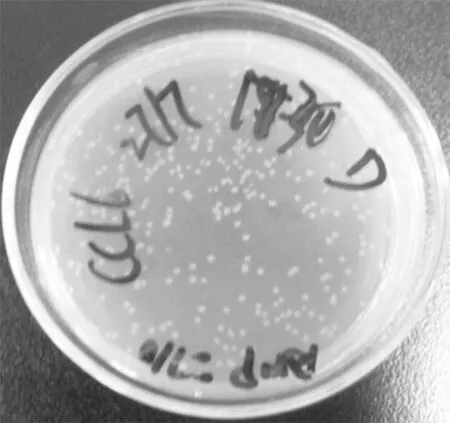
图4 质粒pABP-CCL6-PEP重组克隆隔夜培养平板
Figure 4Overnight incubated plates of recombinant clones of plasmid pABP-CCL6-PEP
2.3.1酶切鉴定挑取4 个单菌落过夜振荡培养后,提取质粒,对所提的4 管质粒进行酶切鉴定,电泳结果显示,HindⅢ + XbaⅠ切出约430 bp的条带,符合预期,表明酶切鉴定正确。见图5。
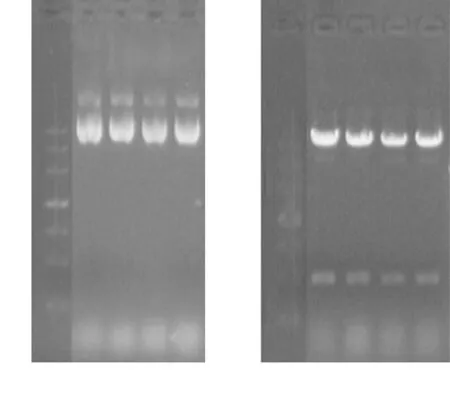
图5 质粒pABP-CCL6-PEP及其酶切鉴定电泳图
Figure 5Electrophoretogram of plasmid pABP-CCL6-PEP and restriction enzyme digestion
2.3.2表达载体测序结果对表达载体pABP-CCL6-PEP进行测序鉴定,比对结果表明,测序完全正确,符合设计。见图6。

图6 pABP-CCL6-PEP基因测序图
2.4CCL6-PEP-6XHis质粒制备与瞬时转染
2.4.1CCL6-PEP-6XHis质粒制备将鉴定正确的质粒转化到DH5a菌中,接种平皿培养后挑取单菌落放大培养,并用DNA提取试剂盒制备转染用质粒DNA。提取质粒名称CCL6-PEP-6XHis,DNA比光度为1.82,数量为13.2,转染DNA为3.8 mg。
2.4.2细胞培养与瞬时转染细胞培养进行转染后的生长曲线见图7。细胞峰活细胞密度(Peak VCD)达4.8 million/mL,总细胞密度(TCD)达7.66 million/mL,活细胞比VCD/TCD为63%。
2.5CCL6-PEP-6XHis蛋白的层析纯化和检测
2.5.1CCL6-PEP-6XHis蛋白层析纯化约2.8 L无血清细胞培养液经过15 min低速离心(4 000 r/min)去除细胞和细胞碎片,依次采用不同浓度咪唑阶段梯度进行洗脱,层析分离图谱见图8。以上金属螯合亲和层析收集各洗脱峰,SDS-PAGE还原电泳检测。峰4(P4)为500 mmol/L咪唑洗脱后所得目标蛋白。总细胞上清液为2 650 mL,目标蛋白约43 mL,根据紫外分光仪波长280 nm检测,目标蛋白低于最低检测阈值。
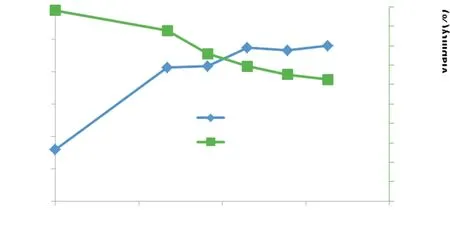
图7CCL6-PEP-6XHis质粒在HEK293细胞中瞬时表达生长曲线
Figure 7Growth curve of transient expression of plasmid CCL6-PEP-6XHis in HEK293 cell
2.5.2目标蛋白SDS-PAGE电泳分析根据SDS-PAGE电泳分析(见图9),目标蛋白(约15 kD)与金属螯合填料(IMAC)结合较强,需使用500 mmol/L 咪唑洗脱(P4)。根据电泳条带估计,纯化得到0.05~0.1 mg痕量目标蛋白,当前方案的表达量较低。
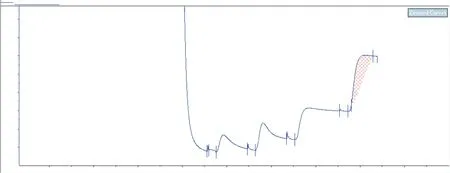
图8 CCL6-PEP-6XHis蛋白金属螯合亲和层析分离纯化层析图谱
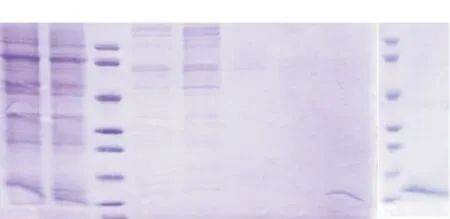
柱M:蛋白Marker;柱1:细胞培养上清液;柱2:未洗脱前离心液;柱3—5: 分别为40、100、250 mmol/L 咪唑洗脱后;柱6:第三峰(P3)尾峰的250 mmol/L咪唑洗脱后;柱7—8: 500 mmol/L 咪唑洗脱后 (CCL-PEP-6XHis),其中柱8采用20倍浓缩
图9CCL6-PEP-6XHis蛋白层析分离纯化还原电泳分析图
Figure 9Electrophoretogram of chromatographic separation and purification of CCL6-PEP-6XHis protein
2.6CCL6-PEP-6XHis蛋白Western Blot检测使用Anti-hisx6抗体对P4进行Western Blot检测,结果确定为阳性,表明纯化得到的目标蛋白带有hisx6标签,但由于浓度较低,显色条带肉眼观察较浅。见图10。

1泳道:阳性对照;2泳道:空白对照; 3泳道:Marker; 4泳道:洗脱后的P4
图10CCL6-PEP-6XHis蛋白Western Blot 检测结果
Figure 10Western Blot analysis on CCL6-PEP-6XHis protein
3讨论
多重耐药菌是临床期待解决的问题。肠道分泌的CCL6具有广泛抗病原体作用,且对人体无害,是一种理想的候选抗菌药物[7,10-12]。但CCL6由于分子小,易被蛋白酶降解,限制了其临床应用。利用新型技术提高抗菌肽的穿透力,是抗菌肽研究的热点和关键问题。本研究成功构建了细胞穿透肽CCL6融合蛋白,为进一步高表达目的蛋白及体内外实验奠定了基础。
研究[13]表明,HEK293细胞是比较理想的宿主细胞。本课题中的CCL6由于具有杀菌作用,不宜于采用传统的大肠埃希菌培养。初试中载体细菌起初浓度呈指数增加,但随时间进展,尤其3 d后数量又呈指数下降,大肠埃希菌表达的CCL6由于自身的杀伤作用导致产量低下。表明CCL6具有强大的杀菌作用,且与浓度呈正相关,大肠埃希菌并非其理想表达系统。由于CCL6机制主要为破坏细菌细胞壁,因而对细胞无损伤[10]。本组研究采用HEK 293细胞作为宿主细胞,避免了对宿主的破坏,提高了蛋白的产出率。
CCL6的最低抑菌浓度值较高,达到理想杀菌效果的浓度需100 nmoL左右,表明CCL6的细胞壁穿透能力有待进一步提高。该浓度的CCL6价格昂贵,限制了其在临床广泛使用。因而增强CCL6的透壁能力十分必要。PEP-1是一种穿透蛋白,能够增强靶分子的细胞壁穿透能力。既往研究[14-15]表明,PEP-1能够增强靶蛋白的穿透能力,提高生物活性,如SOD,EGFP和过氧化氢酶等。理论上PEP-1可以提高CCL6的穿壁能力,但能够提高CCL6的穿壁能力是否一定提高杀菌能力尚需要进一步研究。本研究为进一步评估CCL6的杀菌机制,开发新一代抗菌素奠定了技术基础。本研究的限制之处为靶蛋白的浓度和产量还不够高,未来实验中需要予以进一步改良和优化。
[参 考 文 献]
[1]Wittekamp BH, Bonten MJ. Antibiotic prophylaxis in the era of multidrug-resistant bacteria [J]. Expert Opin Investig Drugs, 2012,21(6):767-772.
[2]Vila-Farrés X, Giralt E, Vila J. Update of peptides with antibacterial activity [J]. Curr Med Chem, 2012,19 (36):6188-6198.
[3]Liao Z, Wang XC, Liu HH, et al. Molecular characterization of a novel antimicrobial peptide from Mytilus coruscus [J]. Fish Shellfish Immunol, 2013, 34 (2):610-616.
[4]Gottschalk S, Gottlieb CT, Vestergaard M, et al. Amphibian antimicrobial peptide fallaxin analogue FL9 affects virulence gene expression and DNA replication inStaphylococcusaureus[J]. J Med Microbiol, 2015, 64(12): 1504- 1513.
[5]Chen B, Fan DQ, Zhu KX, et al. Mechanism study on a new antimicrobial peptide Sphistin derived from the N-terminus of crab histone H2A identified in haemolymphs of Scylla paramamosain [J]. Fish Shellfish Immunol, 2015,47(2): 833-846.
[6]Goh HF, Philip K. Purification and characterization of bacteriocin produced by weissella confusa A3 of dairy origin [J]. PloS one, 2015,10(10):e0140434.
[7]Kotarsky K, Sitnik KM, Stenstad H, et al. A novel role for constitutively expressed epithelial-derived chemokines as antibacterial peptides in the intestinal mucosa [J]. Mucosal Immunol, 2010,3(1):40-48.
[8]Liu JY, Li F, Wang LP, et al. CTL-vs Treg lymphocyte-attracting chemokines, CCL4 and CCL20, are strong reciprocal predictive markers for survival of patients with oesophageal squamous cell carcinoma [J]. Br J Cancer, 2015,113(5):747-755.
[9]Zhang YE, Wang JN, Tang JM, et al. In vivo protein transduction: delivery of PEP-1-SOD1 fusion protein into myocardium efficiently protects against ischemic insult [J]. Mol Cells, 2009,27(2):159-166.
[10] Bukharin OV, Valyshev AV. mechanisms of resistance ofenterococcito antimicrobial proteins and peptides [J]. Zh Mikrobiol Epidemiol Immunobiol, 2012,5:89-94.
[11] Corrales-Garcia L, Ortiz E, Castaeda-Delgado J, et al. Bacterial expression and activities of recombinant variants of human β-defensins on pathogenic bacteria andM.tuberculosis[J]. Protein Expr Purif, 2013,89 (1):33-43.
[12] Hu H, Wang C, Guo X, et al. Broad activity against porcine bacterial pathogens displayed by two insect antimicrobial peptides moricin and cecropin B [J]. Mol Cells, 2013,35(2):106-114.
[13] Chumanov RS, Kuhn PA, Xu W, et al. Expression and purification of full-length mouse CARM1 from transiently transfected HEK293T cells using Halo Tag technology [J]. Protein Expr Purif, 2011,76(2):145-153.
[14] 黄光庆,王家宁, 唐俊明,等. 细胞穿透肽 PEP-1介导过氧化氢酶转导大鼠心肌H9C2细胞 [J]. 郧阳医学院学报, 2010,29(2):103-107.
[15] 张永军,王家宁,唐俊明,等. PEP-1-CAT融合蛋白预处理对在体大鼠心肌缺血再灌注损伤的保护作用 [J]. 南方医科大学学报, 2009,29(12):2429-2432.
(本文编辑:左双燕)
Construction and expression of cell-penetrating peptide CCL fusion protein expression vector
LIUYong1,2,ANYan-fang2,WANGZhong-xia2,YANGJian-ye2,WUJun2
(1ShenzhenHospitalofSouthernMedicalUniversity,Shenzhen518101,China; 2RenminHospitalAffiliatedtoHubeiUniversityofMedicine,Shiyan442000,China)
[Abstract]ObjectiveTo evaluate the construction of expression vector for fusion protein of cell-penetrating peptide CCL (PEP-CCL). MethodsCCL6-PEP-6XHis was inserted into plasmid pABP, pABP-CCL6-PEP plasmid was extracted and then transfected into HEK293 cells, CCL6-PEP-6XHis was expressed and purified by chromatography and detected with Western Blot. ResultsPEP-CCL express vector was successfully constructed and purified. PCR product of CCL6-PEP-6XHis Tag was ligated with T vector, recombinant was transferred into the host cells, then host cells were cultured, plasmid was extracted and sequenced, the sequence was identical to targeted gene. CCL6-PEP-6XHis was successfully inserted into the eukaryotic expression vector pABP, plasmid was extracted and digested, electrophoresis results revealed that a fragment with 430bp was digested by Hind Ⅲ+XbaⅠ, which was identical to the expected value. Western Blot revealed that CCL6-PEP fusion protein could be recognized by His monoclonal antibody. ConclusionPEP-CCL express vector can be constructed and expressed in eukaryotic cells.
[Key words]cell-penetrating peptide; CCL; gene expression; recombinant fusion protein
[收稿日期]2015-08-23
[基金项目]湖北省教育厅重点项目支持(D20112101)
[作者简介]刘勇(1973-),湖北省十堰市人,男(汉族),副主任医师,主要从事危重病研究。 [通信作者]吴君E-mail:1091372776@qq.com
DOI:10.3969/j.issn.1671-9638.2016.06.001
[中图分类号]R3Q2-33
[文献标识码]A
[文章编号]1671-9638(2016)06-0361-06
·论著·
