外源性瘦素对重症急性胰腺炎肝损伤的机制研究
2016-07-15黄元龙邓明明
颜 琼,黄元龙,尹 青,杨 丹,邓明明△
(1.西南医科大学附属医院消化内科,四川泸州 646000;2.四川省阿坝州人民医院 624000;3.湖南省郴州市第一人民医院北院 423000)
外源性瘦素对重症急性胰腺炎肝损伤的机制研究
颜琼1,黄元龙2,尹青3,杨丹1,邓明明1△
(1.西南医科大学附属医院消化内科,四川泸州 646000;2.四川省阿坝州人民医院624000;3.湖南省郴州市第一人民医院北院423000)
[摘要]目的探讨外源性瘦素对重症急性胰腺炎(SAP)大鼠肝损伤的作用机制。方法将30只雄性SD大鼠随机分为假手术组、SAP组、瘦素干预组。采用逆行胰胆管注射3.5%牛黄胆酸钠制作SAP大鼠模型。瘦素干预组大鼠腹腔内注入瘦素20 μg/kg。在术后12 h处死各组大鼠,取胰腺、肝脏组织进行HE染色、检测肝脏组织核因子-κB(NF-κB),采用细胞凋亡原位缺口末端标记法(TUNEL)测定肝脏组织的细胞凋亡指数,检测丙氨酸氨基转移酶(ALT)、天门冬酸氨基转移酶(AST)及淀粉酶(AMY)水平。结果与假手术组比较,SAP组和瘦素干预组大鼠肝脏组织病理评分均明显增加(P<0.05);与SAP组比较,瘦素干预组大鼠肝脏组织病理评分降低(P<0.05);肝脏组织NF-κB表达在SAP组和瘦素干预组较假手术组明显增加(P<0.01),与SAP组比较,瘦素干预组大鼠NF-κB表达下降(P<0.05)。肝细胞凋亡指数SAP组、瘦素干预组大鼠均较假手术组明显增高(P<0.05),而瘦素干预组较SAP组降低(P<0.05)。SAP组和瘦素干预组大鼠ALT、AST、AMY水平较假手术组显著增高(P<0.05),而瘦素干预组较SAP组降低(P<0.05)。结论外源性瘦素可能通过降低肝脏组织NF-κB的表达而降低肝细胞的凋亡指数起到保护SAP并发的肝损害作用。
[关键词]急性胰腺炎;肝损伤;瘦素;NF-κB;细胞凋亡
肝脏是重症急性胰腺炎(severe acute pancreatitis,SAP)并发损害的首要胰外器官,尽管在SAP时由于肝功能受损后所进一步导致的肝功能衰竭发生率只有5%[1],但是一旦发生了肝功能衰竭将严重影响患者的预后,并可能进一步增加疾病的病死率。SAP并发肝功能损害的机制众多,包括解剖关系、炎症介质损害、循环障碍、肝细胞凋亡等。瘦素由肥胖基因所表达,瘦素与肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)被认为是由脂肪组织所产生的免疫相关信号[2]。有实验发现,在SAP并发的肺损伤中,给予外源性的瘦素可降低肺组织中核因子-κB(unclear factor-kappa B,NF-κB)的表达水平。本试验探讨外源性瘦素对SAP并发的肝损伤组织中NF-κB的活化影响,以及对肝细胞凋亡情况的影响。
1材料与方法
1.1材料雄性SD大鼠30只,由重庆鑫腾公司提供,鼠龄8~ 12个月,体质量为250~300 g。牛黄胆酸钠、戊巴比妥钠由美国Sigma公司提供,瘦素为由博奥森公司提供(每支0.5 mg的粉剂),兔抗大鼠的NF-κB P56单抗由Biworld公司提供,细胞凋亡检测试剂盒购自罗氏公司。主要实验仪器包括:光学显微镜(NX40),全自动生化分析仪(AU3500),高速离心机(545F),光学摄像系统(AR-45),酶标仪DENLEY DRAGON,洗板机(Wellwash 4 MK2)等。
1.2方法将30只雄性SD大鼠随机分为假手术、SAP、瘦素干预3组,每组10只。SAP组、瘦素干预组采用逆行胰胆管注射法将3.5%的牛黄胆酸钠注入胰胆管中,制作SAP大鼠模型,假手术组开腹翻动胰腺周围肠道组织;关腹后将20 μg/kg剂量的瘦素注入瘦素干预组大鼠腹腔,而假手术组和SAP组大鼠注入相同剂量的生理盐水。术后各组大鼠禁食,自由饮水,12 h后剖杀各组大鼠,取胰腺组织进行HE染色,判断模型制作成功与否,肝脏组织HE染色后进行光镜下病理评分,免疫组化PV法检测肝脏组织NF-κB的表达情况,每张切片在40×10倍数光镜下,随机选取10个肝组织视野,用ipp6.0图像分析软件分析阳性面积和阳性区域平均灰度值,以阳性单位(Positive unit,PU)值的大小代表着阳性细胞表达的高低。采用原位缺口末端标记法(TUNEL)检测肝脏细胞凋亡情况,以凋亡指数(apoptotic index,AI)表示,AI检测计数方法为:分别计数5个高倍镜下凋亡肝细胞总数和该5个高倍视野下的总肝细胞数,全自动生化仪检测丙氨酸氨基转移酶(ALT)、天门冬酸氨基转移酶(AST)、淀粉酶(AMY)水平。以Saidi等[3]所提出的肝脏组织病理评分标准为指导进行病理评分。
PU=阳性面积/阳性区域平均灰度值×100%
(1)
AI值=凋亡细胞数/总细胞数×100%
(2)
2结果
2.13组大鼠胰腺组织病理变化比较假手术组大鼠胰腺组织小叶结构完整,未见到坏死、出血、炎症细胞浸润等,组织间无水肿。SAP组大鼠胰腺组织大片状坏死,结构消失,组织间大量的炎症细胞及红细胞浸润,组织间隙明显增宽。瘦素干预组大鼠胰腺组织间隙增宽,部分胰腺小叶坏死,结构紊乱,组织间可见炎症细胞及红细胞,见图1。
2.23组大鼠肝脏组织病理变化及评分比较假手术组大鼠肝细胞排列整齐,肝细胞无水肿,细胞间隙无增宽,无细胞坏死,组织间无炎症细胞及红细胞浸润。SAP组大鼠肝细胞水肿明显,细胞排列紊乱,细胞间隙增宽,组织间、肝窦及汇管区可见大量的炎症细胞及红细胞堆积,可见部分细胞出现嗜酸性变,点片状的细胞坏死。瘦素干预组大鼠细胞轻度水肿,组织间隙稍增宽,点状细胞坏死,少量细胞出现嗜酸性变,肝窦及汇管区少量的炎症细胞及红细胞(图2)。假手术组、SAP组、瘦素干预组病理评分分别为(0.15±0.24)、(7.14±1.57)、(2.89±0.78)分,假手术组明显低于SAP组和瘦素干预组(P<0.05),而瘦素干预组又明显低于SAP组(P<0.05)。
2.33组大鼠AMY、AST及ALT 3项检测结果比较3项检测数据统计分析显示,SAP组和瘦素干预组检测值较假手术组明显增高(P<0.05);而瘦素干预组其检测值明显低于SAP组(P<0.05),见表1。
2.43组大鼠肝脏组织NF-κB表达情况假手术组大鼠肝脏组织可见少量的NF-κB表达,瘦素干预组、SAP组NF-κB的表达较假手术组明显增加(P<0.01);瘦素干预组NF-κB的表达明显低于SAP组(P<0.05)。 假手术组、SAP组、瘦素干预组的NF-κB表达分别为(0.24±0.18)、(0.49±0.25)、(0.35±0.18)。免疫组化检测3组大鼠肝组织NF-κB表达情况,见图3。
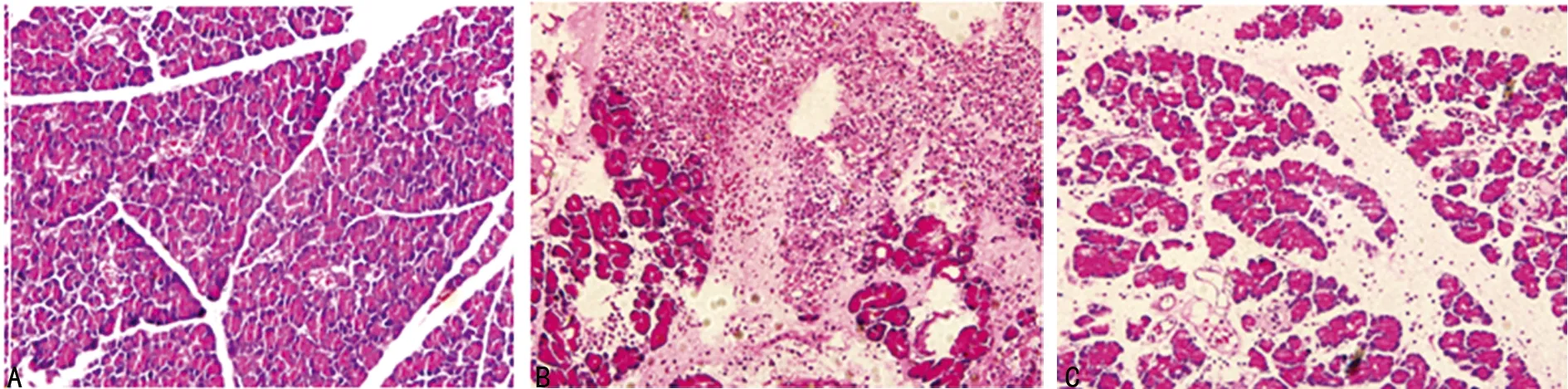
A:假手术组;B:SAP组;C:瘦素干预组。
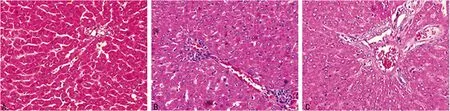
A:假手术组;B:SAP组;C:瘦素干预组。
2.5TNUEL法检测肝脏凋亡细胞通过TUNEL法检测可见各组大鼠均有凋亡细胞,假手术组凋亡细胞数量极少。假手术组、SAP组、瘦素干预组大鼠肝组织AI分别为16.22±1.74、36.13±1.67、26.85±1.20,SAP组肝细胞AI明显高于假手术组和瘦素干预组(P<0.01),瘦素干预组较假手术组AI明显增高(P<0.01)。 TUNEL法检测3组大鼠肝脏凋亡细胞的表达,见图4。
2.6NF-κB表达与TNF-α及肝细胞AI的相关性分析Pearson相关分析显示,各组大鼠肝脏组织中NF-κB的表达与肝细胞的AI、血清TNF-α水平呈正相关(r=0.868、0.926,P<0.01);肝细胞的AI与血清TNF-α水平亦呈正相关(r=0.942,P<0.01)。
表1 3组大鼠血清AMY、AST及ALT水平比较
a:P<0.05,与假手术组比较;b:P<0.05,与SAP组比较。
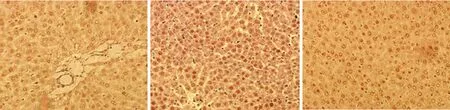
A:假手术组;B:SAP组;C:瘦素干预组。
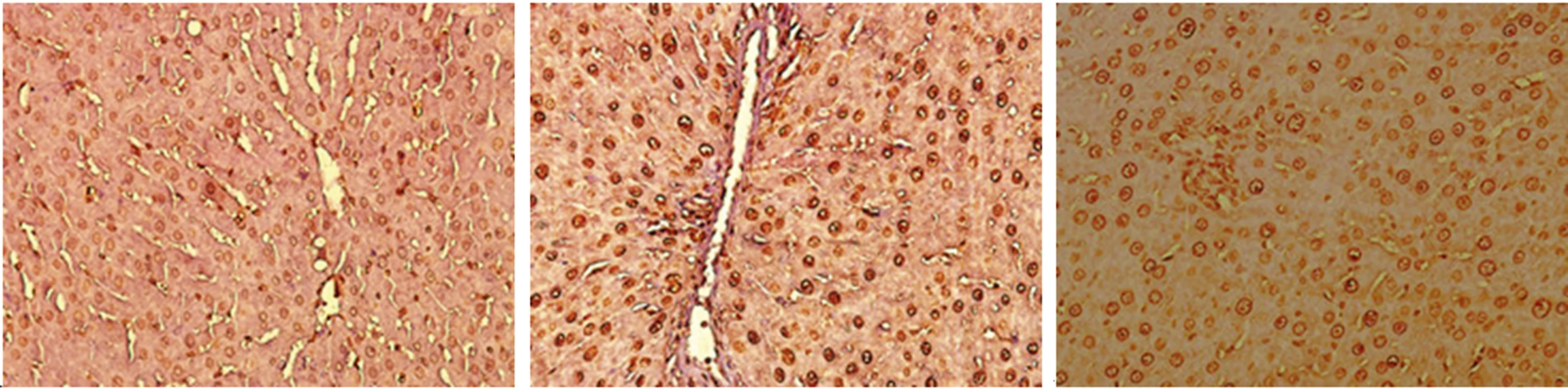
A:假手术组;B:SAP组;C:瘦素干预组。
3讨论
急性胰腺炎是胰腺组织的无菌性炎症,分为轻、中、重度[4]。中、重度的急性胰腺炎常常并发多器官功能的损害,其病死率高,并可能导致胰腺内外分泌功能障碍[5],使患者出现继发性糖尿病及慢性脂肪泻等并发症。肝细胞的过度凋亡是导致SAP时肝功能受损最直接的原因。SAP时众多因素导致了肝细胞的凋亡,如Kupffer细胞衍生的Fas配体(FasL)表达增加[6],线粒体的功能状态[7],细胞内的钙离子超载,凋亡基因的调控,氧化剂的诱导等均促使了肝细胞的凋亡发生。TNF-α也是一重要的细胞凋亡诱导因子,可通过线粒体和死亡受体途径参与细胞凋亡的调控,SAP时由于TNF-α的过度表达,诱导了肝脏细胞的凋亡和坏死,致使肝脏功能损害[8]。
NF-κB是真核内普遍存在的一种核转录因子。NF-κB的活化与细胞的凋亡有着密切的联系,NF-κB的活化可诱导感染休克大鼠的肝细胞凋亡增加[9],导致肝脏功能进一步损害。在缺血再灌注大鼠模型研究中发现,NF-κB活性增加的同时促凋亡基因Fas/FasL的蛋白表达水平亦明显升高,肝细胞的凋亡数量增加[10]。另有研究表明,NF-κB和Caspase-3在SAP肝组织中的表达呈正相关,且与肝损伤程度一致[11]。由此说明肝脏组织的NF-κB活化可能通过上调凋亡相关基因Fas/FasL及促进凋亡相关蛋白Caspase-3的表达来促进肝细胞的凋亡,SAP并发肝损伤时可见肝组织内的NF-κB大量活化,在NF-κB活化的同时伴随着肝细胞凋亡数目的增多,随着NF-κB的继续活化致使炎症介质数量进一步增多,使肝组织损害加重。在本实验中肝脏组织在12 h时,SAP组NF-κB明显升高,同时转氨酶及血清TNF-α升高,且NF-κB的升高与TNF-α的升高相关性分析结果提示二者之间存在正相关性,表明肝脏组织NF-κB的活化导致了血清TNF-α水平的升高,进而导致肝脏组织受损。另外在实验中发现在SPA 组中肝脏组织NF-κB大量活化的同时伴随着肝细胞的AI的增加,且二者存在正相关性。以上实验结果说明,SAP时肝脏组织NF-κB的活化表达促进了血清TNF-α的活化及肝细胞的凋亡,从而导致肝脏组织损害的加重。NF-κB可能是通过促进血清TNF-α的释放,诱发了肝细胞的调亡途径而促进了肝细胞的调亡,导致了SAP时肝组织的损伤。
瘦素在SAP并发的多器官功能损害中的保护作用目前已有了大量的研究[12]。在体外和体内实验研究中发现,瘦素可促进中性粒细胞的活化并趋化单核细胞,诱导IL-6α的产生,促进单核细胞/巨噬细胞活化和吞噬作用,增强淋巴细胞增殖[13-14]。瘦素可以影响胃、胰腺组织的分泌功能,能保护胃黏膜免受有害物质的损伤,且对胰腺的炎症也有作用[15]。瘦素可通过降低SAP时组织的炎症反应,改善组织血液循环等达到对胰腺组织的保护作用[16]。在本研究中,给予外源性瘦素干预后的大鼠肝脏组织NF-κB水平明显较SAP组降低,同时肝细胞的AI和血清TNF-α也有所下降,肝脏组织的病理评分降低,表明肝脏组织的NF-κB活化降低后肝脏组织的损伤明显好转。外源性瘦素在SAP大鼠肝损伤模型中对肝脏组织中NF-κB的活化有抑制作用,而NF-κB的活化与TNF-α水平和肝细胞的AI存在正相关性,本研究发现外源性瘦素可通过抑制肝脏组织中NF-κB的活化而减轻组织中的炎症介质的释放,减轻肝细胞的凋亡而达到对SAP并发肝损伤的保护作用。
但是本实验研究仅仅对于外源性瘦素的作用做了初步的研究,但瘦素抑制肝脏组织NF-κB活化的具体机制尚未明确,有待进一步进行相关研究。
参考文献
[1]TakeyamaY.Significance of apoptotic cell death in systemic Complications with severe acute pancreatitis[J].J Gastroenterol,2005,40(1):1-10.
[2]Kershaw EE,Flier JS.Adipose tissue as an endocrine organ[J].J Clin Endocrinol Metab,2004,89(6):2548-2556.
[3]Saidi RF,Chang J,Verb S,et al.The effect of methylprednisolone on warm ischemia-reperfusion injury in the liver[J].Am J Surg,2007,193(3):347-348.
[4]Sarr MG,Banks PA,Bollen TL,et al.The new revised classification of acute pancreatitis 2012[J].Surg Clin North Am,2013,93(3):549-562.
[5]Andersson B,Appelgren B,Sjodin V,et al.Acute pancreatitis——costs for healthcare and loss of production[J].Scand J Gastroenterol,2013,48(12):1459-1465.
[6]Yu HB,Zhang HF,Zhang X,et al.Resveratrol inhibits VEGF expression of human hepatocellular carcinoma cells through a NF-kappa B-mediated mechanism[J].Hepatogastroenterology,2010,57(102/103):1241-1246.
[7]肖经纬,李斌,钟才高.肝细胞凋亡机制及其检测方法的研究进展[J].国外医学(卫生学分册),2006,33(2):93-96.
[8]Malleo G,Mazzon E,Siriwardena AK,et al.TNF-alpha as a therapeutic target in acute pancreatitis--lessons from experimental models[J].Sci World J,2007,30(7):431-438.
[9]高建芝,徐自超,王庆志,等.核因子-κB与感染性休克大鼠肝细胞凋亡的关系[J].新乡医学院学报,2007,24(5):447-450.
[10]庄永敬,曹云飞,吴桂荣,等.缺血预处理对大鼠肝脏缺血/再灌注早期核因子κB活性及细胞凋亡的影响[J].肝胆胰外科杂志,2009,21(6):431-434.
[11]邹自万,郭贵海,徐萍,等.NF-κBp65、Caspase-3在重症急性胰腺炎大鼠肝损伤中的表达意义[J].江西医药,2009,44(11):1069-1072.
[12]Konturek PC,Jaworek J,Maniatoglou A,et al.Leptin modulates the inflammatory response in acute pancreatitis[J].Digestion,2002,65(3):149-160.
[13]La Cava A,Matarese G.The weight of leptin in immunity.Nature reviews[J].Immunology,2004,4(5):371-379.
[14]Sanchez-Margalet V,Martin-Romero C,Santos-Alvarez J,et al.Role of leptin as an immunomodulator of blood mononuclear cells:mechanisms of action[J].Clin Exp Immunol,2003,133(1):11-19.
[15]Gonzalez A,Merino B,Marroqui L,et al.Insulin hypersecretion in islets from diet-induced hyperinsulinemic obese female mice is associated with several functional adaptations in individual beta-cells[J].Endocrinology,2013,154(10):3515-3524.
[16]Dossin O.Laboratory tests for diagnosis of gastrointestinal and pancreatic diseases[J].Top Comp Anim Med,2011,26(2):86-97.
Protective effects of exogenous leptin on liver injury induced by severe acute pancreatitis
YanQiong1,HuangYuanlong2,YinQing3,YangDan1,DengMingming1△
(1.DepartmentofGastroenterology,AffiliatedHospitalofSouthwestMedicalUniversity,Luzhou,Sichuan646000,China;>2.AbaPrefecturePeople′sHospital,Aba,Sichuan624000,China;3.ChenzhouMunicipalNo.1People′sHospital,Chenzhou,Hunan423000,China)
[Abstract]ObjectiveTo investigate the effect and mechanism of exogenous leptin on liver injury in severe acute pancreatitis rat.MethodsThirty male SD rats were randomly divided into the sham operation group,SAP group and leptin intervention group.The SAP rat models was established by retrograde injection of 3.5% sodium taurocholate into the biliopancreatic duct.The leptin intervention group was intraperitoneally injected with leptin 20 μg/kg.The rats in each group were sacrificed at 12 h after modeling.The pancreas and liver tissues were taken for HE staining and detecting the nuclear factor kappa B(NF-κB).The cell apoptosis in situ labeling method was adopted for detecting the liver tissue cell apoptosis index.ALT,AST and AMY were detected.ResultsCompared with the sham operation group,the liver tissue pathology score in SAP group and leptin intervention group were significantly increased(P<0.05).The liver tissue pathology scores in the leptin intervention group were lower than those in the SAP group(P<0.05).The NF-κB expression of liver tissue in the SAP group and leptin intervention group was obviously increased compared with the sham operation group,the expression in the leptin intervention group was decreased compared with the SAP group (P<0.05).The liver cell apoptosis index in the leptin intervention group and SAP group was significantly higher than that in the sham operation group (P<0.05),and which leptin intervention group was decreased compared with the SAP group(P<0.05).The results of ALT,AST and AMY in the SAP group and leptin intervention group were increased significantly compared with the sham operation group(P<0.05),while which in the leptin intervention group was decreased compared with the SAP group(P<0.05).ConclusionThe exogenous leptin may play the protective effect on SAP complicating liver damage by lowering the liver tissue NF-κB expression and reducing the liver cell apoptosis index.
[Key words]acute pancreatitis;liver injury;leptin;NF-kappa B;apoptosis
作者简介:颜琼(1986-),医师,硕士研究生,主要从事胃肠及胰腺疾病的研究。△通讯作者,E-mail:793070544@qq.com。
doi:论著·基础研究10.3969/j.issn.1671-8348.2016.18.007
[中图分类号]R576
[文献标识码]A
[文章编号]1671-8348(2016)18-2471-04
(收稿日期:2015-11-21修回日期:2016-03-06)
