红花多糖对人结肠癌LoVo细胞增殖、凋亡、侵袭作用机制研究
2016-07-15童仕伦郑勇斌秦凯迪
孙 伟,童仕伦,郑勇斌,秦凯迪,宋 丹,肖 旷
(武汉大学人民医院肠胃科 消化系统疾病湖北省重点实验室,湖北 武汉 430060)
◇药学研究◇
红花多糖对人结肠癌LoVo细胞增殖、凋亡、侵袭作用机制研究
孙伟,童仕伦,郑勇斌,秦凯迪,宋丹,肖旷
(武汉大学人民医院肠胃科消化系统疾病湖北省重点实验室,湖北 武汉430060)
摘要:目的红花多糖对人结肠癌 LoVo 细胞增殖、凋亡、侵袭作用机制研究。方法体外培养人结肠癌 LoVo 细胞,在不同浓度(0.5、1.0、1.5 g·L-1)的红花多糖处理后,分别在干预24、48、72 h后采用 MTT 比色法测定红花多糖对LoVo细胞的增殖抑制作用,利用倒置显微镜观察细胞的形态,采用PI单标流式细胞仪测定细胞周期分布,Annexin V-FITC /PI 双标法检测细胞凋亡率;采用RT-PCR检测Bax、Bcl-2、Caspase-3 mRNA表达水平及检测Caspase-3活性,Western-blot检测Bax、Bcl-2、Caspase-3蛋白表达情况;应用Transwell细胞侵袭试验检测红花多糖对结肠癌LoVo细胞侵袭能力的影响。结果MTT 检测显示红花多糖能显著抑制人结肠癌 LoVo 细胞的生长、増殖,呈现浓度和时间效应关系;倒置显微镜显示红花多糖能使结肠癌LoVo 细胞出现典型凋亡特征;流式细胞仪分析结果提示红花多糖具有调节人结肠癌LoVo细胞周期的功能。RT-PCR实验和Western-blot实验结果显示随着红花多糖浓度增加可促进LoVo细胞中Bax、Caspase-3 mRNA表达,并抑制 Bcl-2 mRNA表达。Transwell侵袭实验示随着红花多糖浓度增加,LoVo 细胞侵袭能力降低。结论红花多糖能显著促进人结肠癌 LoVo 细胞凋亡,可使结肠癌LoVo 细胞增殖受到抑制,侵袭能力减弱,调节细胞周期,红花多糖的抗肿瘤的生物学效应可能与Bax、Bcl-2、Caspase-3 的信号通路有关。
关键词:红花;结肠肿瘤;肿瘤侵润;细胞凋亡;细胞增殖
结肠癌是我国最常见的恶性消化系统疾病肿瘤之一,发病率和死亡率分别排在我国肿瘤第3位和第4位[1],随着人们生活水平不断提高,结肠癌在我国发病率明显增高。由于近年来,人们对于西药成分居多的化疗药物耐药性,使得当前无特异性化疗药物,加之化疗药物对于正常细胞具有杀伤性和人体副作用较大,如今越来越多实验转移到中药研发上,红花多糖具有抗肿瘤作用,对人体毒副作用较小等优点,受到越来越多的临床医生关注,但由于红花多糖的药理作用比较复杂,目前对于红花多糖抗肿瘤机理不清楚,关于红花多糖作用结肠癌研究较少。本实验红花多糖对人结肠癌LoVo 细胞增殖,凋亡及侵袭作用机制研究,为后续红花多糖药理作用提供基础,同时还可为结肠癌治疗提供新的临床方案。
1仪器与试药
红花多糖购置西安天瑞生物技术有限公司;人结肠癌LoVo 来自武汉大学人民医院消化实验室;RPMI-1640培养基、PBS和胰酶(含EDTA)购置吉诺公司,Trizol试剂购置Sigma公司,反转录试剂盒、实时定量聚合酶连反应试剂盒购置Takara公司;细胞计数试剂盒细胞增殖购置碧云天生物技术有限公司;膜联蛋白V(Annexin V)-别藻蓝蛋白(APC)凋亡试剂盒购置美国BD Pharmingen公司;引物设计与合成来自上海生工公司;Transwell小室购置美国Corning公司;细胞培养箱(美国Thermo),光学显微镜、倒置显微镜(日本Olympus),PCR仪(美国Bio-RAD),超净工作台(苏州苏洁净化设备有限公司)。
2方法
2.1细胞培养及分组人结肠癌细胞系LoVo在含10%胎牛血清、1%青-链霉素的 RPMI-1640 培养液中培养,37 ℃、5%CO2培养箱中培养。实验中所使用LoVo细胞均处于对数生长期。待融合度至70%~80%时,将LoVo细胞胰酶(含EDTA)消化,制成细胞悬液并提前1 d将LoVo细胞接种12孔板中待细胞贴壁,生长良好后加药。实验设四组,每组重复3个样本,其中第1组为只含有RPMI-1640对照组、第2、3、4组为含有不同浓度的红花多糖RPMI-1640组。
2.2MTT比色分析法检测细胞抑制率将处于对数生长期细胞消化后制成悬液,以每孔1×103个接种于96孔板中,待细胞贴壁生长后,弃其上清,加入含红花多糖的完全培养基,置于37 ℃、5%CO2培养箱中培养24、48、72 h后,去上清,每孔加入含MTT不含胎牛血清培养基,37 ℃继续培养4 h后,去上清,加入150 μL DMSO溶解,震荡10 min使结晶完全溶解,混匀后在酶标仪检测下,测量在490 nm波长的吸光度值。每组设置3个复孔,根据公式细胞抑制率=[1-(实验组吸光度值/对照组吸光度值)]×100%,计算各组LoVo细胞抑制率并绘制抑制生长曲线。
2.3流式细胞仪检测细胞凋亡和细胞周期将处于对数生长期的细胞悬液以每孔5×105个接种于六孔板中,待24 h后,弃其上清,加入含红花多糖的完全培养基,置于37 ℃、5%CO2培养箱中培养24、48、72 h后,使用含EDTA的0.25%胰酶消化细胞,终止消化后收集细胞离心,弃上清,加PBS重悬,PBS清洗2次,1 500 r·min-1,5 min。按照Annexin V-PI细胞凋亡试剂盒说明进行操作,流式细胞仪上检测。收集细胞,调整细胞浓度为1×106·L-1,加入75%冰乙醇,4 ℃固定过夜,1 500 r·min-1,5 min,去除固定液,经PBS清洗后,加含PI的PBS进行重悬,加入RNAse,然后加入PI后4 ℃避光30 min后流式细胞仪记录细胞周期,计数G0/G1、S、G2/M期细胞比例。
2.4RT-PCR检测LoVo细胞的Bcl-2、Bax、Caspase-3 mRNA表达水平使用SPS作用于LoVo细胞0、24、48、72 h 后收集LoVo细胞,提取总RNA,离心细胞,每(5~10)×106个细胞中加入 1 mL Trizol,反复吹打或剧烈震荡充分裂解细胞直至无明显沉淀,室温静置5 min使细胞充分裂解。按 200 μL氯仿/1 mL Trizol 比例加入氯仿,充分震荡混匀后室温放置2~3 min。4 ℃ 12 000 g 离心 15 min,使样品分三层,吸取上层水相,放至另一个新 EP 管中加入等体积异丙醇,上下颠倒混匀,4 ℃静置 5~10 min。 4 ℃ 12 000 g,离心 10 min,弃上清,离心后管壁和管底出现胶状沉淀。加入1 mL 75%乙醇,悬浮沉淀。4 ℃ 12 000 g 离心5 min,尽量弃上清,室温晾干或真空干燥 5 min然后加入20 μL无Rnase的水,充分震荡混匀。Nanodrop测定RNA的纯度和纯度。OD260/OD280正常比值范围为1.8~2.0,按照Takara逆转录试剂盒说明逆转录获得Bcl-2、Bax、Caspase-3 基因cDNA。Bcl-2、Bax、Caspase-3基因及内参(磷酸甘油醛脱氢酶GAPDH作为内参)PCR引物序列见表1。R-T PCR 循环参数设定: 95 ℃ 3 min;72 ℃ 30 s,62 ℃ 40 s,经35个循环。取10 μL反应产物,进行琼脂糖凝胶电泳测定。红花多糖作用后LoVo细胞Bcl-2、Bax、Caspase-3 mRNA表达水平。采取RIPA裂解液来提取LoVo细胞内蛋白,通过BCA蛋白浓度试剂盒对所提取蛋白进行浓度测定,提取后的蛋白上样后行SDS-PAGE电泳并转膜.转膜结束后加封闭液(5%脱脂牛奶)封闭12 h,丢弃封闭液,加入Bcl-2、Bax、Caspase-3一抗(1∶100),然后过夜。TBST预洗1min,再清洗3次,每次5 min,加入二抗(1∶5 000),杂交1 h,TBST 预清洗1 min,再清洗3次,每次5 min。然后向样本中加入显色剂后闭光显色,利用凝胶图象处理系统进行分析,测定蛋白条带定量表示Bcl-2、Bax、Caspase-3 mRNA相对表达量。

表1 引物序列
2.5LoVo细胞体外侵袭能力的测定在Transwell小室上室中加入无血清RPMI-1640培养基中重悬细胞液100 μL,下室中加入750 μL含15%胎牛血清RPMI-1640培养基,放入37 ℃、5%CO2条件下培养24 h后吸取小室内液体,使用棉签檫拭上室内残留液体,4%多聚甲醛固定20 min,室温风干或真空干燥,使用0.1%结晶紫染色20 min。倒置显微镜(×100)倍下任意选取5个视野拍照片并计算5个视野计数细胞数平均值作为穿膜细胞数。
3结果
3.1药物干预后细胞形态学改变倒置显微镜下观察细胞形态,对照组LoVo细胞生长旺盛,细胞贴壁生长,折光率较高,胞体较大,成梭形或多边形,胞质均匀透明,几乎无漂浮细胞,且随培养时间的延长,对照组LoVo细胞形态变化不明显,红花多糖处理组的LoVo细胞增殖受到明显抑制,并且随着红花多糖浓度的增加和干预时间的延长,LoVo细胞逐渐变小、变圆,折光率减弱,核浓缩等,部分凋亡细胞脱落漂浮于培养瓶中。
3.2红花多糖对LoVo细胞增殖影响配置一定比例稀释后不同浓度的红花多糖对LoVo细胞生长的抑制作用,分析得出红花多糖对LoVo细胞的24、48、72 h,与未加红花多糖的LoVo细胞相比,红花多糖对 LoVo细胞的抑制率作用明显,SPS的浓度在0.5~1.5 g·L-1可一定程度上抑制LoVo细胞增殖,且随着SPS浓度的升高和干预时间增加,增殖抑制作用也逐渐增强,呈现明显的浓度和时间依赖效应,见图1。

图1 SPS对LoVo细胞增殖抑制率
3.3红花多糖对LoVo细胞凋亡影响红花多糖能够诱导LoVo细胞凋亡,经过红花多糖处理的LoVo细胞凋亡率均表现升高趋势,随着用药浓度和干预时间增加,凋亡率也随之升高,在经过 0.5、1.0、1.5 g·L-1不同浓度的红花多糖处理24 h后,各组细胞凋亡率分别为(2.65±0.33)%、(9.14±0.27)%、(15.24±0.43)%、(25.45±1.34)%,各浓度红花多糖与对照组比较差异有统计学意义(P<0.05),在同一浓度作用下,干预48 h后凋亡率进一步增加,相比于未加入红花多糖的对照组差异有统计学意义(P<0.01),并且这种差异与药物浓度和时间呈正相关性。图2流式细胞仪检测结果显示,SPS能诱导LoVo细胞凋亡。处理LoVo细胞48 h后,细胞凋亡率分别为5.94%、12.3%、15.5%,明显高于对照组凋亡率2.71%的凋亡率。

图2 流式细胞仪检测SPS对LoVo细胞凋亡的影响
3.4检测红花多糖对LoVo细胞细胞周期影响不同浓度的红花多糖作用于结肠癌LoVo细胞24 h后显示LoVo细胞表现出具有规律性的细胞周期,红花多糖浓度在0.5、1.0、1.5 g·L-1浓度时干预LoVo细胞48 h后,能抑制细胞的S期和G1/S转换,S和G2期细胞比例降低,表示SPS能够阻滞细胞周期进行,S期细胞比例分别为(39.2±0.7)%,(34.4.9±1.57)%,(29.4±0.99)%,0.5、1.0、1.5 g·L-1的浓度红花多糖组与对照组相比,出现S期细胞所占百分比逐渐降低,而浓度为0.5、1.0、1.5 g·L-1时红花多糖组差异也具有统计学意义(P<0.05),说明红花多糖能调节LoVo细胞的周期,见图3。

图3 流式细胞仪检测SPS对LoVo细胞周期的影响
3.5红花多糖对LoVo细胞侵袭影响通过Transwell试验的结果提示,根据选取视野计数各个方向上LoVo细胞数,浓度分别为0、0.5、1.0、1.5 g·L-1时,细胞数分别为(56.28±0.24)、(50.32±0.45)、(43.78±0.34)、(36.72±0.64)个,与对照组相比,差异有统计学意义(P<0.01),组间各浓度差异有统计学意义(P<0.05),该实验结果表明红花多糖降低LoVo细胞侵袭能力,见图4,5。
3.6红花多糖作用LoVo细胞后Bcl-2、Bax、Caspase-3蛋白表达通过RT-PCR检测Bcl-2、Bax、Caspase-3基因表达水平来分析红花多糖对结肠癌LoVo细胞调控凋亡相关基因表达效果影响。与浓度为0 g·L-1对照组相比,浓度为0.5、1.0 g·L-1的红花多糖干预LoVo细胞24 h后,能够显著降低调控凋亡抑制基因Bcl-2 mRNA的表达量(P<0.05),并且随着红花多糖的浓度升高可以增强调控促凋亡相关基因Bax和Caspase-3 mRNA的表达(见图6,7),SPS处理LoVo细胞48 h后,结果显示随着SPS浓度的升高,Bax蛋白表达量也逐渐升高,而Bcl-2蛋白表达量逐渐降低,数据分析显示,实验组与对照组比较,差异有统计学意义(P<0.05),对照组LoVo细胞Caspase-3相对活性为0.31±0.05,SPS组(浓度分别为0.5、1.0、1.5 g·L-1)处理LoVo细胞48、72 h后,LoVo细胞Caspase-3相对活性明显升高。各实验室组,SPS组Caspase-3相对活性升高,差异有统计学意义(P<0.05)。

图4 Transwell实验研究SPS对LoVo细胞侵袭能力影响

图5 不同浓度的红花多糖作用后LoVo细胞数量变化
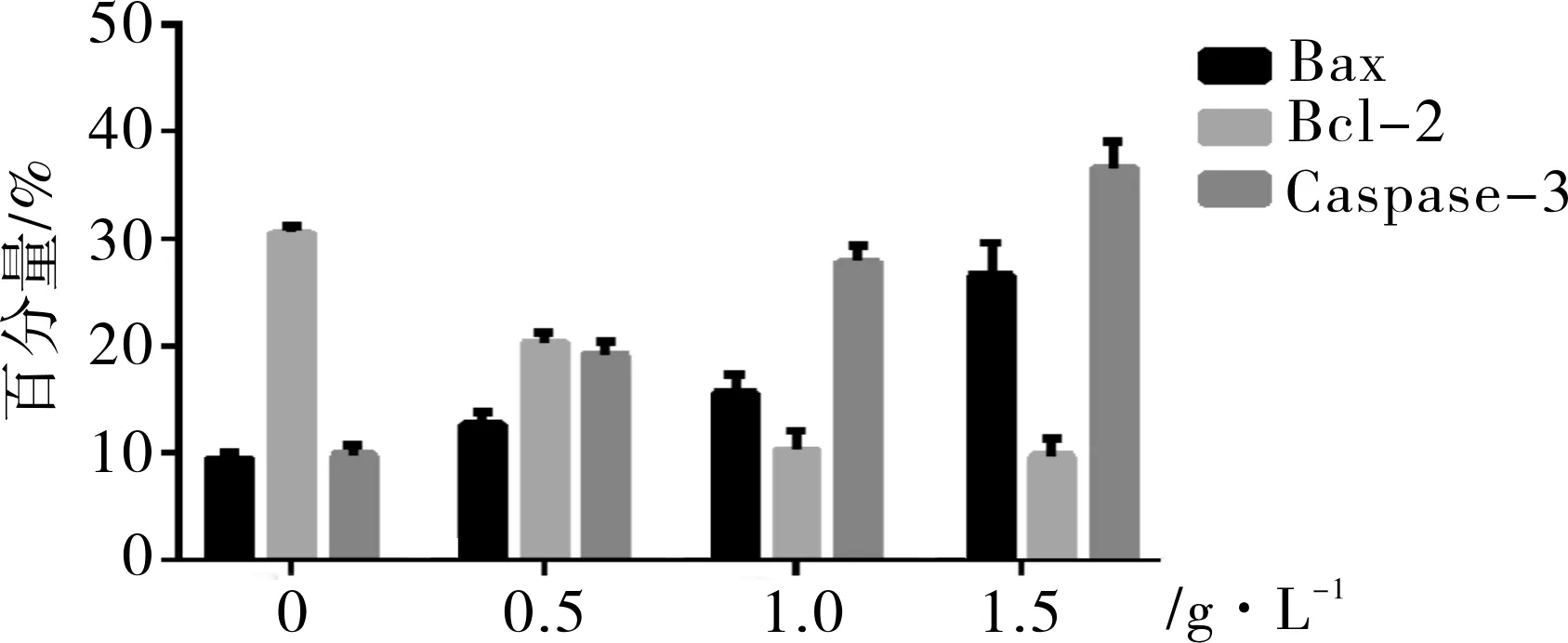
图6 SPS对LoVo细胞Bcl-2、Bax、Caspase-3

图7 SPS对LoVo细胞中Bcl-2、Bax、Caspase-3
4讨论
由于近年来国内外针对红花多糖体外作用人结肠癌细胞研究较少,本实验主要针对红花多糖对人结肠癌LoVo细胞增殖、凋亡及侵袭作用机制研究,研究红花多糖抗肿瘤机制,为今后红花多糖广泛应用于临床结肠癌治疗实验依据。
红花多糖是提取自中药红花中,是其主要活性成分,大量实验研究表明红花多糖具有抗氧化、调节机体免疫、抗肿瘤、抑制血小板聚集等多种作用[2],红花多糖抑制红花多糖抑制肿瘤细胞增殖和促进肿瘤细胞凋亡可能与细胞膜上传导通路或相关基因作用相关,在临床得到广泛应用,由于红花多糖药理作用复杂,目前对其如何促进肿瘤细胞凋亡机制仍不清楚,国内实验研究报道红花多糖可以将肝癌细胞阻滞在G2周期[3]。本研究主要研究红花多糖在体外对结肠癌LoVo细胞的增殖、凋亡及侵袭作用,可以为今后正确合理的使用红花多糖提供依据,也为明确将红花多糖应用于临床肿瘤的防治提供可靠的理论依据。
红花多糖,作为一种中药,其来源广,价格低,毒副作用少,应用十分广泛,是一种具有重大研究价值和应用价值的新型抗癌药物。大量研究实验证实红花多糖具有体外抗肿瘤功能和体内预防作用。陶冀等[4]研究认为SPS抑制肿瘤作用可能是降低AKT mRNA的表达,下调AKT和P-AKT 表达蛋白量,抑制 AKT通路而发挥抗肿瘤作用。由于诱导人肿瘤细胞凋亡的细胞信号途径较复杂,不同类型细胞的凋亡途径也不相同。目前对红花多糖诱导LoVo细胞凋亡的分子机制尚不明确,肿瘤形成是机体细胞无限制增殖和细胞凋亡不平衡一种结果,细胞凋亡在肿瘤研究中受到很大重视[5]。诱导细胞凋亡是红花多糖抗肿瘤作用的一个重要机制。但根据当前研究结果显示红花多糖诱导细胞凋亡作用在不同类型细胞所获得结果不同。Reed等[6]研究表明SPS可能抑制人结肠癌LoVo细胞增殖进而诱导该细胞凋亡,并且呈现明显的时间与剂量相关性。根据大量实验研究得出结论,Bax基因可明显促进肿瘤细胞的凋亡,Bcl-2基因可显著降低肿瘤细胞的凋亡[7]。前期实验[8-10]结果认为SPS可能作用于 Bcl-2、Bax 基因来抑制肿瘤细胞增殖及诱导细胞凋亡。Bcl-2基因调控肿瘤细胞途径是线粒体膜电位途径来完成的。凋亡抑制基因Bcl-2 与凋亡促进基因Bax相互结合形成异源二聚体[11],同时 Bcl-2基因与Bax基因的比例可直接决定肿瘤细胞是否凋亡。Bax基因表达的蛋白可以同自身构成同源二聚体,还可以与 Bcl-2基因表达的蛋白形成异源二聚体;当 Bax基因过度表达,与Bax所构成同源二聚体相对增多,一定程度抑制Bcl-2基因的作用,所形成的效应是促进肿瘤细胞凋亡;反之,当 Bcl-2基因所表达蛋白增高时,Bcl-2/Bax所形成的异源二聚体增多可以抑制肿瘤细胞凋亡[11]。Caspase-3属于半胱氨酸蛋白酶家族一员,在细胞凋亡中发挥重要作用[12]。Caspase蛋白在人体细胞凋亡过程中起着关键作用,Caspase蛋白活化后将激活整个半胱氨酸蛋白酶家族,因此凋亡一旦发生,即表现成为Caspase蛋白家族级联式反应。所有Caspase家族蛋白中,Caspase-3起着凋亡效应子作用,接受上游起动信号激活,然后特异性作用于底物使细胞发生分子水平改变和形态学变化,最终诱导细胞发生凋亡[13]。
本实验采用RT-PCR及Western blot方法检测结果提示SPS作用于结肠癌LoVo细胞,可以增强Bax 、Caspase-3mRNA 的表达量,减低Bcl-2 mRNA 的表达量,呈现出剂量相关性;而由Western blot结果提示,随着SPS干预时间的增加,LoVo细胞内Bcl-2 基因表达蛋白水平明显减少,而Bax、Caspase-3 基因表达蛋白水平则出现显著升高。我们可以认为在 mRNA 表达水平和蛋白表达水平上SPS可降低LoVo细胞Bcl-2基因的表达,上调Bax基因的表达,这一过程可能与SPS诱导人结肠癌LoVo细胞凋亡的机制有关。
本研究中MTT结果表明红花多糖能够明显抑制LoVo细胞增殖,并具有剂量-时间效应关系。红花多糖作用细胞后在倒置显微镜下观察细胞形态出现典型凋亡形态学表现。根据流式细胞仪所显示荧光强度来对凋亡细胞定量分析[14]。流式细胞仪检测细胞周期和细胞凋亡结果说明红花多糖能诱导LoVo细胞发生凋亡,增殖受到抑制,使细胞分裂停滞。Western blot和RT-PCR实验结果分析,红花多糖降低Bcl-2基因的表达同时增加Bax、Caspase-3 基因的表达,从而使 LoVo细胞发生凋亡。这提示红花多糖诱导LoVo细胞凋亡与调控Caspase-3、Bax基因高表达,抑制Bcl-2基因传导信号通路有关。
参考文献
[1]李道娟,李倩,贺宇彤.结直肠癌流行病学趋势[J].肿瘤防治研究,2015,42(3):305-306.
[2]吴伟,金鸣,童静,等.羟基红花黄色素A缓解脂多糖诱导家兔白细胞活化的作用[J].药学学报,2011,46(2):153-157.
[3]孙阳,张琪琪,石学魁,等.红花多糖诱导SMMC-7721细胞增殖阻滞的实验研究[J].中国免疫学杂志,2013,29(12):1269.
[4]陶冀,黎清炜,石学魁,等.红花多糖抑制 PI3K/Akt 信号通路诱导人胃癌细胞凋亡的研究[J].实用肿瘤学杂志,2012,26(2):119-124.
[5]Luo Z,Zeng H,Ye Y,et al.Safflower polysaccharide inhibits the proliferation and metastasis of MCF-7 breast cancer cell[J].Mol Med Rep,2015,11(6):4615-4616.
[6]Reed JC.Bcl-2 family proteins[J].Oneogene,1998,17(25):3225.
[7]张晓莉,程翔,刘洋,等.红花多糖对人肝癌 SMMC-7721细胞Bcl-2与 Bax 基因转录及蛋白表达的影响[J].中国实验方剂学杂志,2012,18(14):239-244.
[8]Ouyang L,Shi Z,Zhao S,et al.Prgrammed cell death pathway in cancer: a review of apoptosis,autophagy and programmed necrosis[J].Cell Proliferation,2012,45(6):487-499.
[9]Benderska N,Chakilam S,Hugle M,et al.Apoptosis signaling activated by TNF in the lower gastrointestinal tract review[J].Current Pharmaceutical Biotechnology,2012,13(11):2248-2258.
[10] Min LW,Li-Weber M.Targeting apoptosis pathway in cancer by Chinese medicine[J].Cancer Letters,2013,332(2):304-312.
[11] 马新博,杨婧,陈丽,等.红花多糖对人胃癌SGC-7901细胞凋亡相关基因 Bcl-2和Bax表达的影响[J].广东医学,2012,33(24):3700-3701.
[12] Degterev A,Boyce M,Yuan J.A decade of caspases[J].Oncogene,2003,22(53):8543-8567.
[13] 郭立达,焦振霞,宋瑛,等.姜黄素诱导结肠癌LoVo 细胞凋亡的作用及机制研究[J].中国中医杂志,2013,38(13):2191-2195.
[14] 石学魁.红花多糖诱导人胃癌SGC-7901细胞凋亡及对AKT信号的影响[J].黑龙江中医药大学学报,2011,10(6):333-338.
Mechanism of safflower polysaccharide on apoptosis of LoVo cell
SUN Wei,TONG Shi-lun,ZHENG Yong-bin,et al
(DepartmentofGastroenterologySurgery,RenminHospitalofWuhanUniversityKeyLaboratoryofHubeiProvienceforDigestiveSystemDisease,Wuhan,Hubei430060,China)
Abstract:ObjectiveTo study the mechanism of safflower polysaccharide (SPS) on apoptosis of LoVo cell.MethodsThe LoVo cell was treated with different concentrations of SPS (i.e.0.5、1.0、1.5 g·L-1).At 24、48、72 h after intervention,the morphology and state of cell were observed by inverted microscope,the inhibitions of cell proliferation were analysed by MTT assay,and the change of cell cycle phase and cell apoptosis were detected by flow cytometry in Annexin V-FITC/PI.The expressions of Bcl-2,Bax and Caspase-3 were detected by RT-PCR,and the expressions of Bax,Bcl-2,Caspase-3 protein were detected by Western-blot.Transwell cell invasion assay was performed to detect the effect of safflower polysaccharide on the invasion ability of colon cancer LoVo cells.ResultsCompared with normal cell,the cells treated with SPS showed typical apoptosis detected by MTT assay.Many cells were floated in medium by inverted microscope,the cell cycle was blocked in phase G1by flow cytometry,and RT-PCR and Western blot both indicated SPS can restrain the Bcl-2 and enhance Bax and Caspase-3.ConclusionsSPS can significantly induce apoptosis,inhibit growth of the LoVo cell,decrease its ability of invasion,and regulate the cycle of cells.The effect may be related to pathways of Bax,Bcl-2,and Caspase-3.
Key words:Carthamus tinctorius;Colonic neoplasms;Neoplasm invasiveness;Apoptosis;Cell proliferation
基金项目:国家自然科学基金(81372553)
通信作者:童仕伦,男,主任医师,硕士生导师,研究方向:胃肠道肿瘤防治与研究,E-mail:tongshilun@163.com
doi:10.3969/j.issn.1009-6469.2016.06.006
(收稿日期:2016-03-22 ,修回日期:2016-05-02)
