实验动物中沙门菌的实验室检测能力验证的结果与分析
2016-07-15邢进冯育芳王洪王吉岳秉飞贺争鸣
邢进,冯育芳,王洪,王吉,岳秉飞*,贺争鸣
(中国食品药品检定研究院,实验动物资源研究所,北京 100050)
实验动物中沙门菌的实验室检测能力验证的结果与分析
邢进,冯育芳,王洪,王吉,岳秉飞*,贺争鸣
(中国食品药品检定研究院,实验动物资源研究所,北京 100050)
【摘要】目的 通过实验动物中沙门菌检测能力验证计划,了解实验动物检测机构对沙门菌的检验能力,提高实验动物质量检测水平。方法 按照CNAS批准的能力验证方案,通过冷冻干燥法制备含有沙门菌及干扰菌的实验动物粪便样品,经过稳定性和均匀性检验合格,作为能力验证样品。采用随机编号,经冷链运输发放给参加单位,并附作业指导书。在规定时限提交检验报告和原始记录复印件,其结果与样品预检结果一致的判为满意结果,不一致或未能提交结果的判为不满意结果。结果 全国共有20个省市的30个实验室参加沙门菌能力验证项目,其中28个实验室获满意结果,占总参加机构的93.3%,不满意的2个实验室,占6.7%。采用分离培养方法的有29个实验室,采用PCR方法的有2个实验室。结论 实验动物质量检测机构沙门菌检测能力较高,实施能力验证计划能够反映实验室的检测水平。
【关键词】实验动物;沙门菌;能力验证;中国合格评定认可委员会
能力验证是利用实验室间的比对,确定实验室和检查机构从事特定测试活动的技术能力的活动,是实验室证明其技术能力的一种重要手段,也是实验室质量控制的重要工作。申请认可和获准认可的合格评定机构必须通过参加能力验证,包括中国合格评定认可委员会(CNAS)组织实施或承认的能力验证计划、实验室间比对和测量审核,以证明其技术能力[1]。
中国食品药品检定研究院(以下简称中检院)此前与CNAS已经联合举办了两次能力验证工作,在病毒[2]、病原菌[3]和遗传[4,5]检测项目上积累了丰富的经验。2015年中检院顺利通过了CNAS能力验证提供者(proficiency testing provider,简称PTP)的现场评审。CNAS评审组通过现场实验、关键人员技术考核、记录查考等方式,结合核查组织能力验证和比对实验经历以及其报告对中检院申请的食品、药品、实验动物等9个领域的24个产品,共60个项目/参数的PTP能力进行了确认,成为合格的能力验证提供者。
中检院作为本次能力验证活动的 PTP,依据CNAS-RL02《能力验证规则》[1]和CNAS-RL03《能力验证提供者认可准则》(ISO/IEC 17043:2010)[6]运作本次NIFDC-PT-037“实验动物粪便中沙门菌检测”的能力验证工作。
沙门菌是一种重要的人兽共患病原,能够感染各种动物,也是现有实验动物细菌检测国家标准中需首要排除的病原菌[7]。作为实验动物病原菌检测的最基本项目,本次实验动物能力验证项目设定为沙门菌,检测要求是能够检测出样品中的沙门菌,并准确鉴定。
1 材料与方法
1.1 菌种
乙型副伤寒沙门菌CMCC 50094,大肠埃希菌CMCC 44110购自中国食品药品检定研究院中国医学菌种保藏中心。奇异变形杆菌分离株,由本实验室分离保存。
1.2 SPF大鼠
SPF级SD大鼠5只,体重200~250 g,2月龄,由中国食品药品检定研究院提供【SCXK(京)2014 -0013】。实验在中国食品药品检定研究院进行【SYXK(京)2011-0008】。
1.3 主要试剂
DHL琼脂、三糖铁培养基、靛基质、尿素、赖氨酸脱羧酶试剂购自北京三药科技开发有限公司;SF增菌液和氰化钾试剂购自青岛海博;SS琼脂购自Oxoid;API 20E生化鉴定条购自生物梅里埃;革兰阴性细菌鉴定板购自BD;沙门菌诊断血清购自宁波天润。
1.4 主要仪器
Thermo Scientific A2生物安全柜、Thermo Scientific Heratherm恒温培养箱、BD Phoenix-100细菌鉴定仪、Hettich冷冻离心机、Labconco冻干机。
1.5 样品制备
将沙门菌、大肠埃希菌和变形杆菌分别用无菌生理盐水制成菌悬液,与高压灭菌的大鼠回盲内容物均匀混合,制成1份阳性和2份阴性样品,其中各菌浓度约为107CFU/g。三种样品分装于螺口1.5 mL无菌冻存管中,冷冻干燥,每管内固体含量约为50~200 mg/管。通过软件对样品编号及实验室分组,每组3管样品,包含1管阳性和2管阴性样品,其中沙门菌、大肠埃希菌、变形杆菌各1管。实验室无法通过样品编号识别组别,防止了实验室间对结果的相互串通。
1.6 样品检验
1.6.1 准确性检验
将制备样品根据实验动物粪便中沙门菌检测作业指导书处理,采用国标方法[8],对培养出的菌落形态和生化特征进行鉴定和血清凝集实验。
1.6.2 均匀性检验
在3种样品中分别随机抽取20管样品进行均匀性检验,每管样品重复测试3次。参照作业指导书,将样品管中加入500 μL无菌水,用10 μL接种环接种一满环菌液涂布于DHL琼脂上,36℃培养18 h,观察菌落数。
1.6.3稳定性检验
设置5种温度条件(37℃、25℃、4℃、-20℃和-80℃),每种温度放置20组样品,检测样品在各温度下的稳定性。37℃和25℃中样品每天取样,4℃中样品每3 d取样,-20℃中样品每周取样,-80℃中样品每月取样。参照作业指导书,将样品管中加入500 μL无菌水,用10 μL接种环接种一满环菌液涂布于DHL琼脂上,36℃培养18 h,观察菌落生长情况。
1.7 样品编号
本次能力验证样品编号延续此前的能力验证样品顺序编号,随机分组,由软件自动分配,确保每个参与实验室随机得到3种样品,见表1。
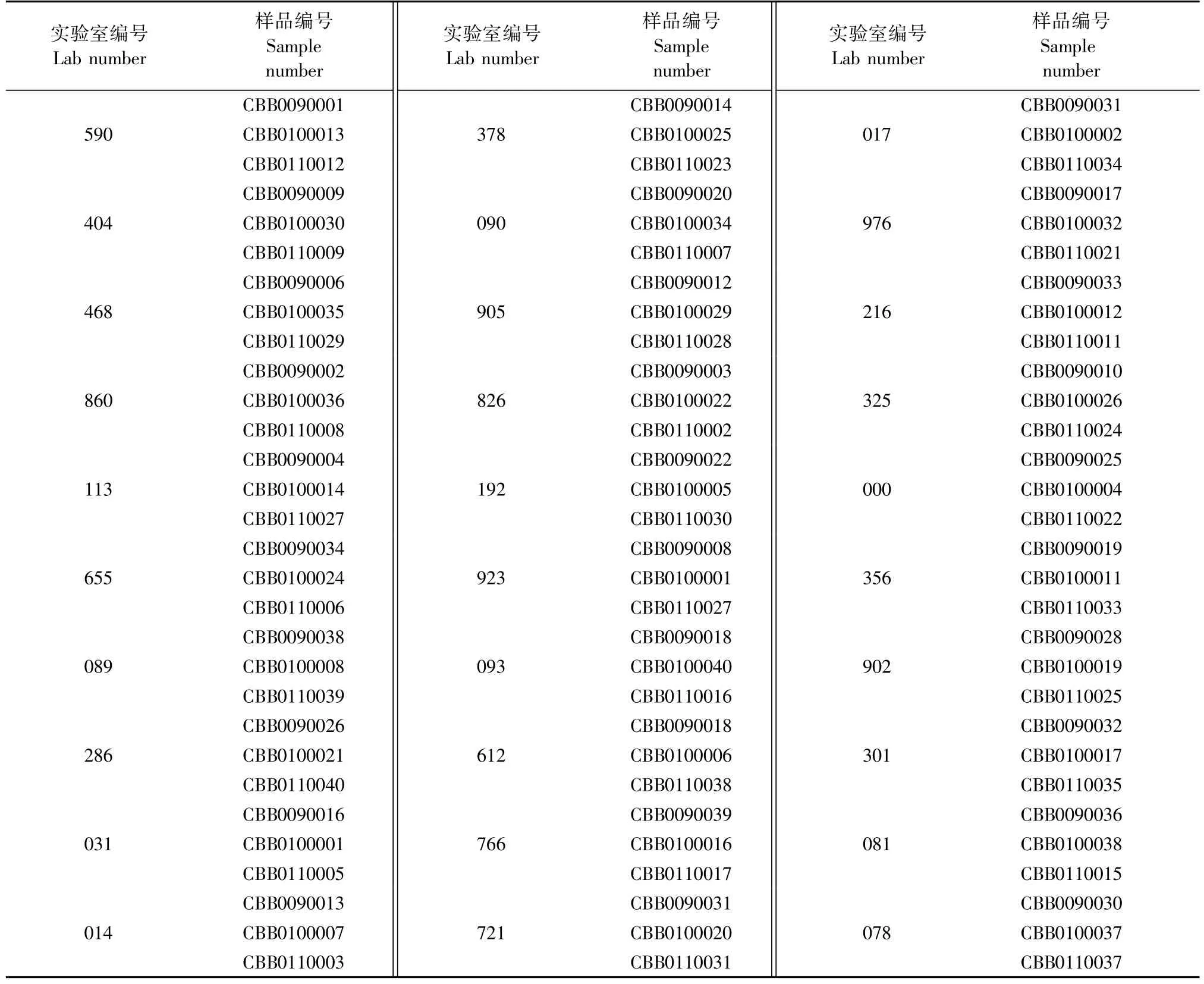
表1 样品编号设置Tab.1 Sample number setting
1.8 样品运输
样品通过干冰冷链运输寄送至参加实验室。
1.9 参加实验室
全国共有20个省市的30家实验室报名参加本次能力验证计划,其中北京4家,江苏和四川各3家,甘肃、广东、山东和上海各2家,贵州、河北、河南、湖北、湖南、吉林、江西、辽宁、陕西、天津、新疆、云南和浙江各1家。参与实验室的类型包括实验动物检测机构17家,省级疾病预防控制中心实验室2家,省市级药检系统实验室4家,科研院校实验室6家,企业内部实验室1家。
1.10 检测方法
本次能力验证未规定测试方法,建议实验室采用日常检测方法,可参考GB/T 14926.1-2001实验动物沙门菌检测方法。要求在反馈结果同时提交完整的检测报告。
1.11 结果评价原则
实验室结果与标准结果完全一致,即判定为满意结果;实验室结果与标准结果不一致,判定为不满意结果;未按时限反馈结果,判定为不满意结果。
2 结果
2.1 样品准确性
所抽检的3种样品中,沙门菌和变形杆菌在DHL和SS平皿上生长为边缘无色、中央黑心的中等大小菌落,大肠埃希菌生长为粉红色中等大小菌落,菌落形态准确。国标方法、API 20E和BD细菌鉴定仪的鉴定结果准确、一致。血清凝集实验仅沙门菌与沙门菌多价诊断血清发生凝集。
2.2 样品均匀性
3种样品在DHL琼脂平皿上的菌落数肉眼均不可计,达到样品均匀性要求。
2.3 样品稳定性
3种样品在37℃条件下可稳定存放20 d,25℃下可稳定存放40 d,4℃下至少可稳定存放60 d,-20℃下至少可稳定存放180 d,-80℃条件下至少可稳定存放240 d。
2.4 结果反馈
所有参与实验室均按时反馈结果和报告。检测结果满意的实验室为28个,满意率93.3%。不满意实验室为2个,其中1个实验室申请测量审核并通过。
3 讨论
3.1 方法的选择
根据实验动物国家标准,沙门菌的检测程序为:将样本接种于SF增菌液中再转种于DHL或SS琼脂培养基上,或直接接种上述两种培养基上。经37℃培养18~24 h后,观察有无产黑心或无色菌落。实际检测中应对产黑心和无色菌落进行纯培养并进行生化鉴定。一般情况下,在初代培养时变形杆菌经常与沙门菌的菌落形态相混淆,可以通过接种血琼脂平皿的方法来筛选,方法简便易行。变形杆菌在血琼脂上会形成弥漫生长的菌苔,沙门菌则形成单个的菌落。为避免漏检,应挑取至少3个初代平皿中的可疑菌落进行纯培养。实验动物沙门菌的检测不需要鉴定血清分型,因此血清凝集试验对于实验动物中沙门菌的检测没有决定意义。分子生物学方法的合理应用可以快速得出结果,本次参与实验室中,一家实验室使用PCR方法进行检测,获得满意结果。
在参与单位中,对样品进行增菌培养的有20个实验室,占66.7%,其余实验室将样本直接接种于固体培养基。当遇到临床样本中目标菌量极少的情况时,可能会出现假阴性结果。
3.2 不满意结果原因分析
本次比对样品中所加入的受试菌均为单一菌株,作为载体的回盲内容物已经过高压灭菌,没有杂菌的干扰。实验室404和468将阴性样品检测为阴性,但两者错误的样品不同。实验室404将变形杆菌样品检测为阳性,实验室468将大肠埃希菌样品检测为阳性。从原始记录分析,其检测步骤根据国家标准进行,错误原因可能为在检测中造成了样品间的交叉污染。
此外,本次所用变形杆菌的氰化钾生长实验为缓慢生长,如果培养时间仅为24 h以内,很可能得到氰化钾假阴性结果,由此导致整体结果的误判。
3.3 总结
一次能力验证的结果只能证明实验室参加的本次能力验证活动的情况,不能说明实验室的检测水平,只有持续参加同一项目的能力验证活动,其总体结果才能反映实验室的能力状况[1]。因此逐步完善和改进实验动物能力验证计划,对于提升整体实验动物检测工作的水平和能力具有积极意义。
CNAS-RL01:2011《实验室认可规则》、CNASRL02:2010《能力验证规则》规定申请认可和获准认可的实验室必须通过参加能力验证活动(包括CNAS组织实施或承认的能力验证计划、测量审核)证明其技术能力[1,9]。只有在能力验证活动中表现满意,或对于不满意结果能证明已开展了有效纠正措施的实验室,CNAS方受理认可申请或予以认可。当不满意结果已不能符合专业标准或规范时,除实施纠正措施并验证其有效性外,实验室还应自行暂停在相应项目的证书/报告中使用CNAS认可标识。在验证纠正措施有效后,实验室可自行恢复使用认可标识。对不能满足能力验证领域和频次要求,或虽参加了能力验证但结果不满意且未在180 d(能力验证结果报告发布之日起计)内开展纠正措施及其验证活动的实验室,CNAS可撤销其相应项目的认可资格。对参加了CNAS组织及其承认的能力验证活动且有稳定满意表现的实验室,在CNAS的各类评审中可考虑适当简化相关项目的能力确认过程。实验室应保存上述记录以备评审组检查。
参考文献
[1] CNAS-RL02:2010.能力验证规则[S].中国合格评定国家认可委员会.
[2] 李晓波,王洪,付瑞等.实验大鼠细小病毒H-1株抗体检测能力验证结果评价[J].中国药事,2014,28(9):990-994.
[3] 王洪,魏杰,李芳芳,等.实验动物质检机构碱性磷酸酶-1测定能力验证评价[J].中国药事,2014,28(12):1339-1341.
[4] 邢进,冯育芳,王洪,等.实验动物中绿脓杆菌检测能力验证的结果与分析[J].中国药事,2014,28(9):986-989.
[5] 魏杰,王洪,李芳芳,等.实验室能力验证用酯酶-3标准样品的均匀性和稳定性研究[J].中国药事,2014,28(9):990-994.
[6] CNAS-RL03:2010.能力验证提供者认可准则[S].中国合格评定国家认可委员会.
[7] GB/T 14922.2-2010,实验动物微生物学等级及监测[S]. 2011.
[8] GB/T 14926.1-2001,实验动物沙门菌检测方法[S].2001.
[9] CNAS-RL01:2011.实验室认可规则[S].中国合格评定国家认可委员会.
Results and analysis of the proficiency of laboratories in detection of Salmonella in laboratory animals
XING Jin,FENG Yu-fang,WANG Hong,WANG Ji,YUE Bing-fei*,HE Zheng-ming
(Department of Laboratory Animal Quality Testing,National Institutes for Food and Drug Control,Beijing,100050,China)
【Abstract】Objective To understand the Salmonella detectability in the laboratory animal testing laboratories,improve the level of detection for the quality of laboratory animals,by means of laboratory animals Salmonella proficiency testing program.Method According to the proficiency testing program approved by CNAS,freeze-dried animal stool samples containing Salmonella bacteria and interference bacteria were prepared,and through stability and homogeneity tests qualified as proficiency testing samples.The randomly numbered samples were issued to the participating units by cold-chain transportation,and attached work instructions.The original reports and copies of the tests should be submitted on time.The sample results consistent with the results of the pretested results were considered as satisfactory,and the results inconsistent or fails to submit were judged as unsatisfactory.Results A total of 30 laboratories from 20 provinces and cities nationwide participated in this proficiency testing programs for Salmonella,including 28(93.3%)laboratories with satisfactory results,and two laboratories unsatisfactory(6.7%).29 laboratories used separate culture methods,and two laboratories used PCR method.Conclusions The laboratory animal quality inspection agencies have good detection ability for Salmonella.The implementation of the capacity verification plan can well reflect the detection level of laboratories.
【Key words】Laboratory animal;Salmonella;Proficiency testing;China National Accreditation Service for Conformity,CNAS
【中图分类号】Q95-33
【文献标识码】A
【文章编号】1005-4847(2016)02-0191-04
Doi:10.3969/j.issn.1005-4847.2016.02.015
[基金项目]国家科技支撑计划:实验用动物病原分子生物学快速检测新技术研究与应用,课题编号2015BAI07B02。
[作者简介]邢进(1979-),男,副研究员,研究方向:实验动物微生物检测。Email:xjvet@nifdc.org.cn。
[通讯作者]岳秉飞(1960-),男,博士,研究员,研究方向:实验动物学。Email:y6784@126.com。
Corresponding author:YUE Bing-fei,Email:y6784@126.com
[收稿日期]2016-01-13
