染色体核型异常和Y染色体微缺失在男性不育中的临床研究
2016-07-14邵小光
裘 娟,李 岩,刘 璐,刘 群,邵小光
(1.大连市妇女儿童医疗中心 生殖与遗传医学中心,辽宁 大连 116037;2.大连医科大学 解剖学教研室,辽宁 大连 116044)
染色体核型异常和Y染色体微缺失在男性不育中的临床研究
裘娟1,李岩2,刘璐2,刘群1,邵小光1
(1.大连市妇女儿童医疗中心 生殖与遗传医学中心,辽宁 大连 116037;2.大连医科大学 解剖学教研室,辽宁 大连 116044)
[摘要]目的探讨染色体异常及Y染色体微缺失在男性不育中的临床意义。方法选择2013年1月至2015年6月来大连市妇女儿童医疗中心生殖与遗传医学中心要求助孕的90例无精子症患者(无精子症组),62例严重少精子症患者(严重少精子症组)及50例已有生育史或精液常规检查正常男性自愿者(正常对照组),采用外周血常规染色体制备方法对染色体进行核型分析。其中无精子症组56例,少精子症组42例,正常对照组30例,采用多重聚合酶链反应进行Y染色体无精子因子(AZF)微缺失检测。结果90例无精子症者检出染色体核型异常16例,异常率为17.8%,均为性染色体异常;62例严重少弱精子症者检出染色体核型异常9例,异常率为14.5%,分别为性染色体异常6例(9.7%),常染色异常3例(4.8%);三组组间比较差异均有显著性意义(P<0.01)。9例无精子症及4例少精子症患者检测出Y染色体AZF微缺失,缺失位点为AZFb 1例、AZFc 10例、AZFd 1例、AZFc+d 1例,30例对照组未见缺失。结论染色体异常与Y染色体微缺失是男性不育的重要病因,其检测为男性不育临床诊断和治疗提供科学依据。
[关键词]男性不育;无精子症;严重少精子症;染色体异常;Y染色体微缺失
[引用本文]裘娟,李岩,刘璐,等.染色体核型异常和Y染色体微缺失在男性不育中的临床研究[J].大连医科大学学报,2016,38(1):48-51.
育龄夫妇中不孕不育的发生率为10%~15%,其中男性因素约占50%。染色体异常是男性不育的首要原因,Y染色体微缺失是造成男性不育的第二大遗传学因素[1]。造成睾丸生精障碍的主要原因:(1)染色体异常,克氏症为其中的大多数,在不育男性中发病率为3%[2];国外文献报道无精子症中染色体异常率为12.5%~31%,严重少精症中染色体异常率为1.1%~13.3%。(2)Y染色体微缺失,Y染色体长臂上含有的无精子因子(azoospermia factor,AZF)是导致睾丸精子生成障碍的主要原因。2014年欧洲男科学协会(EAA)和欧洲分子遗传实验质控协作网(EMQN)在Y染色体微缺失检测指南中指出,中国地区男性Y染色体微缺失发生率为11.5%[3]。本研究旨在探讨男性不育患者精子异常情况与染色体核型及Y染色体微缺失的关系。
1资料与方法
1.1一般资料
选择2013年1月至2015年6月于大连市妇女儿童医疗中心生殖与遗传医学中心要求助孕的无精子症患者90例作为无精子组;严重少精子症患者62例作为少精子组。无精子组年龄24~43岁,平均年龄(32.8±5.7)岁;不育年限1~14年,平均(4.7±3.7)年;少精子组年龄26~50岁,平均年龄(35.2±6.6)岁;不育年限1~18年,平均(4.1±4.3)年。每名患者详询病史及生育史,排除外伤史和家族遗传病史,排除女方不孕因素,经皮睾丸穿刺精子抽吸术/经皮附睾穿刺精子抽吸术(TESA/PESA)者穿刺之前行生殖器体格检查。对照组为同期年龄相当、已有生育史或精液常规检查正常的健康男性50例。采用外周血常规染色体制备方法对染色体进行核型分析。其中无精子症组56例,少精子症组42例,正常对照组30例,采用多重聚合酶链反应进行Y染色体AZF微缺失检测。
1.2精液分析
排精后2~7 d手淫法收集精液,手工精液分析参照WHO标准指南,所有病例均常规进行至少2次以上的精液分析检查。镜下检查未见精子者的精液,1500 r/min离心15 min沉淀后仍未发现精子者为无精子症,并排除逆向射精;精子浓度<5×106/mL为严重少精子症。
1.3染色体检查
外周血染色体常规制备方法对染色体进行核型分析,G显带分析计数20个中期分裂象,分析5个细胞核型,异常核型则分析20个分裂象,根据《人类细胞遗传学国际命名体制》描述染色体异常核型。
1.4Y染色体微缺失检测
从外周血淋巴细胞提取DNA,参考欧洲生殖协会(EAA)2014版指导原则和EMQN标准,选择Y染色体微缺失共4个区域9个位点设计引物,9个选择位点分别是AZFa(SY84、SY86)、AZFb(SY127、SY134、SY143)、AZFc(SY157、SY254、SY255)、AZFd(SY152),以SRY和ZFX/Y的扩增作为PCR质控对照,正常男性的DNA作为阳性对照,正常女性DNA作为阴性对照,灭菌蒸馏水作为空白对照,与患者DNA同时进行以上各位点的多重PCR,分两组进行扩增,扩增后电泳检查PCR扩增产物。
1.5睾丸/附睾穿刺
会阴局部皮肤消毒,检查附睾寻找穿刺位点,用注射器连接5号半头皮针经皮直接穿刺抽吸附睾组织饱满处抽吸附睾液寻找活动精子;若一侧附睾穿刺取精失败则检查对侧附睾穿刺取精;以上均失败则用注射器连接7号头皮针经皮直接穿刺睾丸抽取生精小管寻找活动精子。
1.6统计学方法
采用SPSS17.0统计软件进行分析。比较各组染色体异常的发病率。n≥40,且所有期望值T≥5时,采用pearson卡方检验;n≥40,1≤T≤5时,采用连续校正卡方检验。P<0.05视为差异有统计学意义。
2结果
2.1染色体异常核型检出率及分布
90例无精子症患者检出染色体异常核型16例,异常率为17.8%,均为性染色体异常。其中克氏综合征10例(11.1%);47,XYY 1例;Y染色体部分缺失5例(5.5%)。另外有染色体多态性4例(4.4%),见表1。62例严重少精子症患者染色体异常核型9例,异常率为14.5%,分别为性染色体6例(9.7%),常染色体3例(4.8%),另外有染色体多态性3例(4.8%),见表2。50例对照组中未发现染色体异常核型,检出染色体多态性2例(4%),分别是21ps+和小Y。3组间异常核型染色体检出率差异有显著性意义(P<0.01)。见表3。
表1无精子症患者染色体异常核型分类及分布
Tab 1 Classification and distribution of chromosomal anomalies in 90 azoospermia patients

分类及染色体核型例数率(%)总异常染色体1617.8 性染色体异常 47,XXY1011.1 47,XYY11.1 46,XY,del(Y)(q12)55.5染色体多态44.4 46,XY,小Y22.2 46,XY,大Y11.1 46,XY,21ps+11.1
表2严重少精子症患者染色体异常核型分类及分布
Tab 2 Classification and distribution of chromosomal anomalies in 62 severe oligozoospermia patients
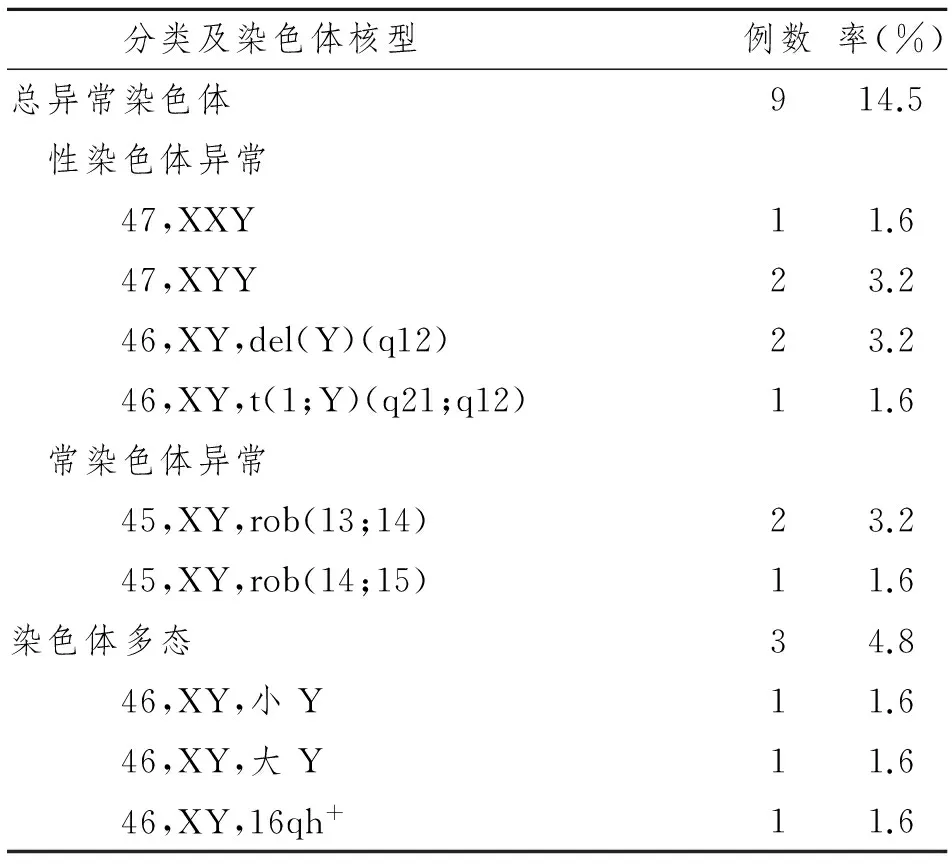
分类及染色体核型例数率(%)总异常染色体914.5 性染色体异常 47,XXY11.6 47,XYY23.2 46,XY,del(Y)(q12)23.2 46,XY,t(1;Y)(q21;q12)11.6 常染色体异常 45,XY,rob(13;14)23.2 45,XY,rob(14;15)11.6染色体多态34.8 46,XY,小Y11.6 46,XY,大Y11.6 46,XY,16qh+11.6
表3三组之间异常染色体发生率的比较
Tab 3 Comparison of chromosomal anomaly occurrence rate in three groups
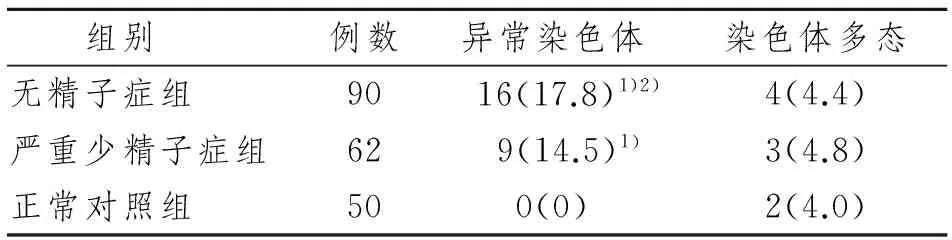
n(%)
1)与正常对照组比较,P<0.01;2)与严重少精子症组比较,P<0.01
2.2Y染色体微缺失检测
共128例进行AZF微缺失检查,发现有13例存在微缺失,其中9例为无精子症,4例为严重少精子症。包括AZFb、AZFc、AZFd及AZFc+d区缺失。见表4。
表 4Y染色体微缺失发生率的比较
Tab 4 Comparison of Yq microdeletion occurrence rate in three groups
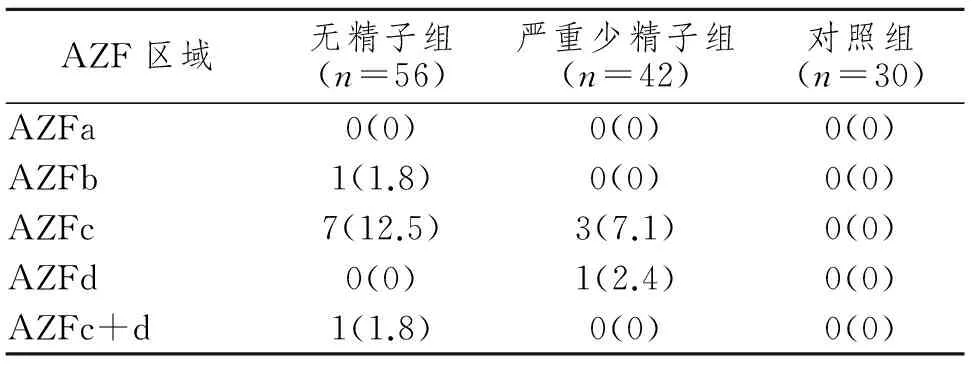
n(%)
3讨论
染色体异常是引起男性生殖功能障碍的重要原因,尤其是性染色体异常。本文中无精子症患者中异常染色体的检出率为17.8%,显著高于严重少弱精子症患者的异常核型检出率14.5%,对照组中未发现染色体异常核型。结果表明精液情况越差,其染色体异常核型检出率越高,尤其是性染色体的异常对生精功能影响最大,这与其他一些文献报道相符[4-5]。此外,本文在无精子症患者中检出染色体多态性4例(4.6%),在严重少精子症患者中检出染色体多态性3例(4.8%),与正常对照组2例(4.0%)相比差异无显著性意义,验证了染色体多态性是异染色质的高度重复,从分子水平上看结构异染色质所含DNA主要是“非编码”的高度重复序列,不含有结构基因,没有转录活性,这与其他文献报道相符[6]。
克氏综合征,全名克莱恩费尔特氏综合征(Klinefelter's征、先天性睾丸发育不全),最常见的染色体核型是47,XXY。报道称其发生率在不育男性中占3%,无精子症患者中占13%。本文90例无精子症患者中检出10例47,XXY,占无精子症患者的11.1%,与文献报道相符。染色体核型的异常发生原因推测是卵子或精子在减数分裂时染色体未分离,从而导致子代多出1条X染色体。病人在出生时和儿童期与正常人没有什么差别,只是到了青春期,才显露出一些病态,外观是男性,但睾丸小,阴茎可有一定程度的发育,但也较正常人小,多数患者阴茎能勃起,也可射精,但精液中无精子或精子量极少,因故称无精症,大多数患者不能自然生育。通过辅助生殖技术,胞浆内单精子显微注射技术(ICSI),可能使少部分克氏综合征患者生产自己的后代[7]。如果精液中有精子,大部分都是正常染色体的精子;如果患者射出精液中无精子,这其中也有少部分患者能从睾丸活检得到所需要的精子或精子细胞。迄今有文献报道487例采用父亲精子行ICSI助孕,200例患者获得妊娠,其中4例流产,2例产前诊断发现胎儿染色体为47,XXY,行减胎手术。194个婴儿出生,核型均正常。本文中有3例47,XXY的无精症患者穿刺见到成熟活精子,3例穿刺未见精子,4例患者拒绝睾丸/附睾穿刺。本实验室同时为穿刺取出的精子做FISH检测,均见到正常染色体的精子,遂行ICSI治疗,其中2例妊娠,妊娠中期行羊水穿刺查胎儿染色体均正常,分娩2个健康活婴。
Y染色体微缺失是导致生精障碍的重要因素。此类患者大都不育,但可通过ICSI技术生育后代。研究表明Y染色体微缺失发生的AZF区域不同,相应的临床表型也有所不同,因此AZF缺失位点检测可为男性不育症临床诊治方案的选择提供依据。AZFa区缺失患者比较罕见,约占Y染色体微缺失的1%~5%,临床表现为唯支持细胞综合征(SCOS),几乎不可能通过睾丸穿刺得到精子[8]。AZFb缺失的患者约占Y染色体微缺失的3%~5%,表现为精子成熟障碍,也不能通过外科技术取到成熟精子。AZFc缺失是较常见的缺失类型,约占60%以上[9],该类患者生精表型变异比较大,从无精症、严重少精、少弱精以及正常精子都有可能。在AZFc缺失的无精症患者中50%以上的患者可通过附睾穿刺获得精子。AZFa、AZFb和AZFc三个区全部缺失患者,主要见于异常核型患者,如46,XX或iso(Y)男性患者,因此100%表现为无精子症[10]。AZFb和AZFc完全缺失患者表现为唯支持细胞综合征或生精障碍导致的无精症,也不能进行经睾丸或附睾穿刺取得精子。这些区域的微缺失或联合缺失均会影响男性胚细胞发育和维持,影响精子的产生。在生育方面,前文提到AZFa、AZFb缺失者活检到精子可能性很小,因此可以通过供精人工授精(AID)或供精体外受精(IVF-D)技术来获得妊娠,获得下一代。而AZFc缺失者75%可以检到成熟精子,可以用丈夫精子行ICSI获得妊娠。但有研究表明Y染色体微缺失患者子代的生育力比父代更差。且ICSI子代可出现Y染色体微缺失的垂直遗传、扩大和新生缺失。因此,Y染色体微缺失患者男性后代生精障碍的严重程度不可预知。所以,对严重少精和无精的男性不育患者,应常规行Y染色体微缺失检测,并在其行ICSI治疗前充分告知其男性后代可能发生的基因和睾丸表型异常。本研究中检测到Y染色体微缺失的类型大多为AZFc,有10例,另外有AZFb、AZFd、AZFc+d各1例,其中7例AZFc缺失的无精子患者中,有3例穿刺见成熟精子,与报道相符。
综上所述,无精子症、重度少弱精子症与染色体核型高度相关,与Y染色体微缺失也密切相关,另外,由于Y染色体是单倍体,会垂直遗传给下一代男性,所以为了避免将这种微缺失遗传给男性子代,避免原发性无精子症患者做无必要穿刺,对于男性不育症患者在提供辅助生殖技术之前进行染色体核型分析、Y染色体微缺失检查,是非常有意义的。
参考文献:
[1] 何楠楠,孙莹璞.男性不育中Y染色体微缺失的研究进展[J].生殖与避孕,2012,32(7):482-485.
[2] 张雅君,卢实.无精子症、重度少弱精子症患者染色体核型与Y染色体微缺失发生率的研究[J].中国男科学杂志,2014,28(7):44-48.
[3] Krausz C, Hoefsloot L, Simoni M, et al. EAA/EMQN best practice guidelines for molecular diagnosis of y-chromosomal microdeletions: state-of-the-art 2013[J]. Andrology, 2014, 2(1): 5-19.
[4] Suganthi R, Vijesh VV,Vandana N,et al.Y choromosomal microdeletion screening in The Workup of Male Infertility and its current status in India[J].Int J Fertil Steril,2014,7(4):253-266.
[5] Singh R,Kaleem AM,Narayana S, et al. A case of oligoasthenoterat ozoospermia with AZFc deletion and persistent oxidative stress[J].Indian J Hum Genet,2012,18(3):359-362.
[6] Hong Y, Zhou YW,Tao J,et al,Do polymorphic variants of chromosomes affect the outcome of in vitro fertilization and embryo transfer treatment?[J].Hum Reprod,2011,26(4):933-940.
[7] Greco E, Scarselli F, Minasi MG, et al. Birth of 16 healthy children after ICSI in cases of nonmosaic Klinefelter syndrome[J]. Hum Reprod,2013,28(5):1155-1160.
[8] Kleiman SE,Almog R,Yogev L,et al.Screening for partial AZFa microdeletions in the Y chromosome of infertile men:is it of clinical relevance[J].Fertil Steril,2012,98(1):43-47.
[9] Soares AR,Costa P,Silva J,et al.AZFb microde-etions and oligozoospermia-which mechanisms[J].Fertil Steril,2012,97(4):858-863.
[10] Lange J,Skaletsky H,van Daalen SK,et al.Isodicentric Y chromosomes and sex disorders as byproducts f homologous recombination that maintains palindromes[J].Cell,2009,138(5):855-869.
Clinical signification of chromosomal anomalies and Y chromosomal microdeletions in male infertility
QIU Juan1, LI Yan2, LIU Lu2, LIU Qun1, SHAO Xiao-guang1
(1.ReproductiveandGeneticMedicalCenter,DalianMunicipalWomenandChildren'sMedicalCenter,Dalian116037,China;2.DepartmentofAnatomy,DalianMedicalofUniversity,Dalian116044,China)
[Abstract]Objective To assess the relevant relationship and clinical significance of Y chromosomal microdeletions and chromosomal anomalies in male infertility. Methods 90 cases of azoospermia, 62 cases of severe oligozoospermia and 50 normal fertile men in our reproductive center were recruited. Karyotype analysis was performed in peripheral blood lymphocytes using standard G-banding on all cases. Y chromosome AZF microdeletions were detected using multiplex PCR on 56 cases of azoospermia, 42 cases of severe oligozoospermia and 30 normal control. Results Chromosomal anomalies were identified in 16 of 90 azoospermia patients (17.8%). All abnormalities were on sex chromosomes. Chromosomal anomalies were identified in 9 of 62 oligozoospermia patients (14.5%), including sex chromosomal abnormalities in 6 patients (9.7%) and euchromosomal abnormalities in 3 patients (4.8%). The chromosome abnormal rates in both azoospermia and severe oligozoospermia groups were significant higher than that in the healthy men (P<0.01). AZF microdeletions were identified in 9 azoospermia patients and 4 severe oligozoospermia patients. The microdeletion sites were AZFb 1 case, AZFc 10 cases, AZFd 1 case, and AZFc+d 1 case. No such deletions were observed among the 30 normal fertile men in the contral group. Conclusion Chromosomal anomalies and Y chromosome microdeletions are major causes for male infertility. Chromosomal analysis will provide scientific indications for diagnosis and treatment of male infertility.
[Key words]infertile men; azoospermia; severe oligozoospermia; chromosomal anomaly; Y chromosome microdeletion
doi:论著10.11724/jdmu.2016.01.12
作者简介:裘 娟(1982-),女,辽宁大连人,主管技师。E-mail:21632277@qq.com 通信作者:邵小光,主任医师。E-mail:shaoxiaoguang03@sina.com
[中图分类号]R615
[文献标志码]A
文章编号:1671-7295(2016)01-0048-04
(收稿日期:2015-10-29;修回日期:2015-12-24)
