vIL-10对鼻咽癌细胞株MHC-1类分子抗原加工提呈“操纵子”表达的影响
2016-07-14任艳鑫孙瑞梅赵留芳张世文费继敏尚艺泰李舟蕾李晓江
任艳鑫,杨 洁,孙瑞梅,赵留芳,李 磊,张世文,费继敏,尚艺泰,李舟蕾,李晓江
(昆明医科大学第三附属医院,云南省肿瘤医院头颈外科,云南昆明 650118)
◇基础研究◇
vIL-10对鼻咽癌细胞株MHC-1类分子抗原加工提呈“操纵子”表达的影响
任艳鑫,杨洁,孙瑞梅,赵留芳,李磊,张世文,费继敏,尚艺泰,李舟蕾,李晓江
(昆明医科大学第三附属医院,云南省肿瘤医院头颈外科,云南昆明650118)
摘要:目的研究病毒白介素-10(vIL-10)对鼻咽癌细胞株MHC-1类分子抗原加工提呈“操纵子”表达的影响。方法收集不同时间段vIL-10处理的鼻咽癌细胞(CNE-1和CNE-2),采用RT-PCR、Western blot方法检测vIL-10处理的鼻咽癌细胞中MHC-1类分子抗原加工提呈“操纵子”(TAP-1、2,LMP-2、7及HLA-I)表达的变化。结果①mRNA水平:CNE-1和CNE-2的TAP-1水平在不同时间点均未表现出显著差异;vIL-10作用1、4、6、12 h时,CNE-1和CNE-2的TAP-2、LMP-2均未出现变化,24 h时,两者均出现显著下降甚至消失;CNE-1在vIL-10作用后4 h即出现LMP-7下降,而CNE-2在vIL-10作用后6 h出现下降;在vIL-10作用24 h时CNE-1和CNE-2的HLA-I出现显著下降。②蛋白水平:vIL-10作用后24 h时,两种细胞的TAP-1均出现显著下降,TAP-2则在vIL-10作用后1、6、12、24 h出现逐渐下降;CNE-2的LMP-2、LMP-7在vIL-10作用后随时间逐渐下降,而CNE-1的两种蛋白仅在作用后12 h出现显著下降;HLA-I在vIL-10作用后出现下降趋势,但在CNE-1中各时间段变化无统计学差异,CNE-2在24 h 显著下降。结论vIL-10可明显抑制鼻咽癌MHC-I类分子抗原加工和提呈的“操纵子”的表达,并且呈一定的时间依赖性。
关键词:鼻咽肿瘤;病毒白介素-10;抗原处理相关转运体蛋白(TAP);低分子量多肽复合物(LMP);人类白细胞抗原-I(HLA-I)
抗原处理相关转运体蛋白(transporter associated with antigen processing, TAP)主要功能是与低分子量多肽复合物-2、7(1ow molecular mass polypeptide, LMP-2、7)一起加工、转运内源性抗原肽(其中包括肿瘤抗原)至内质网,在内质网锚定的主要组织相容性复合体(major histocompatibility complex, MHC)(主要是HLA-I)结合抗原肽后将其呈递至细胞表面供CD8+细胞毒性T淋巴细胞(CTLs)识别,从而启动细胞免疫。由于MHC-I类基因、TAP基因、LMP-2及LMP-7基因位置靠近,转录活性同时受干扰素的诱导,能够协调三者基因产物的量,有效提呈抗原,故三者构成的系统被比喻成真核生物MHC-I类分子抗原加工和提呈的“操纵子”,其主要作用是将外源性抗原提呈并激活CD8+CTL,启动机体细胞免疫。在一系列抗原呈递过程中,无论哪个环节出现异常都会影响肿瘤抗原的提呈,抑制机体对肿瘤的免疫杀伤。其中人们比较关注的是TAP基因表达的调控。TAP-1启动子是593 bp的双向启动子,包含IFN-r反应元件、P53反应元件和NF-κB结合位点。其中任何异常调节反应元件及影响NF-κB的因素都可以引起TAP基因的表达异常,从而影响抗原加工和提呈的“操纵子”,最终引起肿瘤细胞表面抗原的表达异常[1]。研究发现,在小细胞肺癌、结直肠癌、乳腺癌、恶性黑色素瘤、头颈恶性肿瘤及脑恶性肿瘤中都有TAP-1、LMP-2、LMP-7及HLA-I的缺失或下调,转染TAP-1后可诱导LMP-2、LMP-7及HLA-I表达的增加[2-5]。TAP的表达可以被某些细胞因子[如干扰素(interferon, IFN)-γ、IFN-α和肿瘤坏死因子(tumor necrosis factor, TNF)-α]和脂多糖等诱导,TAP表达上调与MHC-I类分子递呈和CTL杀伤功能的增强密切相关,IFN-γ作用12 h后TAP-1和TAP-2的mRNA可上调10~20倍,IL-10会导致TAP转录及翻译水平的下调,从而引起MHC-I类分子表达下调[6]。同时,SCHOTTELIUS等[7]发现IL-10通过抑制FN-κB通路中IκBa的活性从而抑制NF-κB的激活,限制其转移到细胞核内发挥转录作用。
我们前期研究发现鼻咽癌组织中TAP-1、TAP-2、LMP-2、LMP-7及HLA-I存在表达下调或缺失[8]。在鼻咽癌新鲜组织中检测到高表达的病毒白介素-10(vIL-10),并且认为vIL-10可以导致鼻咽癌患者免疫细胞出现偏移,表现为免疫抑制[9]。为验证vIL-10是否通过抑制MHC-I类分子抗原加工和提呈的“操纵子”的功能来实现其免疫抑制作用,本文通过RT-PCR、Western bolt检测vIL-10对鼻咽癌细胞株MHC-I类分子抗原加工和提呈的“操纵子”表达的影响,探讨vIL-10对鼻咽癌细胞免疫抑制的影响及可能的机制。
1材料与方法
1.1细胞株及vIL-10人鼻咽癌细胞株CNE-2由云南省肿瘤研究所馈赠,CNE-1细胞株由中山大学肿瘤防治中心馈赠。Recombinant Viral HCMV IL-10购自美国R&D Systems 。
1.2主要试剂组织蛋白裂解液(RIPA)、PMSF、300 g/L丙烯酰胺溶液、1.5 mol/L Tris-HCl缓冲液、1 mol/L Tris-HCl缓冲液、100 g/L过硫酸铵、Tween 20、Tris(相对分子质量121.14)、甘氨酸(相对分子质量75.07)、十二烷基硫酸钠(SDS)、丽春红均购自北京Solarbio公司,TEMED(FW:116.2)购自美国Sigma公司,ECL显色液购自美国Millipore公司,蛋白质定量试剂盒(BCA法)购自北京普利莱。
1.3鼻咽癌细胞株的培养CNE-1、CNE-2培养于含100 mL/L FBS的RPMI 1640完全培养基,细胞均置于37 ℃、含50 mL/L CO2的细胞培养箱中。
1.4vIL-10配制取0.02 g BSA加入20 mL PBS中,使其终浓度为1 g/L。取250 μL 1 g/L BSA液,加入25 μg vIL-10,使vIL-10的浓度为100 μg/mL。将制备的vIL-10分装,-20 ℃保存。
1.5RT-PCR检测TAP-1、TAP-2、LMP-2、LMP-7和HLA-I mRNA的表达收获细胞按照试剂盒提取总RNA,紫外分光光度计下测A260 nm及A280 nm处的吸光度(A值)。计算A260/A280的比值,留取比值在1.8~2.0的样本进行逆转录。RNA定量:RNA浓度(μg/mL)=A260×40×100。逆转录具体步骤参考文献[10],各个基因引物序列见表1。
1.6免疫印迹法检测TAP-1、TAP-2、LMP-2、LMP-7和HLA-I蛋白的表达收集细胞并裂解,按照试剂盒提供的方法提取总蛋白,BCA法测定蛋白浓度。取等量蛋白(25 μg)样品进行100 g/L聚丙烯酰胺凝胶电泳1 h,湿法电转膜,50 g/L脱脂奶室温封闭1 h,加入一抗室温孵育0.5 h后4 ℃过夜,加入二抗室温孵育1.5 h,显影、定影。
表1各个基因引物序列
Tab.1The primers for individual genes

基因引物序列GAPDH上游:5'-GAAGGTGAAGGTCGGAGTC-3'下游:5'-GAAGATGGTGATGGGATTTC-3'TAP-1上游:5'-ACCCTACCGCCTTCGTTGT-3'下游:5-TGAGCCATCTTGTAGAATCCAGTC-3'TAP-2上游:5'-CTGCGAAGATGATAAGGTGATG-3'下游:5'-GCCAGACGTTGTTTCTGTCC-3'LMP-2上游:5'-TTGTGATGGGTTCTGATTCCCG-3'下游:5'-CAGAGCAATAGCGTCTGTGG-3'LMP-7上游:5'-TCGCCTTCAAGTTCCAGCATGG-3'下游:5'-CCAACCATCTTCCTTCATGTGG-3'HLA-I上游:5'-CCTACGACGGCAAGGATTACA-3'下游:5'-ACATCACGGCAGCGACCA-3'
1.7统计学处理数据用SPSS 11.5统计软件进行统计,mRNA及蛋白条带用Image J软件进行灰度分析,得出数据均为计量资料,多组间比较采用方差分析,P<0.05为差异有统计学意义。
2结果
2.1鼻咽癌细胞株TAP-1、TAP-2、LMP-2、LMP-7和HLA- ImRNA表达的变化实验中CNE-1、2细胞株生长良好,加入vIL-10并未影响各组细胞的形态、贴壁时间及传代周期。前期实验我们分别将不同浓度vIL-10(10、20、50、100 ng/mL)加入细胞株中观察,发现浓度为50 ng/mL的vIL-10对TAP-1、TAP-2、LMP-2、LMP-7及HLA-I的mRNA水平发生显著影响。因此,本实验中用50 ng/mL的vIL-10对鼻咽癌细胞株进行处理,并分别在vIL-10作用1、4、6、12、24 h,采用RT-PCR方法检测TAP-1、TAP-2、LMP-2、LMP-7及HLA-I的mRNA水平。结果显示:①CNE-1和CNE-2的TAP-1 mRNA水平在不同时间点没有显著差异;②vIL-10作用1、4、6、12 h时,CNE-1和CNE-2的TAP-2 mRNA没有明显变化,但在24 h时TAP-2显著下降甚至消失(P<0.05);③与TAP-2相似,LMP-2 mRNA在前4个时间段均未显示变化,在24 h时CNE-1的LMP-2 mRNA下降(P<0.05),CNE-2的LMP-2 mRNA甚至消失(P<0.05);④CNE-1细胞在vIL-10作用后4 h即出现LMP-7 mRNA下降,12、24 h时升高,而CNE-2细胞在vIL-10作用6 h后出现下降,12、24 h维持在该水平未出现进行性下降;⑤HLA-I mRNA变化与TAP-2相似,在12 h以前均没有明显变化,24 h时CNE-1和CNE-2的HLA-I水平出现显著下降(P<0.05)(图1)。
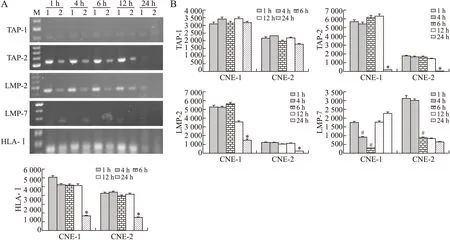

图1 vIL-10(50ng/mL)在不同时间段对鼻咽癌“操纵子”mRNA水平的影响Fig.1InfluenceofvIL-10on“theoperon”mRNAlevelinnasopharyngealcarcinomacelllinesatvarioustimepointsA:RT-PCR分析。1:鼻咽癌细胞CNE-1;2:CNE-2。B:RT-PCR结果灰度分析。与1、4、6、12h比较,*P<0.05;与1h比较,#P<0.05。
2.2鼻咽癌细胞株TAP-1、TAP-2、LMP-2、LMP-7及HLA-I蛋白表达的变化分别用50 ng/mL vIL-10作用CNE-1和CNE-2 1、6、12、24 h,采用Western Blot方法检测TAP-1、TAP-2、LMP-2、LMP-7及HLA-I的蛋白表达。 结果显示:①CNE-1在vIL-10作用后6 h时,TAP-1蛋白水平出现略微下降,12 h时有所上升,24 h时再次出现显著下降(P<0.05);CNE-2细胞在vIL-10作用后6、12 h时,TAP-1水平比1 h增高,在24 h时显著下降(P<0.05)。②CNE-1和CNE-2细胞在vIL-10作用后1、6、12、24 h,TAP-2蛋白水平逐渐下降(P<0.05)。③vIL-10作用CNE-1细胞后,LMP-2蛋白水平在12 h时出现显著下降,24 h又升高,而在CNE-2细胞中则表现为逐渐下降趋势(P<0.05)。④LMP-7蛋白在vIL-10作用CNE-1细胞后的变化与LMP-2相似,在12 h时显著下降,24 h又升高;CNE-2细胞中LMP-7蛋白水平变化与LMP-2一致,均表现为逐渐下降(P值均<0.05)。⑤CNE-1和CNE-2细胞在vIL-10作用后,HLA-I出现下降趋势,但在CNE-1细胞中各时间段变化无统计学差异(P>0.05),CNE-2细胞在24 h显著下降,差异有统计学意义(P<0.05),其余时间段变化均无统计学差异(P>0.05)(图2)。
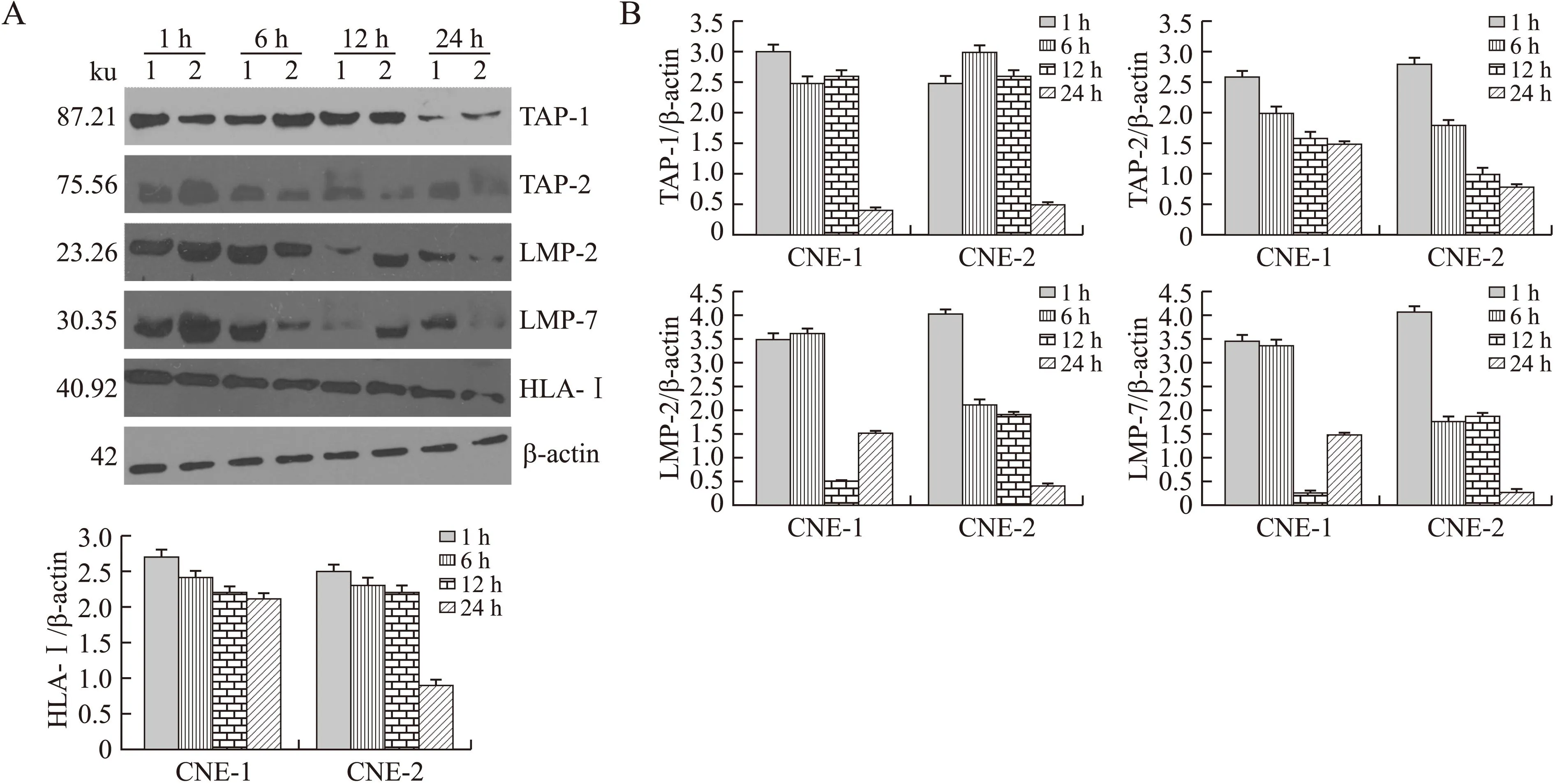

图2 vIL-10(50ng/mL)在不同时间段对鼻咽癌“操纵子”蛋白表达水平的影响Fig.2InfluenceofvIL-10on“theoperon”proteinlevelinnasopharyngealcarci-nomacelllinesatvarioustimepointsA:Westernblot分析。1:鼻咽癌细胞CNE-1;2:CNE-2。B:Westernblot结果灰度分析。
3讨论
肿瘤抗原肽是肿瘤免疫治疗的一大热点[11-13],肿瘤表面的抗原肽是肿瘤抗原经过内源性或外源性加工处理并呈递至细胞膜与MHC分子结合的短肽,是机体免疫应答的关键物质基础。HLA-I类分子表达下调是肿瘤细胞逃逸细胞毒性T淋巴细胞杀伤作用的主要机制之一。鼻咽癌患者EB病毒感染可以使细胞免疫功能明显受到抑制,其重要原因是肿瘤细胞的MHC分子结合的抗原低表达或者不表达[14]。肿瘤细胞中一个或者多个抗原提呈分子如TAP-1、TAP-2、LMP-2及LMP-7等下调可导致细胞膜表面的HLA-I类分子复合物表达下调,从而逃避T淋巴细胞杀伤作用。
3.1vIL-10对TAPs在鼻咽癌中表达的作用TAP广泛分布于原核与真核细胞中,负责转运离子、小分子物质、多肽及蛋白质等物质以非分泌途径通过细胞膜。TAP主要基因产物有TAP-1和TAP-2,TAP-1和TAP-2形成异二聚体定位并穿透内质网膜,形成一个通道帮助抗原肽从胞浆转运到内质网,以便HLA-I类分子和抗原肽形成复合物并表达于细胞表面供CTL识别,同时TAP还协助HLA-I类分子的表达。在有一些缺乏TAP的突变细胞系,HLA-I类分子对抗原肽的捕获能力大大下降,从而使细胞表面的HLA-I类分子表达降低,尽管一些HLA-I类分子能够离开内质网到细胞表面,但它们大多数是空载的,而且很快降解。许多肿瘤常通过TAP表达的降低或缺失,使MCH-I类分子限制的抗原递呈途径受损或缺失,这成为肿瘤细胞、病毒感染细胞逃避监视的重要机制。YANG等[15]发现黑色素细胞SK-MEL-19细胞株存在TAP-1和HLA-I表达缺失,SK-MEL-19细胞的TAP-1基因1 489位点(也正是外显子7所在位置)缺失导致其表达异常,即使IFN-γ可诱导激活TAP-1基因,但是TAP-1 mRNA也无法表达,也不可能促进HLA-I的表达上调。ZEIDLER等[6]把B淋巴细胞与未处理的B95.8细胞(绒猴EB病毒转化的白细胞株)上清液一起培养,TAP-1基因表达出现下降,而与EB病毒阴性的伯基特淋巴瘤细胞上清一起培养的B淋巴细胞的TAP-1基因表达无明显下降,因此推测可能是EB病毒基因BCRF-1编码的vIL-10引起TAP-1表达下降。本研究中CNE-1和CNE-2均在vIL-10作用24 h时TAP-1蛋白出现显著下降,与ZEIDLER等[6]实验中描述的时间存在差异,这可能是本研究用商品化vIL-10,纯度比较高,作用直接、显著,而ZEIDLER是利用携带hIL-10或vIL-10基因的质粒转染Cos7 cells,收集培养细胞的上清液得到的,浓度及纯度无法保证。而且两组实验作用目的细胞不一样,细胞表面IL-10受体分布存在差异,也会影响实验结果。
3.2vIL-10对LMPs在鼻咽癌中表达的作用LMP-2和LMP-7参与非溶酶体蛋白水解途径,具有各自的水解活性,可将内源性抗原降解为5~15个氨基酸的短肽,在热休克蛋白的协助下与抗原加工相关转运体TAP-1和TAP-2组成的异二聚体结合转运至内质网(ER),在内质网中进行氨基端的修饰后与MHC-I类分子结合,经高尔基体在细胞表面共同被CD8+T淋巴细胞识别,产生特异性的免疫应答。
LMP-2、LMP-7基因的某些变化会改变肽段羧基端氨基酸的性质,进而对抗原处理和提呈过程起到限制性作用。在多种肿瘤中均发现LMP基因存在碱基缺失或表达下调,不能产生适合与MHC-I类分子结合的短肽,导致MHC-I类分子在肿瘤细胞表面的数量下降,降低细胞毒性T淋巴细胞(CTL)对肿瘤细胞的敏感性,从而逃避免疫监视。大多数研究者认为LMP表达下调预示着患者的不良预后[16]。
LMPs基因表达受到各种细胞因子的调节,正向性刺激作用的因子包括TNF-a、IFN-γ、粒巨噬细胞集落刺激因子、IL-4,负向细胞因子为IL-10[17]。本研究发现vIL-10对鼻咽癌细胞的LMPs表达具有负向调节作用,LMP-7 mRNA在CNE-1与CNE-2细胞株下调时间有差异,而且LMP-2、LMP-7蛋白表达在CNE-1与CNE-2间表达也不同步,我们认为可能与两种细胞株特性存在差异相关。CNE-1来源于高分化鳞状细胞癌,而CNE-2来源于低或未分化鳞状细胞癌,两者生物学特性存在差异。SELIGER[17]认为LMPs基因表达任何时段都可能受到影响,这些因素包括基因结构的改变,外在因素导致表达失调,转录以及转录后调节。作者在神经母细胞瘤和恶性黑色素瘤中检测到LMPs表达下调,这些基因既有点突变也有碱基缺失。MEISSNER等[18]研究发现头颈部恶性肿瘤中抗原提呈体(antigen processing machinery, APM)分子表达异常主要原因是外在因素引起的异常调节而不是基因结构改变引起的。本文中vIL-10可能在转录后水平调节LMPs的表达,并未改变其基因结构。
3.3vIL-10对HLA-I在鼻咽癌中表达的作用HLA即人类白细胞抗原(human leukocyte antigen),其编码基因称为HLA复合体,HLA-I类分子由重链(a链)和β2微球蛋白(β2m)轻链组成,分布在几乎所有的有核细胞表面。CD8+CTL是机体抗肿瘤的主要效应细胞,它的激活是通过TCR识别HLA-I类分子及其递呈的内源性肿瘤特异抗原肽来实现的。HLA-I正常表达有助于CD8+CTL识别特定抗原肽而杀伤肿瘤细胞。目前的研究显示多数恶性肿瘤细胞表面HLA-I类分子低表达或表达缺失,而且其发生频率随肿瘤细胞来源不同而不同(16%~50%)[19]。因此,HLA-I类分子低表达或不表达不能有效激活特异性CD8+CTL而造成肿瘤免疫逃逸。
本研究CNE-1和CNE-2细胞在vIL-10作用后,在mRNA水平上,CNE-1和CNE-2的HLA-I水平在1、6、12 h时间段均无明显变化,24 h时出现显著下降。在蛋白水平上,只有CNE-2细胞在24 h出现显著下降,说明vIL-10对CNE-2细胞HLA-I的表达具有抑制作用,但是较其他APM分子(TAP-1、TAP-2、LMP-2、LMP-7)变化时间较晚。目前尚无vIL-10对HLA-I表达影响的相关报道。RODRGUEZ等[20]用免疫组化检测63例宫颈癌和Ⅲ度宫颈上皮内瘤变组织标本中HLA-I和IL-10的变化,发现50/59例HLA-I表达缺失或降低,IL-10阳性率达46.6%,并且IL-10表达与HLA-I下调呈正相关(P=0.028),作者认为在宫颈癌中IL-10可以通过下调HLA-I的表达抑制机体免疫应答。YUE等[21]原代培养14株来自原发灶、淋巴结转移和远处器官转移的黑色素瘤细胞,其中12株细胞表达IL-10受体,黑色素瘤细胞可以自分泌IL-10并通过其受体抑制细胞表面HLA-I、HLA-Ⅱ及细胞间粘附分子(intercellular adhesion molecule, ICAM-1),抑制率达10%~60%,进而促进恶性黑色素瘤细胞的生长。vIL-10与IL-10具有83%的同源性,可发挥IL-10的免疫抑制作用。因此,我们认为vIL-10可以抑制肿瘤细胞表面HLA-I的表达,但是可能不具有直接抑制作用,而是通过抑制APM分子表达发挥其作用。
参考文献:
[1] LI W, DENG XM, WANG CX, et al. Down-regulation of HLA class I antigen in human papillomavirus type 16 E7 expressing HaCaT cells: correlate with TAP-1 expression[J]. Int J Gynecol Cancer, 2010, 20(2):227-232.
[2] SINGAL DP, YE M, BIENZLE D. Transfection of TAP 1 gene restores HLA class I expression in human small-cell lung carcinoma[J]. Int J Cancer, 1998, 75(1):112-116.
[4] WANG X, NI J, HSU CL, et al. Reduced expression of tocopherol-associated protein (TAP/Sec14L2) in human breast cancer[J]. Cancer Invest, 2009, 27(10):971-977.
[5] FACOETTI A, Nano R, Zelini P, et al. Human leukocyte antigen and antigen processing machinery component defects in astrocytic tumors[J]. Clin Cancer Res, 2005, 11(23):8304-8311.
[6] ZEIDLER R, EISSNER G, MEISSNER P, et al. Downregulation of TAP1 in B lymphocytes by cellular and Epstein-Barr virus-encoded interleukin-10[J]. Blood, 1997, 90(6):2390-2397.
[7] SCHOTTELIUS AJ, MAYO MW, SARTOR RB, et al. Interleukin-10 signaling blocks inhibitor of κB kinase activity and nuclear factor κB DNA binding[J]. J Biol Chem,1999, 274(45):31868-31874.
[8] REN YX, YANG J, ZHANG LJ, et al. Downregulation of expression of transporters associated with antigen processing 1 and 2 and human leukocyte antigen I and its effect on immunity in nasopharyngeal carcinoma patients[J]. Mol Clin Oncol, 2014, 2(1):51-58.
[9] 任艳鑫,李晓江,喻博,等. VIL-10下调鼻咽癌细胞TAP-1基因表达的研究[J]. 中国耳鼻咽喉头颈外科,2012, 19(5):255-257.
[10] 任艳鑫,李晓江,杨洁,等. 鼻咽癌组织中BCRF-1基因表达及其与免疫功能的相关性分析[J]. 西安交通大学学报(医学版), 2012, 33(4):494-497.
[11] EISENBACH L, BAR-HAIM E, EL-SHAMI K, et al. Antitumor vaccination using peptide based vaccines[J]. Immunol Lett, 2000, 74(1):27-34.
[12] LEWIS JD, REILLY BD, BRIGHT RK, et al. Tumor-associated antigens: from discovery to immunity[J]. Int Rev Immunol, 2003, 22(2):81-112.
[13] RENNER C, TRÜMPER L, PFREUNDSCHUH M, et al. Tumour vaccines: a new immunotherapeutic approach in oncology[J]. Ann Hematol, 2000, 79(12):651-659.
[14] SELIGER B. Different regulation of MHC class I antigen processing components in human tumors[J]. J Immunotoxicol, 2008, 5(4):361-367.
[15] YANG T, MCNALLY BA, FERRONE S, et al. A single-nucleotide deletion leads to rapid degradation of TAP-1 mRNA in a melanoma cell line[J]. J Biol Chem, 2003, 278(17):15291-15296.
[16] MÜLLER M, AGAIMY A, ZENK J, et al. The prognostic impact of human leukocyte antigen (HLA) class I antigen abnormalities in salivary gland cancer. A clinicopathological study of 288 cases[J]. Histopathology, 2013, 62(6):847-859.
[17] SELIGER B. Molecular mechanisms of MHC class I abnormalities and APM components in human tumors[J]. Cancer Immunol Immunother, 2008, 57(11):1719-1726
[18] MEISSNER M, REICHERT TE, KUNKEL M, et al. Defects in the human leukocyte antigen class I antigen processing machinery in head and neck squamous cell carcinoma: association with clinical outcome[J]. Clin Cancer Res, 2005, 11(7):2552-2560.
[19] SETTE A, CHESNUT R, FIKES J. HLA expression in cancer: implications for T cell-based immunotherapy[J]. Immunogenetics, 2001, 53(4):255-263.
[21] YUE FY, DUMMER R, GEERTSEN R, et al. Interleukin-10 is a growth factor for human melanoma cells and down-regulates HLA class-I, HLA class-II and ICAM-1 molecules[J]. Int J Cancer, 1997, 71(4):630-637.
(编辑邱芬)
收稿日期:2015-10-19修回日期:2015-12-21
基金项目:2013年国家自然科学基金(No.81260312);2014年云南省科技厅-昆明医科大学应用基础研究联合专项(No.2014FZ037);2012年云南省卫生科技内设研究机构项目资助(No.2012WS0035);2014年昆明市西山区科技计划项目(No.西科字50号)
通讯作者:李晓江. E-mail: wingman11@163.com
中图分类号:R739.63
文献标志码:A
DOI:10.7652/jdyxb201604011
Effects of vIL-10 on MHC-I antigen processing “the operon” in nasopharyngeal carcinoma cell lines
REN Yan-xin, YANG Jie, SUN Rui-mei, ZHAO Liu-fang, LI Lei, ZHANG Shi-wen,FEI Ji-min, SHANG Yi-tai, LI Zhou-lei, LI Xiao-jiang
(Department of Head and Neck, the Third Affiliated Hospital of Kunming Medical University;Tumor Research Center of Yunnan Province, Kunming 650118, China)
ABSTRACT:ObjectiveTo explore the effects of virus interleukin-10(vIL-10) on different expressions of MHC-I antigen processing “the operon”. MethodsWe collected nasopharyngeal carcinoma cells (CNE-1 and CNE-2) treated by vIL-10 at different time points, and detected the changes of MHC-I antigen processing “the operons” (TAP-1, TAP-2,LMP-2, LMP-7 and HLA-I) by RT-PCR and Western blot. Results① mRNA level: There was no difference in the expression of TAP-1 in CNE-1 and CNE-2 cells at various time points. The expressions of TAP-2 and LMP-2 in CNE-1 and CNE-2 did not change at 1, 4, 6, 12 h, but downregulated and even disappeared at 24 h. The expression of LMP-7 in CNE-1 decreased 4 h after vIL-10 was added, and that in CNE-2 decreased at 6 h. The expression of HLA-I in CNE-1 and CNE-2 showed significant decrease at 24 h. ② Protein expression: The expression of TAP-1 in CNE-1 and CNE-2 showed significant decrease at 24 h. The expression of TAP-2 in CNE-1 and CNE-2 was gradually downregulated at different time points. The expressions of LMP-2 and LMP-7 in CNE-2 were gradually downregulated at different periods, while that in CNE-1 was only decreased at 12 h. The expression of HLA-I in CNE-1 and CNE-2 was gradually downregulated, but there was no significant difference at each period in CNE-1, while the expression of HLA-I in CNE-2 at 24 h was significantly downregulated. ConclusionvIL-10 can inhibit the expression of MHC-I antigen processing “the operon” in NPC in the time-dependent manner.
KEY WORDS:nasopharyngeal carcinoma (NPC); virus interleukin-10; transporter associated with antigen processing (TAP); low molecular mass polypeptide (LMP); human leukocyte antigen I (HLA-I)
Supported bythe National Natural Science Foundation of China (No.81260312), Joint Project of Basic Application Research of Science and Technology Department of Yunnan Province and Kunming Medical University (No.2014FZ037), Science and Health Research Institutes Foundation of Yunnan Province (No.2012WS0035), and Key Medical Project of Xishan District of Kunming City Science and Technology Bureau
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160608.0934.012.html(2016-06-08)
