应用光标测技术观察INa-L和IKr对左、右心室间电异质性的影响
2016-07-14孙红梅蒋永荣薛小临
孙红梅,李 丽,蒋永荣,杨 琳,薛小临,孔 澍,杨 昭
(1. 延安大学附属医院心内科,陕西延安 716000;2.西安交通大学第一附属医院心内科,陕西西安 710061;3. 西安交通大学医学部,陕西西安 710061)
◇基础研究◇
应用光标测技术观察INa-L和IKr对左、右心室间电异质性的影响
孙红梅1,2,李丽2,蒋永荣2,杨琳2,薛小临2,孔澍3,杨昭3
(1. 延安大学附属医院心内科,陕西延安716000;2.西安交通大学第一附属医院心内科,陕西西安710061;3. 西安交通大学医学部,陕西西安710061)
摘要:目的应用高分辨率光标测技术,观察INa-L、IKr对左、右心室间异质性及频率依赖性的影响。方法构建兔离体心脏模型(12只),将电压敏感性染料通过Langendorff方法灌注兔离体心脏,使用波长为532 nm的LED光源,分別记录心脏左、右心室动作电位时程(APD80和APD50);分别使用多菲利特(30 nmol/L)、多菲利特+ATX-Ⅱ(1 nmol/L)、多菲利特+ATX-Ⅱ+美西律(10 μmol/L)进行灌注,加药前为自身对照,每组分别给予刺激周长(BCL)为2 000、1 000、500、300 ms的刺激,观察药物干预前后左心室或右心室APD的变化。结果①在不同刺激条件下,对照组右心室的APD80、APD50均长于左心室,呈反向频率依赖性;②加入多菲利特后,BCL=1 000 ms时,左、右心室的APD80、APD50分别较对照组相应心室明显延长,但两心室的ΔAPD80和ΔAPD50相比差异有统计学意义(P>0.05);随频率的减慢,两心室的ΔAPD80较对照组增加明显。③加入ATX-Ⅱ后,BCL=1 000 ms时,左、右心室的APD80、APD50较单用多菲利特及对照组显著增加,两心室的ΔAPD80和ΔAPD50相比差异均有统计学意义(P<0.05),且左心室的ΔAPD80和ΔAPD50大于右心室。随刺激频率的减慢,两心室的ΔAPD80较对照组显著增加。④加入美西律后,BCL=1 000 ms时,左、右心室的APD80、APD50较使用前明显缩短,两心室的ΔAPD80和ΔAPD50与对照组相比差异有统计学意义(P<0.05),两心室的ΔAPD80与ATX-Ⅱ组相比差异有统计学意义(P<0.05),而ΔAPD50与ATX-Ⅱ组相比差异无统计学意义(P>0.05)。随频率的减慢,两心室ΔAPD80增加的幅度减小。结论①多菲利特阻断IKr未能增大心室间的异质性,左、右心室表现出反向频率依赖性。②在阻断IKr的基础上使用INa-L开放剂ATX-Ⅱ,增加了左、右室间的异质性,并加强IKr的反向频率依赖性;美西律阻断INa-L减小心室间的异质性,并减轻其反向频率依赖性。
关键词:光标测;左右心室;复极异质性;INa-L;IKr
近年来大量基础研究发现,整体心脏左、右心室以及心脏各层心肌细胞之间的电生理异质性增大,为折返激动和室性心律失常的发生提供基质。电压敏感性光标测技术可通过多位点、同步和无创记录心肌细胞群的膜电位变化,被用于研究整体心脏的电生理特征及心律失常的发生机制。
研究发现,心肌肥厚、慢性心力衰竭及3型长QT综合征(LQT3)等疾病发生TdP(Torsades de pointes)的主要原因是心室肌细胞晚钠电流(INa-L)增大,使用阻断hERG通道(IKr通道)的药物时,发生TdP的风险性增高,使得原本安全的药物变得不安全。跨壁复极离散度(TDR)的增大是发生TdP的重要机制,但左、右心室间的复极异质性所发挥的作用尚不明确。
1材料与方法
1.1实验对象与仪器选取成年雄性家兔12只,体质量2.4~2.7 kg,由西安交通大学医学部实验动物中心提供。本实验的光学标测系统主要包括Langendorff灌流系统、荧光信号检测系统和ECG采集系统。
1.2实验分组12只家兔均为自身对照,根据药物干预的不同分为4组,依次是对照组、多菲利特组、多菲利特+ATX-Ⅱ组、多菲利特+ATX-Ⅱ组+美西律组。加药前为自身对照,依次给予3种药物干预(如出现不可消除的自主节律干扰则停止实验)。以上4组实验的台式液为循环灌注,且没有药物洗脱,对照组只含电压敏感性染料Di-4-ANEPPS、肌松剂(+)-Blebbistatin(10 μmol/L),之后依次加入多菲利特(30 nmol/L)、ATX-Ⅱ(1 nmol/L)和美西律(10 μmol/L)。所有实验用药均由DMSO配置。
1.3离体兔心室标本的制备①固定家兔,首先肌肉注射安定0.2 mL,后经耳缘静脉先后注射肝素200 IU/kg和250 g/L乌拉坦5 mL/kg充分抗凝和麻醉。开胸后连同心包取出心脏,暴露主动脉弓,在主动脉弓起始部离断,留有完整的升主动脉。②采用Langendorff方法主动脉逆行灌流心脏,应保证冠状动脉的良好灌注。从取出心脏到成功插管应在2 min内完成。③灌流速度稳定于15~20 mL/min之间。心脏持续稳定灌流后,将正、负刺激电极扎入心尖部附近,心电信号通过放大器输入计算机,给予不同基础刺激周长(basic cycle length, BCL)2 000、1 000、500、300 ms的连续单刺激,电流约2~4 mA,设定刺激电流强度为阈值的2倍,脉宽为2 ms。标本平衡约40 min。整个实验限定在1.5 h内完成。
1.4刺激方式①标本连接到心脏灌流装置后,给予BCL=1 000 ms的连续单刺激平衡,加入肌松剂(+)-Blebbistatin(10 μmol/L)后(避免气泡生成),使得心脏无机械收缩(约20~40 min)。② 通过灌流装置的三通管缓慢注射电压敏感性染料Di-4-ANEPPS 0.2 mL(避免气泡生成),打开LED光源,用专用眼镜可见心脏外膜为均匀的橘红色(绿光激发红光的原理)。如心室荧光亮度较暗或者荧光衰减,可随时追加染料0.1 mL。③依次给予BCL=2 000、1 000、500、300 ms的刺激1 min,保存数据作为对照组。记录时间为每一时间段结束之前的APD。④原台式液中依次加入多菲利特30 nmol/L、ATX-Ⅱ 1 nmol/L、美西律10 μmol/L后,均灌流10 min后,依次给予BCL=1 000、500、300 ms的刺激1 min,并记录。⑤ 在步骤3、4中,改变刺激周长之间以BCL=1 000 ms平衡1~2 min。⑥结束实验,清洗灌流系统。
1.5左、右心室动作电位的采集和分析实验选用电压敏感性染料Di-4-ANEPPS(Invitrogen公司),使用激发波长为532 nm、发射波长约620 nm的滤光镜。通过2个装有高速数字摄像头的CCD摄像机(加拿大Dalsa公司,空间分辨率为128×128)和两个LED光源(激发波长为532 nm,国产)分别对准心脏的左、右心室,由CCD摄像机捕捉心脏左、右心室的电信号变化。CCD捕获的图像以261帧/s的速度采集,每次保存图像根据实验需要设置为1 000帧或者2 000帧。标测左、右心室心外膜的面积各约1.5 cm×1.5 cm。通过Lab View平台建立的图像数据采集软件进行左、右心室动作电位(APD)的同步采集。测量左、右心室APD80、APD50,用ΔAPD80和ΔAPD50表示药物干预前后左心室或右心室APD80和APD50变化的差值。
2结果
2.1生理条件下左、右心室异质性的比较生理条件BCL分别为2 000 ms、1 000 ms、500 ms、300 ms时,观察到同一心脏标本的左、右心室间APD的差异(图1)。APD均分别于心脏左、右心室上某一固定像素点记录获得。红色表示右心室,蓝色表示左心室。BCL=300 ms时,两心室的APD几乎重叠,BCL=(2 000、1 000、500 ms),右心室的APD长于左心室,且左右心室APD的差值呈反向频率依赖。
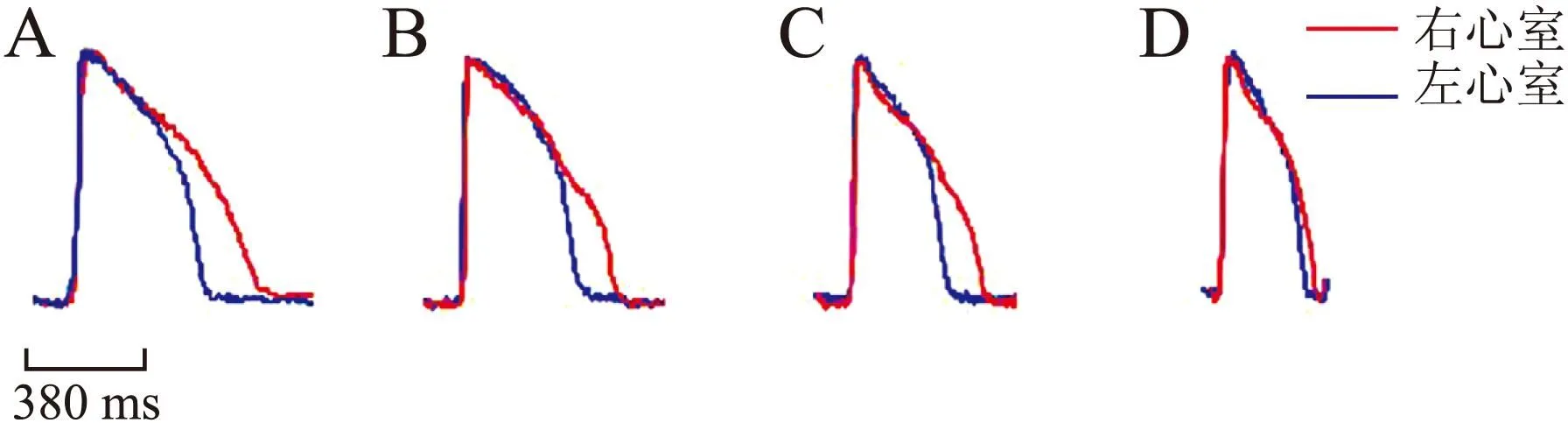
图1生理条件不同BCL下左、右心室动作电位的比较
Fig.1 Comparison of APD in the left and right ventricles of different BCL in physiological conditions
A:2 000 ms;B:1 000 ms;C:500 ms;D:300 ms。
2.2多菲利特、ATX-Ⅱ及美西律对左、右心室APD的影响当BCL=1 000 ms,加入多菲利特,两心室的APD80和APD50较对照组均明显延长。在多菲利特的基础上加用ATX-Ⅱ,两心室的APD80和APD50较单用多菲利特延长更明显。加入美西律后,两心室的APD80和APD50较使用前均明显缩短。实验各组中右心室的APD80较左心室长。当BCL分别为500 ms和300 ms时,两心室的APD80和APD50随着刺激频率的增快而缩短,但药物干预后APD的变化趋势同BCL=1 000 ms时的变化相似(图2)。
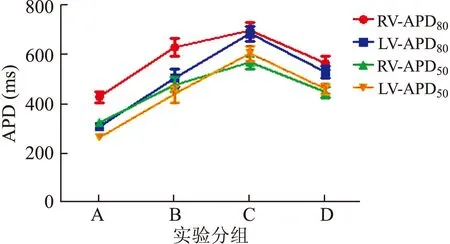
图2BCL=1 000 ms时不同药物干预对左、右心室APD80、APD50(ms)的影响
A:对照组;B:多菲利特组;C:多菲利特+ATX-Ⅱ组;D:多菲利特+ATX-II+美西律组。每组取18个点的数据分析,RV:右心室;LV:左心室。
当BCL=1 000 ms时,对照组台式液中依次加入多菲利特、ATX-Ⅱ、美西律,观察到某一标本左、右心室APD的变化规律(图3)。左、右心室的图像用光标测分析的ratio图表示,中间的两列AP分别来自同一标本左、右心室的某一固定像素点,其中蓝色为对照组,绿色为多菲利特组,红色为多菲利特+ATX-Ⅱ组,紫红色多菲利特+ATX-Ⅱ+美西律组。色标表示膜电压(mV),红色代表去极化状态,深蓝色代表复极化状态。
整治手法:修缮和更换结构破损严重的建筑构件,现状瓷砖贴面予以保留,裸露的砖墙墙面以白色防水涂料进行粉刷,勒脚部分用深灰色防水涂料粉刷,进行建筑节能改造。
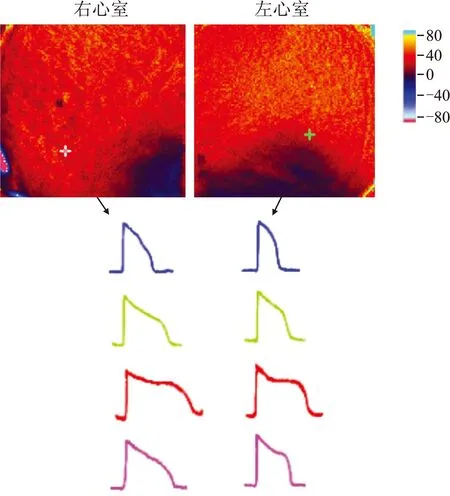
图3BCL=1 000 ms时不同药物干预后左、右心室APD变化的个例
Fig.3 Changes of APD in the left and right ventricles before and after intervention in one case when BCL was 1 000 ms
2.3多菲利特、ATX-Ⅱ及美西律对心室间异质性的影响BCL=1 000 ms,加入多菲利特,左、右心室的ΔAPD80较对照组无统计学差异(P>0.05);在多菲利特基础上加ATX-Ⅱ后,两心室的ΔAPD80均增加明显,较对照组有统计学意义(P<0.05);最后加入美西律后,两心室的ΔAPD80缩短,但较对照组仍有统计学意义(P<0.05)。
还发现加入ATX-Ⅱ后,两心室的ΔAPD80较单用多菲利特有统计学意义(P<0.05),左心室的ΔAPD80比右心室增大显著;加入美西律相比,左、右心室的APD80均缩短明显,两心室的ΔAPD80相比差异有统计学意义(P<0.05)。
当BCL=1 000 ms,加入多菲利特,两心室的ΔAPD50相比无统计学意义(P>0.05);加ATX-Ⅱ后,两心室的ΔAPD50明显增大,两心室相比差异有统计学意义(P<0.05);加入美西律后,两心室的ΔAPD50缩短,较对照组仍有统计学差异(P<0.05)。加入ATX-Ⅱ后,两心室的ΔAPD50较单用多菲利特有统计学差异(P<0.05),左心室的ΔAPD50明显增大;同使用美西律相比,左、右心室的APD50均缩短,但无统计学差异(P>0.05)。
2.4多菲利特、ATX-Ⅱ及美西律对左、右心室频率依赖性的影响图4、5、6表示不同BCL左、右心室用药组分别与对照组差值(ΔAPD80)的比较。使用多菲利特后,左、右心室的ΔAPD80随着刺激频率的减慢逐渐增加,BCL=1 000 ms时ΔAPD80延长的幅度最大,BCL=500 ms,ΔAPD80延长的幅度减小,BCL=300 ms时最小。多菲利特与ATX-Ⅱ共同作用后,随着刺激频率的减慢,两心室的ΔAPD80增加的更为明显,即反向频率依赖性加强。使用美西律后,这种反向频率依赖性减轻。
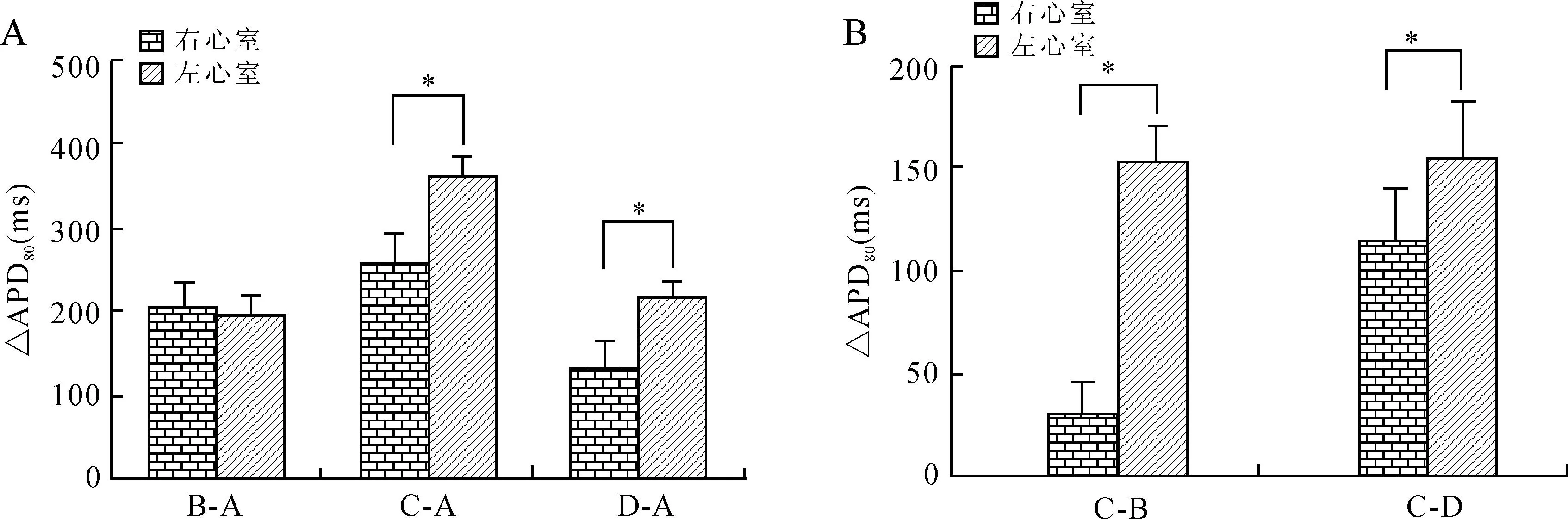
图4BCL=1 000 ms时药物干预后的左、右心室ΔAPD80比较
Fig.4 Comparison of ΔAPD80in the left and right ventricles before and after intervention when BCL was 1 000 ms
A:B-A表示多菲利特组与对照组的差值组,C-A表示多菲利特+ATX-Ⅱ组与对照组的差值组,D-A表示多菲利特+ATX-Ⅱ+美西律组与对照组的差值组。B:左、右心室用药组之间差值(ΔAPD80)的比较。C-B表示多菲利特+ATX-Ⅱ组与多菲利特组的差值组,C-D表示多菲利特+ATX-Ⅱ组与多菲利特+ATX-Ⅱ+美西律组的差值组。
3讨论
近20年来,高分辨率光标测技术(optical mapping)是一种新的功能成像技术,用整体心脏标本建立病理生理状态的动物模型,将心脏电活动形象、直观地展现出来,对疾病的发生机制及其临床治疗可提供一个可靠的基础,也为药物的安全性使用提供依据。
3.1生理条件下左、右心室的异质性特点本实验条件中恒定的温度、酸碱度、灌注压及足够的氧供等使离体心脏接近正常生理状态,这能够很好地反映整体心脏心肌细胞本身的电生理特性。发现生理条件下心室间也存在异质性,右心室的APD比左心室长,

图5BCL=500 ms时药物干预后的左、右心室ΔAPD80比较
Fig.5 Comparison of ΔAPD80in the left and right ventricles before and after intervention when BCL was 500 ms
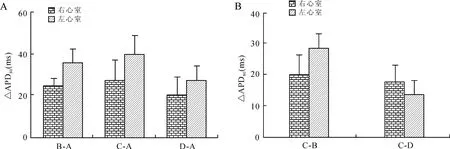
图6BCL=300 ms时药物干预后的左、右心室ΔAPD80比较
Fig.6 Comparison of ΔAPD80in the left and right ventricles before and after intervention when BCL was 300 ms
特别是在慢频率条件下。其他物种的研究也有相似的结果[1-2]。JUSTUS等研究心室肌内膜的特殊传导系统浦肯野氏纤维,结果是右心室浦氏纤维的APD90大于左心室,APD50反而小于左心室。VOLDERS等[3]用单细胞膜片钳技术表明右室M细胞APD长于左室。在心室肌细胞,Ito电流在AP复极中起着重要作用[4],右心室的Ito通常大于左心室,这是兔右心室APD长于左心室的基础。
3.2 IKr、INa-L对左、右心室间异质性的影响由于实验过程中,BCL=2 000 ms标本总是出现不可消除的自主节律,BCL=1 000 ms则没有,认为是刺激频率过于缓慢造成心脏自身的心电活动不稳定,故药物干预后只有BCL=1 000 ms、500 ms、300 ms 3种刺激频率。本实验侧重于药物作用后左、右心室间异质性的变化,由于实验分组较多,组间比较会加大误差,因此对同一药物作用后分别对两心室的ΔAPD80和ΔAPD50进行配对比较,仅对药物作用后两心室APD的变化趋势进行观察。
研究发现,多菲利特阻断编码IKr通道的HERG基因,增大TDR而发挥致心律失常作用。本实验观察到,多菲利特没有增加左、右心室间的异质性,仅延长左、右心室的APD,表明该浓度的多菲利特产生TdP的原因主要是TDR增大。
还发现多菲利特与ATX-Ⅱ共同作用后,明显增大左、右心室间的异质性,引起心电活动的不稳定,为TdP的发生提供可能基质。由于M细胞本身INa-L电流分布密度较大,ATX-Ⅱ使得INa-L增大,其APD延长更明显。使用美西律能明显缩短左、右心室的APD80,减小左、右心室间异质性,降低TdP风险性。在阻断IKr的基础上增大INa-L增强左、右心室间异质性,参与心律失常基质的形成[5],这是临床INa-L增大相关疾病使用IKr阻断药物发生TdP的可能机制。
但美西律没有完全减小左、右心室的异质性,表示该浓度的美西律不足以完全阻断平台期的INa-L电流。但我们在临床中发现,美西律可以缩短8型LQT患者的QT间期及QTc(服药前的600 ms缩小为495 ms),消除2∶1房室传导阻滞及T波电交替,显著减小QT-RR关系图的斜率(P<0.01),降低发生TdP的风险性[6]。对于先天性LQTS,治疗有效的药物较少,美西律是单纯的Na通道阻断剂,小剂量阻断INa-L,对缩短QT间期及减小频率适应性表现出很好的临床治疗前景[7-8]。
3.3 IKr、INa-L对左、右心室频率依赖性的影响药物的反向使用依赖性是促发TdP的一个主要因素。实验发现,多菲利特在整体心脏仍表现出反向频率依赖性,从而增加了心动过缓患者因QT间期过度延长发生恶性心律失常的危险性。ATX-Ⅱ是INa-L开放剂,与IKr阻断剂有相同的反向频率依赖性,二者联合,心肌的反向频率依赖性加强,为QT间期延长致TdP发生提供了基质。有研究表明,IKr阻断剂(克拉霉素)可以产生EAD,合用ATX-Ⅱ后发生TdP[9],但INa-L阻断剂雷诺嗪可以消除ATX-Ⅱ诱发的心律失常。JIA等[10]认为,心动过缓时增大TDR可能是APD频率依赖异质性的结果,至少部分归为心室壁晚钠的分布异质性。
任何原因致QT间期延长均会增大INa-L,美西律减少INa-L,减轻了两心室的反向频率依赖性。因此,阻断INa-L可缩短QT间期及减轻频率依赖性,对预防和治疗LQTS致TdP提供了可靠的实验研究基础。LIU等[11]发现阻断INa-L减小TDR可以支持上述理解。
本实验选用的药物为选择性的离子通道阻断剂或开放剂,是离子电流的改变导致心脏的异质性变化。但光标测技术标测的仅仅是两心室外膜细胞,通过细胞间偶联观察两心室的异质性变化,没有楔形组织块标本测量三层细胞APD及TDR反映致心律失常风险高;但是研究整体心脏异质性更贴近临床疾病的发生,为指导临床治疗提供可靠依据。
参考文献:
[1] MORLEY GE, VAIDYA D, SAMIE FH, et al. Characterization of conduction in the ventricles of normal and heterozygous Cx43 knockout mice using optical mapping[J]. J Cardiovasc Electrophysiol, 1999, 10(10):1361-1375.
[2] ANUMONWO JM, TALLINI YN, VETTER FJ, et al. Action potential characteristics and arrhythmogenic properties of the cardiac conduction system of the murine heart[J]. Circ Res, 2001, 89 (4):329-335.
[3] VOLDERS PGA, SIPIDO KR, CARMELIET E, et al. Repolarizing K+currents ITO1 and IKs are larger in right than left canine ventricular midmyocardium[J]. Circulation, 1999, 99(2):206-210.
[4] YAN GX, ANTZELEVITCH C. Cellular basis for the electrocardiographic J wave[J]. Circulation, 1996, 93(2):372-379.
[5] LIN Y, XIAO-LIN X, LI L, et al. Effect of cardiac I_ (Na-L) on APD accommodation and drug induced arrhythmia[J]. Chin J Clin Pharmacol, 2011.
[6] GAO YF, XUE XL, HU DY, et al. Inhibition of late sodium current by mexiletine: A novel pharmotherapeutical approach in Timothy syndrome[J]. Circ Arrhythm Electrophysiol, 2013, 6:614-622.
[7] GAO Y, XUE X, HU D, et al. Inhibition of late sodium current by mexiletine: A novel pharmotherapeutical approach in timothy syndrome[J]. Circ Arrhythm Electrophysiol, 2013, 6(3):614-622.
[8] GUO D, LIAN J, LIU T, et al. Contribution of late sodium current (I(Na-L)) to rate adaptation of ventricular repolarization and reverse use-dependence of QT-prolonging agents[J]. Heart Rhythm, 2011, 8:762-769.
[9] RODRIGUEZ B, LI L, EASON JC, et al. Differences between left and right ventricular chamber geometry affect cardiac vulnerability to electric shocks[J]. Cir Res, 2005, 97(2):168-175.
[10] JIA S, LIAN J, GUO D, et al. Modulation of the late sodium current by ATX-Ⅱ and ranolazine affects the reverse use-dependence and proarrhythmic liability of IKr blockade[J]. Br J Pharmacol, 2011, 164(2):308-316.
[11] LIU T, BROWN BS, WU Y, et al. Blinded validation of the isolated arterially perfused rabbit ventricular wedge in preclinical assessment of drug-induced proarrhythmias[J]. Heart Rhythm, 2006, 3(8):948-956.
(编辑卓选鹏)
收稿日期:2015-07-14修回日期:2016-03-13
基金项目:国家自然科学基金资助项目(No.30870659/30971221)
通讯作者:薛小临. E-mail: xxiaolin358@sina.com
中图分类号:R331.3
文献标志码:A
DOI:10.7652/jdyxb201604007
Voltage sensitive optical mapping used to observe effects of late Na and rapidly activating delayed rectifier K currents on the right and left ventricular electrophysiological heterogeneity
SUN Hong-mei1,2, LI Li2, JIANG Yong-rong2, YANG Lin2,XUE Xiao-lin2, KONG Shu3, YANG Zhao3
(1. Department of Cardiology, the Affiliated Hospital of Yan’an University,Yan’an 716000; 2. Department o f Cardiology, the First Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710061; 3. Xi’an Jiaotong University Health Science Center, Xi’an 710061, China)
ABSTRACT:ObjectiveTo observe the effects of late Na current (INa-L) and rapidly activating delayed rectifier K current (IKr) on ventricular heterogeneity and frequency dependency by using high resolution voltage sensitive optical mapping technology. MethodsThe model of 12 isolated hearts was constructed in rabbits. Voltage sensitive dye Di-4-ANEPPS were perfused into the isolated hearts by Langendorff method. LED source with the wave length of 532 nm was used to record APD80 and APD50 of the left and right ventricles. Experimental groups were divided into 3 groups by perfusion drugs dofetillide (30 nmol/L), dofetillide+ATX-Ⅱ(1 nmol/L), and dofetillide +ATX-Ⅱ+mexiletine (10 μmol/L). The subjects were intervened by the above drugs in order, and they were self-compared before dosing. After each drug administration, the hearts were stimulated respectively with the BCL of 2 000 ms, 1 000 ms, 500 ms, and 300 ms. Then we observed the changes of APD80 and APD50 in the left and right ventricles before and after the interventions. Results① In the control group, APD80and APD50of the right ventricle were longer than those of the left ventricle in response to different stimulation, and the differences increased with the decrease of stimulating frequency. ② When BCL was 1000 ms, APD80and APD50of the left and right ventricles were prolonged respectively after administration of dofetillide, but the differences in APD80and APD50were insignificant between the left and right ventricles (P>0.05). ΔAPD80of the two ventricles increased significantly with the decrease of stimulating frequency. ③ After administration of ATX-Ⅱ, when BCL was 1000 ms, APD80and APD50of the left and right ventricles increased significantly compared with those in the control group and dofetillide intervention group (P<0.05). And the increase of APD in the left ventricle was greater than that of the right ventricle. ΔAPD80of the two ventricles increased significantly with the decrease of stimulating frequency. ④ After administration of mexiletine, when BCL was 1000 ms, APD80and APD50of the left and right ventricles reduced significantly compared with those of the primary state (P<0.05). APD80and APD50of the left and right ventricles reduced significantly compared with those of the control group (P<0.05) and ATX-Ⅱ group (P>0.05). The increase of ΔAPD80of the two ventricles became milder when the stimulating frequency decreased. Conclusion① IKrblocked by dofetillide did not affect the heterogeneity between the two ventricles, which showed reverse-frequency dependence. ② In the context of blocking IKr, ATX-Ⅱ increased the heterogeneity between the left and right ventricles and enhanced the reverse-frequency dependence. In contrast, mexiletine, the blocker of INa-L, decreased the heterogeneity between the two ventricles and reverse-frequency dependence.
KEY WORDS:optical mapping; left and right ventricles; repolarization heterogeneity; INa-L; IKr
Supported by the National Natural Science Foundation of China (No.30870659 and 30971221)
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160615.0854.006.html(2016-06-15)
