牛病毒性腹泻病毒感染对牛外周血来源树突状细胞表型及其分泌Th1/Th2细胞因子的影响
2016-07-13刘金玲赵玉军何剑斌
刘金玲,魏 澍,赵玉军,何剑斌*
(1.沈阳农业大学畜牧兽医学院,沈阳 110866;2.辽宁省动物疫病预防控制中心,沈阳 110164)
牛病毒性腹泻病毒感染对牛外周血来源树突状细胞表型及其分泌Th1/Th2细胞因子的影响
刘金玲1,魏澍2,赵玉军1,何剑斌1*
(1.沈阳农业大学畜牧兽医学院,沈阳 110866;2.辽宁省动物疫病预防控制中心,沈阳 110164)
摘要:旨在探究BVDV感染对牛外周血来源的树突状细胞成熟及Th1和Th2型细胞因子分泌水平的影响,进一步揭示BVDV感染对机体免疫机能的影响机制。从牛外周血分离单核细胞,诱导培养为树突状细胞后接种BVDV共培养,采用显微镜观察细胞的形态,流式细胞术分析细胞表面标志分子,半定量RT-PCR法检测Th1型细胞因子IL-12p40和Th2型细胞因子IL-10的mRNA转录水平。结果显示,获得形态及表型典型的树突状细胞,诱导纯度为93.81%;BVDV接种组树突状细胞表面的MHCⅡ类分子、CD40分子、CD80分子均明显低于未接种组,差异极显著(P<0.01);BVDV接种组的IL-12p40 mRNA转录水平低于未接种组,差异显著(P<0.05);而IL-10 mRNA转录水平高于未接种组,差异显著(P<0.05)。结果说明BVDV感染影响树突状细胞的成熟及功能,并能通过高效表达Th2型细胞因子IL-10、降低Th1型细胞因子IL-12p40而影响Th1/Th2的平衡。
关键词:牛病毒性腹泻病毒;树突状细胞;免疫表型;Th1/Th2
牛病毒性腹泻病(BVD)是危害养牛业的一种重要疾病。其病原牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)是黄病毒科(Flaviviridae)瘟病毒属(Pestivirus)的成员[1]。主要引起牛的病毒性腹泻、母畜流产、呼吸道疾病以及机体的免疫抑制[2-4]。最新的调查数据显示,新疆地区奶牛BVDV的阳性率为43%,基因型为BVDV-Ib和BVDV-Ic亚型,表明该病在我国的流行较为严重,对养殖业的健康发展存在着严重威胁[5-6]。目前现有的药物和疫苗并不能完全对该病进行防治,造成该病在局部地区暴发。因此阐明BVDV对机体的致病机制对于研制出更加安全可靠有效的疫苗、控制BVD发生和蔓延就显得尤为重要。机体免疫系统对外来病原的抗感染免疫应答首先反映在抗原提呈细胞对抗原的摄取和处理。树突状细胞(dendritic cells,DCs)是分布广泛的专职抗原提呈细胞(antigen-presenting cells,APC)。未成熟DCs具有极强的抗原吞噬能力,在摄取抗原或受到某些因素刺激时即分化为成熟DCs,而成熟的DCs表达高水平的共刺激因子和黏附因子。DCs在清除抗原抗体复合物、吞噬杀伤病原体,抵抗病原体入侵过程中起到非常重要的作用,也是唯一能够启动初始T细胞活化的重要免疫细胞,是天然免疫和获得性免疫应答的关键连接[7-9],其功能状态直接影响细胞免疫和体液免疫应答,在抗病毒的细胞免疫中起重要作用。因此,DCs的功能是免疫应答的关键环节。本研究拟采用BVDV感染牛外周血来源的DCs,观察BVDV感染对DCs免疫表型和Th1/Th2型细胞因子的分泌水平的影响。探究BVDV感染对DCs调控Th1和Th2型免疫应答的潜在机制,对于进一步揭示BVDV感染对机体免疫机能的影响及致病机制具有重要意义。
1材料与方法
1.1材料
RPMI-1640培养基购自美国Bioland公司,胎牛血清(fetal bovine serum,FBS)购自Gbico公司,淋巴细胞分离液购自天津灏洋生物技术公司,牛源树突状细胞免疫磁珠购自德国Miltenyl Biotec公司,重组牛源GM-CSF、IL-4以及鼠抗牛源CD34、CD11c、CD8、CD71、CD56荧光标记抗体购自Kingfisher Biotech公司,RT-PCR试剂购自大连宝生物试剂公司,BVDV (OregonAV69)标准毒株由辽宁省动物疫病预防控制中心惠赠。
1.2实验动物的筛选
根据农业部规定的标准选取4周龄幼牛,即口腔黏膜、粪便、血液分别通过RT-PCR和PCR检测牛病毒性腹泻黏膜病毒(BVDV)、猪瘟病毒(HCV)、牛传染病鼻气管炎病毒(IBRV)抗原均为阴性,并且ELISA法检测BVDV、HCV、IBRV 抗体阴性。无菌采集牛的外周血,肝素(100 μg·mL-1)抗凝。
1.3牛外周血来源树突状细胞的诱导培养及鉴定
将采集的100 mL牛外周血2 000 r·min-1离心5 min,弃血清。加入等量带有酚红指示剂的Dulbecco’s-Hanks(去钙、镁离子),混匀后加入到淋巴细胞分离液上,常温2 500 r·min-1离心15 min,离心后液体分层,用移液管将分层中白色浑浊层小心吸出于另一离心管,2倍Dulbecco’s-PBS混匀后常温2 000 r·min-1离心10 min,弃上清,反复洗涤两遍后并以2×106·mL-1的细胞密度接种细胞培养瓶,次日用RPMI-1640基础培养液轻轻洗出悬浮细胞,用免疫磁珠纯化后,添加含GM-CSF (20 ng·mL-1)和IL-4(10 ng·mL-1)的RPMI-1640完全培养液,置5% CO2培养箱37 ℃过夜培养,3 d半量换液一次,并用倒置显微镜观察不同时间点树突状细胞形态的变化。培养至第7天,用吸管轻轻吹打后收集所有悬浮细胞,即为富集的牛外周血来源的树突状细胞,经流式细胞仪分选鉴定树突状细胞,并测定其纯度。
1.4BVDV对牛外周血来源树突状细胞形态学及表型的影响
将上述流式分选鉴定后的树突状细胞分为两组,一组接种毒价为108.5TCID50·mL-1的BVDV,未接毒组作为对照组。接毒2 h后,各试验组添加LPS至终浓度为1 μg·mL-1,3 d后,观察各组细胞的形态学变化,并将各组树突状细胞用PBS悬浮,浓度调为1×106·mL-1,加入流式管后,分别加入荧光标记抗体CD11c-FITC,CD40-APC,CD80-Percp,MHCⅡ-PE各1 μL,4 ℃避光放置30 min,然后PBS洗涤2次,流式细胞仪检测诱导的树突状细胞共刺激分子的表达情况。对照为FITC、PE、Percp 或APC 交联的同型对照抗体。
1.5BVDV病毒载量的检测
分别在接毒第1、2、3天后,采用半定量RT-PCR法检测BVDV的E2基因,观察BVDV的增殖情况。
1.6BVDV对牛外周血来源树突状细胞Th1和Th2型细胞因子分泌的影响
收集接毒3 d后各组树突状细胞,离心后重新悬浮,调整细胞密度为1×105·mL-1,TRIzoL裂解提取细胞的总RNA并反转录,以cDNA为模板分别扩增Th1型细胞因子IL-12p40和Th2型细胞因子IL-10的mRNA,同时以GADPH作为内参照,以靶基因/GADPH灰度比值作为mRNA的相对表达丰度进行半定量检测,从细胞因子转录水平分析BVDV感染对树突状细胞的Th1和Th2偏转的影响。
1.7统计学处理
2结果
2.1牛外周血来源树突状细胞的诱导培养
在诱导培养第1天,观察到大部分细胞边界清晰、呈圆形、细胞质透亮、细胞悬浮于细胞液中。第3天可见半数细胞变大,细胞呈现不规则形态。第5天形成细胞集落,多数细胞有细微丝状刺突。于培养第7天可见细胞胞体拉长、具有游离的细微丝状刺突、呈半悬浮生长,具有典型的树突状细胞突起的外形,见图1。

图1 牛外周血来源树突细胞第1、3、5、7天的情况(400×)Fig.1 Dendritic cells derived from bovine peripheral blood on the day 1,3,5,7(400×)
2.2牛外周血来源树突状细胞的鉴定和纯度测定
收集诱导培养7 d的树突状细胞悬液0.1 mL至流式管中,分别加入牛树突状细胞、巨噬细胞、NK细胞、CTL细胞标志性表型抗体Anti-CD11c-FITC、Anti-CD71-PE、Anti-CD56-APC、Anti-CD8-Percp染色后,采用流式细胞仪对牛外周血来源性树突状进行检测,检测结果显示细胞纯度为93.81%,表明牛外周血来源的树突状细胞经免疫磁珠分离,诱导剂诱导能够达到较高的诱导纯度,见图2。
2.3BVDV感染对牛外周血来源树突状细胞形态的影响
接种BVDV后第3天,用倒置显微镜观察到接种组树突状细胞,不规则细胞增多,外形轮廓模糊,细胞壁溶解界限不清,细胞碎片增多,而未接种组细胞质透明,细胞刺状突起明显,呈典型的树突状细胞形态,见图3。
2.4BVDV感染对牛外周血来源树突状细胞重要表型的影响
接毒3 d后,分别收集接毒组树突状细胞和未接毒组树突状细胞,分别加入FITC、PE、APC和Percp标记的单克隆抗体,通过流式细胞仪收集要测定的细胞群并检测不同荧光标记强度,从而分析各组树突状细胞表面标志的表达情况。流式分析结果表明,BVDV接毒组树突状细胞表面的MHCⅡ类分子、CD40分子、CD80分子均明显低于未接毒组,差异极显著(P<0.01),表明BVDV感染影响树突状细胞的成熟,见图4。

图2 树突状细胞(DC)流式细胞仪纯度检测Fig.2 Dendritic cells(DC) purity of flow cytometry detection

图3 BVDV对树突状细胞(DC)形态的影响(400×)Fig.3 Morphology influence of dendritic cells(DC) by BVDV(400×)
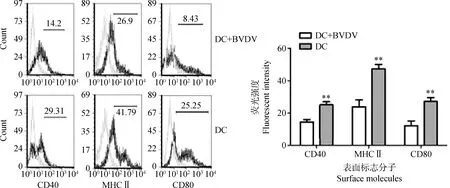
**.P<0.01图4 树突状细胞(DC)表面标志分子的分析Fig.4 Analysis of surface molecules on dendritic cells(DC) by FCM
2.5BVDV病毒载量的检测
采用半定量RT-PCR方法扩增牛外周血来源树突状细胞接毒组cDNA中E2基因及其内参基因GDPAH,用1.2%浓度的琼脂糖凝胶电泳鉴定PCR产物,PCR扩增基因片段大小与预期相符。结果表明,BVDV在树突细胞中的持续性存在。病毒含量在第1、2、3天中增殖不明显,无显著性差异(P>0.05),见图5。

M.DL1000 DNA相对分子质量标准;1.第1天;2.第2天;3.第3天M.DL1000 DNA marker;1.The 1st day;2.The 2nd day;3.The 3rd day图5 BVDV病毒载量分析Fig.5 Analysis graph of viral load
2.6树突状细胞Th1和Th2型细胞因子mRNA转录水平分析
采用半定量RT-PCR方法扩增牛外周血来源树突状细胞IL-12p40、IL-10基因及其内参基因GDPAH,与正常对照组相比,接毒组IL-12p40的mRNA转录水平低于正常对照组,差异显著(P< 0.05),而IL-10的mRNA转录水平则高于对照组,差异显著(P<0.05),以上研究结果表明BVDV感染的树突状细胞降低了刺激Th1细胞的IL-12p40基因转录水平,同时提高了刺激Th2细胞的IL-10基因转录水平,诱导免疫反应向Th2型极化漂移,抑制了树突细胞的免疫功能,见图6。

1.DC组;2.DC+BVDV组;*.P<0.051.DC group;2.DC+BVDV group;*.P<0.05图6 IL-12p40、IL-10 mRNA转录水平Fig.6 The transcription of IL-12p40 and IL-10 for DC at mRNA level
3讨论
DCs是外周免疫系统最强的抗原提呈细胞,能够感知和捕获病毒、分泌干扰素、活化特定的炎性细胞因子,也是唯一能激活初始化T淋巴细胞的抗原提呈细胞[10]。DCs 通过与T 细胞相互作用来参与体内的免疫应答,其分泌细胞因子的类型决定后续免疫应答是Th1型还是Th2型。DCs通过分泌TNF-α、IFN-γ、IFN-β和IL-12可促进Th0向Th1型分化,Th1主要介导细胞免疫,在促进辅助细胞毒性T细胞、NK细胞分化成熟并激活其生物学活性方面具有重要的作用。 DCs通过分泌IL-4、IL-5、IL-10、IL-13可刺激Th0向Th2型方向分化,Th2主要介导体液免疫,辅助B细胞增殖、分化[11]。IL-10不仅是Th2分化细胞因子,而且还是免疫反应负调节因子。IL-10可以抑制B 细胞表面MHCⅡ的表达以及T细胞、NK细胞的免疫功能,在抑制以Th1为主的细胞免疫中发挥重要作用[12]。正常情况下,Th细胞巧妙地协调着Th1/Th2的极化水平,维持着细胞和体液免疫应答的平衡[13],一旦这种平衡发生偏离,机体将趋向疾病状态。在本研究中,BVDV感染后对DCs分泌细胞因子的检测结果显示,IL-12p40的mRNA转录水平与未感染BVDV组相比明显(P<0.05)降低,而IL-10的mRNA转录水平则显著(P<0.05)高于未接毒组,表明BVDV感染的DCs降低了刺激Th1细胞分化的IL-12p40基因转录水平,同时提高了刺激Th2细胞分化的IL-10基因转录水平,提示BVDV在感染DCs的过程中,通过上调抑制性细胞因子IL-10的转录来诱导免疫反应向Th2型极化漂移。而且BVDV的感染影响了树突状细胞的成熟,抑制了树突状细胞的免疫功能,流式分析结果表明BVDV感染导致DCs表面的MHCⅡ类分子、CD40分子、CD80分子均明显(P<0.01)低于未接毒组。但是我们也发现BVDV感染DCs后,病毒载量的变化不明显,没有显著差异,说明DCs不是BVDV感染的主要宿主细胞。但是BVDV能够通过感染DCs,导致DCs形态学发生改变。在本研究中观察到BVDV接种组不规则细胞增多,外形轮廓模糊,细胞壁溶解界限不清,细胞碎片增多,而未接种BVDV组DCs细胞质透明,细胞刺状突起明显,呈典型的DCs形态。BVDV感染DCs后是否导致了DCs的凋亡还有待进一步的研究。综上,本研究从DCs免疫表型和DCs诱导Th1/Th2型反应的角度揭示了BVDV对DCs的免疫抑制机制,进一步补充、完善了BVDV抑制DCs功能的现有理论,从新的角度揭示了BVDV的免疫抑制机制,为BVDV的防治提供新靶点和新思路,同时为更加有效地进行以 DCs为基础的抗病毒免疫治疗及BVD新型疫苗设计提供一定的实验基础和理论支持,对控制BVD的发生具有重要意义。
参考文献(References):
[1]韩猛立,李娜,黄新,等.牛病毒性腹泻病毒巢式RT-PCR检测方法的建立及应用[J].西北农业学报,2010,19(10):6-9,15.
HAN M L,LI N,HUANG X,et al.Establishment and application of nested PCR assay for bovine viral diarrhea virus detection[J].ActaAgriculturaeBoreali-OccidentalisSinica, 2010,19(10):6-9,15.(in Chinese)
[2]韩猛立,黄新,宋天增,等.牛病毒性腹泻病毒与宿主细胞的相互作用研究[J].湖北农业科学,2012,51(8):1519-1523.
HAN M L,HUANG X,SONG T Z,et al.Research progress of interactions between bovine viral diarrhea virus and host cell[J].HubeiAgriculturalSciences,2012,51(8):1519-1523.(in Chinese)
[3]GLEW E J,CARR B V,BRACKENBURY L S,et al.Differential effects of bovine viral diarrhoea virus on monocytes and dendritic cells[J].JGenVirol,2003,84 (Pt 7):1771-1780.
[4]LEE S R,NANDURI B,PHARR G T,et al.Bovine viral diarrhea virus infection affects the expression of proteins related to professional antigen presentation in bovine monocytes[J].BiochimBiophysActa,2009,1794(1):14-22.
[5]TOPLIFF C L,SMITH D R,CLOWSER S L,et al.Prevalence of bovine viral diarrhea virus infections in alpacas in the united states[J].JAmVetMedAssoc,2009,234(4):519-529.
[6]BYERS S R,SNEKVIK K R,RIGHTER D J,et al.Disseminated Bovine viral diarrhea virus in a persistently infected alpaca(Vicugna pacos) cria[J].JVetDiagnInvest,2009,21(1):145-148.
[7]朱诗语,王春凤,杨桂连.树突状细胞在病毒感染动物免疫应答中的作用[J].畜牧与兽医,2014,46(12):106-108.
ZHU S Y,WANG C F,YANG G L.The role of dendritic cells on animal immune response against virus infection[J].AnimalHusbandryandVeterinaryMedicine,2014,46(12):106-108.(in Chinese)
[8]PINCHUK G V,LEE S R,NANDURI B,et al.Bovine viral diarrhea viruses differentially alter the expression of the protein kinases and related proteins affecting the development of infection and anti-viral mechanisms in bovine monocytes[J].BiochimBiophysActs,2008,1784(9):1234-1247.
[9]SALMOND R J,ZAMOYSKA R.The influence of mTOR on T helper cell differentiation and dendritic cell function[J].EurJImmunol,2011,41(8):2137-2141.
[10]LEE K,GUDAPATI P,DRAGOVIC S,et al.Mammalian target of rapamycin protein complex 2 regulates differentiation of Th1 and Th2 cell subsets via distinct signaling pathways[J].Immunity,2010,32(6):743-753.
[11]MORRIS S,SWANSON M S,LIEBERMAN A,et al.Autophagy-mediated dendritic cell activation is essential for innate cytokine production and APC function with respiratory syncytial virus responses[J].JImmunol,2011,187(8):3953-3961.
[12]LEE S R,PHARR G T,BOYD B L,et al.Bovine viral diarrhea viruses modulate toll-like receptors,cytokines and co-stimulatory molecules gene expression in bovine peripheral blood monocytes[J].CompImmunolMicrobiolInfectDis,2008,31(5):403-418.
[13]NEURATH M F,FINOTTO S,GLIMCHER L H.The role of Th1/Th2 polarization in mucosal immunity[J].NatMed,2002,8(6):567-573.
(编辑白永平)
The Influence of BVDV on Immunophenotype and Th1/Th2 Cytokine Secretion of Bovine Peripheral Blood-derived Dendritic Cells
LIU Jin-ling1,WEI Shu2,ZHAO Yu-jun1,HE Jian-bin1*
(1.CollegeofAnimalScienceandVeterinaryMedicine,ShenyangAgriculturalUniversity,Shenyang110866,China;2.ThePreventiveCenterofAnimalDiseaseofLiaoningProvince,Shenyang110164,China)
Abstract:The objective of this study was to investigate the influence of BVDV on the cell maturation and cytokine level of Th1 and Th2 type in dendritic cells (DC) derived from bovine peripheral blood,and to further reveal the immune mechanism of BVDV infection.The monocytes from bovine peripheral blood were separated and induced into DCs,and then were co-cultured with BVDV.The cell morphology and the expression of MHCⅡ,CD80 and CD40 on DCs were observed by microscopy and flow cytometry respectively,the semi-quantitative RT-PCR was used to analyzeIL-12p40 of Th1 type cytokines andIL-10 of Th2 at mRNA levels.The results showed that DCs had typical morphology and immunophenotype with 93.81% purity.Post BVDV infection,the MHCII molecules,CD40 molecules and CD80 molecules were greatly lower than that of the control groups,the differences were statistically significant (P<0.01).IL-12p40 mRNA level was down-regulated,whileIL-10 mRNA level was up-regulated,the differences were significant (P<0.05) compared with the control groups.These results indicated that BVDV infection to DC plays an important role on maturation and regulating the balance of Th1/Th2.
Key words:BVDV;dendritic cell;immunophenotype;Th1/Th2
doi:10.11843/j.issn.0366-6964.2016.03.016
收稿日期:2015-05-20
基金项目:辽宁省博士启动项目(20141057);大学生科技创新项目(201339)
作者简介:刘金玲(1977-),女,辽宁沈阳人,讲师,博士,主要从事微生物与免疫学研究,E-mail:ljlfree@sina.com *通信作者:何剑斌,E-mail:wsfree@163.com
中图分类号:S852.659.6
文献标志码:A
文章编号:0366-6964(2016)03-0536-07
