外源性dsRNA 对蛋鸡卵泡CART基因表达及雌激素和孕酮分泌的影响
2016-07-13李鹏飞孟金柱于雪静庞钰莹杜海燕李晓明姚晓磊赵妙妙吕丽华
李鹏飞,孟金柱,于雪静,庞钰莹,杜海燕,李晓明,姚晓磊,赵妙妙,吕丽华*
(1.山西农业大学生命科学学院,太谷 030801; 2.山西农业大学动物科技学院,太谷 030801)
外源性dsRNA 对蛋鸡卵泡CART基因表达及雌激素和孕酮分泌的影响
李鹏飞1,孟金柱2,于雪静2,庞钰莹2,杜海燕2,李晓明2,姚晓磊2,赵妙妙2,吕丽华2*
(1.山西农业大学生命科学学院,太谷 030801; 2.山西农业大学动物科技学院,太谷 030801)
摘要:旨在研究双链RNA(Double-stranded RNA,dsRNA)对海兰褐蛋鸡卵泡可卡因-苯丙胺调节转录肽(Cocaine-and amphetamine-regulated transcript,CART)基因表达及雌激素(Estrodiol,E2)和孕酮(Progestin,P)分泌的影响。选择60只20周龄海兰褐蛋鸡,全价日粮预饲30 d后,随机平均分为3个处理组:对照组(A组)、dsRNA每5 d注射1次(B组)、dsRNA仅第1天注射1次(C组);30 d后每组各选择10只健康蛋鸡宰杀,分别采集3~5、6~8、9~12 mm卵泡,提取总RNA进行qRT-PCR检测;并对E2和P浓度进行测定。结果显示:注射dsRNA后,处理组B和C组CART表达量与对照组相比均降低,且在6~8 mm卵泡CART表达量显著低于对照组(P<0.05);B组注射dsRNA后,可显著提高6~8、9~12 mm卵泡E2的分泌(P<0.05);但各处理组对各卵泡P浓度无显著影响。表明体外静脉注射dsRNA可抑制蛋鸡卵泡CART的表达,并进一步通过促进卵泡细胞E2的分泌来影响卵泡的发育。
关键词:蛋鸡;卵泡;CART;双链RNA;雌激素;孕酮
蛋鸡卵泡发育过程中有成熟卵泡和未成熟卵泡之分。未成熟卵泡可分为直径<2 mm小白卵泡、3~5 mm的大白卵泡、6~8 mm小黄卵泡和9~12 mm大黄卵泡[1-2],其中每天都有6~8 mm卵泡发育成排卵前卵泡[3-4],经5~10 d的终分化排卵[5-6]。蛋鸡卵泡闭锁特点是胞浆内有红细胞、膜细胞和颗粒细胞侵入,多出现在2~8 mm卵泡[7],而9~12 mm卵泡很少闭锁[6]。蛋鸡卵巢大约包含4 000个原始卵泡,每个原始卵泡都有潜力形成一枚蛋黄,但只有不足1/4卵泡能够发育成熟和排卵,其余均在卵泡发生过程中闭锁和退化。卵泡发育中,促性腺激素对促进卵泡细胞的生长和增殖以及诱导排卵具有重要作用。研究表明,E2对调节卵泡的递次发育具有重要作用,E2在垂体前叶抑制FSH和排卵诱导素(OIH)的分泌,高浓度P抑制FSH和OIH的分泌,进而抑制卵泡发育和排卵。
CART是动物体内广泛分布的内源性神经肽,研究证实CART对牛[8-9]、猪[10]、绵羊[11]卵泡颗粒细胞的生长增殖及E2的分泌具有抑制作用。课题组前期研究已证实,CART在蛋鸡卵泡中有表达,并获得230 bp鸡卵泡CART序列[12]。而dsRNA在动物组织或细胞内可抑制同源序列的基因表达,引起干扰素反应。本试验探索性研究静脉注射dsRNA对蛋鸡不同大小卵泡内E2和P浓度的影响,探讨静脉注射dsRNA的可行性及其对鸡卵泡发育的影响,为后期研究提供技术和思路上的指导。
1材料与方法
1.1材料
1.1.1试验动物及组织本试验蛋鸡来自于偏关县新牧畜禽养殖有限公司,选择60只20周龄健康海兰褐蛋鸡,全价日粮预饲30 d,并经30 d试验,屠宰后采集不同大小卵泡,4 ℃ DPBS中保存。
1.1.2试剂dsRNA(TaKaRa,大连),鸡E2Elisa Kit试剂盒、PROG Elisa Kit试剂盒(DRG,德国)。
1.1.3溶液的配制新合成的dsRNA为粉末状,开盖前离心5 min,加入灭菌超纯水振荡混匀,终浓度为0.1 mol·mL-1。
1.2试验方法
1.2.1qRT-PCR引物设计与合成根据课题组前期测定的蛋鸡CART序列设计qRT-PCR引物;以GenBank提供的鸡β-actin基因作为内参基因,Primer 5.0在线设计引物,由TaKaRa公司合成,引物见表1。退火温度60 ℃。

表1 qRT-PCR引物
1.2.2dsRNA的设计与合成根据本课题组前期获得鸡、猪、羊CART序列结合GenBank公布的其他动物CART序列,DNAStar序列比对获得蛋鸡CART的高保守区,依据dsRNA设计原则,将5′-GAGCCCTGGACATCTACTCCGC-3′及其互补链作为CART dsRNA序列,交由TaKaRa公司合成。
1.2.3卵泡分离预饲30 d后,翅膀内侧翅静脉注射dsRNA。B组每5 d注射1次,共注射6次;C组仅在第1天注射1次,每次剂量200 μL,A组以生理盐水代替;30 d后各组分别选择10只精神状态较佳的蛋鸡屠宰,分别采集3~5、6~8、9~12 mm的卵泡各3枚,投入4 ℃ DPBS的EP管中备用。
1.2.4总RNA的提取及qRT-PCR将不同大小卵泡分别投入液氮预冷研钵中,加液氮研成粉末,转移至装有RNAiso Plus EP管,样品充分融化,4 ℃12 000 r·min-1离心5 min,吸取上清液转移至装有200 μL氯仿的EP管中,混匀后静置5 min;4 ℃12 000 r·min-1离心15 min;吸取上清液转移至装有同体积异丙醇的EP管中,混匀后,静置10 min;4 ℃12 000 r·min-1离心10 min,弃上清,底部白色沉淀即RNA。
电泳检测后,核酸蛋白测定仪检测总RNA的浓度和纯度。经反转录获得cDNA,进行qRT-PCR,每组样品重复6次,技术重复3次,反应条件:95 ℃预变性30 s;95 ℃5 s,60 ℃30 s,60个循环;95 ℃15 s,60 ℃1 min,95 ℃15 s。
1.2.5抽取卵泡液在超净台上,分别将不同大小卵泡转移到无菌表面皿上,手术剪剪开卵泡,刮刀小心刮取卵泡膜内层,2.5 mL无菌注射器及5.5号针头预润后,缓慢抽取各组卵泡液,保存至EP管中并分别标记(注意更换注射器和针头),-20 ℃保存备用。
1.2.6E2和P的测定本试验E2和P的测定使用鸡E2Elisa Kit试剂盒和PROG Elisa Kit试剂盒进行测定,试验步骤参照说明书。各组OD值都先减除空白值后分别计算。以标准品8 000、4 000、2 000、1 000、500、250、125、0 ng·mL-1为横坐标,OD值为纵坐标,在坐标纸上作图,画出标准曲线;并根据OD值在标准曲线图上分别查出相应E2和P浓度,乘上稀释倍数即为实际浓度。
1.2.7数据处理与分析检测结果用4次重复“平均值±标准误”表示,Excel 2010作图,SPSS(Statistic package for social science 18.0)对各指标进行线性相关分析。
2结果
2.1不同直径卵泡CART表达量分析
经ΔΔCT算法对不同处理组CART在不同直径卵泡的表达量进行分析,结果显示:对照组中,6~8 mm卵泡CART表达量显著高于3~5、9~12 mm卵泡;注射dsRNA后,与对照组相比,6~8 mm卵泡CART表达量显著降低(P<0.05),9~12 mm卵泡C处理组与对照组A差异显著(P<0.05);3~5 mm卵泡注射dsRNA后,与对照组相比,CART表达量不存在显著差异,但呈下降趋势(图1)。该结果表明:蛋鸡翅静脉注射dsRNA后,会不同程度抑制卵泡CART表达,其中6~8 mm处理组表达量显著下降。
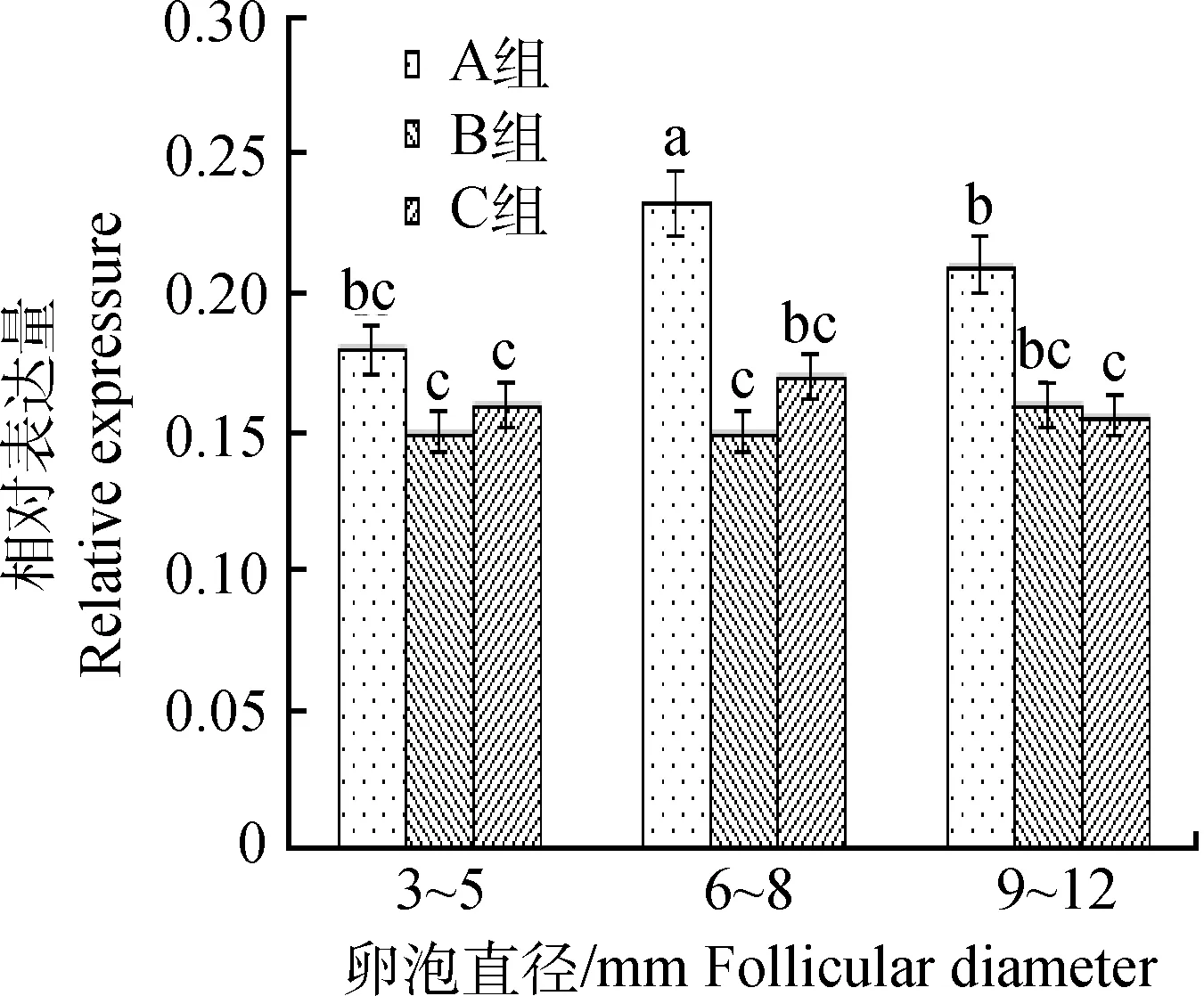
上标小写字母表示在显著水平0.05的比较结果,字母相异表示差异显著,字母相同表示差异不显著。下同Superscript small letters indicate significantly different at the level of 0.05.Values with the same letters were not significantly different and values with the different letters were significantly different.The same as below图1 不同直径卵泡中CART表达量分析Fig.1 Analysis of CART relative expression in different diameter follicles
2.2不同直径卵泡E2和P水平测定
利用鸡E2Elisa Kit试剂盒和PROG Elisa Kit试剂盒、酶标仪对各组卵泡液E2、P进行测定,经显著性检验(图2),结果显示:对照组9~12 mm卵泡E2浓度显著高于3~5、6~8 mm卵泡(P<0.05);B组9~12 mm卵泡E2浓度显著高于3~5、6~8 mm卵泡,且显著高于对照组和C组(P<0.05);C组不同直径卵泡E2浓度不存在显著差异(图2A)。P浓度测定结果显示:A组、B组、C组6~8 mm卵泡P浓度显著高于其它直径卵泡(P<0.05);不同直径卵泡各组内P浓度差异不显著(图2B)。
3讨论
dsRNA在干扰基因表达和功能执行中具有(1)特异性:dsRNA只引起与其同源的mRNA降解;(2)高效性:微量dsRNA即可有效抑制目的基因表达;(3)可传播性:dsRNA可跨膜发挥作用,局部注射能够传播到整个机体。因此,dsRNA干扰技术受到广泛关注。本试验选择不同时间间隔通过鸡翅静脉注射dsRNA,研究dsRNA对蛋鸡卵泡CART表达的抑制效果,目的在于验证dsRNA体外注射后,血液中的相关酶类是否对dsRNA进行酶解,能否运送到卵泡发挥其干扰CART的表达;结果表明体外注射特异性dsRNA可引起蛋鸡卵泡CART表达发生显著变化。蛋鸡6~8 mm 卵泡是卵泡走向闭锁或继续发育为优势卵泡的转折点[5,12],本研究qRT-PCR结果显示,6~8 mm卵泡CART表达量显著高于3~5、9~12 mm卵泡,这表明CART 可能是蛋鸡卵泡发育的关键影响因素之一。
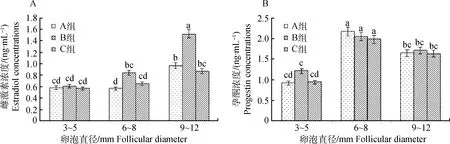
图2 各处理组不同直径卵泡中E2和P浓度显著性分析Fig.2 Significant analysis of E2and P concentration in different diameter follicles and treatment groups
本研究中9~12 mm卵泡处理组C与对照组A差异显著,但与处理组B不存在显著差异,该结果还需要在后期研究中进行验证。dsRNA每5 d注射1次(B组)及仅在第1天注射1次(C组)均会不同程度抑制卵泡CART的表达。本课题组在前期通过免疫组化技术对蛋鸡不同大小卵泡CART表达进行了研究,包括直径<2 mm卵泡在内,CART在蛋鸡卵巢卵母细胞、膜层细胞和颗粒层细胞均有表达,且膜层表达量高于颗粒层细胞,在6~8 mm 卵泡CART表达量最高[12]。在本研究中,选择3~5、6~8、9~12 mm卵泡作为检测CART表达量的样本;直径<2 mm的卵泡从颗粒细胞、膜细胞的分离、卵泡液的抽取及样本量上,没有可操作性,故未作为试验样本。
A.Sen等[13]对CART的信号传导通路进行了研究,结果表明:CART高度抑制FSH诱导的卵泡颗粒细胞cAMP水平的升高,并抑制E2的积累以及芳香化酶mRNA的表达。Ca2+对FSH诱导的卵泡颗粒细胞cAMP水平的升高以及E2的积累是必需的,而CART能明显抑制FSH诱导的Ca2+流入。2008年A.Sen等[8]提出牛卵泡颗粒细胞内CART作用机制的模型。该模型表明,FSH刺激Erk1/2和 Akt激活,而CART则加速该信号的终止,CART单独刺激并诱导牛卵泡颗粒细胞Erk1/2激活过程中Go/i-PKC-MEK依赖的通路。是否CART诱导Go/i蛋白直接使PKC磷酸化,然后激活MEK和Erk1/2,或者是否Erk1/2通过PKC依赖的方式被激活,这些机理仍不清楚。CART刺激Erk1/2 激活是不依赖于PKA、PI3K、和RTK,双特异性磷酸酶5(Dual specificity phosphatase 5,DUSP5)的表达依赖于Erk1/2。CART诱导DUSP5表达,功能上需要CART诱导Erk1/2信号的终止和通过Erk1/2依赖的转录机制的调节。而对于蛋鸡卵泡,其P的分泌是由颗粒细胞执行该功能的,这与牛卵巢P的分泌机制不同,在整个信号传导过程中,CART表达量及信号通路的变化也会影响到芳构化酶CYP19A1 的表达,进而影响P的分泌。

家禽卵泡P的合成主要由颗粒细胞执行,从原始卵泡到排卵卵泡的整个发育进程中,LH和FSH协同作用于卵泡细胞,调节并促进P和E2合成、卵泡成熟和排卵有序进行[19-20]。雄激素和E2生物合成以P作为前体物,P浓度适量时促进卵泡成熟和排卵;浓度较高则抑制FSH和LH的分泌与调节过程,进一步会抑制鸡卵泡发育和排卵[21-24]。本试验结果表明:3~5、6~8、9~12 mm卵泡各处理组内P浓度差异不显著,仅在6~8 mm卵泡内P浓度显著高于其它直径卵泡,这也进一步证明蛋鸡6~8 mm卵泡是走向闭锁或继续发育为优势卵泡的转折点。
4结论
外源性dsRNA干扰后可不同程度降低蛋鸡卵泡CART的表达,并进一步通过影响卵泡颗粒层和膜层细胞P和E2的合成与分泌,对蛋鸡卵泡的发育及排卵过程发挥调控作用。
参考文献(References):
[1]ONAGBESAN O,BRUGGEMAN V,DECUYPERE E.Intra-ovarian growth factors regulating ovarian function in avian species:a review[J].AnimReprodSci,2009,111(2-4):121-140.
[2]LOVELL T M,GLADWELL R T,GROOME N P,et al.Ovarian follicle development in the laying hen is accompanied by divergent changes in inhibin A,inhibin B,activin A and follistatin production in granulosa and theca layers[J].JEndocrinol,2003,177(l):45-55.
[3]MAHON M G,LINDSTEDT K A,HERMANN M,et al.Multiple involvement of clusterin in chicken ovarian follicle development.Binding to two oocyte-specific members of the low density lipoprotein receptor gene family[J].JBiolChem,1999,274(7):4036-4044.
[4]WOODS D C,JOHNSON A L.Regulation of follicle-stimulating hormone-receptor messenger RNA in hen granulosa cells relative to follicle selection[J].BiolReprod,2005,72(3):643-650.
[5]TILLY J L,KOWALSKI K I,JOHNSON A L.Stage of ovarian follicular development associated with the initiation of steroidogenic competence in avian granulosa cells[J].BiolReprod,1991,44(2):305-314.
[6]GILBERT A B,PERRY M M,WADDINGTON D,et al.Role of atresia in establishing the follicular hierarchy in the ovary of the domestic hen(Gallusdomesticus)[J].JReprodFertil,1983,69(1):221-227.
[7]GUPTA S K,GILBERT A B,WALKER M A.Histological study of follicular atresia in the ovary of the domestic hen(Gallusdomesticus)[J].JReprodFertil,1988,82(1):219-225.
[8]SEN A,LÜ L H,BELLO N,et al.Cocaine- and amphetamine-regulated transcript accelerates termination of follicle-stimulating hormone-induced extracellularly regulated kinase 1/2 and Akt activation by regulating the expression and degradation of specific mitogen-activated protein kinase phosphatases in bovine granulose cells[J].MolEndocrinol,2008,22(12):2655-2676.
[9]LÜ L H,JIMENEZ-KRASSEL F,SEN A,et al.Evidence supporting a role for cocaine- and amphetamine-regulated transcript(CARTPT) in control of granulosa cell estradiol production associated with dominant follicle selection in cattle[J].BiolReprod,2009,81(3):580-586.
[10]李鹏飞,岳文斌,李富禄,等.可卡因-苯丙胺调控转录肽(CART)对猪卵巢卵泡颗粒细胞雌激素产生的影响[J].畜牧兽医学报,2012,43(12):1879-1886.
LI P F,YUE W B,LI F L,et al.Effects of CART on estradiol production of pig ovarian follicular granulosa cellsinvitroculture[J].ActaVeterinariaetZootechnicaSinica,2012,43(12):1879-1886.(in Chinese)
[11]李鹏飞,岳文斌,黄洋,等.可卡因-苯丙胺调控转录肽对绵羊卵巢卵泡颗粒细胞雌激素产生的影响[J].畜牧兽医学报,2013,44(6):853-857.
LI P F,YUE W B,HUANG Y,et al.Effects of CART on estradiol productioninvitroin follicular granulose cells of sheep ovarian[J].ActaVeterinariaetZootechnicaSinica,2013,44(6):853-857.(in Chinese)
[12]于雪静.蛋鸡卵巢CART基因的表达及蛋白定位[D].太谷:山西农业大学,2013.
YU X J.Expression ofCARTgene and protein locating in ovary of hen[D].Taigu:Shanxi Agricultural University,2013.(in Chinese)
[13]SEN A,BETTEDOWDA A,JIMENEZ-KRASSEL F,et al.Cocaine- and amphetamine-regulated transcript regulation of follicle-stimulating hormone signal transduction in bovine granulosa cells[J].Endocrinology,2007,148(9):4400-4410.
[14]NITTA H,OSAWA Y,BAHR J M.Multiple steroidogenic cell population in the thecal layer of preovulatory follicles of the chicken ovary[J].Endocrinology,1991,129(4):2033-2040.
[15]JOHNSON P A,STOKLOSOWA S,BAHR J M.Interaction of granulosa and theca layers in the control of progesterone secretion in the domestic hen[J].BiolReprod,1987,37(5):1149-1155.
[16]TANAKA K,LI Z D,ATAKA Y.Studies of ovulation in the perfused ovary of the fowl(Gallusdomesticus)[J].JReprodFertil,1987,80(2):411-416.
[17]JOHNSON A L.Intracellular mechanisms regulating cell survival in ovarian follicles[J].AnimReprodSci,2003,78(3-4):185-201.
[18]JOHNSON A L,WOODS D C.Dynamics of avian ovarian follicle development:cellular mechanisms of granulosa cell differentiation[J].GenCompEndocrinol,2009,163(1-2):12-17.
[19]PALERMO R.Differential actions of FSH and LH during folliculogenesis[J].ReprodBiomedOnline,2007:15(3):326-337.
[20]TSUTSUI K,BENTLEY G E,BEDECARRATS G,et al.Gonadotropin-inhibitory hormone(GnIH) and its control of central and peripheral reproductive function[J].FrontNeuroendocrinol,2010,31(3):284-295.
[21]ING N H.Steroid hormones regulate gene expression posttranscriptionally by altering the stabilities of messenger RNAs[J].BiolReprod,2005,72(6):1290-1296.
[22]STOCCO C.Aromatase expression in the ovary:hormonal and molecular regulation[J].Steroids,2008,73(5):473-487.
[23]WALTERS K A,ALLAN C M,HANDELSMAN D J.Androgen actions and the ovary[J].BiolReprod,2008,78(3):380-389.
[24]LUCKI N C,SEWER M B.The interplay between bioactive sphingolipids and steroid hormones[J].Steroids,2010,75(6):390-399.
(编辑程金华)
Effects of Exogenous dsRNA onCARTGene Expression and Secretion of Estrodiol and Progestin in Layer Follicles
LI Peng-fei1,MENG Jin-zhu2,YU Xue-jing2,PANG Yu-ying2,DU Hai-yan2,LI Xiao-ming2,YAO Xiao-lei2,ZHAO Miao-miao2,LÜ Li-hua2*
(1.CollegeofLifeScience,ShanxiAgriculturalUniversity,Taigu030801,China;2.CollegeofAnimalScienceandTechnology,ShanxiAgriculturalUniversity,Taigu030801,China)
Abstract:To investigate the effect of double-stranded RNA(dsRNA) on cocaine-and amphetamine-regulated transcript(CART) gene expression and estrodiol(E2) and progestin(P) secretion in follicles of Highland Brown Laying hen.A total of 60 healthy layers at 20-week-old were selected and randomly divided into 3 experimental groups(A group:control group;B group:with treatment of dsRNA intravenous injection every 5 d;and C group:with treatment of dsRNA one initial injection).After 30 d of feeding,the different size of 3-5,6-8,9-12 mm follicles of 10 layers from each group were collected for analyzing mRNA expression of CART and determining the concentration of E2and P.The results showed that mRNA expression of CART was decreased in group B and C,compared with the control group.Especially,mRNA expression of CART in 6-8 mm follicle was lower than that in the control group with significant difference(P<0.05);The levels of E2was increased in the follicles with the size of 6-8 and 9-12 mm in group B with significant difference(P<0.05);However,there was no significant difference in the level of P among different treatment groups.The results suggested that intravenous injection of dsRNA could affect the follicular development through inhibiting the mRNA expression of CART and promoting the E2production in layer.
Key words:hen;follicle;CART;dsRNA;estrodiol;progestin
doi:10.11843/j.issn.0366-6964.2016.03.013
收稿日期:2015-08-26
基金项目:国家自然科学基金(31172211);农业部948项目(2010-Z43);山西省横向协作与委托项目(2010HX54);山西省回国留学人员科研资助项目(2014-重点5);山西省科技攻关项目(20130311027-2);山西省人事厅人才引进项目;山西农业大学引进人才博士科研启动费(2014ZZ04) ;科研管理费资助重大项目和标志性成果培育项目(71060003)
作者简介:李鹏飞(1978-),男,山西偏关人,博士,副教授,主要从事动物生殖生理方面的研究,E-mail:adamlpf@126.com *通信作者:吕丽华,E-mail:lihualvsxau@126.com
中图分类号:S831.2
文献标志码:A
文章编号:0366-6964(2016)03-0515-06
