不同海拔条件下牦牛颈动脉体组织微细结构的比较研究
2016-07-12雷乃虎马艳芳沈明华
张 寿,常 兰*,雷乃虎,2,马艳芳,沈明华
(1.青海大学 农牧学院动物医学系,西宁 810016; 2.青海省天峻县畜牧兽医工作站,天峻 817200)
不同海拔条件下牦牛颈动脉体组织微细结构的比较研究
张寿1,常兰1*,雷乃虎1,2,马艳芳1,沈明华1
(1.青海大学 农牧学院动物医学系,西宁 810016; 2.青海省天峻县畜牧兽医工作站,天峻 817200)
摘要:旨在揭示牦牛在不同程度低氧下颈动脉体的结构特征。本研究采用组织学、免疫组织化学方法和透射电子显微镜技术,对青海省不同海拔的成年健康牦牛颈动脉体的形态结构进行观察,并运用显微体视学方法比较Ⅰ型细胞(明细胞、暗细胞)、Ⅱ型细胞和血管的体密度(Vv)、面密度(Sv)、面数密度(NA)、比表面(δ)。结果表明,牦牛颈动脉体中明细胞数量多、暗细胞较少,胞质含大量线粒体和特有的电子致密核心囊泡,随着海拔升高,线粒体和EDCV的大小和数量无明显变化;Ⅱ型细胞分布于Ⅰ型细胞的周围,细胞小而少。间质中分布有丰富的毛细血管,管腔随海拔升高逐渐变大。明细胞的Sv、NA随着海拔的升高逐渐增大,各海拔组之间差异显著;暗细胞的Vv、Sv和NA随着海拔的升高逐渐增大,海拔4 600 m与2 800 m组间差异均显著;Ⅱ型细胞的Sv、NA随着海拔的升高逐渐增大,海拔4 600 m组与其它两组间(海拔2 800 m组和3 800 m组)差异均显著;颈动脉体微血管的Sv、δ随着海拔的升高逐渐减小,且Sv在海拔4 600 m与2 800 m组之间差异显著,δ各组之间差异均显著。综上表明,随着海拔升高,牦牛颈动脉体Ⅰ型细胞和Ⅱ型细胞数量明显增多、微血管明显扩张。
关键词:结构;体视学;颈动脉体;牦牛;不同海拔
颈动脉体(Carotid body,CB)是机体内感受动脉血的化学感受器,位于颈总动脉分叉处、血管壁外周的结缔组织中。CB可感受血液中的化学变化,如血液中出现缺氧、CO2分压升高和H+浓度增大等变化。缺氧引起Ⅰ型细胞胞浆钙离子升高,神经递质释放增加,窦神经放电频率增加,通过呼吸中枢,引起呼吸加深加快。颈动脉体由实质和间质组成,实质细胞有两种主要类型,即Ⅰ型细胞(或称主细胞、球细胞)和Ⅱ型细胞(或称支持细胞、卫星细胞),Ⅰ型细胞是数量最多的一种细胞,又分为明细胞和暗细胞;Ⅱ型细胞包绕在Ⅰ型细胞周围,间质有丰富的毛细血管、结缔组织和神经[1-3]。自发现颈动脉体对缺氧的敏感性以来,低氧环境下颈动脉体形态和功能的改变引起了国内外许多学者的重视,但主要集中在人[4]、小鼠[5-7]、大鼠[8-9]和兔[10]上,而对生活在青藏高原高寒低氧生态环境下牦牛颈动脉体的研究未见报道。本研究对不同海拔牦牛颈动脉体光镜及电镜结构和光镜体视学进行研究,以揭示牦牛不同低氧程度下CB的结构特征。
1材料与方法
1.1材料
选取生活在青海省玛多县(海拔4 600 m)、天峻县(3 800 m)和湟源县(2 800 m)的成年(5岁左右)健康牦牛各5头,经颈动脉放血处死后,立即取左、右两侧颈动脉体,左侧颈动脉体置于4%多聚甲醛磷酸缓冲液(0.01 mol·L-1,pH 7.4)中固定48 h,用于光镜制样(右侧颈动脉体取1 mm×1 mm×2 mm大小组织投入冷2.5%戊二醛固定液中,用于透射电镜制样)。
1.2光镜制样
经4%多聚甲醛磷酸液固定的颈动脉体,常规石蜡包埋,切片,片厚4 μm,分别行苏木精-伊红(HE)染色和免疫组织化学染色。
免疫组织化学染色:切片脱蜡至水,用0.01 mol·L-1PBS液(pH7.4)漂洗3次,每次8 min;切片柠檬酸修复液高压修复2 min,自然冷却至室温,用0.01 mol·L-1PBS液(pH 7.4)漂洗3次,每次8 min;切片在室温下用内源性过氧化物酶阻断剂孵育20 min,用0.01 mol·L-1PBS液(pH 7.4)漂洗3次,每次8 min;滴加非免疫动物血清(羊),室温下孵育45 min;弃去血清,加第一抗体(兔源性CD34多克隆抗体,工作浓度为1∶200,武汉博士德公司产品),置4 ℃冰箱过夜,用0.01 mol·L-1PBS液(pH 7.4)漂洗3次,每次8 min;滴加生物素标记的羊抗兔IgG,室温下孵育2 h,用0.01 mol·L-1PBS液(pH 7.4)漂洗3次,每次8 min;加链霉菌抗生素蛋白-过氧化物酶溶液,37 ℃孵育30 min(SP试剂盒,福州迈新公司),用0.01 mol·L-1PBS液(pH 7.4)漂洗3次,每次8 min;入DAB显色剂显色6 min,蒸馏水洗终止反应,用0.01 mol·L-1PBS液(pH 7.4)漂洗3次,每次8 min;苏木精染液中复染、脱水、透明、封片、镜检。阴性对照试验以用0.01 mol·L-1PBS液代替一抗,其余同前所述。
每枚CB经HE和免疫组织化学染色的组织分别选取5张切片,用Olympus显微镜观察,Olympus DP70图像采集系统取图,在400倍的放大倍率下每张切片选取随机拍摄3个视野用于显微体视学分析。
1.3透射电镜制样
经2.5%戊二醛固定液(0.2 mol·L-1磷酸缓冲液50 mL,25%戊二醛水溶液10 mL,然后加双蒸水至100 mL配制而成;25%戊二醛由天津市光复精细化工研究所生产)中的颈动脉体组织,0.1 mol·L-1PBS漂洗后,1%锇酸固定2 h,丙酮梯度脱水,环氧树脂618包埋,每头做2个包埋块,超薄切片,进行醋酸铀和枸橼酸铅双重染色,用日本产H-7650型透射电镜在放大3 000倍、10 000倍和30 000倍下观察超微结构。
1.4立体定量分析方法
参照E.R.Weibel[11]和郑富盛[12]正方测试格点计数法,绘制光镜电子方格测量系统,用点计数法在光镜照片上计数落入参照系的测试点数(Pr),参照系内待测结构(明细胞、暗细胞、支持细胞、血管)的数目(Nx)、待测结构内的测试点数(Px)、待测结构的边界与测试线的交点数(Ix),按立体学公式计算出待测结构的体积密度(Volume density,Vv)、面密度(Surface density,Sv)、比表面(Specific surface,δ)、面数密度(Numerical density on area,NA)各结构参数。
1.5统计学处理
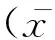
2结果
2.1不同海拔牦牛颈动脉体光镜和透射电镜结构观察
牦牛颈动脉体由实质和间质构成。实质被间质分隔成许多小叶,每个小叶由大量紧密排列的小球构成,小球内有丰富的实质细胞和少量的间质细胞。实质细胞包括Ⅰ型细胞和Ⅱ型细胞。图1~3表明,Ⅰ型细胞数量多,分布于小球外围的“C”型区域内侧,常排列成簇,Ⅰ型细胞又根据细胞核的形态分为明细胞和暗细胞两种,明细胞核膜明显,核内常染色质丰富,细胞体积较大、数量多,胞浆淡染并含有大小不等的空泡,暗细胞核含大量异染色质,核深染,细胞体积比前者小。Ⅰ型细胞内含大量线粒体和特有的电子致密核心囊泡(Electron dense-cored vesicles,EDCV),随着海拔升高,线粒体和EDCV的大小和数量无明显变化。Ⅱ型细胞分布于Ⅰ型细胞的周围,细胞小而少,呈扁的细长形,胞核呈三角形、椭圆形或梭形的,并略向主细胞弯曲,胞浆少。随海拔的升高,Ⅰ型细胞、Ⅱ型细胞数量增多。间质中分布有丰富的毛细血管,并且随海拔的升高,毛细血管管腔逐渐变大。
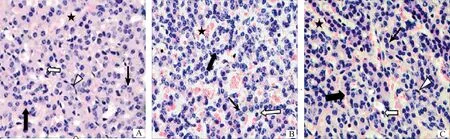
A.海拔2 800 m;B.海拔3 800 m;C.海拔4 600 m。.小球;↑.明细胞;.暗细胞;.Ⅱ型细胞,★.毛细血管A.Altitude 2 800 m;B.Altitude 3 800 m;C.Altitude 4 600 m..Globule;↑.Light cell;.Dark cell;.Type II cell;★.Blood capillary图1 牦牛颈动脉体光镜结构图(HE染色 40×)Fig.1 Light microscopic structure of yak carotid body (HE staining 40×)

A、B、C.海拔2 800 m:A.3 000×;B.10 000×;C.30 000×。☆.Ⅰ型细胞;△.Ⅱ型细胞;.电子致密核心囊泡;.线粒体A,B,C.Altitude 2 800 m:A.3 000×;B.10 000×;C.30 000×.☆.Type I cell;△.Type II cell;.EDCV;.Mitochondria图2 牦牛颈动脉体透射电镜图Fig.2 Chief cell and mitochondria in carotid body of yak at different altitudes
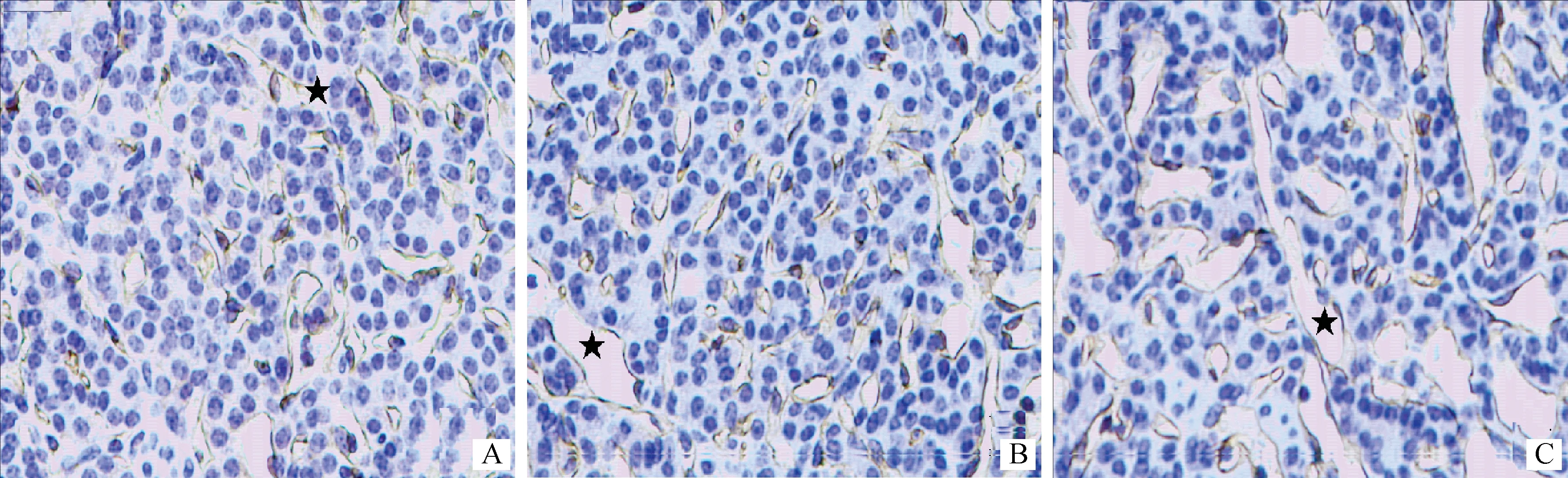
A.海拔2 800 m;B.3 800 m;C.海拔4 600 m。★.微血管A.Altiude 2 800 m;B.Altitude 3 800 m;C.Altitude 4 600 m.★.Micrangium图3 牦牛颈动脉体微血管(CD34免疫组织化学染色 40×)Fig.3 The carotid body micrangium of the yak (CD34 immunohistochemical staining 40×)
2.2不同海拔牦牛颈动脉体的体视学结果
2.2.1Ⅰ型细胞明细胞:由表1和图1可知,随着海拔的升高,牦牛颈动脉体明细胞的Sv、AN逐渐增大,到海拔4 600 m达到最高值,并且各海拔组之间差异显著(P<0.05);Vv、δ也均表现为上升趋势,到海拔4 600 m时也达到最大值,Vv在海拔4 600 m组与海拔2 800 m、海拔3 800 m组差异均显著(P<0.05),但后两组间差异不显著(P>0.05);δ在海拔2 800 m组与海拔3 800 m、海拔4 600 m组之间差异均显著(P<0.05),而海拔3 800 m和海拔4 600 m组间差异不显著(P>0.05)。暗细胞(表1):牦牛颈动脉体暗细胞的Vv、Sv和NA随着海拔的升高逐渐增大,到海拔4 600 m达到最高值,且与海拔2 800 m组间差异均显著(P<0.05),而与海拔3 800 m间差异均不显著(P>0.05);δ随着海拔升高到3 800 m时达到最大值,然后略有下降,且海拔4 600 m组与海拔2 800 m、海拔3 800 m组之间差异均不显著(P>0.05),但后两组之间差异显著(P<0.05)。
2.2.2Ⅱ型细胞由表1可知,随着海拔的升高,牦牛颈动脉体Ⅱ型细胞的Sv、NA逐渐升高,到海拔4 600 m达到最高值,且海拔4 600 m组与其它两组相比差异均显著(P<0.05),其它两组之间相比差异均不显著(P>0.05);Vv随着海拔升高至3 800 m时略有减小(P>0.05),随后在海拔4 600 m时升至最大值,且海拔4 600 m与其它两个海拔组的相比差异均显著(P<0.05);δ随着海拔升高到3 800m时达到最大值,然后略有下降且各海拔组之间差异不显著(P>0.05)。
2.2.3微血管由表1可知,随着海拔的升高,牦牛颈动脉体微血管的Sv、δ逐渐减小,且Sv在海拔2 800 m组与海拔3 800 m、海拔4 600 m组间差异均显著(P<0.05),后两组之间差异不显著(P>0.05),δ各组之间差异均显著(P<0.05);NA随着海拔升高而增大,但3组之间差异均不显著(P>0.05);Vv随海拔升高到海拔3 800 m时有所下降(P>0.05),随后逐渐升高,到海拔4 600 m时达到最大值(P<0.05),但海拔2 800 m组与4 600 m组间差异不显著(P>0.05)。
3讨论

表1 不同海拔牦牛颈动脉体明、暗细胞、Ⅱ型细胞和血管参数的比较
同列上标不同字母代表差异显著(P<0.05)。n=5;Δn.照片张数
The data with different capital letters within the same column differ significantly(P<0.05).n=5;Δn.Number of photograph
颈动脉体对血浆氧和二氧化碳分压的改变以及H+的含量十分敏感,并通过神经体液反射性调节心血管及呼吸功能,促进机体对缺氧的适应。长期低氧刺激可引起颈动脉体体积增大,其原因除了血管增生、扩张外,主要是实质细胞增生所致。比较正常大鼠和慢性缺氧大鼠CB组织成份,发现慢性缺氧大鼠CB含有较多的Ⅰ型细胞[13-14];卜凤珍等[4]对高原成人颈动脉体研究时发现高原组颈动脉体主细胞和支持细胞明显增生,表现为数量增多、体积增大,并且随着海拔高度的增加而增加。
明细胞和暗细胞被认为是相同细胞的不同转化类型[3],有学者称暗细胞为“储备”细胞,在一定的范围内会增殖为明细胞,向明细胞过渡[15]。也有人认为暗细胞是主细胞的幼稚阶段[4]。本研究结果发现,牦牛颈动脉体明细胞(执行功能成熟氧感受细胞)的数量随海拔升高而增加,且各海拔组之间具有明显差异,这与卜凤珍等[4]的研究结果相同。而牦牛颈动脉体暗细胞的数量虽然随海拔升高而增加,但在海拔2 800 m与3 800 m组间差异显著,而海拔3 800 m与4 600 m组间差异不显著,这与卜凤珍等[4]的研究结果不太一致,分析原因可能是在海拔3 800 m时,中度低氧刺激使暗细胞大量增生,部分暗细胞转化为主细胞,而在海拔4 600 m时,低氧刺激程度增加,大部分增生的暗细胞迅速转化成为明细胞,以执行低氧适应的功能。随着海拔升高,牦牛细胞内线粒体和EDCV的大小和数量无明显变化。牦牛虽然选自不同海拔,但是它们都世代生活在高原低氧环境中,机体受到高原低氧的持续刺激后,CB中线粒体和EDCV的数量、大小等均处在相对稳定的范围内。主细胞可迅速刺激呼吸中枢,研究发现,虽然棕色挪威大鼠的通气反应低于SD大鼠,但棕色挪威大鼠的主细胞数量却多于SD大鼠[16],至于不同海拔牦牛的低氧通气反应特征如何将有待于进一步研究。
颈动脉体支持细胞具有干细胞潜能[17]。最近的研究表明,在对低氧的应答中,低氧并没有直接影响神经干细胞增生,而是通过颈动脉体成熟球细胞分泌的神经递质-内皮素1(为氧感受元件),与表达内皮素1受体的干细胞建立大量的突触样联系,诱导支持细胞增生[18]。在慢性低氧刺激下支持细胞可以分化为神经干细胞标记物(Nestin)阳性的过渡态细胞,并可增殖分化为酪氨酸羟化酶(Tyrosine hydroxylase,TH) 阳性的球细胞[17]。牦牛为了能更好地适应低氧环境,随着海拔升高,机体需要大量的支持细胞向明细胞过渡以执行其功能,本研究中表现为支持细胞数量随海拔升高而增多的现象,这也与卜凤珍等[4]的研究结果相同。
颈动脉体具有复杂的血管构筑和巨大的血流量[8,10,19],目前认为这与它的化学感受器感受功能有密切的关系,高度的血管化有利于准确地获得动脉血液化学成分的变化。低氧下颈动脉体体积明显增大,其原因与血管的增生及扩张有关。大鼠低氧28 d,发现CB血窦体密度从14%增加到31%[20];杨风乡等[8]报道进入高原7 d大鼠颈动脉体微血管体密度急剧增多,与平原组之间均有极显著差异,但微血管比表面下降,与平原组相比显著差异,表明微血管扩张明显;进入高原30 d大鼠微血管体密度、面密度进一步增高,比表面继续呈下降趋势,表明微血管进一步扩张。本研究结果显示,各海拔组牦牛颈动脉体中均分布有丰富的血管,并且随着海拔的升高,血管数量呈增加趋势,但3个海拔组之间差异不显著;而血管的管腔随海拔的升高明显增大,这与杨风乡等[8]研究报道基本一致,说明牦牛通过颈动脉体组织中微血管扩张,增加颈动脉体的血流量来准确地获得动脉血液化学成分的变化,从而提高颈动脉体组织获氧效率,以增强对低氧环境的适应能力。研究报道,兔子CB血流量的减少参与了外周化学反应敏感性的增加[21],那么,随着海拔的升高,牦牛CB血流量的增加,是否与低氧通气反应钝化有关将有待于进一步研究证实。
参考文献(References):
[1]成令忠.组织学[M].第2版.北京:人民出版社,1992:871-874.
CHENG L Z.Histology[M].2ndedition.Beijing:People’s Publishing House,1992:871-874.(in Chinese)
[2]EYZAGUIRRE C,MONTI-BLOCH L,WOODBURY J W.Effects of putative neurotransmitters of the carotid body on its own glomus cells[J].EurJNeurosci,1990,2(1):77-88.
[3]VINHAES E N,DOLHNIKOFF M,SALDIVA P H.Morphological changes of carotid bodies in acute respiratory distress syndrome:a morphometric study in humans[J].BrazJMedBiolRes,2002,35(10):1119-1125.
[4]卜凤珍,屠道同,程仲谋,等.高原成人颈动脉体的光镜观察和体视学研究[J].中国病理生理杂志,1999,15(3):287-293.
BU F Z,TU D T,CHENG Z M,et al.Light microscopic observation and stereologic study of carotid bodies at high altitude[J].ChineseJournalofPathophysiology,1999,15(3):287-293.(in Chinese)
[5]KLINE D D,PENG Y J,MANALO D J,et al.Defective carotid body function and impaired ventilatory responses to chronic hypoxia in mice partially deficient for hypoxia-inducible factor 1alpha[J].ProcNatlAcadSciUSA,2002,99(2):821-826.
[6]BALBIR A,LEE H,OKUMURA M,et al.A search for genes that may confer divergent morphology and function in the carotid body between two strains of mice[J].AmJPhysiolLungCellMolPhysiol, 2007,292(3):L704-L715.
[7]SHIRAHATA M,KOSTUK E W,PICHARD L E.Carotid chemoreceptor development in mice[J].RespirPhysiolNeurobiol,2013,185(1):20-29.
[8]杨风乡,薜大海,朱建刚.高原低氧大鼠颈动脉体的体视学研究[J].青海医学院学报,1993,14(3,4):145-152.
YANG F X,XUE D H,ZHU J G.A stereological study of the carotid bodies exposed to high-altitued hypoxid[J].JournalofQinghaiMedicalCollege,1993,14(3,4):145-152.(in Chinese)
[9]KANG D W,WANG J J,HOGAN J O,et al.Increase in cytosolic Ca2+produced by hypoxia and other depolarizing stimuli activates a non-selective cation channel in chemoreceptor cells of rat carotid body[J].JPhysiol,2014,592(Pt 9):1975-1992.
[10]ALMARAZ L,PÉREZ-GARCA M T,GMEZ-NINO A.Mechanisms of α2-adrenoceptor-mediated inhibition in rabbit carotid body[J].AmJPhysiol,1997,272(2 Pt 1):628-637.
[11]WEIBEL E R.Stereological principles for morphometry in electron microscopic cytology[J].IntRevCytol,1969,26(26):235-302.
[12]郑富盛.细胞形态立体计量学[M].北京:北京医科大学中国协和医科大学联合出版社,1990:19-86.
ZHENG F S.Solid metrology of cell morphous[M].Beijing:Beijing Medical University,Peking Union Medical College United Publishing House,1990:19-86.(in Chinese)
[13]DHILLON D P,BARER G R,WALSH M.The enlarged carotid body of the chronically hypoxic and chronically hypoxic and hypercapnic rat:a morphometric analysis[J].QJExpPhysjol,1984,69(2):301-317.
[14]BARER G,WALSH M.Chronically hypoxic rat carotied bodies[J].JPhysiol,1979,290(2):38p.
[15]屠道同,卜凤珍,程仲谋.高原人的颈动脉体形态学研究[J].高原医学杂志,1992,2(2):20-23.
TU D T,BU F Z,CHENG Z M.A morphlogic study on human carotid bodies at high altitue[J].JournalofHighAltitudeMedicine,1992,2(2):20-23.(in Chinese)
[16]DONOVANA L M,CHAI S,GILLOMBARDO C B,et al.Ventilatory behavior and carotid body morphology of Brown Norway and Sprague Dawley rats[J].RespirPhysiolNeurobiol,2011,178(2):250-255.
[18]PLATERO-LUENGO A,GONZLEZ-GRANERO S,DURN R,et al.An O2-sensitive glomus cell-stem cell synapse induces carotid body growth in chronic hypoxia[J].Cell,2014,156(1-2):291-303.
[19]CLARKE J A,DE BURGH DALY M,EAD H W.Dimensions and volume of the carotid body in the adult cat,and their relation to the specific blood flow through the organ.A histological and morphometric study[J].AcatAnat(Basel),1986,126(2):84-86.
[20]MCGREGOR K H,GIL J,LAHIRI S.A morphometric study of the carotid body in chronically hypoxic rats[J].JApplPhysiolRespirEnvironExercPhysiol,1984,57(5):1430-1438.
[21]DING Y F,LI Y L,SCHULTZ H D.Role of blood flow in carotid body chemoreflex function in heart failure[J].JPhysiol,2011,589(Pt 1):245-258.
(编辑程金华)
Morphological Observation and Stereologic Study on Carotid Body of Yaks at Different Altitudes
ZHANG Shou1,CHANG Lan1*,LEI Nai-hu1,2,MA Yan-fang1,SHEN Ming-hua1
(1.VeterinaryMedicineDepartmentofAgricultureandAnimalHusbandaryCollege,QinghaiUniversity,Xining810016,China;2.TianjunCountyAnimalHusbandryandVeterinaryStationofQinghai,Tianjun817200,China)
Abstract:To reveal the morphological structure characteristics of carotid body of Yak in different hypoxia.In this study,the morphological structures of carotid body observed by histologial,immunohistochemical methods and electron transmission microscopy techniques in health adult yaks at different altidudes in Qinghai Province,and the volume density(Vv),surface density(Sv),numerical density on area(NA) and specific surface(δ) of type Ⅰ cells(light and dark),type Ⅱ cells and microvessels in carotid body of yaks at different altitudes were compared by light microscope and microstereology.The results showed that there were many more light cells than dark cells.The type I cells contain mitochondria and electron dense-cored vesicles in their cytoplasm,in size and number of mitochondria and electron dense-cored vesicles,no significant differences between 2 of the groups were found with height of sea level.The type Ⅱ cells surrounding type Ⅰ cells were small and little.There were rich capillaries in mesenchyme,increasing diameter of the inner lumen of the capillaries with the elevation increasing.The numerical density on area and surface density of light cells were increased with height of sea level,and there were the significant difference between any 2 of the groups.The volume density,surface density and numerical density on area of dark cells gradually increased with altitude,there was the significant difference between altitude 4 600 m and altitude 2 800 m.The surface density and numerical density on area of type Ⅱ cells gradually increased with the elevation rise,and there were the significant difference between 4 600 m and 2 800 m,3 800 m respectively.The surface density and specific surface of microvessels decreased with altitude.In surface density,there was significantly different between altitude 4 600 m and 2 800 m,in specific surface,there were significant difference between any 2 of the groups.The results suggested that these type Ⅰ cells and type Ⅱ cells increased markedly in number,and the microvessels lumina dilated obviously with height of sea level.
Key words:structure;microstereology;carotid body;yak;different altitude
doi:10.11843/j.issn.0366-6964.2016.03.029
收稿日期:2015-08-17
基金项目:国家自然科学基金(31360590);青海省科技应用基础项目(2014-ZJ-711)
作者简介:张寿(1964-),男,青海西宁人,教授,硕士生导师,主要从事高原动物低氧适应研究,E-mail:qhzhangshou@163.com *通信作者:常兰,E-mail:changlan0123@163.com
中图分类号:S852.16
文献标志码:A
文章编号:0366-6964(2016)03-0630-07
