糖肾方改善db/db小鼠脂代谢紊乱与巨噬细胞活化分型的实验研究
2016-07-09孔勤张并璇张浩军严美花李平
孔勤 张并璇 张浩军 严美花 李平


[摘要]肥胖、脂代谢紊乱及其相关代谢疾病,包括非酒精性脂肪肝(NAFLD)是公认的重要危险因素,患病人数逐年增加,已成为严重危害人类健康的慢性疾病之一。該研究主要探究糖肾方对C57BLKS/J db/db(db/db)小鼠脂代谢紊乱与巨噬细胞活化分型的作用及机制。8周龄雄性自发性糖尿病肥胖db/db小鼠与同源不发病db/m小鼠,随机分为正常对照组(db/m)、模型组(db/db)、糖肾方给药组(db/db+TSF),连续喂养12周后处死动物,留取组织标本备用。油红O染色检测肝脏脂滴沉积,免疫组织化学法检测肝脏巨噬细胞活化分型标记物 CD68,F4/80的表达变化;荧光定量PCR法检测白色脂肪组织巨噬细胞活化标记物Mrc1,Arg1,TNFα等mRNA表达。研究发现与正常对照组相比,模型组小鼠肝组织脂质沉积增多,TSF干预后脂质沉积显著减少; db/db小鼠肝脏组织CD68和F4/80的表达增加,TSF干预后可显著抑制其表达水平;此外,与正常对照组相比,db/db小鼠白色脂肪组织巨噬细胞活化标记物Mrc1,Arg1和TNFα mRNA表达增加,TSF干预后TNFα显著下降,但Mrc1,Arg1无显著差异。结果表明中药糖肾方可减轻db/db小鼠肝脏脂肪变,改善血脂异常,其机制可能与其调节巨噬细胞活化有关。
[关键词]糖肾方;非酒精性脂肪肝;肝脏脂肪变;巨噬细胞活化
[Abstract]Obesity and its associated metabolic disorders, including nonalcoholic fatty liver disease (NAFLD), have become major chronic diseases threatening public health NAFLD is a chronic liver disorder that is strongly associated with type 2 diabetes and obesity In this study, we investigated the effects and mechanism of Tangshen formula (TSF) on hepatic dyslipidemia and phenotypic switch of macrophage in db/db mice Eightweekold male C57BLKS/J db/m control and db/db mice were divided into 3 groups (namely db/m, db/db, db/db+TSF), and fed with TSF or distilled water for 12 weeks It was found that after treatment with TSF, the triglycerides accumulation in db/db mice was decreased on the basis of oil red O staining with cryosections of liver tissues And protein expressions of macrophage activation markers CD68 and F4/80 were decreased according to immunohistochemical analysis of hepatic sections The mRNA level of TNFα (M1 marker) was significantly decreased by TSF in db/db mice, but with no significant difference in Mrc1 and Arg1 (M2 marker) According to the results, TSF attenuated hepatic steatosis and relieved dyslipidemia, its mechanism may be correlated with the regulation of macrophage activation and phenotypic switch
[Key words]Tangshen formula; nonalcoholic fatty liver disease(NAFLD); hepatic steatosis; macrophage activation
doi:10.4268/cjcmm20160920
非酒精性脂肪肝病(nonalcoholic fatty liver disease, NAFLD)是一类以甘油三酯为主的脂质在肝脏组织中异常蓄积为病理改变的疾病(除饮酒和其他已明确的肝损伤因素),是最为常见的一类慢性肝脏疾病,目前我国患病率约为15%~30%[1]。其发生发展包括单纯性脂肪肝、脂肪性肝炎、肝硬化和肝癌4个阶段。有研究显示亚洲人群中糖尿病、肥胖及血脂异常患者中NAFLD的患病率显著增加,约为35%~80%[1]。尽管目前对NAFLD的认识越来越深入,但NAFLD病因和发病机制较为复杂,目前尚未完全明了。近年研究表明NAFLD的发生发展与肥胖、胰岛素抵抗、炎症及巨噬细胞活化有着密切的联系。有研究发现,巨噬细胞的活化分型在肥胖诱导的组织炎症和胰岛素抵抗中发挥着重要作用,其对于NAFLD的发生发展有着显著的调节作用,其激活方式以经典(activated, M1)与选择性(alternatively activated, M2)激活方式参与此过程的发生发展[2]。糖肾方是李平教授继承名老中医经验基础上总结的科研用方,以往研究表明中药复方糖肾方颗粒可显著减轻糖尿病肾病大鼠肝肾损伤并降低血浆甘油三酯和总胆固醇水平[3]。本研究通过利用NAFLD模型db/db小鼠研究糖肾方对其脂质代谢的影响并探讨巨噬细胞不同分型在NAFLD中的作用,为糖肾方下一步临床应用提供科学依据。
1材料与方法
11试剂与仪器TRIzol试剂(Invitrogen,美国);反转录试剂盒(ThermoFisher,美国);UltraSYBR Mixture(康为世纪公司,中国);油红O染液(Sigma,美国);CD68抗体[Abcam(1∶400),美国];F4/80抗体[Abcam(1∶200),美国];光学显微镜(Olympus BX43型光学显微镜,日本);ABI 7500荧光定量PCR仪(ABI,美国)。
12动物自发性2型糖尿病及肥胖C57BLKS/J db/db 小鼠(以下简称db/db小鼠),雄性,8周龄,体重(35±5) g;同遗传背景C57BLKS/J db/+正常小鼠(以下简称db/m小鼠),体重(20±2) g,以上动物购自北京大学实验动物中心,动物生产许可证号SCXK(京)20110001。所有小鼠饲养于中日友好医院SPF级实验动物室屏障环境,使用许可证号SYXK(京)20100011。温度(23±3) ℃,相对湿度(55±15)%,光照12 h明暗交替,自由饮水和进食,普通饲料饲喂。本次实验所有操作均严格按照实验动物伦理相关规定进行。
13受试药物糖肾方配方颗粒(江阴天江药业有限公司制剂),批号1206346,规格8 g/袋。组成:黄芪、生地、大黄、山茱萸、鬼箭羽、三七、枳壳7味中药。实验动物购入顺应性喂养2周,称重并进行基础状态观察,随机分组情况见表1。实验动物于第10周开始灌胃给药,每日1次,每周称重,连续给药12周。糖肾方剂量参考前期临床研究并按照标准动物剂量换算[4]。
14标本采集禁食12 h,眼内眦取血,离心收集上清,-20 ℃保存备用。全自动生化仪检测血清总胆固醇(total cholesterol,TC)和甘油三酯(triglyceride,TG)。实验动物于第22周处死,收集肝脏和皮下白色脂肪组织,滤纸吸取水分,称重,切取部分4%多聚甲醛中固定1 h,取出放入30%蔗糖溶液中脱水过夜,OCT包埋,-80 ℃冰冻,常规冰冻切片5 μm,-80 ℃保存备用;其余中性甲醛中固定,石蜡包埋,备石蜡切片用。
15油红O染色病理学观察将肝脏冰冻切片从冰箱中取出,室温下平衡15 min,60%异丙醇稍洗切片,油红O染液染色15 min,60%异丙醇洗去多余染液,自来水冲洗2 min,苏木素复染细胞核1 min,自来水冲洗泛蓝5 min,甘油封片,显微镜下观察病理改变并使用ImagePro Plus 软件统计分析。
16免疫组织化学检测取新鲜肝脏组织,10%中性甲醛固定,石蜡包埋,切片(5 μm)。常规脱蜡至水,TBST洗涤3次,3% H2O2孵育15 min,热抗原修复,TBST洗涤3次,滴加CD68(1∶400)或者F4/80(1∶200)抗体,置4 ℃冰箱过夜;取出,室温放置30 min,TBST洗涤3次,滴加二抗,37 ℃孵育30 min,DAB显色剂显色(1∶150),蒸馏水冲洗,苏木素复染,常规梯度脱水,二甲苯透明,中性树胶封片。次日显微镜下观察并使用ImagePro Plus 软件统计分析结果。
17实时荧光定量PCR(quantitative realtime PCR)将组织从液氮中取出放入15 mL离心管中,加入适量TRIzol后置于冰上,电动均浆机使组织充分裂解后,加入100 μL氯仿,剧烈振动40 s,静置2 min使其自然分相;4 ℃,13 000 r·min-1离心15 min,用微量移液器小心吸取最上层液体移入新的EP管中;每个管中加入等体积的异丙醇,颠倒混匀,室温静置10 min使RNA沉淀;4 ℃,13 000 r·min-1离心10 min,弃去上清,加入75%乙醇(DEPC水配制)1 mL洗去异丙醇并再次4 ℃,13 000 r·min-1离心5 min;放入超净工作台中自然晾干,加入30 μL的RNasefree水溶解;测定RNA濃度,按照试剂盒方法逆转录后进行荧光定量PCR。引物合成由Invitrogen有限公司完成。引物序列见表2。
孔勤等:糖肾方改善db/db小鼠脂代谢紊乱与巨噬细胞活化分型的实验研究表2实时荧光定量PCR引物序列
Table 2List of primers used for quantitative real timePCR
基因正向引物(5′3′)反向引物(5′3′)PCR大小/bpUcp2ATGGTTGGTTTCAAGGCCACACGGTATCCAGAGGGAAAGTGAT109TNFαCAGGCGGTGCCTATGTCTCCGATCACCCCGAAGTTCAGTAG89Ccl2TTAAAAACCTGGATCGGAACCAAGCATTAGCTTCAGATTTACGGGT121F4/80CTGCACCTGTAAACGAGGCTTGCAGACTGAGTTAGGACCACAA127CD68TGTCTGATCTTGCTAGGACCGGAGAGTAACGGCCTTTTTGTGA75Mrc1CTCTGTTCAGCTATTGGACGCTGGCACTCCCAAACATAATTTGA190Arg1CTCCAAGCCAAAGTCCTTAGAGAGGAGCTGTCATTAGGGACATC184
18数据统计学处理所有计量数据均表示为±s,采用GraphPad Prism 60软件进行统计分析,检验方法采用Oneway ANOVA分析和Dunnettt检验,P<005视为差异有统计学意义。
2结果
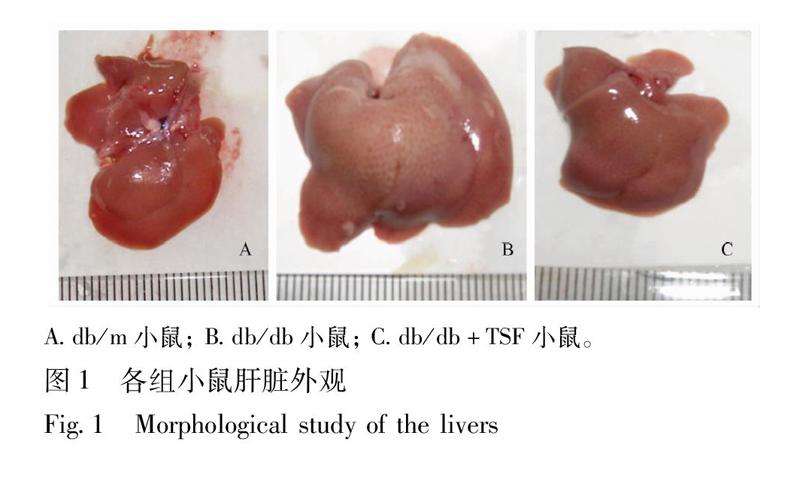
21肝组织形态学观察正常对照组db/m小鼠肝脏形态正常,色泽红润,质地柔软。db/db小鼠肝组织体积异常增大,色泽土黄,质地较硬,表面油腻感较显著,提示该组小鼠肝脏脂肪变严重;给予糖肾方后,色泽质地均有显著改善,触之无明显油腻感,体积显著减小,见图1。
Adb/m小鼠; Bdb/db小鼠; Cdb/db+TSF小鼠。
22糖肾方对db/db小鼠体重和肝重的影响db/db小鼠较db/m小鼠体重增加显著;连续给药12周后,与db/db组相比较,糖肾方可显著减少db/db小鼠体重增加和肝脏质量,见图2。
23糖肾方对db/db小鼠血脂及肝脏脂质沉积的影响与db/m小鼠相比,db/db小鼠血清中TC和TG 含量显著上升,表明小鼠体内出现脂肪代谢异常,给予糖肾方后可显著降低db/db小鼠血清TC和TG水平;此外,油红O染色显示db/m小鼠肝细胞几乎无脂肪滴,肝细胞排布整齐,而db/db小鼠肝脏组织分布大量脂肪滴和空泡,脂肪变性程度严重,油红O阳性着色面积显著增加,给予糖肾方治疗的小鼠脂质沉积显著下降,空泡减少,见图3。
24糖肾方对db/db小鼠肝脏组织巨噬细胞活化的影响实时荧光定量PCR结果显示,与正常db/m小鼠比较,db/db小鼠肝脏组织巨噬细胞标记物基因CD68和F4/80显著上调,给予糖肾方后表达均有显著下降;免疫组织化学结果同样证实糖肾方可显著降低CD68和F4/80的表达,见图4。
25糖肾方对db/db小鼠白色脂肪组织巨噬细胞
与db/m 小鼠相比**P<0001;与db/db小鼠相比#P<001, ##P<0001。
极化分型的影响与肝脏组织中巨噬细胞活化情况相同,db/db小鼠白色脂肪组织(white adiposetissue,WAT)CD68和F4/80基因mRNA水平显著高于db/m小鼠,而糖肾方可显著抑制CD68和F4/80 mRNA的水平;此外,与db/m小鼠相比,db/db小鼠白色脂肪组织巨噬细胞M1活化标记物肿瘤坏死因子α(tumor necrosis factor α, TNFα)mRNA水平显著升高,给予糖肾方后可显著降低其表达;M2型活化标记物甘露糖C型受体1(mannose receptor C type 1, Mrc1)和精氨酸酶(arginase, Arg1)同样显著上调,但糖肾方干预后并未抑制其mRNA水平;与此同时,趋化因子(chemokine ligand 2, Ccl2)和解耦联蛋白2(uncoupling protein 2, Ucp2)mRNA水平也较db/m小鼠显著上调,糖肾方干预后显著抑制其表达,见图5。
3讨论
C57BLKS/J db/db小鼠是Leptin受体基因缺陷导致的自发型2型肥胖与糖尿病小鼠,其具有血脂、血糖异常,体重增加等表现,亦有肝脏脂肪样变出现,是良好的脂肪肝动物模型之一,故本实验利用db/db小鼠作为实验对象来研究糖肾方在调节脂代谢紊乱中的作用及相关机制。
NAFLD发病机制较为复杂,由Day和James在1998年提出的“二次打击”学说是目前较为公认的发病机制[5]。首先由于肥胖、糖尿病等导致胰岛素抵抗引起脂代谢异常,游离脂肪酸与甘油三酯升高,
异位沉积在肝脏等组织造成肝脂肪变;第二次打击由于机体内氧化平衡失调导致的氧化应激,随之出现脂毒性与炎症因子释放致使肝细胞受损。
近年来越来越多的学者关注到肝脏巨噬细胞介导的免疫反应也许是NAFLD发病机制的基石而起到了重要的调节作用[68]。巨噬细胞为一群异质性较大的细胞,其来源于骨髓细胞并分化为成熟的单核细胞进入外周血,然后进入各组织后分化为巨噬细胞,如肝脏中的Kuffer细胞,在不同的生理病理和刺激情况下巨噬细胞会有不同的激活途径,发挥各自的生物学功能。肝脏是人体重要的免疫器官,脂肪组织产生的多种细胞因子如趋化因子、肿瘤坏死因子都会对肝脏组织的内环境产生影响,如诱导组织产生活性氧,进而导致脂肪肝的发生发展。此外,脂质异常沉积在肝脏组织也会刺激Kuffer细胞激活从而引起持续的炎症反应,这一系列的结果将会激活肝星状细胞进而引发纤维化的发生[9]。
大量研究表明,巨噬细胞对脂肪肝炎症反应有着双重作用,即抑炎和抗炎作用,產生这样的结果是由其活化类型决定的[10]。白色脂肪组织分泌的TNFα,IL6等细胞因子及巨噬细胞的活化可导致明显的胰岛素抵抗与肥胖病人的肝脏损伤[1112]。本研究结果显示,糖肾方连续给药12周后可显著降低血清甘油三酯、总胆固醇水平并减轻肝脏脂肪变程度;此外,糖肾方显著抑制肝脏组织和白色脂肪组织中CD68与F4/80的表达,提示糖肾方对脂肪肝小鼠体内巨噬细胞的激活有一定的抑制作用;进一步分析发现糖肾方可抑制白色脂肪组织M1活化标记物TNFα mRNA的表达,而M2型活化标记物Mrc1和Arg1则无显著降低,推测这可能是脂肪组织内环境改变的一种保护性机制。近期有研究发现,巨噬细胞在NAFLD的炎症始发阶段和后期大量中性粒细胞、淋巴细胞的浸润有着密切的联系,本研究与此项研究都表明了巨噬细胞的活化在NAFLD发生发展过程起着重要的作用[1314]。但巨噬细胞的分型究竟由何种分子与机制决定,目前并不十分清楚。值得注意的是,与db/m小鼠相比,db/db小鼠白色脂肪组织中Ucp2和Ccl2表达升高,糖肾方同样可以抑制其表达水平,表明糖肾方改善脂代谢紊乱可能与其调节脂质过氧化和抑制炎性细胞浸润有关。有研究表明,炎症损伤是导致NAFLD发生进展的独立危险因素,并可以通过肝脏脂肪酸转运蛋白CD36进而使循环系统中大量脂肪酸进入肝脏合成过多的脂质从而促进NAFLD的发生发展[15]。由此可见,炎症环境尤其是肝脏和白色脂肪组织中大量巨噬细胞的浸润参与了NAFLD的进展。综上,糖肾方可以显著改善db/db小鼠脂代谢异常及肝脂肪变,其机制可能与抑制巨噬细胞M1型活化,改善肝脏和脂肪组织内环境炎症状态有关。
[参考文献]
[1]Loomba R,Sanyal A J. The global NAFLD epidemic[J]. Nat Rev Gastroenterol Hepatol, 2013, 10(11):686.
[2]Gordon S, Martinez F O. Alternative activation of macrophages: mechanism and functions[J]. Immunity, 2010,32(5):593.
[3]董晞, 张浩军, 赵世萍, 等. 糖肾方对自发性2型糖尿病模型大鼠脂代谢及肝脏脂变的影响[J]. 中华中医药杂志, 2010,25(11):1778.
[4]Li P, Chen Y, Liu J, et al. Efficacy and safety of tangshen formula on patients with type 2 diabetic kidney disease: a multicenter doubleblinded randomized placebocontrolled trial[J]. PLoS ONE, 2015,10(5):e0126027.
[5]Day C P, James O F. Steatohepatitis: a tale of two "hits"?[J]. Gastroenterology, 1998,114(4):842.
[6]Yao J, Zhou C S, Ma X, et al, FXR agonist GW4064 alleviates endotoxininduced hepatic inflammation by repressing macrophage activation[J]. World J Gastroenterol, 2014,20(39):14430.
[7]Wehr A, Baeck C, Ulmer F, et al. Pharmacological inhibition of the chemokine CXCL16 diminishes liver macrophage infiltration and steatohepatitis in chronic hepatic injury[J]. PLoS ONE, 2014,9(11):e112327.
[8]Lastra, G, Manrique C, Jia G, et al. The VASP road to NAFLD: a macrophage detour[J]. Diabetes, 2015,64(8):2711.
[9]Browning J D, Horton J D. Molecular mediators of hepatic steatosis and liver injury[J]. J Clin Invest, 2004,114(2):147.
[10]Diehl A M. Nonalcoholic steatosis and steatohepatitis IV. Nonalcoholic fatty liver disease abnormalities in macrophage function and cytokines[J]. Am J Physiol Gastrointest Liver Physiol, 2002,282(1):G1.
[11]Kern P A, Ranganathan S, Li C, et al. Adipose tissue tumor necrosis factor and interleukin6 expression in human obesity and insulin resistance[J]. Am J Physiol Endocrinol Metab, 2001,280(5):E745.
[12]Cancello R, Tordjman J, Poitou C, et al. Increased infiltration of macrophages in omental adipose tissue is associated with marked hepatic lesions in morbid human obesity[J]. Diabetes, 2006,55(6):1554.
[13]Gadd V L, Skoien R, Powell E E, et al. The portal inflammatory infiltrate and ductular reaction in human nonalcoholic fatty liver disease[J]. Hepatology, 2014,59(4):1393.
[14]Kitade H, Sawamoto K, Nagashimada M, et al. CCR5 plays a critical role in obesityinduced adipose tissue inflammation and insulin resistance by regulating both macrophage recruitment and M1/M2 status[J]. Diabetes, 2012,61(7):1680.
[15]Wang C, Hu L, Zhao L, et al. Inflammatory stress increases hepatic CD36 translational efficiency via activation of the mTOR signalling pathway[J]. PLoS ONE, 2014,9(7):e103071. [責任编辑马超一]
