百草枯在Fe/MMt上的吸附降解及重复利用
2016-07-07陶卫国刘雪平蒋晓慧
陶卫国, 刘雪平,蒋晓慧
(西华师范大学 化学化工学院,四川 南充 637009)
百草枯在Fe/MMt上的吸附降解及重复利用
陶卫国, 刘雪平,蒋晓慧
(西华师范大学 化学化工学院,四川 南充637009)
摘要:研究了聚羟基铁柱撑蒙脱土(Fe/MMt)对除草剂百草枯(PQ)的吸附和原位分解、以及Fe/MMt的循环利用。结果显示,溶液中99.2%的PQ被Fe/MMt吸附,PQ在Fe/MMt上的吸附符合假二级动力学模型和Langmuir等温线模型,是一个自发和熵驱动的吸附过程。在碱性条件下,在Fe/MMt上吸附的PQ容易原位氧化,从而Fe/MMt再生。实验中,我们重复吸附-原位氧化操作10次,Fe/MMt对去除PQ的吸附容量没有明显变化。所以,吸附偶联原位氧化的方法可望将百草枯这类有机污染物从环境中彻底根除。
关键词:PQ;Fe/MMt;吸附;芬顿试剂;再生;重复利用
农药对农业生产是必不可少的,它在农作物增收、增产中发挥着重要的作用。百草枯是一种广谱除草剂,所以近几十年来,广泛用于多种农作物的田间除草.尽管土壤对百草枯有很强的吸附能力和分解能力,但通过渗透作用,百草枯污染地下水和地表水、对人、畜和环境造成的不利影响是不容忽视的[1-3],因此从污染水源中去除百草枯是非常必要的。
由于来源丰富、价格便宜,蒙脱土广泛的用作为污水处理的吸附剂。但是由于其吸附能力有限,因此改性蒙脱土的研究一直是环境领域的研究热点。Jose L. Marco-Brown等人利用柱羟基铁修饰了蒙脱土吸附了除草剂毒莠定,结果显示修饰的蒙脱土比原始蒙脱土的比表面积和层间距都比原始蒙脱土高,并且,修饰蒙脱土对毒莠定的吸附容量是原始蒙脱土吸附容量的150倍[4]。何飞研究了无机柱撑蒙脱土,结果显示与天然蒙脱土相比,所制备的材料表现出较大的比表面积和较大的孔体积,且增大了对污染物的吸附速率及吸附容量[5]。所以通过改性可以使蒙脱土去除污染物效率更高、处理污染物范围更广。
考虑到柱撑蒙脱土带负电荷的特点,根据百草枯分子具有很高正电荷的性质,我们制备了铁柱撑蒙脱土,考察其对百草枯的吸附,希望通过二者之间强烈的静电相互作用,使百草枯高效去除。众所周知,吸附仅仅是将污染物从一种介质转移到另一种介质中,污染物并没有从污染环境中彻底消失。Fenton试剂具有很强的氧化性,而且其氧化没有选择性,可以将有机污染物彻底分解,能适应各种废水的处理[6]。因此我们利用Fenton试剂将吸附剂上的百草枯原位氧化分解,并考察吸附剂的重复利用情况。
1实验试剂与方法
1.1实验试剂
原始钠基蒙脱土(Na/MMt,阳离子交换量为(CEC)为600 mmol/kg,层间距(d001) 为1.14 nm。百草枯、Na2CO3、 FeCl3·6H2O、HCl、NaOH均为分析纯试剂。
1.2实验方法
1.2.1Fe/MMt的制备
铁柱撑剂制备如下:将4.24g Na2CO3的溶液逐滴加入到5.46 g 的FeCl3·6H2O溶液中,并在60℃剧烈搅拌2 h,老化24 h,得到铁柱撑剂。在剧烈搅拌下,将该铁柱撑剂逐滴加入到2 g Na/MMt悬浮液中,在60℃下继续搅拌2 h并老化24 h。抽滤,用三次水洗涤沉淀,直到AgNO3溶液测试表明没有氯离子存在。样品在80℃下过夜干燥,105 ℃活化2 h即得到Fe/MMt。
1.2.2吸附实验
在一定量的Fe/MMt加入含20 mL PQ溶液(100 mg/L),通过加入少量HCl或NaOH溶液调节溶液的pH值。在一定温度下搅拌混合溶液,一定时间后离心分离溶液,测量上清液的吸光度。
根据以下表达式计算去除率(R%)[7]:
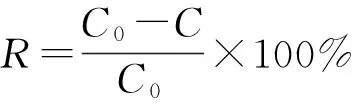
(1)
其中C0为PQ溶液的初始浓度,C(mg/L) 分别是Fe/MMt吸附PQ后的溶液浓度,该浓度从标准工作曲线求得。
1.2.3原位氧化和吸附剂循环利用
吸附试验结束后,离心分离,向得到的沉淀物中加入20 mL的NaOH (0.01M),搅拌,再加入20 mL 30%的H2O2,60℃下反应3 h,离心分离,将得到的固体用蒸馏水洗涤3次,样品在80℃下过夜干燥,于105 ℃活化2 h。根据1.2.2所述步骤进行吸附实验,吸附-原位氧化实验共循环十次。
2结果与讨论
2.1吸附实验结果
吸附剂用量和初始浓度对PQ的去除率的影响如图1所示。从该图可见,当Fe/MMt用量小于60mg时,随着吸附剂用量增加,对PQ的去除率增大,但当Fe/MMt用量达到60mg后,去除率增加不明显。所以后续实验中Fe/MMt用量为60mg。
在吸附剂用量一定的条件下,百草枯浓度影响其去除效果。在PQ浓度增加到100 mg/L 时,PQ的去除率为99%,随着进一步增加浓度,去除率下降.所以后续实验中百草枯初始浓度为100 mg/L。

Fe/MMt对PQ去除能力随着接触时间延长而增大。在开始的30 min内,去除率快速上升到99%。随着时间延长,去除率缓慢升高,60 min后去除率几乎不变。因此,选60 min为Fe/MMt吸附PQ的最佳时间。温度和pH值对PQ去除率的没有显著影响。
所以吸附条件优化结果显示,吸附剂用量与100 mg/L的PQ溶液的比为3 mg∶1 mL,吸附时间为1 h,温度25℃,pH=7,吸附效果最好。
2.2吸附动力学
动力学参数有助于预测吸附速率、吸附机理并给出设计和模拟吸附过程的重要信息。为了了解吸附过程的机理,我们用假一级(2)、假二级动力学模型(3)和Elovich方程(4)拟合了实验数据。
ln(qe-qt)=lnqe-k1t,
(2)
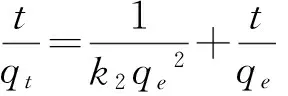
(3)
(4)
式中,qt和qe分别是在t时刻和在平衡时吸附PQ 的量;k1和k2分别是假一级方程和假二级方程的吸附速率常数;α是初始吸附速率;β与表面覆盖度和化学吸附的活化能有关。

表1 PQ在Fe/MMt上的吸附动力学参数
拟合结果显示,假二级模型拟合的相关系数(R2)接近于1,理论值qe都与实验值qe,exp一致。因此,假二级动力学模型是适合于描述整个吸附过程的动力学的模型,表1总结了相应模型的拟合参数。表中数据显示,随温度升高PQ的吸附量增大,升高温度有利于百草枯的吸附。
为了更加清楚的了解吸附的机理,采用Weber-Morris粒间扩散模型对动力学数据进行了模拟分析。结果如图2和表2所示[8,9]。
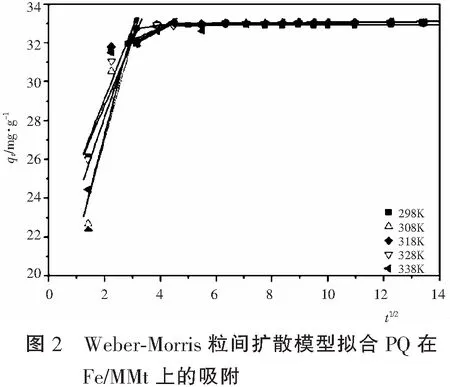
qt=Kdt1/2+I
(5)
式中,qt是PQ在时刻t的吸附量;Kd是颗粒内扩散速率常数,和I表示边界的厚度层,即I值越大表明边界层效应越大。如果I等于零,那么在整个吸附过程中吸附的速率仅由颗粒内的扩散控制。
由图2可以看出吸附是多线性形式;表明吸附是受两个或多个步骤的影响。初始线性部分的扩散相对于整个吸附过程来说,持续时间较短[10]。第二部分的直线描述了PQ在Fe/MMt的粒间扩散,而最后一部分是吸附平衡[11]。由于直线未过零点,表示吸附过程包含了粒子内扩散,但它不是唯一的限速步骤[12]。
分析表2中的数据可知,Kd1远大于Kd2,说明Fe/MMt与百草枯静电作用强,百草枯很容易吸附到Fe/MMt的表面,同时也说明粒间扩散是该吸附的速率控制步骤。随着吸附的进行,溶液中百草枯浓度很低,建立了吸附与脱附平衡,所以表现出很小的Kd3值。
3.4吸附等温线
吸附等温线提供了溶液中吸附质和固体相上吸附质在两相达到平衡时的关系。用Langmuir、Freundlich和Dubinin-Redushkevich(D-R)等温线拟合了实验数据[13,14]。
(6)
(7)
Dubinin-Redushkevich等温线:lnqe=lnqm-K′ε2,
(8)
其中qm代表单层吸附能力,b是Langmuir等温线系数。kf和n是Freundlich常数。ε是Polanyi吸附势(ε= RTln(1+1/Ce)),R是气体常数,T是温度,K′是活性炭结构常数,与平均吸附能(E)有关,其关系由如下等式表达:

(9)
另外,基于进一步分析Langmuir方程,分离因子RL(无量纲参数),由如下公式计算[15]:
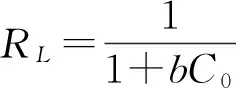
(10)
其中C0(mg/L)是PQ的最高初始浓度。
RL的值表明吸附的类型。不可逆吸附(RL=0),有利吸附(0
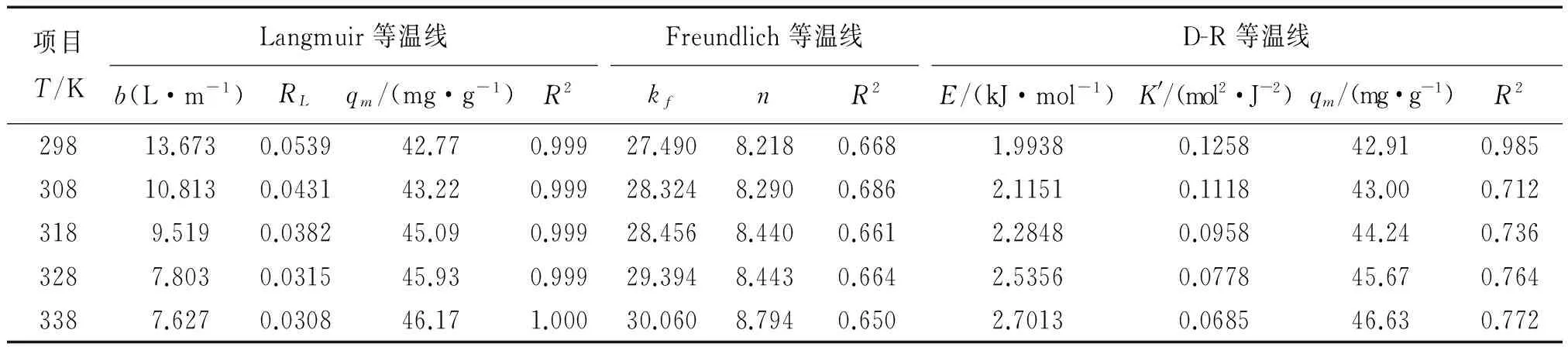
表3 Fe/MMt吸附PQ的Langmuir,Freundlich和D-R等温线的参数
相关系数值(R2)显示Langmuir等温线很好地拟合了实验数据,计算的最大吸附量(qm)与实验值一致。表3中的RL值在0—1范围内[16],表明Fe/MMt 对PQ吸附是有利的。RL值随着溶液温度升高而下降,表明较高温度更有利于吸附[17]。Freundlich的kf也是衡量吸附剂吸附能力的一个指标。kf值越大,吸附能力越强。可用Freundlich常数n是衡量线性偏差及吸附类型。n等于1,吸附是线性的;n<1表明是化学吸附;n>1是有利的物理过程[17]。如表3所示,在298.15—338.15K范围内温度kf值从27.490增加到30.060,n值从8.218增加到8.794,再次表明,温度增加有利于Fe/MMt吸附PQ。平均吸附能(E)能提供关于化学和物理吸附的信息。表3中的E值小于8 kJ/mol,表明PQ在Fe/MMt上的吸附可能是物理吸附[18]。
3.5吸附热力学
对于任何一个吸附过程,都可以根据自由能和熵变来判别该过程的自发性。热力学参数是这个过程的重要指标,从以下公式可以导出[19,20]:
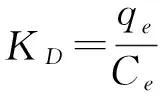
(11)

(12)

(13)
(14)

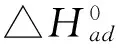

表4 Fe/MMt吸附PQ的热力学参数
3.5PQ的原位氧化分解及Fe/MMt的再生
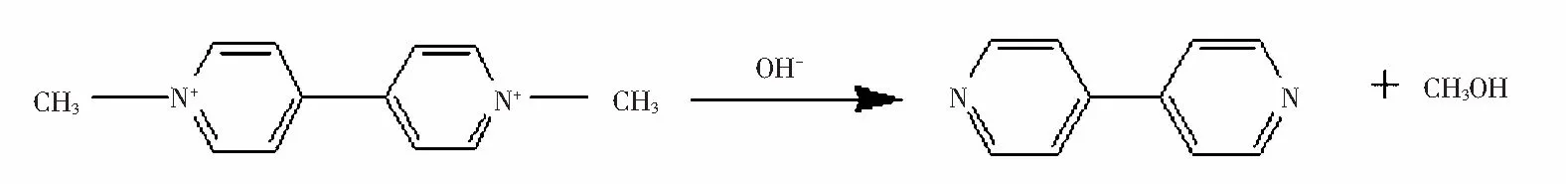
白草枯带正电荷,很难失去电子被氧化,但是它在碱性条件下不稳定。图4清楚显示联吡啶在239 nm处有紫外吸收。后加入50 μL NaOH溶液,在199 nm出现一个新峰。PQ在256.5 nm有一个强吸收峰。碱性条件下,PQ在209 nm出现新的峰,对比联吡啶在碱性条件下的紫外吸收,我们认为碱性条件下,百草枯可能分解为联吡啶(下式)。

从图5中很明显看出60 ℃时加入过氧化氢(20 μL)和Fe2+(0.6 μL)后,PQ的吸光度下降,吸收峰红移。10分钟后,在大约372 nm出现一个新峰.随着延长反应时间,前面的峰持续下降,并移向长波.新峰增高,少许红移。30 min以后,两个吸收峰都变得越来越弱。3 h后无法检测这两个峰,表明Fe2+/H2O2体系将PQ已经氧化完全.由此我们推断,吸附在Fe/MMt上的PQ可以被Fe2+/Fe3+-H2O2在碱性溶液中分解。
尽管FeSO4/H2O2体系是高效率的氧化剂体系,但其在实际应用中受到限制(因为铁离子形成氢氧化物,造成分离困难)。然而,我们在PQ+Fe/MMt体系中只加入了过氧化氢和氢氧化钠,由于铁离子已经存在于柱撑蒙脱土中,所以避免了前述缺陷。
图6显示Fe/MMt在10次吸附/脱附循环中的吸附能力没有显著减少。结果表明,Fe/MMt吸收的PQ在60℃下H2O2/NaOH溶液中3小时内分解。Fe/MMt再生简单,操作方便,Fe/MMt的吸附能力经过多次吸附/再生循环基本保持几乎不变。因此,Fe/MMt能够经济、有效地从水溶液去除类似有机污染物,可望成为性能优良而高效的污水处理剂。

4结论
本文制备了Fe/MMt,考察了其对百草枯的吸附。得到如下结论。
(1)该吸附符合假二级动力学模型(qe,cal与qe,exp一致)和Langmuir等温方程。而粒间扩散模型显示,吸附过程包含了百草枯在Fe/MMt粒子内的扩散,但该扩散不是唯一的限速步骤。
(3)在碱性条件下,Fenton试剂很容易将吸附在Fe/MMt上的百草枯氧化,Fe/MMt表面的吸附活性位点再生,该吸附剂可重复利用。通过10次吸附-氧化-吸附的循环表明,Fe/MMt对PQ的去除能力基本不变。所以吸附-Fenton氧化偶联为有机污染物的彻底降解提供了新的途径。
参考文献:
[1]邓晓,李勤奋,陈照,等.百草枯污染土壤的微生物生态效应[J].中国农学通报,2006,22(8):511-514.
[2]RIAL-OTERO R,CANCHO-GRANDE B,PEREZ-LAMELA C,et al.Simultaneous Determination of the Herbicides Diquat and Paraquat in Water[J].J Chromatogr Sci,2006,44(9):539-542.
[3]韩欣,袁瑞,王国强,等.百草枯降解菌的分离鉴定及降解特性研究[J].安徽农学通报,2014,22(8):38-39.
[4]MARCO-BROWN J L, BARBOSA-L C,TORRES SáNCHEZ R M,et al Adsorption of picloram herbicide on iron oxide pillared montmorillonite[J].Appl Clay Sci,2012,58(1):25-33.
[5]何飞.无机柱撑蒙脱土的制备与表征及其除磷性能研究[D].暨南大学,2013.
[6]冯淑湘, 刘侠, 张茸茸.染料废水处理方法研究进展[J].榆林学院学报,2014,24(6):21-25.
[7]HOU M F,MA C X,ZHANG W D,et al. Removal of rhodamine B using iron-pillared bentonite[J].J Hazard Mater,2011,186(2/3):1118-1123.
[8]ZHANG L,FANG P,YANG L,et al.Rapid Method for the Separation and Recovery of Endocrine-Disrupting Compound Bisphenol AP from Wastewater[J].Langmuir,2013,29(12):3968-3975.
[9]RIDA K,BOURAOUI S,HADNINE S.Adsorption of methylene blue from aqueous solution by kaolin and zeolite[J].Appl Clay Sci,2013,(83/84):99-105.
[10] ROY A,ADHIKARI B,MAJUMDER S B.Equilibrium,Kinetic,and Thermodynamic Studies of Azo Dye Adsorption from Aqueous Solution by Chemically Modified Lignocellulosic Jute Fiber[J].Ind Eng Chem Res,2013,52(19):6502-6512.
[11] SHU Y H,LI L S,ZHANG Q Y.Equilibrium,kinetics and thermodynamic studies for sorption of chlorobenzenes on CTMAB modified bentonite and kaolinite[J].J Hazard Mater,2010,173(1/2/3):47-53.
[12] XUE G,GAO M,GU Z,et al.The removal of p-nitrophenol from aqueous solutions by adsorption using gemini surfactants modified montmorillonites[J].Chemical Engineering Journal,2013,218:223-231.
[13] HU B,LUO H,CHEN H.Adsorption of chromate and para-nitrochlorobenzene on inorganic-organic montmorillonite[J].Appl Clay Sci,2011,51(1/2):198-201.
[14] YU F,WU Y,LI X Kinetic and thermodynamic studies of toluene,ethylbenzene,and m-xylene adsorption from aqueous solutions onto KOH-activated multiwalled carbon nanotubes[J].J Agric Food Chem ,2012,60(50):12245-12253.
[15]ZAGHOUANE-BOUDIAF H,BOUTAHALA M.Adsorption of 2,4,5-trichlorophenol by organo-montmorillonites from aqueous solutions:Kinetics and equilibrium studies[J].Chem Eng J ,2011,170(1):120-126.
[16] SANDHU A K,GU L.Adsorption/desorption characteristics and separation of anthocyanins from muscadine (Vitis rotundifolia) juice pomace by use of macroporous adsorbent resins[J].J Agric Food Chem ,2013,61(7):1441-1448.
[17] ALKARAM U F,MUKHLIS A A,AL-DUJAILI A H.The removal of phenol from aqueous solutions by adsorption using surfactant-modified bentonite and kaolinite[J].J Hazard Mater,2009,169(1/2/3):324-32.
[18] VIMONSES V,LEI S,JIN B.Kinetic study and equilibrium isotherm analysis of Congo Red adsorption by clay materials[J].Chem Eng J,2009,148(S-2-3):354-364.
[19] BHATTACHARYA A K,NAIYA T K,MANDAL S N.Adsorption,kinetics and equilibrium studies on removal of Cr(VI) from aqueous solutions using different low-cost adsorbents[J].Chem Eng J,2008,137(3):529-541.
[20] BOUBERKA Z,KACHA S,KAMECHE M.Sorption study of an acid dye from an aqueous solutions using modified clays[J].J Hazard Mater,2005,119(1/2/3):117-24.
Adsorption and Decomposition of Paraquat on Polymeric Fe Pillared Montmorillonite and Recycling of the Pillared Clay
TAO Weiguo,LIU Xueping,JIANG Xiaohui
(College of Chemistry and Chemical Engineering,China West Normal University,Nanchong Sichuan 637009,China)
Abstract:The adsorption and decomposition of herbicide paraquat (PQ) by polymeric Fe pillared montmorillonite (Fe/MMt) and the recycling of the pillared clay were investigated.The results disclosed that 99.2% of PQ was effectively adsorbed by Fe/MMt,and the adsorption of PQ onto Fe/MMt was well described by the pseudo-second-order kinetics model and Langmuir isotherm,and it was a spontaneous and entropy driving process.The used Fe/MMt was easily regenerated by H2O2 in alkaline solution.The uptake capacity of Fe/MMt for PQ was almost maintained in ten times of recycling.So, adsorption coupling oxidation may offer new idea for the removal of organic contaminants from wastewater.
Keywords:paraquat;pillared montmorillonite;adsorption;regeneration;recycling
文章编号:1673-5072(2016)02-0173-07
收稿日期:2015-06-04
基金项目:四川省教育厅基金项目(10ZA022)
作者简介:陶卫国 (1971—),男,四川营山人,讲师,主要从事精细化学品合成及应用研究。 通讯作者:蒋晓慧(1958—),女,四川遂宁人,教授,主要从事精细化学品和有机化学的教学与研究。 E-mail:jxh23144508@163.com
中图分类号:0643.3
文献标志码:Α
DOI:10.16246/j.issn.1673-5072.2016.02.009
