3-氨基-4-氯-1H吲唑衍生物的合成及抗肿瘤活性测定
2016-07-05周云鹏宋端正
周云鹏,李 源,何 畅,宋端正,王 洋
(辽宁大学 药学院,辽宁省新药研发重点实验室,辽宁 沈阳 110036)
3-氨基-4-氯-1H吲唑衍生物的合成及抗肿瘤活性测定
周云鹏,李源,何畅,宋端正,王洋*
(辽宁大学 药学院,辽宁省新药研发重点实验室,辽宁 沈阳 110036)
摘要:以2,6-二氯苯腈为起始原料通过5 步反应合成了9个具有抗肿瘤活性的吲唑类化合物并对其抗肿瘤活性进行了初步筛选. 目标产物结构经1H-NMR 和IR 确证,体外细胞实验结果显示化合物2c的抗肿瘤活性最好,对K-562、SMMC7721肿瘤细胞有明显抑制作用.
关键词:吲唑;合成;抗肿瘤
吲唑衍生物是一类重要的杂环化合物,因其具有广泛的生物活性,已成为药学领域科研工作者研究的热点[1-4]. 2004年LIOU等[5]报道了具有抗肿瘤活性的考布他汀(CA-4)通过抑制微管蛋白聚集,造成肿瘤细胞的坏死. CA-4对包括很多耐药瘤株在内的多种肿瘤细胞都有强大的细胞毒作用,尤其是其具有肿瘤血管生成抑制作用. 2007年DUAN等人[6]报道作为考布他汀类似结构的吲唑衍生物具有明显的抗癌活性,IC50= 13 nmol·L-1(H460,人类大细胞肺癌细胞株),并明确报道3-位取代吲唑为微管蛋白抑制剂的药理作用,但是没有进行深入的研究该类化合物的构效关系. 在分析文献报道的3-位取代吲唑类化合物结构特点的基础上[7-9],结合考布他汀的骨架结构设计了一系列全新结构的3-氨基取代的吲唑类化合物,通过把连接基团酮羰基改换成酰胺羰基,一方面增加了原化合物的连接基团长度;另一方面所设计的酰胺结构通过烯醇互变得到具有抗肿瘤活性的考布他汀类似结构(图1).
1实验部分
1.1仪器与试剂
AL 104万分之一电子天平(瑞士Mettler-Toledo Group公司); X-4A型显微熔点测定仪(上海精密仪器有限公司);Spectrum One红外光谱仪(美国Perkin Elmer公司);ARX-600核磁共振仪(德国布鲁克公司,TMS为内标); LCQ Advantage MAX 10离子肼质谱仪(美国菲尼根公司). 实验所用试剂购自国药集团药业股份有限公司.
1.2合成
吲唑类化合物的合成路线见图2.
1.2.13-氨基-4-氯-1H-吲唑(1)的合成
称取2,6-二氯苯腈(13.24 g, 73 mmol),量取15 mL无水N-甲基吡咯烷酮于500 mL茄形瓶,溶解后升温至70 ℃,在搅拌下滴入水合肼(98%, 40 mL, 730 mmoL)反应23 h,倾入搅拌中的冰水溶液,过滤,析出白色固体11.70 g,产率96.00%,m.p. 138~139 ℃. IR (KBr, cm-1): 3 462, 3 338 (NH2), 3 169 (NH), 1 620, 1 606, 1 540,1 499 (ArC=C).1H NMR (DMSO,δ): 11.8 (s, 1H, NH), 7.18 (dd, 1H, J = 3.7 Hz, Ph-H ), 7.15 (d, 1H, J = 3.7 Hz, Ph-H), 6.8 (d, 1H, J = 3.6 Hz, Ph-H), 5.14 (s,2H, NH).
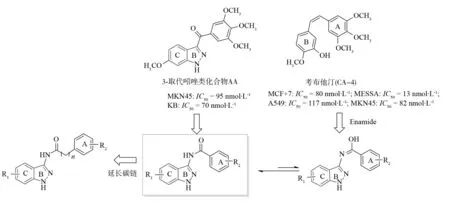
图1 考布他汀拼合设计吲唑类衍生物Fig.1 Combretastatin split design indole derivatives
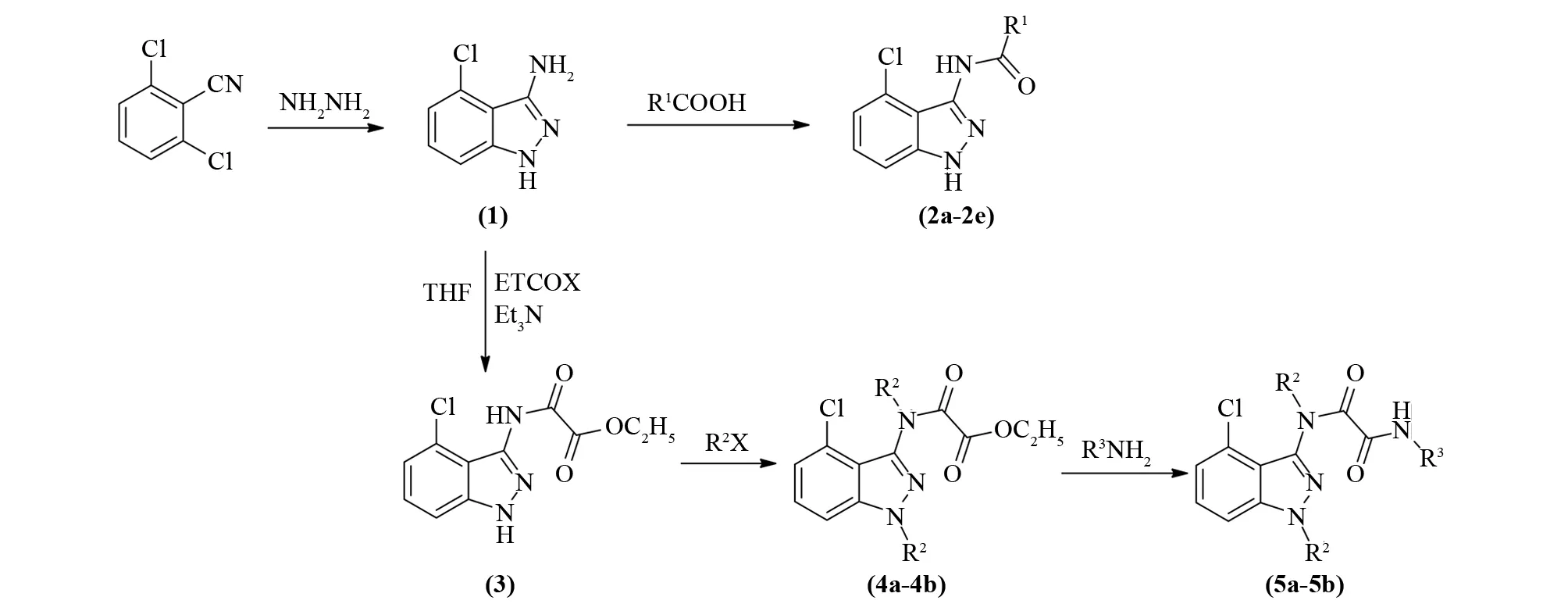
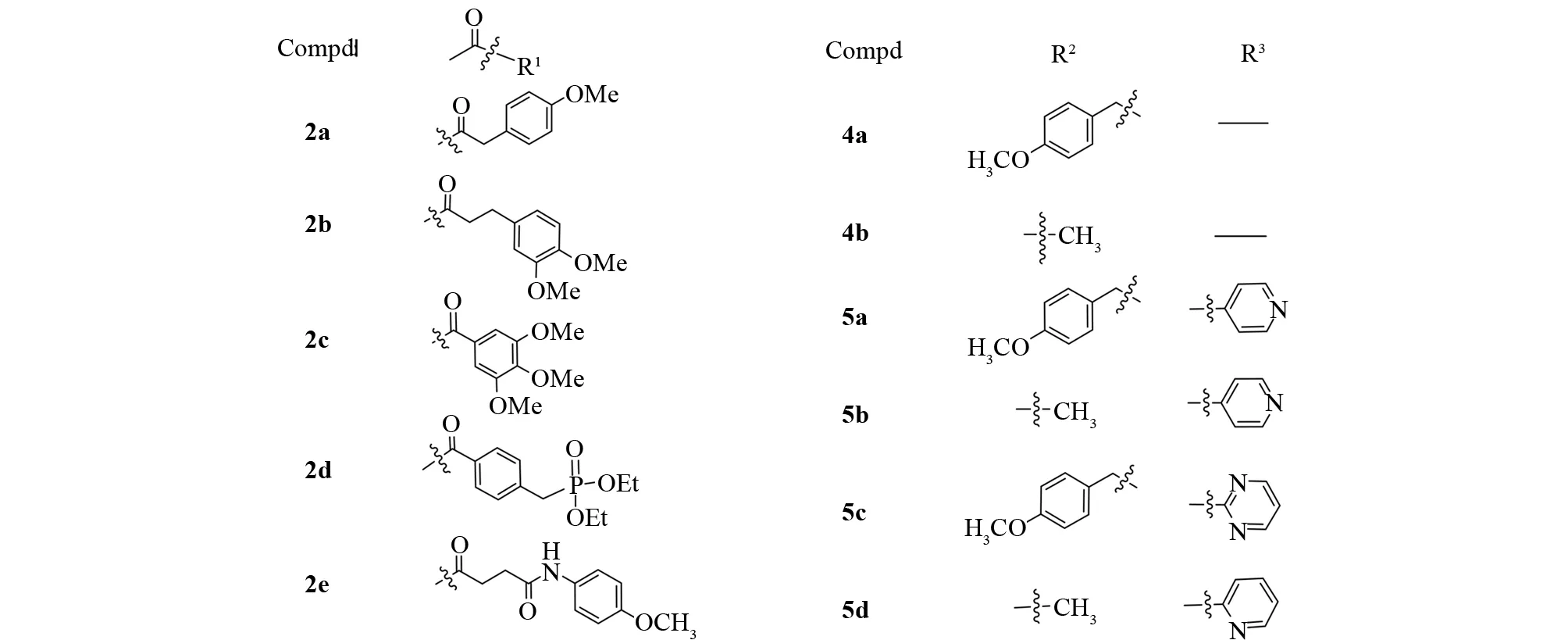
图2 吲唑类化合物的合成Fig.2 Synthesis of indazole compounds
1.2.2氮-(4-氯-1H-吲唑-3-基)-2-(4-甲氧苄基)乙酰胺(2a)的合成
取3-氨基-4-吗啉-1H-吲唑(0.68 g,3.58 mmol),3,4,5-三甲氧基苯甲酸(0.99 g,4.65 mmol),EDCI(1.03 g,5.37 mmol),DMAP(0.44 g,3.58 mmol),HOBT(0.48 g,3.58 mmol)和干燥的DMF 10 mL溶解于25 mL茄型瓶中,室温反应4 h. 将反应液倒入盛有100 mL水的分液漏斗中,乙酸乙酯萃取,无水硫酸钠干燥有机相. 浓缩至1/3冷却后有晶体析出. 得白色针状结晶 1.31 g,产率89.11%,m.p. 163~164 ℃. IR (KBr, cm-1): 3 434, 3 350 (N-H), 2 961, 2 832 (C-H), 1 689 (C=O), 1 605, 1 548, 1 515 (Ar),1 245, 1 126, 1 178, 1 100 (C-O).1H NMR (CDCl3,δ): 8.31 (d, 1H,J= 4.2 Hz, Ph-H), 7.40 (t,1H,J= 8.1 Hz, Ph-H), 7.30 (t, 2H,J= 10.4 Hz, Ph-H), 7.22 (t,1H,J= 3.9 Hz, Ph-H), 6.88 (t, 2H,J= 4.4 Hz, Ph-H), 4.93 (s, 2H, N-H), 4.3 (s,2H,-CH2-), 3.79 (s, 3H, -CH3).
化合物2b-2e合成方法同上.
2bIR (KBr, cm-1): 3 468, 3 416 (N-H), 1 700 (C=O), 1 634, 1 565, 1 543, 1 518 (Ar), 1 256, 1 138 (C-O).1H NMR (CDCl3,δ): 8.34 (d, 1H,J= 4.2 Hz, Ph-H), 7.42 (t, 1H,J= 8.1 Hz, Ph-H), 7.23 (dd, 1H,J= 8.6 Hz, Ph-H), 6.81(d, 1H,J= 1.4 Hz, Ph-H), 4.89 (s, 2H, N-H), 3.86 (d, 6H,J= 2.3 Hz, CH3O ), 3.34 (t, 2H,J= 7.7 Hz, -CH2-), 3.07(t, 2H,J= 7.7 Hz, -CH2-).
2cIR (KBr, cm-1): 3 427, 3 291 (NH), 2 950, 2 816 (C-H),1 667 (C=O), 1 622, 1 585, 1 540, 1 505 (Ar), 1 237, 1 126, 1 114 (C-O).1H NMR (CDCl3,δ): 8.44 (d, 1H,J= 4.2 Hz, Ph-H), 7.48 (t, 1H,J= 4.2 Hz, Ph-H), 7.34 (s, 2H, Ph-H), 7.28 (t, 2H,J= 5.1 Hz, Ph-H), 4.97 (s, 2H, N-H), 3.93 (s, 9H, CH3O).
2dIR (KBr, cm-1): 3 480, 3 442, 3 290 (N-H), 1 665(C=O), 1 629, 1 610, 1 588, 1 550 (Ar), 1 263 (P=O), 1 215, 1 190 (C-O).1H NMR (CDCl3,δ): 8.45 (d, 1H,J= 4.2 Hz, Ph-H), 8.01 (d, 1H,J= 3.9 Hz, Ph-H), 7.45 (m, 3H, Ph-H), 7.28 (d, 1H,J= 3.6 Hz, Ph-H ), 4.94 (s, 2H, N-H), 4.05 (m, 4H,J= 7.7 Hz, -CH2O ), 3.27 (s, 1H, -CH2-), 3.19 (s, 1H, -CH2-), 1.28 (t, 6H,J= 7.5 Hz, -CH3).
2eIR (KBr, cm-1): 3 432, 3 361, 3 332 (N-H), 1 669, 1 645 (C=O), 1 645, 1 606, 1 530(Ar), 1 210, 1 124 (C-O).1H NMR (DMSO,δ): 8.20 (d,1H,J= 3.9 Hz, Ph-H), 7.53 (t, 1H,J= 8.1 Hz, Ph-H), 7.34 (dd, 2H,J= 8.4 Hz, Ph-H), 7.16 (m, 2H,J= 10.5 Hz, Ph-H), 6.62 (d, 2H,J= 5.3 Hz, Ph-H), 6.27 (s, 2H, N-H), 3.71 (s, 3H, -CH3), 3.26 (t, 2H,J= 3.2 Hz, -CH2-), 2.75 (t, 2H,J= 6.6 Hz, -CH2-).1.2.32-(3-氨基-4-氯-1H吲唑)草酸乙酯(3)的合成
取3-氨基-4-氯-1H-吲唑(35.00 g,209 mmol),干燥三乙胺(53.00 g, 524 mmol)和干燥四氢呋喃溶液250 mL于500 mL茄形瓶中,氮气保护0 ℃条件下搅拌,缓慢滴加草酰氯单乙酯(31.50 g,230 mmol)和100 mL干燥四氢呋喃的混合溶液,反应15 min. 将反应液减压旋蒸至干,乙酸乙酯溶解,抽滤,硅胶柱层析,采用V正己烷∶V乙酯为8∶1的洗脱剂洗脱,回收溶剂,得白色固体12.75 g,产率 23.00%,m.p. 136~137 ℃. IR (KBr, cm-1): 3 492, 3 327 (N-H), 2 981, 2 940 (C-H), 1 748, 1 698 (C=O), 1 631, 1 602, 1 550 (Ar), 1 237, 1 126, 1 240, 1 107 (C-O).1H NMR (DMSO-d6,δ): 8.11 (d,1H,J= 3.9 Hz, Ph-H), 7.63 (t, 1H,J= 7.8 Hz, Ph-H), 7.48 (d, 1H,J= 3.9 Hz, Ph-H), 6.57 (s, 2H, N-H), 4.37 (q, 2H,J= 10.8 Hz, -CH2O), 1.32 (t, 3H,J= 7.2 Hz, -CH3).
1.2.42-((4-氯-1-(4-甲氧苄基)-1H-吲唑-3-基)(4-甲氧苄基)氨基) -2-草酸乙酯(4a)的合成
取化合物3 (0.96 g, 3.6 mmol),无水碳酸钾(1.00 g, 7.2 mmol)和100 mL干燥的N,N-二甲基甲酰胺溶液于500 mL茄形瓶中,0 ℃氮气保护条件下搅拌,缓慢滴加溶于干燥的50 mL N,N-二甲基甲酰胺溶的对甲氧基苄氯(0.68 g,4.3 mmol),反应5 h,将反应液加入400 mL蒸馏水和乙酸乙酯萃取,有机相用无水硫酸钠干燥,拌样,硅胶柱层析,采用V正己烷∶V乙酯为6∶1的洗脱剂洗脱,得白色固体0.32 g,产率 17.00%, m.p. 167~169 ℃. IR (KBr, cm-1): 3 415 (N-H),2 954, 2 934 (C-H),1 731, 1 681 (C=O),1 612,1 513, 1 496, 1 442 (Ar),1 247, 1 128, 1 110 (C-O).1H NMR (DMSO-d6,δ):δ7.70 (d,1H,J= 8.1 Hz, Ph-H ), 7.40 (t, 1H,J= 8.4 Hz, Ph-H), 7.26 (d, 1H,J= 7.2 Hz, Ph-H ), 7.07 (d, 2H,J= 8.7 Hz, Ph-H), 6.96 (d, 2H,J= 8.7 Hz, Ph-H), 6.77 (m, 4H, Ph-H), 5.47(s, 2H, Ph-CH2-), 3.71 (s, 6H, CH3O), 3.35 (m, 2H, -CH2O), 2.49 (s, 2H, Ph-CH2-), 0.57 (t, 3H,J= 14.1 Hz, -CH3).
化合物4b合成方法同上.
4bIR (KBr, cm-1): 2 983, 2 938 (C-H), 1 748, 1 679 (C=O), 1 616, 1 566, 1 504 (Ar), 1 243, 1 213 (C-O).1H NMR (CDCl3,δ): 7.34 (t, 1H,J= 4.2 Hz, Ph-H), 7.29 (t, 1H,J= 4.2 Hz, Ph-H), 7.19 (d, 2H,J= 3.9 Hz, Ph-H), 4.02 (q, 2H,J= 2.7 Hz, -CH2-), 4.02 (s, 3H, CH3N), 3.43 (S, 3H, CH3N), 0.94 (s, 3H, -CH3).
1.2.5N1-(4-氯-1-(4-甲氧苄基)-1H-吲唑-3-基)-N1-(4-甲氧苄基)-N2-(吡啶-4-基)草酰胺(5a)的合成
取4-氨基吡啶(500 mg, 5.3 mmol),干燥的甲苯溶剂20 mL于250 mL茄形瓶中. 在氮气保护室温条件下,滴加三甲基铝的甲苯溶液(2.7 mL, 2 mol),反应0.5 h,再加入化合物 4a (1.19 g, 4.43 mmol),110 ℃反应6 h,加入3 mL(4 mol/L)的氢氧化钠水溶液淬灭,反应液经减压旋蒸至干,加入20 mL蒸馏水和乙酸乙酯萃取,将有机相酸碱度调至中性,再经无水硫酸钠干燥,硅胶柱层析,采用V正己烷∶V乙酯为2∶1的洗脱剂洗脱,回收溶剂,得白色固体1.03 g,产率 35.00%. m.p. 152~153 ℃. IR (KBr, cm-1): 3 413 (N-H), 2 955, 2 927 (C-H),1 705, 1 668 (C=O), 1 613 (C=N), 1 593, 1 513, 1 494 (Ar), 1 248, 1 177 (C-O).1H NMR (CDCl3,δ): 9.21 (s, 1H, -NH), 8.45 (d, 2H,J= 3 Hz, Pyridine-H), 7.35 (dd, 2H,J= 3.2 Hz, Ph-H ), 7.24 (dd, 2H,J= 4.8 Hz, Pyridine-H), 7.18 (d, 2H,J= 4.4 Hz, Ph-H), 7.10 ( m,1H, Ph-H), 6.97 (d, 2H,J= 4.4 Hz, Ph-H), 6.74(m, 4H, Ph-H), 5.37 (s, 2H, Ph-CH2-), 5.40 (s, 2H, Ph-CH2-), 3.76 (s, 6H, CH3O).
化合物5b-5d合成方法同上.
5bIR (KBr, cm-1): 3 414 (N-H), 2 924, 2 852 (C-H), 1 707, 1 669 (C=O), 1 616 (C=N), 1 594, 1 498 (Ar).1H NMR (DMSO-d6,δ): 11.2 (s, 1H, N-H), 8.37 (dd, 2H,J= 3.2 Hz, Pyridine-H), 7.66(d, 1H,J= 4.2 Hz, Ph-H),7.48 (m, 2H, Pyridine-H), 7.44 (d, 1H,J= 4.4 Hz, Ph-H), 7.26 (d, 1H,J= 3.6 Hz, Ph-H), 3.96 (s, 3H, -CH3), 3.3 (s, 3H, -CH3).
5cIR (KBr, cm-1): 3 414 (N-H), 2 928, 2 833 (C-H),1 662, 1 636 (C=O), 1 613, 1 585, 1 512, 1 490 (Ar), 1 247, 1 176 (C-O).1H NMR (CDCl3,δ): 8.30 (d, 2H,J= 2.4 Hz, Pyrimidin-H), 7.40 (s, 1H, N-H), 7.22 (d, 2H,J= 4.2 Hz, Ph-H), 7.17 (t, 1H,J= 4.2 Hz, Ph-H), 7.14 (t, 1H,J= 4.2 Hz, Ph-H), 7.04 (d, 1H,J= 3.9 Hz, Pyrimidin -H), 6.95 (d, 2H,J= 4.2 Hz, Ph-H), 6.75 (dd, 4H,J= 8.4 Hz, Ph-H), 6.23 (t, 1H,J= 4.8 Hz, Ph-H), 5.34 (s, 2H, -CH2-), 4.72 (s, 2H, -CH2-), 3.77 (s, 6H, -CH3).
5dIR (KBr, cm-1): 3 414 (N-H), 2 926, 2 851 (C-H); 1 701,1 667 (C=O); 1 615, 1 576, 1 498 (Ar).1H NMR (DMSO-d6,δ): 10.9 (s, 1H, N-H), 8.33 (m, 1H, Pyridine-H), 7.67(d, 1H,J= 1.8 Hz, Pyridine-H), 7.65 (t, 1H,J= 4.1 Hz, Ph-H), 7.6 (d, 1H,J= 4.2 Hz, Ph-H), 7.43 (t, 1H,J= 4.2 Hz, Ph-H), 7.12 (m, 1H, Pyridine-H), 3.96 (s, 3H, -CH3), 3.45 (s, 3H, -CH3).
2结果与讨论
以2,6-二氯苯腈为原料,与水合肼(98%)在N-甲基吡咯烷酮存在下通过环合反应制得3-氨基-4-氯-1H-吲唑(1),并与含有羧基的系列化合物,通过缩合反应合成5个结构新颖的化合物2a-2e,(1)经草酰氯单乙酯缩合、卤代烃加成、酰胺化反应后得到4个目标产物(5a-5d),产物通过IR、1H NMR进行了结构确证(图2).
制备3-氨基-6-氯-1H-吲唑时,原文献以2,6-二氯苯腈为原料,醋酸钠作为缚酸剂,以吡啶作溶剂在105 ℃条件下滴入水合肼反应16 h;在后处理方面,在30 ℃温度条件通过加水析出、过滤, 在0 ℃的水中重结晶得产物,收率74%. 而我们在70 ℃反应条件下以无水N-甲基吡咯烷酮作溶剂,滴入高浓度水合肼反应23 h;在后处理方面,反应液直接倾入搅拌中的冰水溶液析出白色固体,过滤,产率96%. 对比原文献的制备方法,本方法反应条件温和、收率更高.
测定3-氨基-4-氯-1H吲唑衍生物对不同肿瘤细胞的IC50值.
收集对数期细胞用含10%胎小牛血清的培养液配成单个细胞悬液,用RPMI-1640稀释到每毫升1×105个,96孔板中每孔加入细胞悬液100 μL,5% CO237 ℃下孵育,8 h后贴壁或悬浮,加入梯度稀释的药物,浓度分别为1,1×10-1,1×10-2,1×10-3,1×10-4,1×10-5和1×10-6μmol·L-1. 孵育24 h后在倒置显微镜下观察查看细胞状态,每孔加MTT溶液(5 g·L-1)20 μL,继续孵育4 h,终止培养反应,小心吸弃孔内培养上清液. 对于K562等悬浮细胞需要离心后再吸弃孔内培养上清液,小心用PBS冲洗2~3遍再加入MTT孵育4 h,每孔析出紫色结晶后,加150 μL DMSO,振荡10 min,使结晶物充分溶解,在酶联免疫监测仪490 nm处测定各孔光吸收值. 采用MTT法对K562、SMMC7721、A549、T-47D细胞进行抗肿瘤活性测试,阳性对照药为紫杉醇(Taxol),结果见表1.
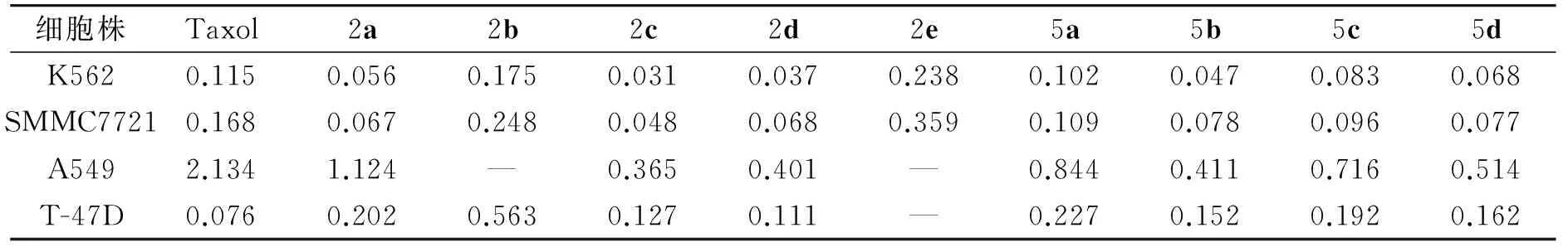
表1 吲唑类化合物体外抗肿瘤活性测定结果(IC50, μmol·L-1)
由体外活性测试结果可以简单推导出如下构效关系:(1)活性顺序为2c>2d>5b>2a>5d> 5c>5a> 2b>2e,当R1上苯环与酰胺键间距延长时,化合物活性有所降低. 且苯环取代基为供电子基团时,活性较好. (2)R2用甲基取代时,活性要优于对甲氧苄基,说明位阻小有利于活性增强. (3)R3含氮杂环取代基活性顺序为嘧啶基>4-吡啶基>2-吡啶基.
3结论
合成了9个新型吲唑类化合物2a-2e、5a-5d,体外抗肿瘤活性研究表明,吲唑系列化合物对慢粒白血病细胞K562、肝癌细胞SMMC7721均有效且体外活性测试优于阳性对照药紫杉醇,具有一定抗肿瘤活性;其中化合物2c活性最好,同时对2c的安全性测试得知,其小鼠LD50为254.32 mg·kg-1,95%的可信限为214.35~294.49 mg·kg-1. 本研究对吲唑类抗肿瘤药物研发具有一定参考价值.
参考文献:
[1] 黄兆琦. DNA拓扑异构酶与细胞凋亡[J]. 医学研究生学报, 2002, 15(6): 539-541.
[2] JAKUPEC M A, REISNER E, EICHINGER A, et al. Redox-active antineoplastic ruthenium complexes with indazole: Correlation of in vitro potency and reduction potential [J]. J Med Chem, 2005, 48(8): 2831-2837.
[3] 张菊, 朱孝峰, 刘宗潮. 酪氨酸激酶小分子抑制剂在肿瘤治疗中的研究[J]. 国际肿瘤学杂志, 2003, 30(3): 199-201.
[4] WONG T W, LEE F Y, YU C, et al. Preclinical antitumor activity of BMS-599626, a pan-HER Kinase inhibitor that inhibits HER1/HER2 homodimer and heterodimer signaling [J]. Clin Cancer Res, 2006, 12(20): 6186-6193.
[5] LIOU J P, CHANG Y L, KUO F M, ET AL. Concise synthesis and structure-activity relationships of combre-tastatin A-4 analogues, 1-aroylin doles and 3-aroylindoles, as novel classes of potent antitubulin agents [J]. J Med Chem, 2004, 47(17): 4247-4257.
[6] DUAN J X, CAI X, MENG F, et al. Potent antitubulin tumor cell cytotoxins based on 3-aroyl indazoles [J]. J Med Chem, 2007, 50(5): 1001-1006.
[7] TUNG Y S, COUMAR M S, WU Y S, et al. Scaffold-hopping strategy: synthesis and biological evaluation of 5, 6-fused bicyclic heteroaromatics to identify orally bioavailable anticancer agents [J]. J Med Chem, 2011, 54(8): 3076-3080.
[8] ATTA-UR-R, MALIK S, HASAN S S, et al. Nigellidine—A new indazole alkaloid from the seeds of Nigella sativa [J]. Tetrahedron Lett, 1995, 36(12): 1993-1996.
[9] SCHMIDT A. Biologically active mesomeric betaines and alkaloids, derived from 3-hydroxypyridine, pyridin-N-oxide, nicotinic acid and picolinic acid: three types of conjugation and their consequences curr [J]. J Org Chem, 2004, 8(8): 653-670.
[责任编辑:任铁钢]
收稿日期:2016-01-17.
作者简介:周云鹏(1974-),男,实验师,研究方向为有机合成. E-mail: 13940355775@163.com. *通讯作者, E-mail:Ldwangyang@163.com.
中图分类号:O621.25
文献标志码:A
文章编号:1008-1011(2016)03-0340-05
Synthesis and antitumor activities of 3-amino-4-chlor-1H-indazole derivatives
ZHOU Yunpeng, LI Yuan, HE Chang, SONG Duanzheng, WANG Yang*
(Collegeofpharmacy,LiaoningUninversity,NewDrugResearchandDevelopmentKeyLaboratoryofLiaoningProvince,Shenyang110036,Liaoning,China)
Abstract:Starting from 2-fluoro-6-morpholinobenzonitrile, 9 compounds were synthesized through five-steps reaction. The structure were verified by1H-NMR and IR. Its antitumor activity was preliminarily screened. In vitro experiments compound 2c exhibited obvious antitumor activities on K-562 and SMMC7721 tumor cells.
Keywords:indazoles; synthesis; anti-tumor
