姜黄素阻断DAMPs-TLR4信号通路抑制黑色素瘤肺转移的效应及机制*
2016-07-05张雨莎占秋晓吴丰华
张雨莎, 柳 慧, 占秋晓, 吴丰华
湖北中医药大学基础医学院,武汉 430065
姜黄素阻断DAMPs-TLR4信号通路抑制黑色素瘤肺转移的效应及机制*
张雨莎,柳慧,占秋晓,吴丰华△
湖北中医药大学基础医学院,武汉430065
摘要:目的探讨姜黄素抑制黑色素瘤细胞DAMPs-TLR4信号通路的激活,从而抑制黑色素瘤肺转移的效应及机制。方法体外培养小鼠黑色素瘤B16细胞,制备肿瘤损伤分子(DTC-Ms)模拟肿瘤微环境中DAMPs分子混合培养,并加入最佳工作浓度姜黄素处理,CCK8细胞活性试剂盒检测细胞活性;CFSE标记B16细胞,尾静脉注射接种,分别在接种后6 h和24 h取肺组织做冰冻切片,观察各组细胞在肺部聚集和对肺组织侵袭情况;接种后15 d解剖小鼠取肺,观察B16细胞在肺表面形成转移结节数量差异;Zymography法检测肿瘤细胞分泌MMP-9水平;Western blot检测肿瘤细胞TLR4信号通路的关键分子表达。结果姜黄素能有效逆转DTC-Ms刺激所致的细胞活性增强及体内转移能力增强的效应,抑制DTC-Ms刺激所致的肿瘤细胞MMP-9和Pro-MMP-9分泌增多的生物学效应,并能明显抑制DTC-Ms刺激下肿瘤细胞TLR4信号通路的激活。结论姜黄素能阻断DAMPs对黑色素瘤细胞TLR4信号通路的激活,抑制实验性黑色素瘤肺转移。
关键词:姜黄素;损伤相关分子模式;肿瘤转移;Toll样受体
肿瘤细胞的非程序性死亡会向肿瘤微环境中释放大量的损伤相关分子模式(Damage-associated molecules pattern,DAMPs)分子,如HMGB1、HSPs、S100家族等。这些成分通常只存在于胞质,释放致胞外被免疫细胞识别后,能启动机体保护性免疫应答,起到免疫监视和免疫自稳的作用[1]。但是,在复杂的肿瘤微环境中,DAMPs的存在却可能起到帮助肿瘤生长和转移的作用[2-3]。近年来研究发现,作为DAMPs的识别受体的Toll样受体(Toll-like receptor,TLR)广泛表达于肿瘤细胞。我们前期通过低渗冻融的方法获取肿瘤损伤分子(molecules from damaged tumor cells,DTC-Ms),用以模拟肿瘤微环境中的DAMPs,发现DTC-Ms能通过激活肿瘤细胞的TLR4-NF-κB信号通路,促进肿瘤的生长和转移[4-5]。
姜黄素(Curcumin)是从姜科黄属植物姜黄(Curcumalonga)根茎中提取的一种植物多酚。体内外研究证明姜黄素同时具有肿瘤的预防和治疗功能[6],临床研究证明姜黄素对放化疗有很好的辅助增效作用[7]。姜黄素通过抑制NF-κB激活在抑制肿瘤转移的过程中扮演重要角色,但其上游信号尚有待进一步证明。在对姜黄素抗炎作用机制的研究中发现,姜黄素能抑制TLR信号通路减轻实验性大肠炎等炎症反应[8-9]。结合以上研究背景和前期工作基础,本研究旨在探讨姜黄素能否阻断肿瘤微环境中DAMPs分子对TLR4信号的激活,发挥抗实验性黑色素瘤肺转移的效应。
1材料与方法
1.1材料
小鼠黑色素瘤细胞B16/F1购自美国AATCC公司,羧基荧光素二乙酸琥珀酰亚铵酯(carboxyfluorescein diacetate succinimidyl ester,CFSE)购自Sigma公司,细胞培养用培养液、血清、胰酶等购自Gibco公司,CCK-8细胞活性检测试剂盒购自南京凯基生物科技发展有限公司,C57BL /6小鼠购自中国医学科学院。姜黄素购自Sigma公司(#C7727),用10 mmol/L DMSO液溶解备用。所用抗体均购自Cell Signaling公司。
1.2细胞低渗冻融上清制备
参考文献[10]诱导细胞坏死模型的方法,将6×106个细胞用PBS洗涤后重悬于400 μL TdH2O中,漩涡振荡30 s,4℃静置4 h,转入-20℃过夜,次日从-20℃转入4℃静置4 h,置室温自然解冻,漩涡振荡30 s,7 000 r/min×10 min离心,收集上清,命名为肿瘤损伤分子(DTC-Ms)。
1.3CCK-8细胞活性检测试剂盒检测细胞活性
将B16细胞调整至5×104/mL,按100 μL/孔接种至96孔板。按以下分组培养,每组设复孔3个:①对照组;②DTC-Ms处理组,培养液中加入DTC-Ms(20 μg/mL)培养4 d;③DTC-Ms+姜黄素处理组,不同浓度姜黄素(高:40 μg/mL;中:20 μg/mL;低:10 μg/mL)预处理24 h后,培养液中加入DTC-Ms(20 μg/mL),继续培养3 d;④姜黄素处理组,不同浓度姜黄素(高:40 μg/mL;中:20 μg/mL;低:10 μg/mL)培养4 d。每孔加入10 μL WST-8溶液,37℃培养1 h,在450 nm检测吸光度值(A450),按以下公式计算相对细胞活性:
相对细胞活性(%)=[(实验组A450-空白组A450)-(对照组A450-空白组A450)]/(对照组A450-空白组A450)×100%
1.4黑色素瘤B16细胞体内侵袭成瘤实验
按以下分组体外培养B16细胞:①对照组;②DTC-Ms处理组,培养液中加入DTC-Ms(20 μg/mL)培养4 d;③DTC-Ms+姜黄素处理组,姜黄素(10 μg/mL)预处理24 h后,培养液中加入DTC-Ms(20 μg/mL),继续培养3 d;④姜黄素处理组,姜黄素(10 μg/mL)培养4 d。
将以上分组培养的B16细胞用CFSE按文献[11]所示方法进行标记,细胞用生理盐水悬浮,调整密度为5×106/mL。C57BL/6小鼠随机分为4组分别接种以上4组细胞,每组8只,每只小鼠注射细胞悬液100 μL(5×105/只)。各组在注射细胞后6 h和24 h后分别随机处死4只小鼠,取肺组织,用4%多聚甲醛固定6 h,20%蔗糖中过夜,制备冰冻切片(厚度为20 μm),将切片置荧光显微镜下观察肺组织中的B16细胞聚集情况(荧光结节)。同时,随机计数每只小鼠肺组织切片的20个视野,计算各组小鼠的荧光结节数。
另将24只小鼠分为3组(每组6只)按上述的处理方法尾静脉注射B16细胞,接种15 d后解剖小鼠,取肺,观察肺表面黑色素瘤细胞转移结节;取肺组织进行石蜡切片,经苏木精-伊红(HE)染色后,镜下观察转移灶的形成。
1.5Zymography法检测肿瘤细胞分泌MMPs水平
按1.4分组培养B16细胞。计数各组细胞数,调整细胞数相等继续培养24 h,收集培养液,取20 μL上样。参照Gogly等[12]的方法,将样品于含1%明胶的7.5%聚丙烯酰胺凝胶上进行电泳。电泳结束后,将凝胶置于2.5% Triton X-100振荡30 min 2次;置于孵育液37℃孵育过夜,用考马斯亮蓝R250染色3 h,脱色。凝胶经HPIAS-1000图文分析系统成像。
1.6Western blot检测肿瘤细胞TLR4下游信号分子
10 μg/mL姜黄素预处理B16细胞60 min,加入DTC-Ms(20 μg/mL),根据前期实验结果,选择作用60 min后提取总蛋白。用改进型lowry法蛋白定量,沸水浴5 min,每份样品取20 μg与上样缓冲液混合后上样。Western blot检测:于10%SDS-PAGE凝胶电泳分离、转膜、封闭,然后依次结合一抗、二抗,加入ECL显影液暗室显影、曝光、洗片。通过以上方法对磷酸化ERK1/2、JNK蛋白水平进行半定量检测。核抽提试剂盒提取核蛋白,同上方法检测核内NF-κB亚基p65(p65-nu)水平。
1.7统计学方法

2结果
2.1姜黄素对DTC-Ms处理后的肿瘤细胞活性影响
按1.3项分组体外培养B16细胞,CCK-8细胞活性检测试剂盒检测细胞活性。结果显示,DTC-Ms处理组细胞活性为对照组的(195±15)%;高、中浓度姜黄素(40 μg/mL、20 μg/mL)能明显降低肿瘤细胞活性,细胞活性分别为对照组的(15±3)%和(51±8)%;低浓度姜黄素(10 μg/mL)单独处理组,虽然细胞活性与对照组无明显差异[(92±12)%],但有趣的是,DTC-Ms+低浓度姜黄素(10 μg/mL)处理组细胞活性[(120±18)%]与DTC-Ms处理组相比有显著性差异。以上结果提示,低浓度姜黄素虽然不能直接影响细胞活性,但是能拮抗DTC-Ms刺激下细胞活性增强的效应(表1)。
为了更好说明姜黄素对DTC-Ms的阻断效应,以下实验中,我们选取了10 μg/mL作为姜黄素的最佳工作浓度。

表1 不同处理组B16细胞相对活性比较
与对照组比较,*P<0.05;与DTC-Ms处理组比较,△P<0.05
2.2姜黄素对DTC-Ms处理后的肿瘤细胞肺侵袭能力及肺部转移瘤形成的影响
将荧光标记的B16细胞经尾静脉注射,分别在接种后6 h和24 h制备肺组织冰冻切片,观察计数荧光结节。表2结果显示,经DTC-Ms处理的B16细胞,接种后6 h和24 h肺部荧光结节数均比对照组明显增多;姜黄素与DTC-Ms共同处理的B16细胞,接种后6 h和24 h肺部荧光结节数比DTC-Ms处理组减少,差异有统计学意义(P<0.05);仅姜黄素处理组与对照组无明显差异。以上说明DTC-Ms能明显促进B16细胞侵袭肺组织能力,而低浓度姜黄素可以逆转这一效应(表2)。
表2各组尾静脉注射B16细胞后肺组织荧光结节数比较

Table 2 Comparison of fluorescent spots in the frozen sections

组别 6h 24h对照组 88±1515±3DTC-Ms处理组149±23*30±5*DTC-Ms+姜黄素处理组110±16△18±4△姜黄素处理组 82±1113±3
与对照组比较,*P<0.05;与DTC-Ms处理组比较,△P<0.05
接种后15 d处死小鼠,取肺,观察实验性肺转移成瘤(肺表面形成的黑色结节)(图1)。结果显示,DTC-Ms处理的B16细胞在肺部形成的转移结节数(620±73)比对照组(413±55)明显增多;姜黄素与DTC-Ms共同处理的B16细胞肺转移结节数(460±63)与对照组虽无明显差异,但是与DTC-Ms处理组相比明显减少,差异有统计学意义(P<0.05)。
肺组织病理切片HE染色显示,DTC-Ms处理的B16细胞肺部转移灶明显增多,姜黄素与DTC-Ms共同处理的B16细胞形成的肺转移灶比DTC-Ms处理组明显减少(图2)。

A:对照组;B:DTC-Ms处理组;C:DTC-Ms+姜黄素处理组;D:姜黄素处理组图1 各组小鼠接种B16细胞后15 d全肺照片Fig.1 Lung tissues of mice 15 days after inoculation with B16 cells in each group

A:对照组;B:DTC-Ms处理组;C:DTC-Ms+姜黄素处理组;D:姜黄素处理组图2 各组小鼠接种B16细胞后15 d肺组织HE染色切片(×200)Fig.2 HE staining of lung tissues in mice 15 days after inoculation with B16 cells(×200)
2.3姜黄素对肿瘤细胞分泌MMP-9的影响
肿瘤细胞侵袭重组基底膜时,需要释放基质金属蛋白酶MMPs水解基底膜,我们前期研究发现,在DTC-Ms刺激下,肿瘤细胞分泌MMPs水平明显升高[4]。我们检测不同处理组肿瘤细胞分泌MMPs蛋白水平。结果发现,DTC-Ms能明显促进B16细胞active-MMP-9和Pro-MMP-9的分泌;而姜黄素能有效逆转这一效应(图3)。

A:对照组;B:DTC-Ms处理组;C:DTC-Ms+姜黄素处理组;D:姜黄素处理组图3 Zymography检测各组细胞分泌基质金属蛋白酶-9水平Fig.3 Levels of MMP-9 in B16 cells detected by Zymography
2.4姜黄素对肿瘤细胞TLR4信号通路的影响
我们前期实验结果显示,DTC-Ms中含有大量TLR4的内源性配体(如HSP70、HMGB-1等),并能激活肿瘤细胞TLR4信号通路[4-5,10]。在此,我们进一步检测,姜黄素能否阻断DTC-Ms对TLR4信号通路的激活,从而发挥以上抑制肿瘤转移的效应。ERK、JNK、I-κB为TLR4信号通路中的重要分子,TLR4信号激活后,磷酸化ERK、JNK、I-κB水平会相应升高,同时磷酸化I-κB会释放NF-κB的p65亚基进入核内进一步发挥核因子的作用,改变相应下游分子的转录[13]。我们发现,加入DTC-Ms后,B16细胞TLR4下游MARK途径的代表分子ERK1/2激活,同时,细胞核内的p65水平升高,证明肿瘤细胞的NF-κB途径也被激活。但是细胞经姜黄素预处理后,再在培养液中加入DTC-Ms,以上信号分子激活的现象被明显抑制(图4)。证明姜黄素能明显拮抗在配体刺激下的肿瘤细胞TLR4信号通路的激活。
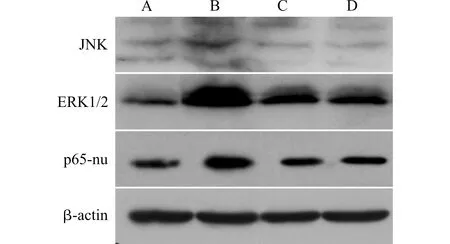
A:对照组;B:DTC-Ms处理组;C:DTC-Ms+姜黄素处理组;D:姜黄素处理组图4 姜黄素对DTC-Ms处理后的B16细胞TLR4信号通路的影响Fig.4 Effect of curcumin on TLR4 signal pathway in B16 cells treated with DTC-Ms
3讨论
DAMPs大多是肿瘤细胞胞内分子,当肿瘤细胞受损或非程序性死亡时被释放至胞外。最近研究显示,在复杂的肿瘤微环境中,DAMPs的持续存在可能起到诱导免疫耐受,帮助肿瘤细胞远处转移的作用[2-3]。因此,阻断DAMPs在肿瘤微环境中的作用靶点或将成为肿瘤治疗新思路。
鉴于坏死的病理学特点,我们将细胞冻融和低渗振荡处理后,收集上清(即DTC-Ms),其成分主要为胞内成分。我们发现DTC-Ms能增强黑色素瘤B16细胞体外活性,并促进细胞的体内侵袭转移。我们尝试以不同浓度姜黄素体外培养B16细胞,发现高浓度姜黄素能明显降低细胞活性,可能是因为姜黄素能直接抑制细胞增殖,诱导肿瘤细胞凋亡等原因。有趣的是,较低浓度姜黄素直接作用于B16细胞,对细胞活性没有影响,但是却能降低DTC-Ms诱导的细胞活性增强的效应,说明姜黄素能间接调控肿瘤细胞对DTC-Ms的反应性。我们选择这个浓度作进一步研究,在实验性黑色素瘤肺转移模型中得到相似结果。肿瘤转移与本身基因的异常表达密切相关,而基因的异常表达受控于肿瘤微环境提供的信号。由于姜黄素口服吸收效果有限,生物利用度低的特点,有文献质疑姜黄素在体内对肿瘤细胞难以实现像体外那样的杀伤效果[14]。我们的结果显示姜黄素在较低工作浓度下,虽然不能对肿瘤细胞直接杀伤,却能调节肿瘤细胞对外部信号的反应性,这为姜黄素的药理学研究提供了一个新的思路。
进一步,我们针对DTC-Ms作用受体,探讨姜黄素对DTC-Ms刺激下TLR4信号通路的影响。TLR4信号激活后,主要通过激活胞内的NF-κB通路和MAPK信号通路调控细胞相关基因的表达,改变细胞的生物学性状[13]。我们通过对磷酸化ERK1/2(MAPK通路关键分子)和核内NF-κB p65亚基蛋白水平的检测,发现姜黄素能明显抑制在DTC-Ms刺激下的肿瘤细胞TLR4下游信号分子的激活。作为同是核因子NF-κB调控对象之一的MMP-9[15],其分泌水平也明显降低。
肿瘤细胞快速生长的特点导致坏死现象非常普遍,传统放化疗和手术治疗又会导致更多的细胞受损或坏死,这些均导致在肿瘤微环境中DAMPs不断堆积,不断恶化肿瘤微环境。姜黄素作为一种放化疗增效剂,能增强肿瘤治疗的效果[16-17]。我们的实验证明,姜黄素能有效阻断DAMPs作用靶点,下调肿瘤细胞对DAMPs的敏感性,抑制肿瘤转移。这可能是姜黄素放化疗增效的重要机制,也为基于DAMPs作用靶点的联合治疗提供了新思路。
[1]Lotze M T,Zeh H J,Rubartelli A,et al.The grateful dead:damage-associated molecular pattern molecules and reduction/oxidation regulate immunity[J].Immunol Rev,2007,220(1):60-81.
[2]He Y,Zha J,Wang Y,et al.Tissue damage-associated "danger signals" influence T-cell responses that promote the progression of preneoplasia to cancer[J].Cancer Res,2013,73(2):629-639.
[3]Wu F H,Yuan Y,Li D,et al.Endothelial cell-expressed Tim-3 facilitates metastasis of melanoma cells by activating the NF-kappaB pathway[J].Oncol Rep,2010,24(3):693-699.
[4]Liao S J,Zhou Y H,Yuan Y,et al.Triggering of Toll-like receptor 4 on metastatic breast cancer cells promotes αvβ3-mediated adhesion and invasive migration[J].Breast Cancer Res Treat,2012,133(3):853-863.
[5]Zhu J H,Yuan Y,Li D,et al.Targeting nuclear factor-κB suppresses the negative effect of toll-like receptor 4 signaling on antimetastasis therapy based on targeting αvβ3[J].Cancer Sci,2012,103(7):1319-1326.
[6]Goel A,Kunnumakkara A B,Aggarwal B B.Curcumin as“Curecumin”:from kitchen to clinic[J].Biochem Pharmacol,2008,75(4):787-809.
[7]López-Lázaro M.Anticancer and carcinogenic properties of curcumin:considerations for its clinical development as a cancer chemopreventive and chemotherapeutic agent[J].Mol Nutr Food Res,2008,52(Suppl 1):S103-S127.
[8]Youn H S,Saitoh S I,Miyake K,et al.Inhibition of homodimerization of Toll-like receptor 4 by curcumin[J].Biochem Pharmacol,2006,72(1):62-69.
[9]Decoté-Ricardo D,Chagas K K,Rocha J D,et al.Modulation ofinvitromurine B-lymphocyte response by curcumin[J].Phytomedicine,2009,16(10):982-988.
[10]Wu F H,Luo L Q,Liu Y,et al.Cyclin D1b splice variant promotes αvβ3-mediated adhesion and invasive migration of breast cancer cells[J].Cancer Lett,2014,355(1):159-167.
[11]吴丰华,张桂梅,刘毅,等.重组纤维连接蛋白多肽CH50对黑色素瘤B16细胞侵袭能力的抑制作用及机制[J].医学分子生物学杂志,2006,3(3):170-175.
[12]Gogly B,Groult N,Hornebeck W,et al.Collagen zymography as a sensitive and specific technique for the determination of subpicogram levels of interstitial collagenase[J].Anal Biochem,1998,255(2):211-216.
[13]Kawasaki T,Kawai T.Toll-like receptor signaling pathways[J].Front Immunol,2014,5:461.
[14]苏旬,贺秀丽,刘秀菊,等.姜黄素的临床研究进展[J].食品与药品,2012,14(5):193-198.
[15]王承兴,邓锡云,李晓艳,等.EB病毒LMP1在鼻咽癌细胞系中通过NF-κB、AP-1促进MMP-9表达[J].中华肿瘤杂志,2002,24(1):9-13.
[16]陈馨,肖乐,吴小雪,等.姜黄素对胃癌细胞抑癌基因甲基化的抑制作用[J].华中科技大学学报: 医学版,2015,44(6):674-677.
[17]许琮,夏超,李德民,等.姜黄素联合吉西他滨对胰腺癌细胞体外增殖、凋亡及肿瘤干细胞表型特征的影响[J].华中科技大学学报: 医学版,2015,44(5):499-504.
(2015-12-28收稿)
Inhibitory Effect of Curcumin on Lung Metastasis of Melanoma B16 Cells via Blocking DAMPs-TLR4 Signal Pathway
Zhang Yusha,Liu Hui,Zhan Qiuxiaoetal
SchoolofBasicMedicalSciences,HubeiUniversityofChineseMedicine,Wuhan430065,China
AbstractObjectiveTo investigate the inhibitory effect of curcumin on the lung metastasis of melanoma by suppressing the activation of DAMPs-Toll-like receptor 4(TLR4)signal in melanoma cells and the underlying mechanisms.MethodsMelanoma B16 cells were treated with DTC-Ms in vitro to simulate the in vivo microenvironment of cells cultured with DAMPs.The tumor cells were then treated or not with curcumin at the best working concentration.Cell viability was measured by CCK-8 cytotoxicity assay kit.The accumulation of B16 cells in lung and their invasion to lung tissue were observed after injection of B16 cells labeled with CFSE into mice via the tail vein,removal of the lungs 6 and 24 h later and preparation of frozen lung sections.The metastatic loci formed by B16 cells in lung were observed 15 days after inoculation.Zymography was used to analyze the activity of MMP-9 and Western blotting to detect the key molecules in the TLR4 signal pathway.ResultsCurcumin could significantly inhibit the DTC-Ms-induced increase of the invasion ability of tumor cells,down-regulate the activities of MMP-9 and Pro-MMP-9 and suppress the activation of TLR4 signal pathway in the presence of DTC-Ms.ConclusionCurcumin may inhibit the lung metastasis of melanoma cells by abrogating DAMPs-induced activation of TLR4 signal pathway.
Key wordscurcumin;DAMPs;tumor metastasis;toll-like receptor
中图分类号:R739.5
DOI:10.3870/j.issn.1672-0741.2016.03.007
*湖北省自然科学基金资助项目(No.2015CFB494);中国博士后基金资助项目(No.2015M570642)
张雨莎,女,1989年生,硕士研究生,E-mail:181261127@qq.com
△通讯作者,Corresponding author,E-mail:wfh0101@163.com
