姜黄素对骨肉瘤细胞增殖和凋亡的影响
2017-08-22原向伟黄秀芳
原向伟+黄秀芳
[摘要] 目的 研究姜黄素对骨肉瘤细胞增殖和凋亡的影响,并探讨其机制。 方法 采用姜黄素单体处理人骨肉瘤U2OS细胞,通过台盼蓝拒染法检测细胞增殖活力,采用流式细胞术和DNA Ladder检测凋亡,通过Westernblot法检测p53和caspase-3的表达。 结果 4、8、16、32、64μmol/L姜黄素处理U2OS细胞48h,生长抑制率为:(9.21±3.11)%、(16.85±3.95)%、(29.57±5.33)%、(52.30±6.07)%和(79.16±6.78)%。姜黄素(16μmol/L)在24、48和72h均可诱导U2OS细胞凋亡,凋亡率为:(18.8±3.05)%、(29.6±5.22)%和(57.3±6.62)%,姜黄素(16μmol/L)作用72h后,DNA电泳显示梯形条带改变。并且姜黄素作用48h可明显上调p53的表达和caspase-3的活化。 结论 姜黄素可抑制骨肉瘤U2OS细胞增殖,并通过p53-caspase-3通路诱导凋亡。
[关键词] 骨肉瘤;姜黄素;细胞增殖;凋亡
[中图分类号] R738.1 [文献标识码] A [文章编号] 2095-0616(2017)13-30-04
[Abstract] Objective To evaluate the effect of curcumin on proliferation and apoptosis in osteosarcoma cells and study its mechanisms. Methods Human osteosarcoma U2OS cells were treated with curcumin monomer.Trypan blue exclusion test was performed to evaluate the cell proliferation.Flow cytometry analysis and DNA Ladder assay were performed to examine the cell apoptosis.Westernblot assay was used to detect the expression of p53 and caspase-3. Results After treatment with curcumin (4,8,16,32,64μmol/L) for 48h,the inhibition rates of U2OS cells were (9.21±3.11)%,(16.85±3.95)%,(29.57±5.33)%,(52.30±6.07)%and(79.16±6.78)%.Curcumin (16μmol/L) induced apoptosis in U2OS cells at 24,48,72h.The apoptotic rates were (18.8±3.05)%,(29.6±5.22)% and(57.3±6.62)%.DNA electrophoresis showed ladder change after treatment with curcumin(16μmol/L) for 72h.The expression of p53 and caspase-3 activation were increased after curcumin treatment for 48h. Conclusion Curcumin decreases proliferation and induces apoptosis through p53-caspase-3 pathway in osteosarcoma U2OS cells.
[Key words] Osteosarcoma;Curcumin;Proliferation;Apoptosis
骨肉瘤是人类最常见的骨组织原发恶性肿瘤,常发于青少年,恶性度极高,目前常用治疗方法为新辅助化疗和手术治疗,但疗效差,预后不佳[1-2],因此寻找治疗骨肉瘤的新方法具有重要意义。中药抗肿瘤已有上千年的历史,随着中药现代化进程,针对具有抗肿瘤效应的部分中草药,提取其有效成分并进行深入研究,已成为肿瘤治疗的研究新方向[3]。姜黄素(curcumin)是提取自中药姜黄的一种单体植物多酚,具有多种药理作用,包括抗肿瘤、抗炎、抗凝、降血脂等[4-5],其可以抑制肺癌、胃癌、膀胱癌等多种肿瘤细胞的生长[6-8],提示了姜黄素在肿瘤治疗中的应用价值。本研究探讨姜黄素对人骨肉瘤细胞增殖和凋亡的影响,以期为拓展骨肉瘤的治疗新方法提供依据。
1 材料与方法
1.1 细胞培养
人类骨肉瘤U2OS细胞来自中山大学病理教研室,培养液为含10%胎牛血清(购自GIBCO公司)、100μg/mL链霉素和100U/mL青霉素的DMEM(购自GIBCO公司),培养于5%CO2培养箱(37℃)。均使用對数生长期的细胞作为实验细胞。
1.2 药物处理
姜黄素单体(购自Sigma公司)溶于DMSO,储存于-20℃备用,采用细胞培养液稀释为工作浓度。
1.3 台盼蓝拒染法检测细胞增殖
收集各种细胞,采用0.4%台盼蓝(Sigma公司产品)进行染色,死细胞染为蓝色,活细胞不染色,随机选择10个高倍视野(400×),记录活细胞数目。计算公式为细胞生长抑制率=[(对照组活细胞数-实验组活细胞数)/对照组活细胞数]×100%。实验重复三次取均值作为统计资料。
1.4 流式细胞术检测U2OS细胞凋亡
收集各组细胞,PBS清洗离心;70%乙醇固定过夜;细胞经10μmol/L的碘化丙啶(PI,Sigma公司产品)染色5min,4℃避光30min;上流式细胞仪(BD FACS Calibur,美国)用488nm激发光检测细胞DNA含量,LYSIS软件分析凋亡率。实验重复三次取均值作为统计资料。
1.5 DNA Ladder法检测细胞凋亡
收集细胞,PBS清洗后加入0.8mL的DNAzol(Invitrogen公司产品),室温放置数分钟,4℃离心15min,将上清移入EP管,加入0.4mL无水乙醇混合,4℃离心10min,弃上清后加入75%乙醇洗2次,待乙醇挥发干净后加入适量TE溶解基因组DNA,取适量DNA在含有EB的1.8%琼脂糖凝胶上电泳3小时,紫外线激发下观察梯形条带,并使用凝胶成像系统采集图像。
1.6 Westernblot法检测p53和caspase-3的表达
收集各组细胞,清洗离心后加入裂解液提取蛋白,采用BCA法定量,配胶加样,进行SDS-PAGE电泳,电转蛋白至PVDF膜,采用含5%脱脂奶粉的Tris-HCl缓冲盐溶液(TBST)4℃封闭过夜;p53和caspase-3抗体(均购自Santacruz公司)1∶1000稀释后室温封膜2h,TBST清洗,加入二抗4℃过夜,再次TBST清洗,最后ECL发光,显影,定影,收集图像。
1.7 统计学分析
采用SPSS15.0软件进行统计分析,计量资料以()表示,采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 姜黄素对骨肉瘤U2OS细胞增殖的影响
4、8、16、32、64μmol/L姜黄素处理U2OS细胞48h后,与对照组相比,U2OS细胞的增殖受到抑制,各组细胞生长抑制率如表1所示,随着姜黄素浓度的增加,生长抑制率随之增加,表现出明显剂量依赖性特征,与对照组比较,差异有统计学意义(P<0.05)。
2.2 姜黄素可诱导U2OS细胞凋亡
我们采用姜黄素16μmol/L处理U2OS细胞24、48、72h后,流式细胞术显示细胞凋亡率随之增加,表现出明显时间依赖性特征,与对照组比较,差异具有统计学意义(P<0.05)。见表2。
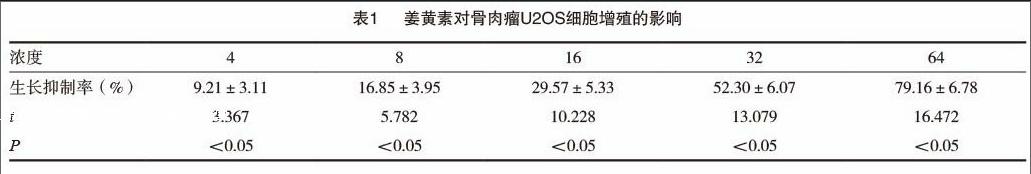
2.3 姜黄素诱导U2OS细胞产生DNA Ladder变化
细胞凋亡时,基因组DNA会在核小体单位之间的连接处断裂,电泳后可形成梯形电泳条带(DNA Ladder),是凋亡的特征性表现,也是鉴定凋亡的经典指标[9]。我们采用姜黄素(16μmol/L)处理U2OS细胞24、48、72h后,抽提细胞基因组DNA进行琼脂糖电泳,结果显示,与空白对照及其他各处理时间组相比,姜黄素(16μmol/L)处理72h的U20S细胞出现明显的梯形条带(图1),从形态学证明凋亡的发生。
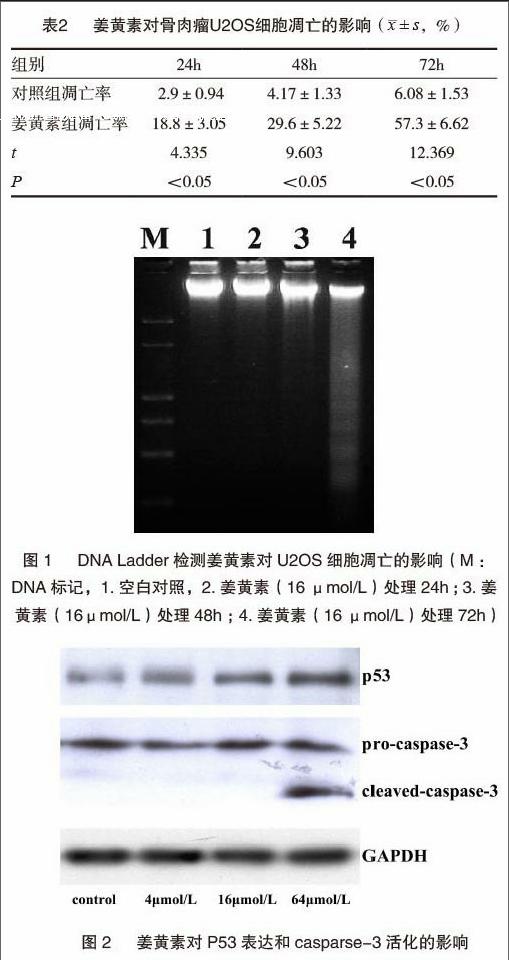
2.4 姜黄素上调p53的表达和caspase-3的活化
不同浓度的姜黄素(4μmol/L、16μmol/L、64μmol/L)处理U2OS细胞48h后,如图2所示,Westernblot结果显示抑癌基因p53蛋白水平的表达随浓度的增加逐渐升高,在64μmol/L组,caspase-3出现明显活化,裂解出17KD的活性caspase-3片段。
3 讨论
近千年来,作为极具中国特色的医学理论,中医药已经在治疗人类疾病方面积累了丰富经验,作为中医药的重要组成部分,以自然界植物为主要来源的中药也获得世界范围内的认可,并获得更为广阔的市场和前景[10-11]。目前,关于中药抗肿瘤的现代化研究已有不少报道,发现其抗肿瘤机制涉及凋亡、细胞周期调控、抑制转移、诱导分化等多个方面[12-14]。然而,在中草药提取物抗骨肉瘤方面罕有报道,并且相关研究选药较为局限,缺乏作用机制研究。
骨肉瘤是青少年最常见的骨组织原发恶性肿瘤,早期肺转移率高,传统手术+化疗对于部分不敏感患者疗效差,导致致死致残率高,预后不佳[15],因此开发新的抗骨肉瘤药物有着不言而喻的重要意义。我们采用中药姜黄的提取物姜黄素处理骨肉瘤U2OS细胞,发现其对U2OS细胞的增殖存在明显的抑制作用,并且抑制效应具有明显的剂量依赖关系。
CAD(caspase activated DNAase)是细胞中一种能切割染色质的核酸酶,可被caspase-3激活[16],CAD可识别DNA序列中的特定位点,将细胞基因组DNA在核小体单位之间的连接处剪断,从而形成180~200bp或其整数倍大小的寡核昔酸片段,经琼脂糖凝胶电泳会出现梯形电泳条带,是凋亡的特征性表现,因而成为鉴定凋亡的经典指标[9]。我们采用流式细胞术和基因组DNA电泳梯形条带实验,从两方面证实姜黄素具有诱导U2OS细胞凋亡的作用,并且呈明显的时间依赖关系。
p53是经典的抑癌基因[17],以p53为中心的凋亡通路包括Bax、Bcl-2、p21、Noxa等下游基因以及执行基因组剪切的caspase(半胱氨酸天门冬氨酸蛋白酶)家族和PARP等效应因子,是细胞内重要的凋亡通路[18-19]。我们发现姜黄素可明显增加p53的表达,从而活化p53凋亡通路。caspase家族中caspase-3是重要的效應成员,在正常情况下,caspase-3以无活性的酶原形式存在,经过p53通路对凋亡信号的转导而发生活化,裂解出17KD的活化片段,进一步激活其底物PARP,剪切基因组DNA,完成凋亡。
此外据文献报道姜黄素还具有其他抗肿瘤机制,如姜黄素可通过诱导细胞周期停滞和抑制AKT/mTOR信号通路的活化而抑制人类黑色素瘤细胞的增殖和侵袭[20];姜黄素可下调Wnt/β-catenin通路,从而抑制胶质瘤细胞增殖,并促进其凋亡[21];姜黄素与5-氟脲嘧定联合作用于鼻咽癌细胞,可抑制Bcl-2的表达,并增强Bax的表达,从而改变Bcl-2/Bax比率,并通过抑制NF-κB活性而诱导凋亡,最终抑制鼻咽癌CNE-2Z细胞的生长[22];姜黄素可抑制Akt的磷酸化同时增强p38MAPK磷酸化,从而在顺铂耐药的卵巢癌细胞中促进G2/M期细胞周期停滞和凋亡[23]。进一步研究姜黄素在抗骨肉瘤中的分子机制可为开发姜黄素治疗骨肉瘤提供依据。
[参考文献]
[1] Botter SM,Neri D,Fuchs B.Recent advances in osteosarcoma[J].Curr Opin Pharmacol,2014,16C(1):15-23.
[2] Daw NC,Billups CA,Rodriguez-Galindo C,et al. Metastatic osteosarcoma[J].Cancer,2006,106(2):403-412.
[3] 李子强,白晓光,杨志衡,等.姜黄素类化合物与生物活性研究进展[J].中国医药工业杂志,2015,46(3):305-311.
[4] 麦镇江.姜黄素的药理作用研究进展[J].中药材,2004,27(9):698-700.
[5] 许东晖,王胜,金晶,等.姜黄素的药理作用研究进展[J].中草药,2005,36(11):1737-1740.
[6] Panda AK,Chakraborty D,Sarkar I,et al.New insights into therapeutic activity and anticancer properties of curcumin[J].J Exp Pharmacol,2017,31(9):31-45.
[7] Liu G,Xiang T,Wu QF,et al.Curcumin suppresses the proliferation of gastric cancer cells by downregulating H19[J].Oncol Lett,2016,12(6):5156-5162.
[8] Chen H,Chen L,Wang L,et al.Synergistic effect of fenretinide and curcumin for treatment of non-small cell lung cancer[J].Cancer Biol Ther,2016,17(10):1-8.
[9] Gavrieli Y,Sherman Y,Ben-Sasson S.Identification of programmed cell death in situ via specific labeling of nuclear DNA fragmentation[J].J Cell Biol,1992,267(19):493-501.
[10] 赵欣,白伟,房涛,等.中药抗肿瘤机制的研究进展[J].广东医学,2014,35(3):466-469.
[11] 王晋,尹军强,沈靖南,等.32种中草药提取物体外抗骨肉瘤作用的筛选[J].南方医科大学学报,2006,26(9):1293-1296.
[12] 林锦璇,王鹏龙,褚福浩,等.新型姜黄素衍生物的合成及其抗癌活性研究[J].中国实验方剂学杂志,2014,20(7):113-117.
[13] Park BH,Lim JE,Jeon HG,et al.Curcumin potentiates antitumor activity of cisplatin in bladder cancer cell lines via ROS-mediated activation of ERK1/2[J].Oncotarget,2016,7(39):63870-63886.
[14] 倪晓辰,陈砚凝,武新慧,等.去甲氧基姜黄素对人膀胱癌T24细胞增殖及凋亡的影响研究[J].中国全科医学,2014,17(20):2353-2356.
[15] Bacci G,Lari S.Current treatment of high grade osteosarcoma of the extremity:review[J].J Chemother,2001,13(3):235-243.
[16] Li B,Liu H,Gong F,et al.Molecular epidemiologic correlation analysis between caspase3 gene polymorphism and gastric cancer susceptibility[J].Cell Biochem Biophys,2014,70(3):1647-1653.
[17] Levine AJ,Momand J,Finlay CA.The p53 tumour suppressor gene[J].Nature,1991,351(6326):453-456.
[18] Harris SL,Levine AJ.The p53 pathway:positive and negative feedback loops[J].Oncogene,2005,24(17):2899-2908.
[19] Cory S,Adams JM.The Bcl2 family:regulators of the cellular life-or-death switch[J].Nat Rev Cancer,2002,2(9):647-656.
[20] 韩晓东,周优优,鄭斯文,等.姜黄素对人黑色素瘤细胞株A375和C8161细胞AKT/Mtor信号通路的影响[J].中华皮肤科杂志,2015,48(6):382-386.
[21] 马光涛,张燕,李晨龙,等.姜黄素通过Wnt/β-catenin信号通路调控胶质瘤细胞增殖和凋亡的实验眼[J].中华神经外科杂志,2015,31(6):625-630.
[22] 吴强,庄坤,袁慧钧,等.姜黄素与5氟脲嘧定联合应用抗鼻咽癌的实验研究[J].哈尔滨医科大学学报,2015,48(5):368-372.
[23] Nathan MW,Karuppaiyah S,Vijay KK.Curcumin Induces G2/M Arrest and Apoptosis in Cisplatin-Resistant Human Ovarian Cancer Cells by Modulating Akt and p38MAPK[J].Cancer Biol Ther,2007,6(2):178-184.
(收稿日期:2017-04-26)
