卵巢早衰患者来源的诱导多能干细胞的建系、鉴定及诱导分化*
2016-07-05文艳飞蔡柳洪曾敏慧蒋满波
文艳飞, 蔡柳洪△, 何 文, 曾敏慧, 蒋满波
(1中山大学附属第三医院生殖医学中心, 广东 广州 510630;2中山大学孙逸仙纪念医院生殖医学中心, 广东 广州 510120; 3广东省中医院生殖科,广东 广州 510006)
卵巢早衰患者来源的诱导多能干细胞的建系、鉴定及诱导分化*
文艳飞1,蔡柳洪1△,何文1,曾敏慧2,蒋满波3
(1中山大学附属第三医院生殖医学中心, 广东 广州 510630;2中山大学孙逸仙纪念医院生殖医学中心, 广东 广州 510120;3广东省中医院生殖科,广东 广州 510006)
[摘要]目的: 建立和鉴定卵巢早衰(又称原发性卵巢功能不全,primary ovarian insufficiency,POI)患者来源的诱导多能干细胞(induced pluripotent stem cells,iPSCs),研究其向原始生殖细胞分化的潜能。方法: 将表达Oct4、Sox2、c-Myc、Klf4和Lin28基因的pEB-C5和表达SV40 T抗原的pEB-Tg质粒转染POI患者的外周血单个核细胞,将其重编程为iPSCs并检测其干细胞多能性特性。添加转化生长因子β1(transfroming growth factor-β1,TGF-β1)和骨形态发生蛋白 4(bone morphogenetic protein 4,BMP4)后,应用real-time PCR和 Western blot方法分别检测原始生殖细胞标志物的mRNA及蛋白表达水平。结果: 通过碱性磷酸酶染色、细胞免疫荧光、拟胚体及畸胎瘤形成检测,证明了POI患者外周血来源的iPSCs可成功向3胚层细胞分化并保持多能性。添加TGF-β1和BMP4后,诱导组原始生殖细胞特异性标志物干细胞生长因子受体(stem cell growth factor receptor, c-Kit)、发育多能性相关蛋白 3 (developmental pluripotency-associated 3,STELLA/DPPA3)和DEAD盒多肽 4(DEAD box polypeptide 4,VASA/DDX4)的mRNA水平明显升高(P<0.05),VASA/DDX4蛋白表达水平亦明显增加(P<0.05)。结论: POI患者外周血单个核细胞在体外可被成功诱导成无外源性基因整合的iPSCs,并且具有多能分化特性,添加TGF-β1和BMP4后可向原始生殖细胞分化。
[关键词]原发性卵巢功能不全; 诱导多能干细胞; 原始生殖细胞
卵巢早衰(premature ovarian failure;又称原发性卵巢功能不全, primary ovarian insufficiency,POI)是指育龄女性40岁以前出现卵巢功能减退,表现闭经、高促性腺激素和低雌激素状态[1],是女性不孕的常见原因。其诊断标准为40岁之前出现原发或继发性闭经至少4个月、血清卵泡刺激素(follicle-stimulating hormone,FSH)水平至少2次大于40 IU/L(2次检查时间间隔至少1个月)和低雌激素水平[2]。卵巢早衰的发病率大约为1%[3],近年来呈上升趋势。卵巢早衰的病因复杂,可能与遗传、免疫、环境和医源性因素相关[4]。目前常见的激素替代治疗无法解决患者的生育要求。而赠卵胚胎移植、卵巢或卵母细胞移植技术则面临伦理困境和来源匮乏的问题。2007年Takahashi 等[5]首次通过慢病毒转染技术将人成纤维细胞重编程为诱导多能干细胞(induced pluripotent stem cells,iPSCs),开创了人诱导多能干细胞建系的先河,为患者特异性的iPSCs建系奠定了基础。iPSCs具有干细胞的多能性分化特点,可以向任何一种体细胞包括向原始生殖细胞(primordial germ cells,PGCs)分化[6-7],这可能是治疗POI的方向之一。将iPSCs向生殖细胞诱导分化的方法多样,比如添加细胞因子Wnt3a、forskolin、维甲酸、内皮生长因子[8-9],或者与基质细胞(如卵巢颗粒细胞、卵巢成纤维细胞)共培养[10-11],或者添加卵泡液[12]等,但目前尚无被广泛接受的生殖细胞诱导方案,也无应用POI患者特异的iPSCs细胞进行定向诱导分化的报道。本研究在采用POI外周血细胞建立iPSCs的基础上,以细胞因子转化生长因子β1(transforming growth factor-β1,TGF-β1)和骨形态发生蛋白 4(bone morphogenetic protein 4,BMP4)为诱导剂,检测其是否能向原始生殖细胞分化,为POI患者特异iPSCs可能的临床应用提供理论依据。
材料和方法
1材料
Essential 8TM培养基、Matrigel、DMEM高糖培养基、胎牛血清(fetal bovine serum,FBS)、KnockoutTMDMEM高糖培养基、KnockoutTM血清替代物(KnockoutTMserum replacement,KSR)、青/链霉素、L-谷氨肽胺(GlutaMAXTM-I)、非必需氨基酸(nonessential amino acids, NEAA)、β-巯基乙醇、0.05%胰酶-EDTA、淋巴细胞分离液、胰岛素转硒乙醇胺和real-time PCR试剂盒均购于Invitrogen;牛血清蛋白、丝裂霉素C和秋水仙碱均购自Sigma;碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)购自PeproTech;电转试剂盒(Lonza);质粒大量提取试剂盒(Qiagen);Triton X-100、Tris-HCl和Tween-20(Amresco);4%多聚甲醛和正常山羊血清封闭液(BOSTER);Hoechst 33342(碧云天);Oct4抗体、Sox2抗体、Tra-1-60抗体、Nannog抗体和碱性磷酸酶(alkaline phosphatase, AKP)染色试剂盒(Sidansai);ROCK inhibitor(Selleck);质粒pEB-C5和pEB-Tg由美国Johns Hopkins大学Linzhao Cheng Lab惠赠;总RNA提取试剂盒购自Omega;逆转录试剂盒购自TaKaRa;VASA单克隆抗体购自Abcam;辣根酶标记的羊抗兔IgG购自KeyGEN;所有引物购自广州铂莱公司,具体序列见表1。

表1 引物序列
外周血30 mL取自同一例POI患者,告知患者实验目的并签署知情同意书。13.5 d昆明孕鼠由中山大学北校区动物中心提供,实验过程中对动物的处置符合医学伦理学的标准。项目的实施获得中山大学附属第三医院生殖医学伦理委员会批准。
2方法
2.1外周血单个核细胞分离及培养和核转染按照课题组之前已经建立的方法[13]进行。简单说来,以孕13.5 d昆明小鼠胚胎皮肤制备饲养层细胞,培养至第3代时用10 mg/L的丝裂霉素37 ℃处理3 h,吸弃培养液,0.05%胰酶+EDTA消化后离心,铺12孔板(每孔2×105)备用。以Ficoll Paque Plus分离POI外周血单个核细胞,体外培养8 d后进行转染。转染细胞数为2×106,利用Lonza试剂盒,电转缓冲液100 μL中加入8 μg pEB-C5和4 μg pEB-Tg,选择Nucleofector II的T-016程序,转染后第12~14天观察iPSCs克隆形成。
2.2G显带核型分析和iPSCs多能性鉴定G显带核型分析、iPSCs AKP染色和表面标志物免疫荧光检测(Oct4、Sox2、Nanog、Tra-1-60),以及iPSCs体内分化能力鉴定(畸胎瘤形成)和体外分化能力鉴定(体外拟胚体形成)根据课题组之前建立的方法进行[13]。
2.3 iPSCs向原始生殖细胞诱导分化将细胞分为对照组和诱导组,诱导组用去bFGF的iPSCs培养液添加1 μg/L TGF-β1预诱导2 d,第3天添加50 μg/L BMP4培养5 d,对照组不添加上述细胞因子,每2 d更换1次培养基。诱导7 d后分别收集2组细胞总RNA和蛋白。
2.4Real-time PCR检测原始生殖细胞标志物mRNA表达总RNA提取试剂盒收集诱导组和对照组细胞的RNA,按照TaKaRa逆转录试剂盒说明书合成cDNA,采用SYBR Green RT-PCR试剂盒,在PCR仪(ABI 7500)上进行3步法扩增,反应条件为95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min,共40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,60 ℃ 15 s。表达水平以2-ΔΔCt值表示,计算Oct4、c-Kit、STELLA和VASA与内参照β-actin的比值。
2.5Western blot检测原始生殖细胞标志蛋白VASA的表达用含PMSF的裂解液裂解2组蛋白,酶标仪测定蛋白浓度,以每孔20 μL上样,进行SDS-PAGE,然后将凝胶转至PVDF膜上,用含5% BSA的TBST 37 ℃封闭1 h。加I抗VASA兔单克隆抗体(1∶1 000),内参照I 抗β-actin鼠单克隆抗体(1∶1 000),4 ℃孵育过夜,加辣根酶标记羊抗兔IgG(1∶2 000)和辣根酶标记羊抗鼠IgG(H+L)(1∶2 000),室温孵育1 h。采用化学发光法检测抗原,并采用凝胶成像扫描系统扫描观察VASA蛋白表达。
3统计学处理
所有实验均重复至少3次,结果以均数±标准差(mean±SD)表示,采用t检验进行分析,以P<0.05为差异有统计学意义。
结果
1POI患者基本资料
外周血单个核细胞来自1例卵巢早衰患者,年龄25岁,因闭经1年就诊,第1次性激素检查结果示FSH 93.99 IU/L,LH 43.35 IU/L;第2次性激素结果示FSH 70.8 IU/L,LH 50.29 IU/L,无特殊家族史及遗传病史。
2POI患者特异iPSCs的建系和鉴定
从外周血分离单个核细胞,核转染质粒后第12~14天可见呈类圆形的小克隆,与周围的饲养层细胞分界清晰,继续培养至第19天,可见克隆逐渐增大,边界清晰,可机械法挑克隆进行传代。
Oct4、Sox2、Nanog和Tra-1-60为胚胎干细胞表达的特异性蛋白,POI患者外周血来源的iPSCs免疫荧光染色结果也表达上述干细胞的特异性蛋白,见图1。
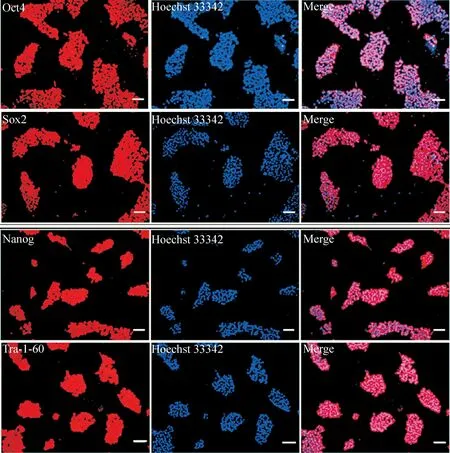
Figure 1.Immunofluorescence staining of the POI-specific pluripotent protein in the iPSCs. The scale bar=100 μm.
图1卵巢早衰患者特异性iPSCs多能性蛋白免疫荧光染色结果
碱性磷酸酶染色是鉴定iPSCs分化状态的可靠方法,处于未分化状态的iPSCs可着色。iPSCs在体外可形成拟胚体,在体内可形成畸胎瘤,可向内、外、中3个胚层的任一种细胞分化,镜下可见血管、神经和软骨细胞,见图2。
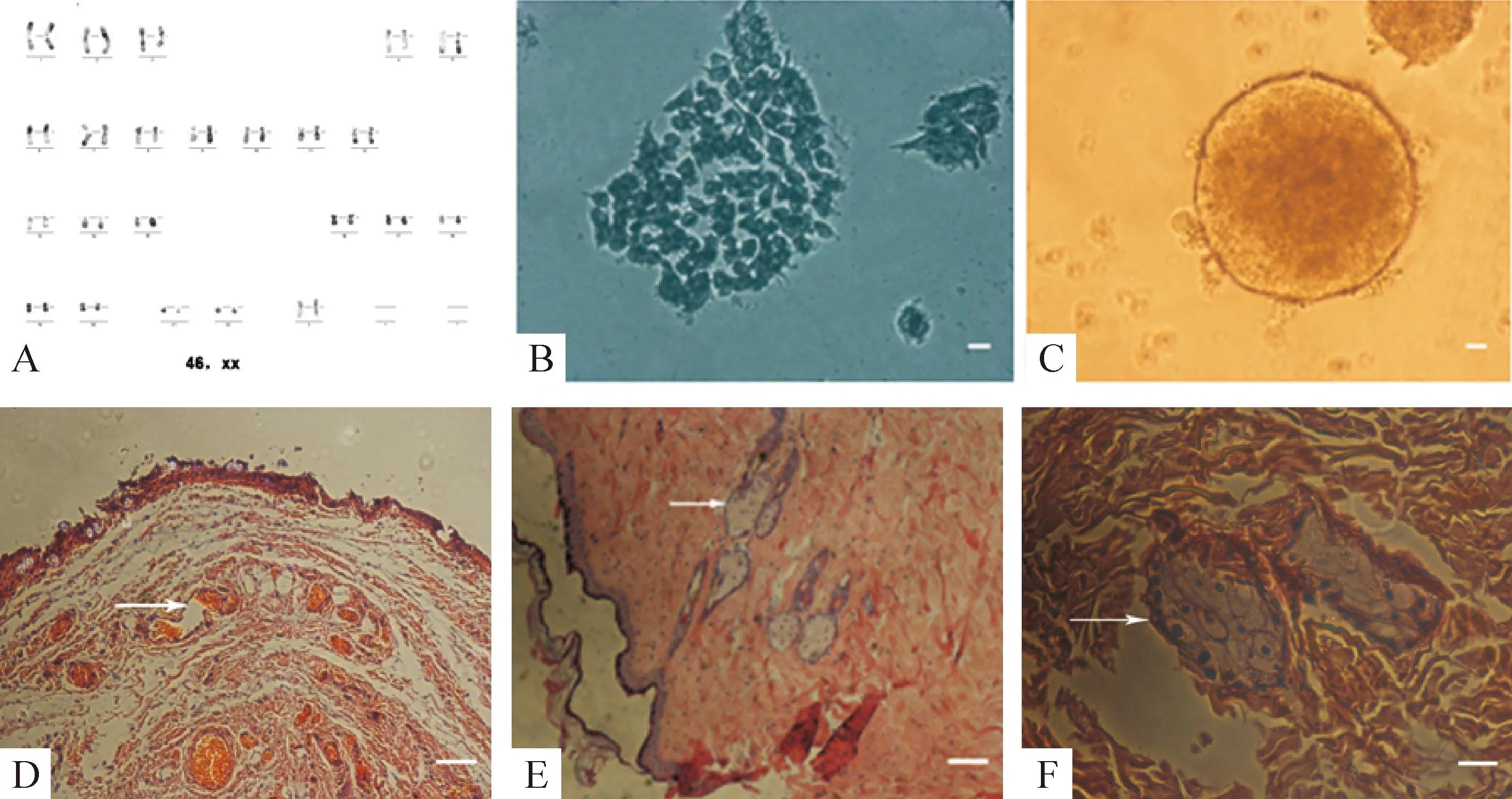
Figure 2.Identification of the POI-specific iPSCs. The scale bar=100 μm. A: karyotype analysis; B: alkaline phosphatase staining; C: embryonic body formation; D: endoderm of teratoma; E: ectoderm of teratoma; F: mesoderm of teratoma.
图2POI患者特异性iPSCs 鉴定
3POI患者特异iPSCs向原始生殖细胞的诱导分化
诱导7 d后,与对照组相比,诱导组原始生殖细胞标志物c-Kit、STELLA和VASA表达量明显升高,两组差异有统计学意义(P<0.05),而Oct4组间差异无统计学意义,见图3。同时,诱导组的VASA蛋白表达水平明显升高,对照组VASA蛋白表达较低,见图4。

Figure 3.Detection of primordial germ cell marker expression with real-time PCR. Mean±SD.n=4.*P<0.05vscontrol.
图3Real-time PCR检测原始生殖细胞标志物的表达变化
讨论
卵巢早衰是不孕症门诊中的常见病之一。POI患者虽有自发性排卵并成功妊娠,但概率也只有5%~10%[14]。目前对卵巢早衰的治疗方法主要是根据患者有无生育要求选择激素替代治疗[15]、赠卵胚胎移植[16]或低温冻存技术[17](胚胎冻存、卵母细胞和卵巢组织冻存技术)。而激素替代治疗只能改善患者的围绝经期症状,对不孕症的治疗效果不显著;赠卵胚胎移植和低温冻存技术虽然在一定程度上有效解决患者的生育问题,但由于面对来源匮乏、宗教信仰和伦理道德问题在一定程度上受到限制。

Figure 4.The expression of VASA protein detected by Western blot. Mean±SD.n=3.*P<0.05vscontrol.
图4Western blot检测VASA蛋白表达的变化
2007年iPSCs技术的兴起,为人类研究难治性疾病发病机制、新药研发提供了细胞模型,也为卵巢早衰的治疗带来新的希望。诱导多能干细胞来源广泛,本研究采用的外周血单个核细胞与其它来源的如皮肤成纤维细胞、羊水细胞[12, 18]等体细胞相比,具有极大的优势,如来源方便、创伤性小,且在体外诱导时间短、诱导过程中发生突变的可能性最小[19-20],这使外周血成为本研究iPSCs的主要来源,而且卵巢早衰患者外周血易获得且具有特异性,无免疫排斥反应,也无道德伦理问题。
POI的致病因素可能与遗传因素、医源性因素、免疫性因素和环境因素有关。对于遗传因素引起的POI患者,需进行与POI相关基因的家族性检测,从而修饰相关基因,达到治疗目的;而医源性、免疫性和环境因素引起的POI,实质上只是引起性腺器官的损害,从而造成一系列内分泌紊乱和生育问题,而抽取这类患者的外周血,可以去除患者自身免疫因素和外源性因素造成的影响,从而获得无缺陷的POI患者来源的iPSCs,在应用方面免除了因POI缺陷造成的危险。
加上本研究所采用的无外源性基因整合的改良oriP/EBNA1质粒载体[21],包括pEB-C5和pEB-Tg,前者表达Oct4、Sox2、c-Myc、Klf4和Lin28重编程因子,后者表达SV40 T抗原,这一改良质粒通过顺式作用原件oriP和反式作用因子EBNA1基因可使oriP/EBNA1载体独立于宿主基因组外进行稳定复制,并随着iPSCs细胞的不断增殖,oriP/EBNA1载体在细胞第10~12代后可自行消失,并且显著提高了细胞重编程效率。
近年来国内外有关用iPSCs向生殖细胞诱导分化来治疗卵巢早衰的报道。2009年Park等[22]将皮肤成纤维细胞来源的iPSCs通过与性腺细胞共培养,诱导其向PGCs分化;2013年Lai等[23]将人羊水细胞重编程为羊水干细胞,并植入卵巢早衰小鼠模型的卵巢中,最终有卵子产生,成功修复了卵巢功能;2015年Leng等[8]将卵巢早衰患者皮肤成纤维细胞来源的iPSCs在体外通过添加细胞因子诱导其向PGCs分化;同年Irie等[24]在体外通过繁琐的诱导方法和添加至少5种细胞因子将人iPSCs向原始生殖细胞分化。以上研究表明iPSCs在体内可借助卵巢微环境的作用,使得干细胞向原始生殖细胞,甚至向卵母细胞分化,但在体外,可能由于缺少内环境的影响,目前只能将iPSCs诱导至原始生殖细胞阶段,未进入减数分裂,使iPSCs向女性生殖细胞诱导分化陷入瓶颈。
原始生殖细胞起源于移植后6.25 d 的胚胎外胚层[25],为促使iPSCs向外胚层分化, TGF家族成员TGF-β1有利于维持干细胞的自我更新并使iPSCs向外胚层样细胞转化,获得向PGCs分化的能力[24]。 BMP4是TGF超家族最大成员,胚外外胚层分泌BMP4,第5.5天至6.5天的胚外胚层在BMP4的诱导下可向原始生殖细胞分化[25]。TGF-β和BMP4受体活化后通过激活胞内Smads因子将信号转至细胞核,促进外胚层向原始生殖细胞的形成和分化[26]。本研究通过TGF-β1和BMP4的联合作用,通过拟胚体阶段,使拟胚体向原始生殖细胞分化,实验结果表明在诱导组表达原始生殖细胞早期阶段标志物Oct4、STELLA、c-Kit和晚期阶段标志物VASA。Oct4的表达对于原始生殖细胞的存活有重要作用,而STELLA则是iPSCs向原始生殖细胞转化的重要标志,VASA的表达说明细胞处于原始生殖细胞晚期、减数分裂前阶段[27]。
本研究利用POI患者外周血来源的单个核细胞重编程为iPSCs,在TGF-β1和BMP4联合作用下,通过拟胚体阶段诱导iPSCs向原始生殖细胞阶段分化,患者特异性来源的iPSCs不仅具有无免疫排斥反应、继承患者遗传物质,而且诱导方法简便有效,这为卵巢早衰治疗的研究提供细胞模型和新的治疗方法。但是本研究生成的原始生殖细胞尚未进入减数分裂阶段,这与国内外大量体外诱导生殖细胞的研究一致,可能与体外诱导缺乏成熟生殖细胞需要的内环境有关,要想攻克卵巢早衰这一难治性疾病,还需要更深入的研究其向卵母细胞的分化。
[参考文献]
[1]Shelling AN. Premature ovarian failure [J]. Reproduction, 2010, 140(5): 633-641.
[2]De Vos M, Devroey P, Fauser BC. Primary ovarian insufficiency [J]. Lancet, 2010, 376(9744): 911-921.
[3]Coulam CB, Adamson SC, Annegers JF. Incidence of premature ovarian failure [J]. Obstet Gynecol, 1986, 67(4): 604-606.
[4]Bricaire L, Laroche E, Bourcigaux N, et al. Premature ovarian failures[J]. Presse Med, 2013, 42(11): 1500-1507.
[5]Takahashi K, Tanabe K, Ohnuki M, et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors [J]. Cell, 2007, 131(5): 861-872.
[6]Hayashi K, Saitou M. Generation of eggs from mouse embryonic stem cells and induced pluripotent stem cells [J]. Nat Protoc, 2013, 8(8): 1513-1524.
[7]Hayashi K, Ogushi S, Kurimoto K, et al. Offspring from oocytes derived frominvitroprimordial germ cell-like cells in mice [J]. Science, 2012, 338(6109): 971-975.
[8]Leng L, Tan Y, Gong F, et al. Differentiation of primordial germ cells from induced pluripotent stem cells of primary ovarian insufficiency [J]. Hum Reprod, 2015, 30(3): 737-748.
[9]Li N, Pan S, Zhu H, et al. BMP4 promotes SSEA-1+hUC-MSC differentiation into male germ-like cellsinvitro[J]. Cell Prolif, 2014, 47(4): 299-309.
[10]Richards M, Fong CY, Bongso A. Comparative evaluation of differentinvitrosystems that stimulate germ cell diffe-rentiation in human embryonic stem cells[J]. Fertil Ste-rility, 2010, 93(3): 986-994.
[11]Zhang J, Li H, Wu Z, et al. Differentiation of rat iPS cells and ES cells into granulosa cell-like cellsinvitro[J]. Acta Biochim Biophys Sin (Shanghai), 2013, 45(4): 289-295.
[12]Yu X, Wang N, Qiang R, et al. Human amniotic fluid stem cells possess the potential to differentiate into primordial follicle oocytesinvitro[J]. Biol Reprod, 2014, 90(4): 73.
[13]蒋满波, 曾敏慧, 章钧, 等. 地中海贫血"integration-free"诱导多能干细胞的建立及造血分化的研究 [J]. 中国病理生理杂志, 2015, 31(2): 245-249.
[14]van Kasteren YM, Schoemaker J. Premature ovarian failure: a systematic review on therapeutic interventions to restore ovarian function and achieve pregnancy [J]. Human Reprod Update, 1999, 5(5):483-492.
[15]Sassarini J, Lumsden MA, Critchley HO. Sex hormone replacement in ovarian failure: new treatment concepts [J]. Best Practice Res Clin Endocrinol Metab, 2015, 29(1):105-114.
[16]Robles A, Checa MA, Prat M, et al. Medical alternatives to oocyte donation in women with premature ovarian fai-lure: a systematic review[J]. Gynecol Endocrinol, 2013, 29(7):632-637.
[17]Silber SJ, Grudzinskas G, Gosden RG. Successful pregnancy after microsurgical transplantation of an intact ovary[J]. New Engl J Med, 2008, 359(24): 2617-2618.
[18]冯年花, 谢安, 娄远蕾, 等. 人诱导性多能干细胞向神经干细胞分化的方法探讨[J]. 中国病理生理杂志, 2010, 26(8):1662-1664.
[19]Su RJ, Neises A, Zhang XB. Generation of iPS cells from human peripheral blood mononuclear cells using episomal vectors [J]. Methods Mol Biol, 2014 Nov 18.[Epub ahead of print]
[20]Yamanaka S. Patient-specific pluripotent stem cells become even more accessible [J]. Cell Stem Cell, 2010, 7(1): 1-2.
[21]Chou BK, Mali P, Huang X, et al. Efficient human iPS cell derivation by a non-integrating plasmid from blood cells with unique epigenetic and gene expression signatures [J]. Cell Res, 2011, 21(3): 518-529.
[22]Park TS, Galic Z, Conway AE, et al. Derivation of primordial germ cells from human embryonic and induced pluripotent stem cells is significantly improved by coculture with human fetal gonadal cells [J]. Stem Cells, 2009, 27(4): 783-795.
[23]Lai D, Wang F, Chen Y, et al. Human amniotic fluid stem cells have a potential to recover ovarian function in mice with chemotherapy-induced sterility [J]. BMC Dev Biol, 2013, 13:34.
[24]Irie N, Weinberger L, Tang WW, et al. SOX17 is a critical specifier of human primordial germ cell fate [J]. Cell, 2015, 160(1-2): 253-268.
[25]Hayashi K, De Sousa lopes SM, Surani MA. Germ cell specification in mice [J]. Science, 2007, 316(5823): 394-396.
[26]Saha S, Ji L, De Pablo JJ, et al. TGFβ/Activin/Nodal pathway in inhibition of human embryonic stem cell differentiation by mechanical strain [J]. Biophys J, 2008, 94(10): 4123-4133.
[27]Hu X, Lu H, Cao S, et al. Stem cells derived from human first-trimester umbilical cord have the potential to differentiate into oocyte-like cellsinvitro[J]. Int J Mol Med, 2015, 35(5):1219-1229.
(责任编辑: 林白霜, 罗森)
Generation, identification and differentiation of primary ovarian insufficiency patient-derived iPSCs
WEN Yan-fei1, CAI Liu-hong1, HE Wen1, ZENG Min-hui2, JANG Man-bo3
(1CenterforReproductiveMedicine,TheThirdAffiliatedHospitalofSunYat-senUniversity,Guangzhou510630,China;2CenterforReproductiveMedicine,SunYat-senMemorialHospitalofSunYat-senUniversity,Guangzhou510120,China;3DepartmentofReproductiveMedicine,GuangdongProvincialHospitalofChineseMedicine,Guangzhou510006,China.E-mail:cailh@mail.sysu.edu.cn)
[ABSTRACT]AIM: To generate and identify primary ovarian insufficiency (POI) patient-derived induced pluripotent stem cells (iPSCs) and to explore their differentiation potential to primordial germ cells. METHODS: Plasmid pEB-C5 expressing reprogramming factors Oct4, Sox2, c-Myc, Klf4 and Lin28, and plasmid pEB-Tg expressing SV40 T antigen, were transfected into peripheral blood mononuclear cells (PBMCs) derived from POI patients at the same time. PBMCs were reprogrammed into iPSCs, and the pluripotency of the cells was identified. After supplementation of transforming growth factor-β1 (TGF-β1) and bone morphogenetic protein 4 (BMP4), the mRNA and protein expression of primordial germ cell markers was detected by real-time PCR and Western blot, respectively. RESULTS: iPSCs derived from the PBMCs of POI patient differentiated into 3-germ layer cells and maintained pluripotency by the detection of alkaline phosphatase staining, immunofluorescence, embryoid body and teratoma formation. After addition of TGF-β1 and BMP4, the primordial germ cell markers, including stem cell growth factor receptor (c-Kit), developmental pluripotency-associated 3 (STELLA/DPPA3) and DEAD box polypeptide 4 (VASA/DDX4) were increased at mRNA level (P<0.05), and VASA/DDX4 was also up-regulated at protein level in induced group. CONCLUSION: PBMCs of POI patient are reprogrammed into integration-free iPSCs in vitro and maintain pluripotency. They differentiate into primordial germ cells by adding TGF-β1 and BMP4.
[KEY WORDS]Primary ovarian insufficiency; Induced pluripotent stem cells; Primordial germ cells
[文章编号]1000- 4718(2016)01- 0140- 06
[收稿日期]2015- 10- 14[修回日期] 2015- 11- 17
*[基金项目]国家自然科学基金资助项目(No. 81170533);广东省科技计划(No. 2013B021800091);广东省大学生创新计划(No. 20132049)
通讯作者△Tel: 020-85256335; E-mail: cailh@mail.sysu.edu.cn
[中图分类号]R363
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.01.024
