一种改良的间歇性低氧细胞模型方法*
2016-07-05蔡晓红洪芳芳陈利亚梅红芳王红霞李秀翠梁冬施温正旺
蔡晓红, 洪芳芳, 陈利亚, 梅红芳, 林 晶, 王红霞, 李秀翠, 梁冬施, 温正旺
(1温州医科大学附属第二医院、育英儿童医院儿童呼吸科, 浙江 温州 325027;2焦作市人民医院, 河南 焦作 454150)
·实验技术·
一种改良的间歇性低氧细胞模型方法*
蔡晓红1△,洪芳芳1,陈利亚1,梅红芳1,林晶1,王红霞2,李秀翠1,梁冬施1,温正旺1
(1温州医科大学附属第二医院、育英儿童医院儿童呼吸科, 浙江 温州 325027;2焦作市人民医院, 河南 焦作 454150)
[摘要]目的: 研制细胞氧舱,建立间歇性低氧(intermittent hypoxia,IH)细胞模型并进行验证。方法: 定制细胞实验舱和空气模拟对照舱,根据氧分压-时间曲线设计间歇低氧模式。将人肺腺癌细胞A549随机分为正常对照(Con)组、间歇低氧6 h(6IH)组、间歇低氧9 h(9IH)组、空气模拟对照6 h(6AC)组、空气模拟对照9 h(9AC)组、持续低氧4 h(4SH)组、持续低氧6 h(6SH)组。暴露结束后光镜下观察细胞形态改变,real-time PCR、免疫组化法检测缺氧诱导因子1α(HIF-1α)的mRNA和蛋白表达变化。结果: 该模型间歇低氧模式为5% O2 60 min-20% O2 30 min,6个循环。与Con组比较,6AC、9AC组为原本细胞形态,6IH、9IH和6SH组部分细胞出现突起、变圆,胞质中出现较多黑色颗粒,细胞边界模糊,而4SH组未见明显异常。与6IH组比较,9IH组HIF-1α的mRNA和蛋白表达量明显增加(P<0.05);6IH和9IH组HIF-1α的mRNA 和蛋白分别高于4SH和6SH组(P<0.05);6AC、9AC组与Con组比较差异不显著。结论: 5% O2 60 min-20% O2 30 min的间歇性低氧-复氧细胞模式能模拟阻塞性睡眠呼吸暂停低通气综合征病理生理过程,是研究该疾病较理想的细胞模型。
[关键词]间歇性低氧; 人肺腺癌细胞; 缺氧诱导因子1α
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome,OSAHS)是一种常见的睡眠障碍性疾病,主要发病机制为间歇性低氧(intermittent hypoxia, IH),这种低氧模式为常氧和低氧交替出现,平均每2~5 min循环1次,每次低氧时间约10~40 s,比持续低氧对人体损害更严重。
OSAHS疾病研究中,大多学者利用手术或氧舱等建立间歇性低氧动物模型,从整体水平研究OSAHS发病机制[1-2]。与动物实验相比,体外细胞实验具有影响因素单一,人为可操控性大,个体间差异小等优点,但由于氧气弥散困难及细胞氧耗等问题,难以制备高效和符合OSAHS病理生理特点的细胞模型,因此,建立有效的OSAHS细胞模型,尚需进一步探索。本研究自主研发设计间歇性低氧细胞模型,并通过监测培养基中溶解氧、A549细胞形态变化及缺氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)表达变化验证此模型。
材料和方法
1细胞
人肺腺癌细胞系A549细胞株购自上海中科院细胞生物研究所。
2主要试剂
RPMI-1640购自Gibco;胎牛血清购自HyClone;TRIzol Reagent购自lnvitrogen;逆转录试剂盒购自Thermo;LightCyler480 SYBR Green I Master购自Roche;兔抗人HIF-1α单克隆抗体、HRP标记羊抗兔 II 抗、PV-9000、DAB显色剂、山羊血清封闭液、PBS均购自北京中杉金桥试剂公司。
3主要方法
3.1细胞氧舱制备氧舱的建立参照Richard等[3]的方法加以改进。氧舱主要由以下部分组成:实验舱、空气模拟对照舱、PLC及电脑控制系统、氧气管道、氮气管道、二氧化碳管道、空气输注管道、气体减压阀、气体流量控制阀和溶解氧电极。实验舱侧壁设有氧气、氮气和二氧化碳进气单向阀门,空气模拟对照舱设有空气和二氧化碳单向阀门,均由程序控制电磁阀开关,舱内压力始终保持常压。通过PLC及电脑控制系统编程不同程序,调控舱内氧气浓度,模拟不同的IH环境。利用氧气和二氧化碳浓度检测仪检测实验箱和对比箱中的氧气和二氧化碳浓度。采用溶解氧电极监测细胞层面上方1 mm处培养基中溶解氧浓度。细胞氧舱示意图见图1。

Figure 1.The schematic diagram of the cell oxygen chamber.
图1细胞氧舱示意图
3.2间歇性低氧模式设定维持实验舱和对照舱温度为37 ℃,CO2含量为5%。6孔板每孔添加3 mL培养基,将舱内氧浓度从20%迅速降至5%,监测培养基中氧分压变化,绘制氧分压-时间曲线。根据曲线特点,当培养基中氧分压降至(56±4)mmHg时维持10~40 s,统计所需时间。再将舱内氧浓度从5%升至20%,记录培养基中氧分压达到正常所需时间。根据记录的低氧和复氧时间,结合人体OSAHS疾病特点,设定该模型间歇性低氧的循环频率和时间。
3.3细胞培养A549细胞株复苏后接种至底面积为25 cm2的培养瓶,加入含10%胎牛血清、1×105U/L青霉素和1×105U/L链霉素的RPMI-1640培养基,置于5% CO2、37 ℃培养箱内生长。每隔2 d传代1次。
3.4分组及模型建立取传代2~3代后稳定对数期生长细胞,消化后吹打成单细胞悬液,调整细胞浓度为3×109/L,按每孔2 mL接种于6孔板, 48 h后用于实验,实验前更换无血清培养基。将细胞随机分为7组:正常对照(control, Con)组;间歇低氧6 h组(6IH),即5% O2低氧60 min,20% O2复氧30 min,低氧和常氧交替进行,共暴露6 h;间歇低氧9 h组(9IH);空气模拟对照6 h(6 h simulated air control, 6AC)组;空气模拟对照9 h(9AC)组;持续低氧4 h(4 h sustained hypoxia,4SH)组:即持续5% O2暴露4 h;持续低氧6 h(6SH)组。
3.5观察细胞形态造模完成后迅速取出,倒置显微镜下观察细胞形态、密度变化及死亡情况。细胞图像通过显微镜(×400)摄取。每组独立的实验均采集超过30个区域的细胞。
3.6Real-time PCR法按照TRIzol试剂说明书操作提取细胞总RNA,并测定RNA浓度及鉴定其纯度。在20 μL逆转录体系中加入总RNA 0.1 ng~5 μg,合成cDNA第一链,反应42 ℃ 60 min,70 ℃ 5 min后终止反应。取cDNA 1 μL,上、下游引物(引物序列见表1)各0.5 μL,LightCycle480 SYBR Green I Master 5 μL,dH2O 3 μL构成PCR体系。95 ℃ 5 min;95 ℃ 10 s,60 ℃ 10 s,72 ℃ 10 s,45个循环。扩增后凝胶电泳观察β-actin、HIF-1α扩增引物特异性,每个样本至少重复3次。记录PCR产物荧光信号达到所设定阈值时所经历的循环数,既Ct值,采用2-ΔΔCt进行统计处理,结果代表目的基因的相对表达量,以对照组为校正样本。

表1 引物序列
3.7免疫组化实验4%多聚甲醛固定20 min,0.3% Triton X-100孵育10 min,3% H2O210 min,山羊血清37 ℃封闭30 min,I 抗(1∶200)4 ℃过夜。PBS洗涤3×5 min, II 抗37 ℃ 30 min,辣根酶标记链霉卵白素工作液37 ℃ 10 min,DAB显色,苏木素复染,脱水,透明,封片,观察。细胞图像通过显微镜(×400)摄取。每组独立的实验均采集超过30个区域的细胞。
4统计学处理
正态性计量资料以均数±标准差(mean±SD)表示,两组间比较采用t检验,多组间比较采用单因素方差分析(one-way ANOVA),两两比较方差齐时采用Bonferroni-t检验,不齐时采用Dunnett’s T3检验。以P<0.05为差异有统计学意义。
结果
1间歇性低氧细胞模型的建立
1.1舱内气体实际浓度实验舱和空气模拟对照舱内CO2实际浓度为(4.89±1.02)%、(5.29±0.48)%;实际O2浓度为(4.47±0.52)%、(20.03±1.08)%。
1.2培养基中氧分压变化将舱内氧浓度从20%降至5%,待培养基中氧分压达到(56±4)mmHg所需时间为(59.48±0.32)min。当培养基中氧分压达到(56±4)mmHg时,维持10~40 s,迅速将舱内氧浓度从5%升至 20%,待培养基中氧分压升至(155±4)mmHg 时所需时间为(28.00±0.48)min。根据OSAHS睡眠模式间歇低氧病理生理的特点,设置该模型间歇低氧/复氧条件为5% O260 min-20% O230 min。氧舱及培养基中实际氧分压见图2。
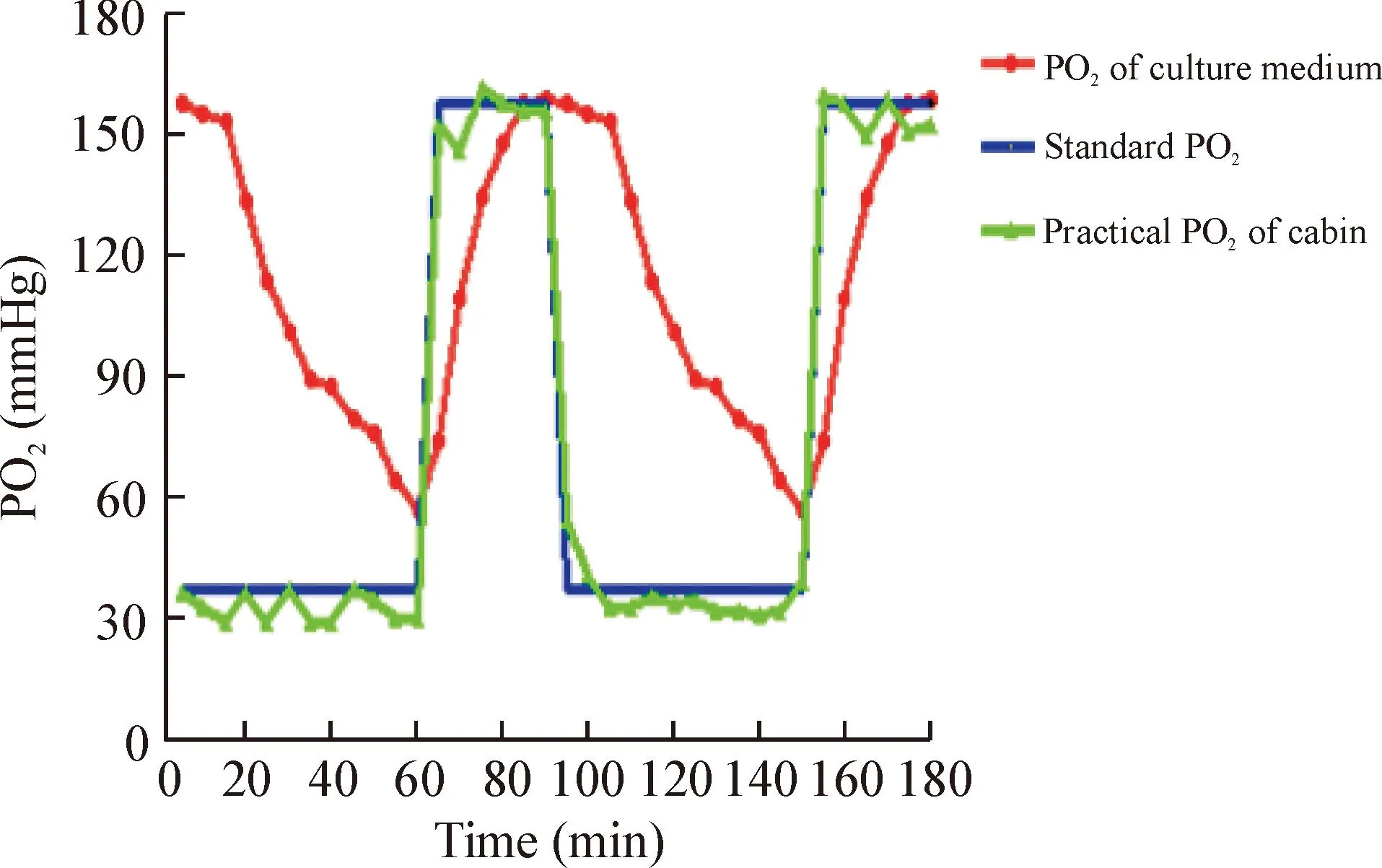
Figure 2.The actual level of oxygen partial pressure in the oxygen chamber and culture medium.
图2氧舱及培养基中实际氧分压水平
2间歇性低氧细胞模型的验证
2.1A549细胞形态的变化光镜下,部分6IH、9IH和6SH组的细胞正常形态破坏,细胞出现突起、变圆,胞质中较多颗粒聚集,细胞边界不清,融合成片,部分死细胞悬浮在培养基中,其中9IH组的变化最明显。Con、6AC、9AC及4SH组的细胞形态基本正常。各组细胞形态见图3。
2.2Real-time PCR法检测HIF-1α的mRNA表达与相应对照组相比,IH组HIF-1α的mRNA表达增加(P<0.05);9IH组HIF-1α的mRNA表达量明显高于6IH组(P<0.05);6IH、9IH组HIF-1α的mRNA 表达量分别高于4SH、6SH组(P<0.05);6AC、9AC组与Con组相比差异无统计学意义,各组HIF-1α的mRNA表达情况见图4。

Figure 3.The changes of cell morphology in the A549 cells under different conditions.
图3A549细胞形态学变化的观察

Figure 4.The mRNA expression of HIF-1α in the A549 cells under different conditions. Mean±SD.n=3.◆P<0.05vscontrol group;#P<0.05vs6IH;★P<0.05vs4SH group;※P<0.05vs6SH group.
图4各组A549细胞HIF-1α的mRNA相对表达量
2.3免疫组化法检测HIF-1α的蛋白表达 HIF-1α主要在细胞核中表达,阳性细胞细胞核呈现棕色或棕褐色。IH组HIF-1α的蛋白表达上调,9IH组更明显(P<0.05)。6IH和9IH组高于相应的4SH和6SH组(P<0.05)。与Con组相比,6AC、9AC组HIF-1α的蛋白表达无显著差异,各组HIF-1α蛋白表达情况见图5。
讨论
OSAHS是睡眠过程中上气道出现反复塌陷或阻塞引起呼吸暂停、通气不足和睡眠片段化的一种综合征,其发病率较高,可导致机体多器官功能障碍。成人重度OSAHS与高血压、心血管并发症密切相关。儿童OSAHS主要表现为学习记忆力、行为执行力等的下降,出现行为和认知功能损害,导致患儿学习和社会适应能力下降。OSAHS的主要病理生理机制为间歇性低氧。

Figure 5.The protein expression of HIF-1α in the A549 cells under different conditions(×400).
图5A549细胞HIF-1α蛋白的表达情况
随着对OSAHS研究的逐渐深入,自1992年Fetcher首次报道慢性间歇性低氧大鼠模型以来,陆续有建立间歇性低氧/复氧的动物模型的报道。目前应用最多的是常压低氧氧舱模型[4]。本课题组前期自主设计的间歇低氧氧舱模型,模型中大鼠动脉最低氧分压和氧饱和度分别为(44±3)mmHg、(76±3)%,60 s-10% O2、90 s-10% O2和60 s-5% O2分别模拟了轻、中、重度OSAHS[5]。
然而,间歇低氧细胞模型的研究进展缓慢,目前已建立的两种间歇性低氧细胞模型都有一定的局限性,导致推广困难。低氧培养基交替暴露细胞模型[6]通过直接改变培养基中氧浓度水平,细胞交替暴露在低氧和正常氧浓度培养基中,通过蠕动泵控制时间,建立间歇低氧模型,该模型设计复杂且气源大多采用混合气体,不易获得。低氧气体直接暴露细胞模型[3]通过改变舱内氧气浓度和频率,模拟不同间歇低氧/复氧模式,该培养箱密闭性强,舱内气体变化缓慢,气体流量大,明显增加了实验的干扰。
与动物模型不同,氧舱内的气相条件并非细胞的直接暴露条件,细胞生长在几毫米厚的培养基中,溶解在培养基中的氧气受气体扩散和自由对流等的影响。氧气为惰性气体,贴壁细胞生长在培养皿底端,细胞层面氧气浓度改变缓慢,气体扩散和对流效应是影响培养基底部氧浓度的主要因素。气体在液体培养基中的传送效率与培养基顶部氧分压和扩散时间呈正比,与培养基厚度呈反比[7]。培养基中PO2计算见下式:
公式中Pb(t) 是培养基中 PO2,P0是初始化PO2,P1为0时点后PO2,D为扩散率,δ为培养基厚度。
Baumgardner等[8]通过减少细胞培养基厚度和增加培养基流动性提高氧气弥散效率,成功模拟了OSAHS快速低氧-复氧循环模式。但该模型中培养基不断流动,液体剪切力可能影响细胞功能。且该模型承载细胞量少,难完成细胞转录和翻译等多方面研究。
理论上培养基底部氧分压即细胞暴露实际水平,但由于代谢等需要,细胞实际暴露氧分压要低于培养基底部。Therade-Matharan等[9]指出多能干细胞在正常大气环境中生长24 h,培养基中溶解氧浓度降低约5%。本研究充分考虑细胞耗氧因素,造模开始前,更换新的无血清培养基,减少了细胞代谢产物对实验的影响。
本研究在Li等[3]模型基础上,设计单通道气源,各气体单独控制,保证氧舱内气体条件稳定,且舱内设有风扇等装置,克服了前期模型中装置密闭性强、气体浓度变化缓慢的缺陷,且操作简单。
OSAHS睡眠过程中因反复上气道塌陷或阻塞而出现通气不足或通气障碍,患者动脉血氧饱和度下降≥4%,常导致严重低氧血症。斯坦福一项研究显示重度OSAHS患者最低动脉氧饱和度约为60.10%[10]。本模型在5% O260 min-20% O230 min低氧循环模式时,培养基中最低氧分压维持在(56±4)mmHg,符合人类OSAHS低氧的特点,与Yuan等[11]IH模型低氧水平相似。
OSAHS对机体的影响是多方面的。OSAHS患者血管内皮细胞修复功能降低,细胞凋亡增加。Hayashi等[12]的研究指出,1周间歇低氧处理后,大鼠心肌细胞出现明显改变。光镜下,心肌明显肥厚,心肌细胞直径增加,细胞周围纤维组织增生;电镜下,细胞核出现塌陷,线粒体肿胀、棘突消失。本研究IH组A549细胞形态破坏,细胞出现突起、变圆,且随造模时间延长破坏更加明显,从细胞形态改变上验证了该模型的有效性。
HIF-1是人体重要的缺氧适应性因子,主要由HIF-1α和HIF-1β两个亚单位组成。其中HIF-1α是缺氧调节活性基团,对缺氧异常敏感,是OSAHS中的重要因子,在OSAHS的疾病模型脑组织中和人嗜铬细胞瘤细胞中表达明显增加[13-14]。IH能上调小鼠中枢神经系统HIF-1α转录水平,通过激活 mTOR信号通路增加HIF-1α蛋白表达,且显著高于SH组[14]。本模型6IH和9IH组HIF-1α表达明显升高,9IH组高于6IH组,且高于相应的4SH、6SH组,间接证明该模型有效,能模拟间歇性低氧的特点。
本模型低氧方式为5% O260 min-20% O230 min,细胞低氧时间和频率与人类OSAHS均不同,然而,本研究中6IH组和9IH组A549细胞HIF-1α的mRNA表达显著高于正常组,且高于相应的SH组。Ryan等[15]的细胞间歇性低氧频率和时间也与人类OSAHS完全不同,Ryan指出,IH组人宫颈癌细胞NF-κB表达明显增加,且高于同等时间持续低氧组,该模型短时间的间歇性低氧即可通过HIF-1α选择性激活NF-κB信号通路引起细胞炎症反应,为验证人类OSAHS炎症信号通路提供了有力证据。因此,从间接方面我们认为该模型成功模拟了低氧-复氧这种人类OSAHS疾病损害方式。
目前尚无关于人类OSAHS细胞氧分压改变情况的研究,很难模拟出完全符合人类OSAHS低氧特点的细胞模型。本研究与其它细胞模型相似,均成功模拟出了间歇低氧状态,且与持续低氧组存在明显差别,本模型同时具有控制精确、操作简单等特点,且设有空气模拟对照组,排除了实验过程中气体冲击对实验造成的影响,是研究间歇性低氧病理生理机制较为可靠的基础保障。另外,该氧舱可通过电脑及PLC系统设置不同气体暴露特点,为研究人体多种疾病病理生理特点提供细胞模型。
[参考文献]
[1]Li C, Lu J, Zhang B. Development of a novel chronic intermittent hypoxia chamber[J]. Sleep Breath, 2012, 16(1): 177-179.
[2]庄向华,倪一虹,刘元涛,等. 用阻塞性睡眠呼吸暂停低通气综合征动物模型研究vaspin与胰岛素信号通路的相关性[J]. 中国病理生理杂志, 2014, 30(11): 2084-2088.
[3]Li RC, Haribabu B, Mathis SP, et al. Leukotriene B4 receptor-1 mediates intermittent hypoxia-induced atherogenesis[J]. Am J Respir Crit Care Med, 2011, 184(1): 124-131.
[4]Nair D, Dayyat EA, Zhang SX, et al. Intermittent hypoxia-induced cognitive deficits are mediated by NADPH oxidase activity in a murine model of sleep apnea[J]. PLoS One, 2011, 6(5): e19847.
[5]李秀翠,蔡晓红,温正旺,等. 间歇性低氧动物模型的建立及验证[J]. 医学研究杂志, 2012, 41(7): 57-61.
[6]Tsapikouni T, Garreta E, Melo E, et al. A bioreactor for subjecting cultured cells to fast-rate intermittent hypoxia[J]. Respir Physiol Neurobiol, 2012, 182(1): 47-52.
[7]Yang CC, Lin LC, Wu MS, et al. Repetitive hypoxic preconditioning attenuates renal ischemia/reperfusion induced oxidative injury via upregulating HIF-1 alpha-dependent bcl-2 signaling[J]. Transplantation, 2009, 88(11):1251-1260.
[8]Baumgardner JE, Otto CM.Invitrointermittent hypoxia: challenges for creating hypoxia in cell culture[J]. Respir Physiol Neurobiol, 2003, 136(2-3):131-139.
[9]Therade-Matharan S, Laemmel E, Duranteau J, et al. Reoxygenation after hypoxia and glucose depletion causes reactive oxygen species production by mitochondria in HUVEC[J]. Am J Physiol Regul Integr Comp Physiol, 2004, 287(5): R1037-R1043.
[10]Goncalves MA, Guilleminault C, Ramos E, et al. Erectile dysfunction, obstructive sleep apnea syndrome and nasal CPAP treatment[J]. Sleep Med, 2005, 6(4):333-339.
[11]Yuan G, Adhikary G, McCormick AA, et al. Role of oxidative stress in intermittent hypoxia-induced immediate early gene activation in rat PC12 cells[J]. J Physiol, 2004, 557(Pt 3):773-783.
[12]Hayashi T, Yoshioka T, Hasegawa K, et al. Inhalation of hydrogen gas attenuates left ventricular remodeling induced by intermittent hypoxia in mice[J]. Am J Physiol Heart Circ Physiol, 2011, 301(3): H1062-H1069.
[13]王赞峰,代冰,康健. 慢性间断低氧对大鼠脑内缺氧诱导因子-1α表达和神经细胞凋亡的影响[J]. 中国病理生理杂志, 2010, 26(3): 593-595.
[14]Yuan G, Nanduri J, Khan S, et al. Induction of HIF-1alpha expression by intermittent hypoxia: involvement of NADPH oxidase, Ca2+signaling, prolyl hydroxylases, and mTOR[J]. J Cell Physiol, 2008, 217(3): 674-685.
[15]Ryan S, Taylor CT, McNicholas WT. Selective activation of inflammatory pathways by intermittent hypoxia in obstructive sleep apnea syndrome[J]. Circulation, 2005, 112(17):2660-2667.
(责任编辑: 陈妙玲, 余小慧)
An improved method to develop cell culture model of intermittent hypoxia
CAI Xiao-hong1, HONG Fang-fang1, CHEN Li-ya1, MEI Hong-fang1, LIN Jing1, WANG Hong-xia2, LI Xiu-cui1, LIANG Dong-shi1, WEN Zheng-wang1
(1DepartmentofPulmonology,TheSecondAffiliatedHospital&YuyingChildren’sHospital,WenzhouMedicalUniversity,Wenzhou325027,China;2ThePeople’sHospitalofJiaozuoCity,Jiaozuo454150,China.E-mail:caixh839@sina.com)
[ABSTRACT]AIM: To establish and validate a novel model of cultured cells for imitating intermittent hypoxia. METHODS: In a chamber with experiment cabin and simulated air control cabin, the frequency and duration of the intermittent hypoxia model according to the time of hypoxia and reoxygenation were evaluated. The A549 cells were randomly divided into 7 groups, named as control (Con) group, 6 h intermittent hypoxia (6IH) group, 9 h intermittent hypoxia (9IH) group, 6 h simulated air control (6AC) group, 9 h simulated air control (9AC) group, 4 h sustained hypoxia (4SH) group, 6 h sustained hypoxia (6SH) group, respectively. When the model was established, the cellular morphology was observed under inverted microscope. The mRNA expression of hypoxia-inducible factor (HIF)-1α was detected by real-time PCR. The protein expression of HIF-1α was analyzed by immunohistochemistry. RESULTS: The intermittent hypoxia cycle (5% O2 60 min-20% O2 30 min for 6 cycles) was established. The damaged A549 cells were observed in 6IH group, 9IH group and 6SH group. Compared with 6IH group, the expression of HIF-1α at mRNA and protein levels was significantly increased in 9IH group (P<0.05). The expression of HIF-1α at mRNA and protein levels in 6IH group and 9IH group was higher than that in 4SH group and 6SH group, respectively (P<0.05). No significant difference among the control group, 6AC group and 9AC group was found. CONCLUSION: The model (5% O2 60 min-20% O2 30 min for 6 cycles) can simulate the pathological process of obstructive sleep apnea hypopnea syndrome. This model is suitable for studying intermittent hypoxia in adherent cells.
[KEY WORDS]Intermittent hypoxia; Human lung adenocarcinoma cells; Hypoxia-inducible factor-1α
[文章编号]1000- 4718(2016)01- 0187- 06
[收稿日期]2015- 06- 01[修回日期] 2015- 09- 17
*[基金项目]浙江省科技厅项目(No. 2013C33174);浙江省自然科学基金资助项目(No. Y2110277);温州市科技合作项目(No. H20130001);浙江省医药卫生科技计划(No. 2014ZDA014);国家卫计委国家重点临床专科开放课题(No. 20130201)
通讯作者△Tel: 0577-88002027; E-mail: caixh839@sina.com
[中图分类号]R363; R563
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.01.032
