视网膜感光细胞退变过程中内层神经元结构和功能的变化*
2016-07-05项宗勤
张 佳, 项宗勤, 徐 颖
(暨南大学粤港澳中枢神经再生研究院,广东 广州 510632 )
▲并列第1作者
视网膜感光细胞退变过程中内层神经元结构和功能的变化*
张佳▲,项宗勤▲,徐颖△
(暨南大学粤港澳中枢神经再生研究院,广东 广州 510632 )
[关键词]感光细胞退变; 双极细胞; 节细胞
视网膜退行性疾病是现今引起人类失明的严重疾病,它主要包括视网膜色素变性(retinitis pigmentosa,RP)等多种眼科常见病。RP发病率大约1/4 000~1/3 500。常染色体隐形遗传占 15%~20%,显性 20%~25%,其中10%~15%为 X连锁遗传[1],目前已经发现45个致病基因位点[2]。RP患者的临床表现为视力下降,夜盲和视野逐渐变窄,主要的病理特征为感光细胞死亡,视网膜血管逐渐萎缩和堵塞,骨样细胞色素沉淀。随着感光细胞进行性凋亡,患者视力逐渐下降最终导致失明。目前,视网膜退变的主要治疗方案是,延缓感光细胞凋亡和视网膜内层神经元(主要是双极细胞和节细胞)对光反应消失的进程后,重建光电转换系统,使内层神经元对光产生反应。目前对于治疗视网膜退变疾病的研究取得了一些成果,主要包括前体感光细胞的移植[3]、干细胞移植[4]、人工视觉假体电刺激[5]、基因治疗感光细胞[6]、基因转导光感受蛋白诱导节细胞或双极细胞直接对光敏感[7-8]等。例如,熊国吟等[9]使用甲基亚硝基脲(methyl-nitroso-urea,MNU)诱导损伤视网膜感光细胞,然后通过电穿孔技术将黑视素基因转导进入给光双极细胞,恢复了小鼠部分视觉。这些实验在动物模型上都有效,并且有一部分还进入临床试验并取得了良好的效果。但是,这些治疗方法都要求在治疗阶段视网膜下游神经元结构和功能的完整。如果双极细胞或者节细胞丧失了对上级神经元信号刺激的兴奋性反应或丧失了往下级神经元传递兴奋性的功能,即使在治疗中成功诱导退变感光细胞、双极细胞或节细胞直接对光产生反应,也无法将信息传递到大脑产生视觉。因此了解感光细胞退变过程中双极细胞和节细胞的形态功能变化,对于寻找治疗视网膜退行性疾病的有效治疗窗口有重要意义。
目前在实验中最广泛和具有特征性视网膜退变的实验动物模型是rd1和rd10小鼠模型。rd1和rd10小鼠视网膜变性由Pde6b基因突变引起[10-11],导致Pde6b蛋白功能缺失,细胞内cGMP堆积[13],造成感光细胞死亡。rd1的感光细胞退变过程非常迅速,大概在出生后第8天感光细胞开始退变,到出生后21 d感光细胞几乎完全凋亡[13]。但是rd1突变小鼠视网膜很早就开始退变,视网膜还没有发育完全,诱发细胞死亡在一定程度上与细胞发育过程中的凋亡重叠,导致很难区别是病理学上的死亡还是生理学上的凋亡。rd10小鼠感光细胞凋亡慢,变性大概在出生后17 d开始,到出生后45 d左右视杆完全凋亡,直到180 d感光细胞几乎全部凋亡[11]。此外,rd10小鼠中的这种突变并未导致蛋白质功能完全丧失[11, 14]。因此rd10小鼠的变性比rd1小鼠的快速细胞死亡更加精准地反映了人类视网膜色素变性疾病。除了这2种常用退变小鼠动物模型外,实验中用到的视网膜退变小鼠模型还包括crx基因敲除小鼠模型[15]、rdcl小鼠模型及hrho小鼠模型[16];大鼠模型有RCS大鼠模型[17-18]、P23H大鼠模型[19]和S334ter大鼠模型[20];P347L视紫质转基因兔模型[21]中也有相关报导。
1视网膜退变过程中内层神经元形态上的改变
早在1980年,Sanyal等[22]在不同感光细胞退变的小鼠模型中发现了视网膜内核层变得更薄更不规则。Santos等[23]在人类视网膜退变捐赠者的视网膜上发现了在内核层(inner nuclear layer,INL)和神经节细胞层(ganglion cell layer,GCL)的神经元发生不同程度的丢失。在2002年,Strettoi等[24]在Rp模型小鼠上发现随着感光细胞的消失,视网膜下游神经元发生了下列相应改变:
1.1双极细胞在视网膜退变过程中形态上的改变在出生后的10~20 d的rd10小鼠和野生型小鼠中,双极细胞的形态和层次上没有什么区别,胞体椭圆形,树突呈树枝状且密度大,轴突很长,伸入到内网状层(inner plexiform layer,IPL)的深层。在出生后25 d的rd10小鼠中,双极细胞的形态开始变化。视杆双极细胞(retinal bipolar cells,RBCs)的树突变得更短,这个差别在视网膜中心较外周区域更加明显。在rd10小鼠出生后30 d,随着感光细胞退变的进行,RBCs的树突回缩变得更明显。在出生后45 d的rd10小鼠中,RBCs的树突在视网膜外周区域只有少许残留,而在中心区域内树突消失[14]。Puthussery等[25]更是发现了在视网膜退变双极细胞重构过程中,RBCs与视锥存在短暂的错位连接。
1.2视网膜神经节细胞在视网膜退变过程中形态上的改变在正常C57小鼠中,树突的延伸从出生后8 d开始直到睁眼(大约在出生13 d左右),之后节细胞的侧面和垂直于内网层的树突不断回缩,节细胞树突野不断减小[26]。在rd1小鼠的节细胞中,树突野的减小发生在出生后30 d左右,此时约有50%的节细胞的树突野减小到原来的50%[28]。但是在rd10小鼠中,节细胞的树突野等其他形态却没有任何明显异常[28]。
2正常视网膜中谷氨酸受体在内层神经元中的表达
视觉传导过程主要分为ON型通路和OFF型通路,分别对应给光和撤光时视网膜各级神经元中谷氨酸信号通道的反应,其中谷氨酸信号通道是视网膜信息传递的最主要通道(图1[29])。谷氨酸受体分为离子型谷氨酸受体(ionic glutamate receptor,iGluR)和代谢型谷氨酸受体(metabotropic glutamate receptor,mGluR)2大类。iGluR包括AMPA、kainate(KA)和NMDA 3类,含有GluR1~7、KA1~2和NR1~3多种亚型;mGluR包括Group I、II、III 3类,含有mGluR1~8各种亚型。在正常视网膜中谷氨酸受体在内层神经元中有不同的表达及功能,其中各类细胞均表达一定的iGluR和mGluR,但ON双极细胞(包括视杆双极细胞和ON视锥双极细胞)主要表达功能性的mGluR,而OFF双极细胞(均为视锥双极细胞)主要表达功能性的iGluR,而节细胞表达的mGluR和iGluR均有一定功能[30],具体总结见表1。
在黑暗环境下,感光细胞会释放谷氨酸,作用于突触后的ON型和OFF型双极细胞。谷氨酸作用的这2种细胞引起的是相反的作用,这是因为这2种细胞在突触后的谷氨酸受体不同。RBCs和ON型视锥双极细胞(ON-cone bipolar cells,ON-CBCs)表达代谢型的谷氨酸受体mGluR6[31],mGluR6被谷氨酸激活后会关闭一种非选择性的阳离子通道TRPM1[32-36],从而使得细胞超极化。在OFF型视锥双极细胞(OFF-CBCs)中,谷氨酸会激活kainate/AMPA型离子通道使细胞去极化。研究表明,在感光细胞退变的过程,RBCs和CBCs上的各种谷氨酸受体的分布和表达均发生了明显的改变[25, 37-39]。
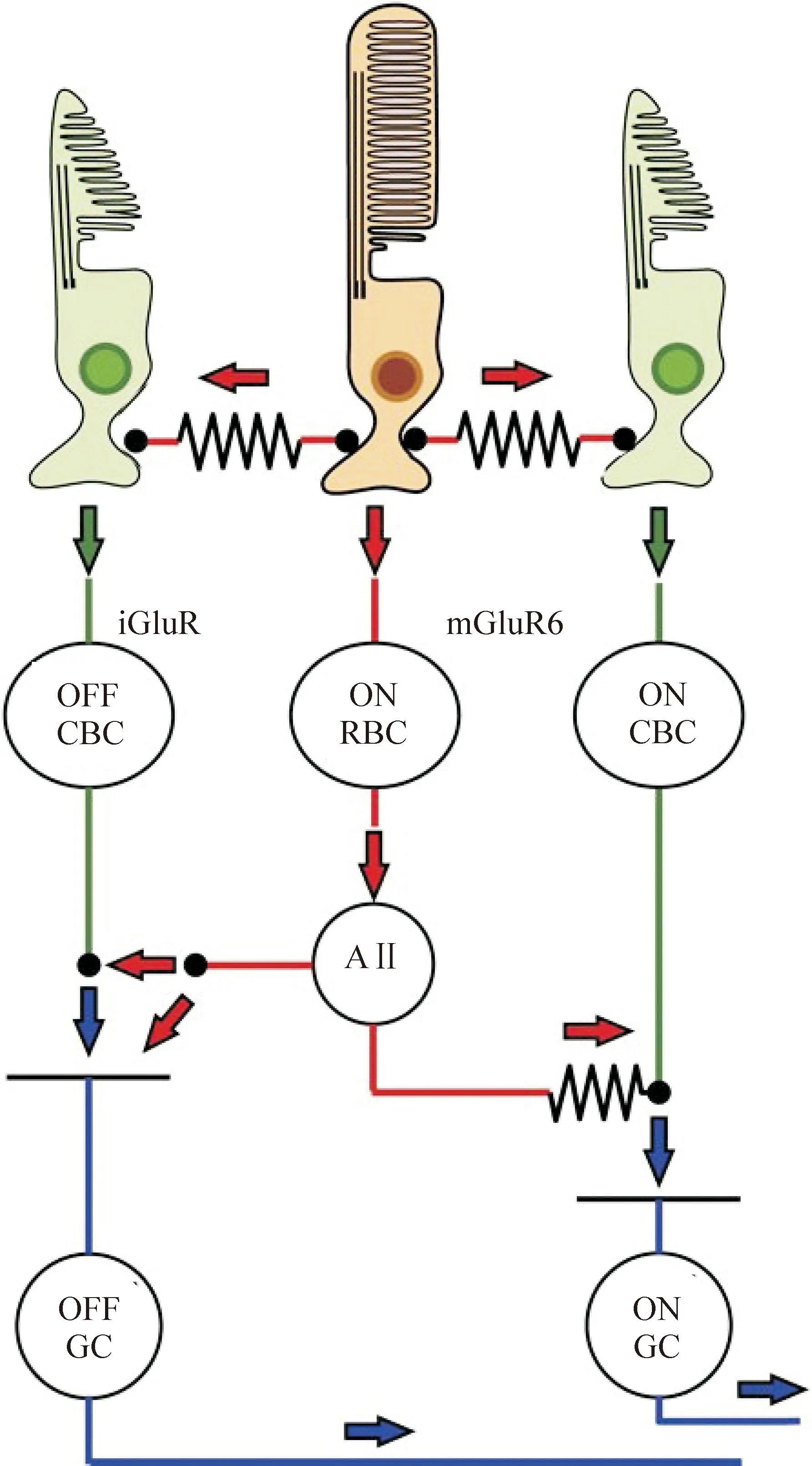
Figure 1.ON and OFF signaling pathways in normal retina. OFF CBC: OFF cone bipolar cell; ON RBC: ON rod bipolar cell; ON CBC: ON cone bipolar cell; AII: AII amacrine cell; OFF GC: OFF ganglion cell; ON GC: ON ganglion cell; iGluR: ionic glutamate receptor; mGluR: metabotropic glutamate receptor.
图1视网膜的给光和撤光信号通路
3视网膜退变过程中内层神经元谷氨酸受体表达的变化
3.1代谢型谷氨酸受体的变化已经证实在视网膜退变过程中,rd1小鼠模型[40]、rd10小鼠模型[15, 26, 39]和crx基因敲除小鼠模型[16]中mGluR6蛋白表达下调。除了表达量下降之外,残余mGluR6受体的表达位置也发生改变,过多的在给光双极细胞胞体和轴突上表达,并且形成簇。相似的发现也在RCS大鼠[18-19]、P23H大鼠[20]和S334ter大鼠[21]模型中有报道。但是,在这些视网膜退变大鼠模型中mGluR6受体表达位置的错误比在小鼠视网膜退变模型中更加显著。更加有趣的是,在这些大鼠视网膜退变模型中mGluR6受体的表达分布与其相应动物早期发育过程中的表达分布十分相似[41-42]。正常状态下,mGluR6在给光双极细胞树突顶端表达,使得RBCs或ON-CBCs超极化。Gargini等[15]发现在出生后25 d的rd10小鼠视网膜中,mGluR6染色结果显示与野生型小鼠基本一致,但是不仅仅限于双极细胞树突终端,而在其轴突和胞体上也有表达。随着视网膜退变的进行,染色显示mGluR6的表达逐渐减少。在出生后45 d的rd10小鼠视网膜中,染色显示在OPL剩余的mGluR6只有少量,并且与RBCs树突不一致。
3.2离子型谷氨酸受体的变化在感光细胞退变过程中,离子型谷氨酸受体在双极细胞中的表达几乎不变,甚至有所上调。Puthussery等[26]在rd10小鼠视网膜上用免疫组化方法对AMPA受体,包括iGluR1、iGluR2和iGluR4的表达进行了检测,发现这3种受体的表达都正常,甚至在视锥完全凋亡之后都没有什么变化。但是Namekata等[43]对表达iGluR1、iGluR3和iGluR4这3种受体rd1小鼠的基因进行了检测,结果显示在视网膜退变高峰之后,三者的表达上调;此外,在ON视锥双极细胞中也发现了iGluR的异常表达[44]。这些研究的结论不一致可能是因为使用了不同退变速度的小鼠。
除了上述研究外,在小鼠感光细胞退变过程中,mGluR是否在OFF双极细胞中的表达和分布有所变化并不清楚,mGluR和iGluR是否在节细胞中有不同的表达及分布变化,目前也未见任何报道。这些都需要进一步去研究。
4双极细胞在视网膜退变过程中功能的改变
4.1ON型双极细胞电生理反应的改变感光细胞退变过程中,ON双极细胞的对光反应逐渐消失,谷氨酸受体调控的阳离子通道关闭,mGluR反应消失或不变,iGluR反应出现或增强,基本符合mGluR和iGluR受体表达的变化趋势。
视网膜电位(electroretinography,ERG)记录是一种非损伤的在体记录视网膜细胞群体光反应的电生理记录手段。ERG中的b波主要来自ON型双极细胞,通过测量b波的峰值和到达峰值的时间可以反映其功能状况。Gargini等[15]发现来自ON双极细胞对光反应的b波在视网膜退变过程中逐渐减弱并消失,提示ON型双极细胞对光反应消失,但难以判断b波的缺失是来自于突触前感光细胞的变化还是突触后ON双极细胞的变化。Varela等[45]用酶裂解4~8周的rd1小鼠视网膜,然后应用膜片钳记录分离出来的视杆双极细胞,他们仅从13个细胞中的1个细胞记录到谷氨酸反应,提示视杆双极细胞的谷氨酸反应缺失。但由于在rd1小鼠视网膜中视杆到视杆双极细胞的突触发育是不正常的,无法说明观察到的功能缺失是由于rd1小鼠视网膜发育异常引起还是由于感光细胞退变造成的。Barhoum等[39]在出生后60 d 的rd10小鼠(这时视杆细胞已经完全凋亡)和野生型小鼠视网膜上记录视杆双极细胞对局部喷发谷氨酸的反应,结果发现rd10小鼠的视杆双极细胞与正常小鼠一样,均可以在50%的细胞上记录到谷氨酸诱发电流,而且反应幅度无显著差别。而与之相反的是, Puthussery等[26]在rd10小鼠视网膜中视杆双极细胞上喷发mGluR6特异激动剂L-AP-4,发现mGluR6诱发电流进行性减小,到出生后45 d电流峰值减少了91%,直到出生后180 d反应完全消失。这些结果的不同可能是由于不同的诱发刺激激活了不同类型的谷氨酸受体。
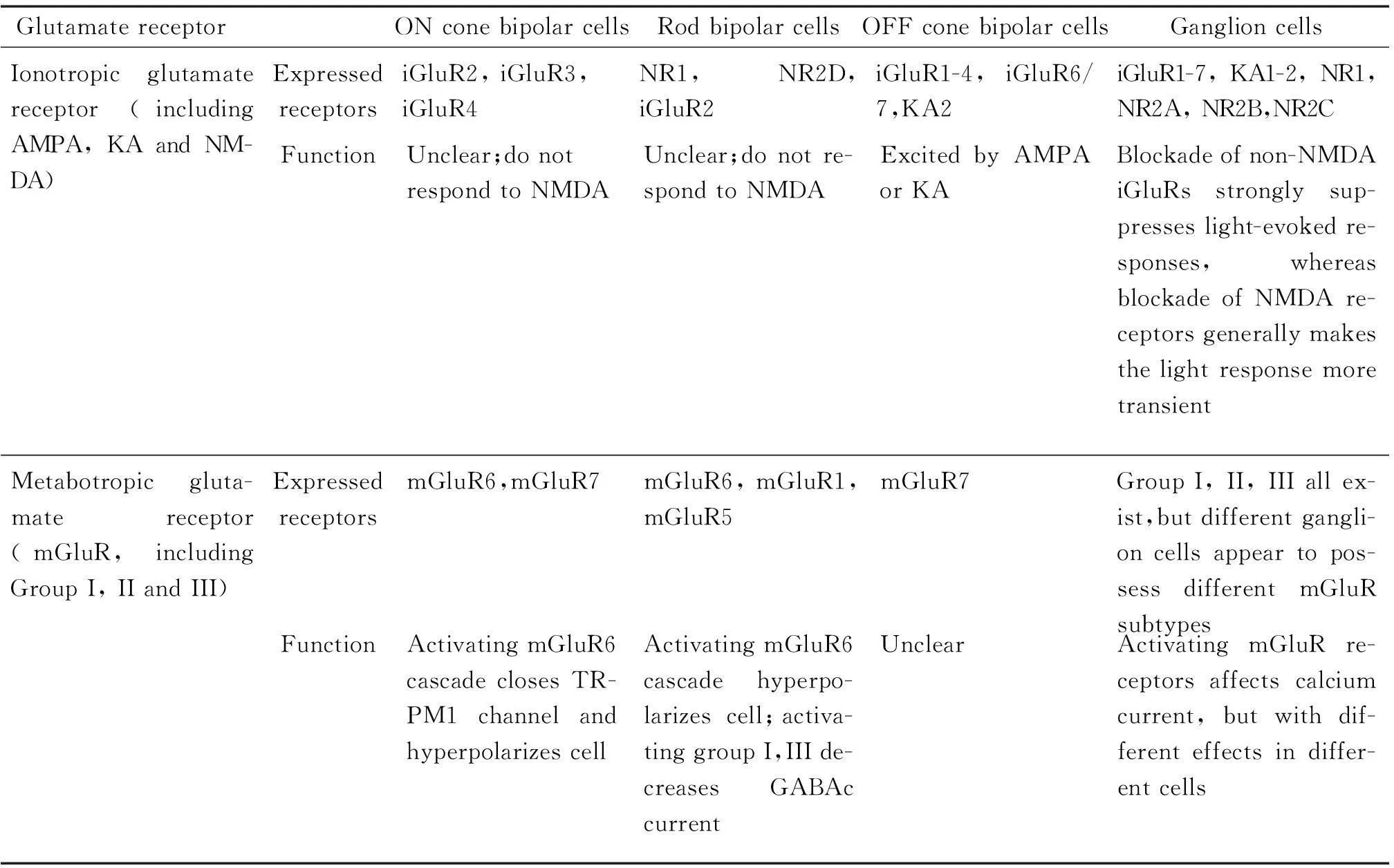
表1 正常视网膜中双极细胞和节细胞上表达的谷氨酸受体及其功能
NMDA receptor (NR): NR1, NR2A, NR2B, NR2C, NR2D, NR3A, NR3B; AMPA receptor: iGluR1, iGluR2, iGluR3, iGluR4; KA receptor: iGluR5, iGluR6, iGluR7, KA1, KA2; Group I mGluR: mGluR1, mGluR5; Group II mGluR: mGluR2, mGluR3; Group III mGluR: mGluR4, mGluR5, mGluR6, mGluR7, mGluR8.
有机阳离子agmatine(AGB)示踪法是一种鉴定离散细胞活性的方法,AGB能够通过开放的阳离子通道进入细胞,从而显示细胞的活性。 研究表明,感光细胞完全敲除的小鼠(rdcl)中ON双极细胞没有任何AGB信号,表明由iGluR或mGluR调控的阳离子通道处于关闭状态[17]。在退变小鼠视网膜ON双极细胞中通过AGB示踪法发现开始异常表达功能性的iGluR[44],尽管采用全细胞膜片钳技术并没有记录到AMPA/kainate引起的iGluR电流[26];而在退变的P23H大鼠中发现ON双极细胞在感光细胞退变后的很长一段时间都维持正常的iGluR反应[46],提示感光细胞退变时ON双极细胞中iGluR可能发挥作用。AGB示踪法也被应用到P347L视紫质转基因兔模型中,用于检测视网膜退变过程中kainate受体的活性。研究显示出了大量活化的双极细胞,表明在退变过程中视杆双极细胞iGluR受体通道具有很高的活性[22]。
4.2OFF型双极细胞电生理反应的改变感光细胞退变过程中,OFF双极细胞的iGluR反应维持不变或消失,mGluR反应未见报道。
Puthussery等[26]在出生后6个月龄rd10小鼠视网膜OFF双极细胞中应用全细胞膜片钳记录到了正常的AMPA和kainate激发电流,表明在视锥死亡后kainate/AMPA受体通道功能仍然正常。但是在退变速度更快的rdcl和hrho小鼠模型中,通过AGB检测并未发现OFF双极细胞中任何kainate受体活性[17],提示iGluR反应消失。此外,在视网膜色素变性患者的视网膜中发现了显著增高的iGluR活性[17],但这来自于OFF还是ON双极细胞中表达增加的iGluR并不清楚。而OFF双极细胞中mGluR电流是否发生变化并不清楚。
5节细胞在视网膜变性过程中功能的变化
感光细胞退变过程中,节细胞感受野变小,自发增强,对光反应减弱,iGluR 反应正常。
5.1感受野变小在rd1小鼠视网膜退变的不同时期,各种节细胞的感受野产生不同的变化,ON型节细胞的感受野从小鼠睁眼之后开始持续减小,直到rd1小鼠出生4周左右,这段时间正好与视杆感光细胞凋亡相对应;而OFF节细胞的感受野在出生后17 d左右才开始减小。同样,与OFF节细胞相对应的视锥的凋亡也发生在视杆凋亡之后。这样的对应关系说明了在感光细胞退变时引起了其下游节细胞结构的改变,进而导致其功能的异常[27]。但是在rd10小鼠视网膜中,节细胞的感受野和树突野均没有明显改变。
5.2视网膜退变过程中节细胞的自发增强正常的视网膜中,节细胞在动物睁眼之前会产生一定频率的自发现象,但是睁眼之后,视网膜受到光线的刺激,自发会降到很低的水平。这一现象在视网膜退变模型小鼠中却发生了改变,改变主要发生在睁眼之后。有大量文献报道,在感光细胞凋亡过程中,伴随着节细胞对光反应逐渐降低,特别是OFF型的节细胞产生有规律的自发发放。在视网膜退变的早期,自发的频率大约是10 Hz,晚期有所降低[47-48]。
阻断感光细胞和ON型双极细胞的输入并不能减少自发,所以节细胞的自发来自于视网膜内层神经元的相互作用。为了确定节细胞的自发是不是由于其自身性质的改变,比如离子通道的作用或分布状况,或是突触前的输入影响,有研究通过电压钳技术探究α节细胞的电生理特性。在加入谷氨酸受体阻断剂CNQX之后,节细胞的自发大部分消失,因此可以确定节细胞的大量自发是通过谷氨酸受体激活引起的[49]。最近更进一步的研究证明,节细胞的自发来自于ON型视锥双极细胞和AⅡ无长突细胞的电偶联[50-51]。
5.3视网膜退变过程中节细胞的光反应幅度降低rd1小鼠在视网膜退变过程中,节细胞发放可以分为3个阶段,第1阶段为出生后7 d到睁眼之前有着正常的自发现象;第2阶段为在出生14 d时,全视野光刺激能够使节细胞产生光反应,并且OFF反应明显高于ON反应;第3阶段为小鼠刚成年后,节细胞的光反应大部分消失。但是此时rd1小鼠的视网膜还没有完全凋亡,还有部分残余的视锥细胞,那成年后的小鼠为什么几乎没有光反应呢[52]?原因是节细胞的大量高频率的自发掩盖了部分光反应。有文献报道,通过阻断GABA受体或阻断缝隙连接能够部分恢复节细胞的光反应并且自发大部分消失[26, 53],提示也许可能通过GABA阻断剂延缓感光细胞退变过程中节细胞光反应降低的时程。
5.4视网膜退变过程中节细胞的光敏度降低视网膜对光刺激能够产生反应。随着绝对光强的减小,反应强度减小,当光强达到一个临界值以下,节细胞不能产生光反应。这个临界值代表着节细胞的光敏度。用光点刺激节细胞的感受野中心来评估其光敏度的变化发现,随着感光细胞的凋亡,节细胞特别是ON型节细胞的光敏度逐渐降低。在凋亡的中期阶段,光敏度有一个平台期,这段时间,光敏度下降得很平缓,随后又快速下降,最后稳定在一定水平。RCS大鼠在出生后28~30 d时,光敏度与正常大鼠只有0.25 log cd/m2的差别,在出生后47~48 d时差异扩大到 0.71 log cd/m2[54]。新近文献报道用mGluR1受体拮抗剂JNJ16259685阻断mGluR1信号通道可以增强P23H大鼠节细胞对光反应的敏感度,从而提高任何来自残存感光细胞的微弱信号,延长节细胞对光反应时程[55]。
5.5视网膜退变过程中节细胞的光反应时间延长在视网膜变性早期,ON型节细胞接受信息延迟。通过全细胞膜片钳技术,比较RCS大鼠和正常大鼠在同一时间和同种类型节细胞的内向电流时程时,发现RCS大鼠ON型节细胞内向电流的潜伏期、上升时间和达峰时间皆比正常大鼠延长。出生30 d时,信息传递到ON型节细胞的时间明显延迟,到60 d时更明显,到90 d时完全中断。但是在OFF和ON-OFF型节细胞中,出生30 d时无明显延迟,而60 d后信息传递中断[56]。
5.6视网膜退变过程中节细胞的对比敏感度降低对比敏感度是指正常视网膜在具有灰度背景的相对光强的刺激下,对不同相对光强产生的反应强弱不同。随着对比度的升高,反应幅度也不断增加。有研究将正常的SD大鼠与RCS大鼠做对比敏感度的行为学检测发现,在出生后28 d~30 d之间,2种大鼠的反应幅度没有明显差别,均随着光栅对比度的增加而变大。但出生后47 d,在100%对比度、0.07 cyc/deg(光栅速度)的光栅刺激时,RCS大鼠的反应幅度较正常大鼠明显降低。更严重的是,在出生76 d之后,虽然仍有残存的视杆细胞,RCS大鼠已不能对任何对比度、任何空间频率的光栅产生反应[54]。
5.7视网膜退变过程中节细胞的iGluR反应正常在P23H大鼠中通过AGB标记发现节细胞在很长一段时间内都维持正常的iGluR反应,而关于mGluR的反应尚无报道。用钙结合蛋白(CR)和AGB标记被kainate激活的视网膜,大约90%左右的节细胞能够被CR和AGB双标,这说明大部分节细胞的iGluR反应正常[46]。
综上所述,虽然已有研究报道感光细胞退变过程中双极细胞和节细胞的功能变化,但各研究结论并不一致甚至相互矛盾,而且没有系统检测mGluR和iGluR反应在各类神经元上的变化。因此,有必要通过不同谷氨酸信号通道的特异性激动剂来测试感光细胞退变过程中ON、OFF双极细胞和节细胞的mGluR和iGluR电流变化,以确定各细胞中谷氨酸兴奋性的变化情况,从而更全面地评估内层神经元的功能退变程度,判断谷氨酸受体表达的变化与内层神经元谷氨酸兴奋性变化的相关性。
6展望
视网膜变性是一个进展相对比较缓慢的疾病,目前针对内层视网膜的研究并不充分,而且争议颇多。对于视网膜退变疾病的治疗,如果仅仅对感光细胞采取治疗,并不能取到很好的效果。例如,虽然视网膜假体的移植已经在临床实验中取得了可喜的成果[57-58]并形成了商业化产品,但是在感光细胞退变的过程中节细胞异常的自发发放[47, 52]会对人工视觉假体移植后刺激视网膜产生的真实视觉电信号造成严重干扰,妨碍正确视觉的产生,因此必须有效控制节细胞的这种非正常自发,才能有效提高治疗效果。因此,探索视网膜退变时内层视网膜神经元功能(包括对光反应及对上级信号引起的兴奋性反应)的变化及其机制,并设法维持其正常功能或延缓其功能衰退的时间,将为临床上寻找有效的防治时间、作用靶点提供重要参数;同时可以为延长治疗的时间窗口寻求可能方案,具有非常重要的临床和社会意义。
[参考文献]
[1] Ferrari S, Di Iorio B, Barbaro B,et al. Retinitis pigmentosa: genes and disease mechanisms[J]. Curr Genomics, 2011, 12(4): 238-249.
[2]Hamel C. Retinitis pigmentosa[J]. Orphanet J Rare Dis, 2006, 1:40.
[3]MacLaren RE, Pearson RA, MacNeil A, et al. Retinal repair by transplantation of photoreceptor precursors[J]. Nature, 2006, 444(7116):203-207.
[4]Mooney I, LaMotte J. A review of the potential to restore vision with stem cells [J]. Clin Exp Optometry, 2008, 91(1):78-84.
[5]Nirenberg S, Pandarinath C. Retinal prosthetic strategy with the capacity to restore normal vision [J]. Proc Natl Acad Sci U S A, 2012, 109(37):15012-15017.
[6]Hufnagel RB, Ahmed ZM, Corrêa ZM, et al. Gene therapy for Leber congenital amaurosis: advances and future directions[J]. Graefes Arch Clin Exp Ophthalmol, 2012, 250(8):1117-1128.
[7]Bi A, Cui J, Ma YP, et al. Ectopic expression of a microbial-type rhodopsin restores visual responses in mice with photoreceptor degeneration[J]. Neuron, 2006, 50(1):23-33.
[8]Lagali PS, Balya D, Awatramani GB, et al. Light-activated channels targeted to ON bipolar cells restore visual function in retinal degeneration[J]. Nature Neurosci, 2008, 11(6):667-675.
[9]熊国吟,罗小鹏,杨昇炎,等. 黑视素基因转染给光双极细胞部分恢复MNU诱导的视网膜感光细胞变性小鼠的视觉[J]. 中国病理生理杂志, 2013, 29(7): 1153-1159.
[10]Bowes C, Li T, Danciger M, et al. Retinal degeneration in the rd mouse is caused by a defect in the beta subunit of rod cGMP-phosphodiesterase[J]. Nature, 1990, 347(6294):677-680.
[11]Chang B, Hawes NL, Pardue MT, et al. Two mouse retinal degenerations caused by missense mutations in the beta-subunit of rod cGMP phosphodiesterase gene[J]. Vision Res, 2007, 47(5):624-633.
[12]Farber DB, Lolley RN. Cyclic guanosine monophosphate: elevation in degenerating photoreceptor cells of the C3H mouse retina[J]. Science, 1974, 186(4162):449-451.
[13]Carter-Dawson LD, LaVail MM, Sidman RL. Differential effect of the rd mutation on rods and cones in the mouse retina J]. Invest Ophthalmol Visual Sci, 1978, 17(6):489-498.
[14]Gargini C, Terzibasi E, Mazzoni F, et al. Retinal organization in the retinal degeneration 10 (rd10) mutant mouse: a morphological and ERG study[J]. J Comp Neurol, 2007, 500(2):222-238.
[15]Pignatelli V, Cepko CL, Strettoi E. Inner retinal abnormalities in a mouse model of Leber’s congenital amaurosis[J]. J Comp Neurol, 2004, 469(3): 351-359.
[16]Marc RE, Jones BW, Anderson JR, et al. Neural reprogramming in retinal degeneration[J]. Invest Ophthalmol Visual Sci, 2007, 48(7):3364-3371.
[17]Cuenca N, Pinilla I, Sauve Y, et al. Early changes in synaptic connectivity following progressive photoreceptor degeneration in RCS rats[J]. Eur J Neurosci, 2005, 22(5):1057-1072.
[18]Pinilla I, Cuenca N, Sauve Y, et al. Preservation of outer retina and its synaptic connectivity following subretinal injections of human RPE cells in the royal college of surgeons rat [J]. Exp Eye Res, 2007, 85(3):381-392.
[19]Cuenca N, Pinilla I, Sauvé Y, et al. Regressive and reactive changes in the connectivity patterns of rod and cone pathways of P23H transgenic rat retina [J]. Neuroscience, 2004, 127(2):301-317.
[20]Seiler MJ, Thomas BB, Chen Z, et al. BDNF-treated retinal progenitor sheets transplanted to degenerate rats: improved restoration of visual function[J]. Exp Eye Res, 2008, 86(1):92-104.
[21]Jones BW, Kondo M, Terasaki H, et al. Retinal remodeling in the Tg P347L rabbit, a large-eye model of retinal degeneration[J]. J Comp Neurol, 2011, 519(14):2713-2733.
[22]Sanyal S, De Ruiter A, Hawkins RK. Development and degeneration of retina in rds mutant mice: light microscopy[J]. J Comp Neurol, 1980, 194(1): 193-207.
[23]Santos A, Humayun MS, de Juan E, et al. Preservation of the inner retina in retinitis pigmentosa. A morphometric analysis[J]. Arch Ophthalmol, 1997, 115(4):511-515.
[24]Strettoi E, Porciatti V, Falsini B, et al. Morphological and functional abnormalities in the inner retina of the rd/rd mouse[J]. J Neurosci, 2002, 22(13):5492-5504.
[25]Puthussery T, Gayet-Primo J, Pandey S, et al. Differential loss and preservation of glutamate receptor function in bipolar cells in the rd10 mouse model of retinitis pigmentosa[J]. Eur J Neurosci, 2009, 29(8):1533-1542.
[26]Koehler CL, Akimov NP, Renteria RC. Receptive field center size decreases and firing properties mature in ON and OFF retinal ganglion cells after eye opening in the mouse[J]. J Neurophysiol, 2011, 106(2):895-904.
[27]Damiani D, Novelli E, Mazzoni F, et al. Undersized dendritic arborizations in retinal ganglion cells of the rd1 mutant mouse: a paradigm of early onset photoreceptor degeneration[J].J Comp Neurol, 2012, 520(7):1406-1423.
[28]Mazzoni F, Novelli E, Strettoi E. Retinal ganglion cells survive and maintain normal dendritic morphology in a mouse model of inherited photoreceptor degeneration[J]. J Neurosci, 2008, 28(52):14282-14292.
[29]Seeliger MW, Brombas A, Weiler R, et al. Modulation of rod photoreceptor output by HCN1 channels is essential for regular mesopic cone vision[J]. Nat Commun, 2011, 2:532.
[30]Thoreson WB, Witkovsky P. Glutamate receptors and circuits in the vertebrate retina [J]. Prog Retinal Eye Res, 1999, 18(6):765-810.
[31]Nakajima Y, Iwakabe H, Akazawa C, et al. Molecular characterization of a novel retinal metabotropic glutamate receptor mGluR6 with a high agonist selectivity for L-2-amino-4-phosphonobutyrate[J]. J Biol Chem, 1993, 268(16): 11868-11873.
[32]Slaughter MM, Miller RF. Characterization of an extended glutamate receptor of the on bipolar neuron in the vertebrate retina[J]. J Neurosci, 1985, 5(1): 224-233.
[33]Xu Y, Dhingra A, Fina ME, et al. mGluR6 deletion renders the TRPM1 channel in retina inactive[J]. J Neurophysiol, 2012, 107(3):948-957.
[34]Dhingra A, Ramakrishnan H, Neinstein A, et al. Gbeta3 is required for normal light ON responses and synaptic maintenance[J]. J Neurosci, 2012, 32(33): 11343-11355.
[35]Koike C, Obara T, Uriu Y, et al. TRPM1 is a component of the retinal ON bipolar cell transduction channel in the mGluR6 cascade [J]. Proc Natl Acad Sci U S A, 2010, 107(1):332-337.
[36]Morgans CW, Brown RL, Duvoisin RM. TRPM1: the endpoint of the mGluR6 signal transduction cascade in retinal ON-bipolar cells[J]. BioEssays,2010,32(7):609-614.
[37]Strettoi E, Pignatelli V, Rossi C, et al. Remodeling of second-order neurons in the retina of rd/rd mutant mice[J]. Vision Res, 2003, 43(8):867-877.
[38]Marc RE, Jones BW, Watt CB, et al. Neural remodeling in retinal degeneration[J]. Prog Retinal Eye Res, 2003, 22(5):607-655.
[39]Barhoum R, Martinez-Navarrete G, Corrochano S, et al. Functional and structural modifications during retinal degeneration in the rd10 mouse[J]. Neurosci, 2008, 155(3):698-713.
[40]Strettoi E, Pignatelli V. Modifications of retinal neurons in a mouse model of retinitis pigmentosa [J]. Proc Natl Acad Sci USA, 2000, 97(20):11020-11025.
[41]Nomura A, Shigemoto R, Nakamura Y, et al. Developmentally regulated postsynaptic localization of a metabotropic glutamate receptor in rat rod bipolar cells[J]. Cell, 1994, 77(3):361-369.
[42]Ueda Y, Iwakabe H, Masu M, et al. The mGluR6 5' upstream transgene sequence directs a cell-specific and developmentally regulated expression in retinal rod and ON-type cone bipolar cells[J]. J Neurosci, 1997, 17(9): 3014-3023.
[43]Namekata K, Okumura A, Harada C, et al. Effect of photoreceptor degeneration on RNA splicing and expression of AMPA receptors[J]. Mol Vis, 2006, 12:1586-1593.
[44]Chua J, Fletcher EL, Kalloniatis M. Functional remodeling of glutamate receptors by inner retinal neurons occurs from an early stage of retinal degeneration[J]. J Comp Neurol, 2009, 514(5):473-491.
[45]Varela C, Igartua I, De la Rosa EJ, et al. Functional modifications in rod bipolar cells in a mouse model of retinitis pigmentosa[J]. Vision Res, 2003, 43(8):879-885.
[46]Zhu Y, Misra S, Nivison-Smith L, et al. Mapping cation entry in photoreceptors and inner retinal neurons during early degeneration in the P23H-3 rat retina[J]. Vis Neurosci, 2013, 30(3):65-75.
[47]Margolis DJ, Newkirk G, Euler T, et al. Functional stability of retinal ganglion cells after degeneration-induced changes in synaptic input[J]. J Neurosci, 2008, 28(25):6526-6536.
[48]Sekirnjak C, Jepson LH, Hottowy P, et al. Changes in physiological properties of rat ganglion cells during retinal degeneration[J]. J Neurophysiol, 2011, 105(5):2560-2571.
[49]Margolis DJ, Detwiler PB. Cellular origin of spontaneous ganglion cell spike activity in animal models of retinitis pigmentosa[J]. J Ophthalmol,2011,2011:507037.
[50]Trenholm S, Borowska J, Zhang J, et al. Intrinsic oscillatory activity arising within the electrically coupled AII amacrine-ON cone bipolar cell network is driven by voltage-gated Na+channels[J]. J Physiol, 2012, 590(Pt 10): 2501-2517.
[51]Borowska J, Trenholm S, Awatramani GB. An intrinsic neural oscillator in the degenerating mouse retina[J]. J Neurosci, 2011, 31(13):5000-5012.
[52]Stasheff SF. Emergence of sustained spontaneous hyperactivity and temporary preservation of OFF responses in ganglion cells of the retinal degeneration (rd1) mouse [J]. J Neurophysiol, 2008, 99(3):1408-1421.
[53]Jensen RJ. Blocking GABA(C) receptors increases light responsiveness of retinal ganglion cells in a rat model of retinitis pigmentosa[J]. Exp Eye Res, 2012, 105:21-26.
[54]Pu M, Xu L, Zhang H. Visual response properties of retinal ganglion cells in the royal college of surgeons dystrophic rat[J]. Invest Ophthalmol Vis Sci, 2006, 47(8):3579-3585.
[55]Jensen RJ. Effects of a metabotropic glutamate 1 receptor antagonist on light responses of retinal ganglion cells in a rat model of retinitis pigmentosa[J]. PLoS One, 2013, 8(10):e79126.
[56]Huang YM, Yin ZQ, Liu K, et al. Temporal and spatial characteristics of cone degeneration in RCS rats[J]. Jpn J Ophthalmol, 2011, 55(2):155-162.
[57]Hossain P, Seetho IW, Browning AC, et al. Artificial means for restoring vision[J]. BMJ, 2005, 330(7481):30-33.
[58]Lakhanpal RR, Yanai D, Weiland JD, et al. Advances in the development of visual prostheses [J]. Curr Opin Ophthalmol, 2003, 14(3):122-127.
(责任编辑: 林白霜, 余小慧)
Functional and structural modifications in inner retinal neurons during photoreceptors degeneration
ZHANG Jia, XIANG Zong-qin, XU Ying
(Guangdong-Hongkong-MacauInstituteofCNSRegeneration,JinanUniversity,Guangzhou510632,China.E-mail:xuying@jnu.edu.cn)
[KEY WORDS]Photoreceptors degeneration; Bipolar cells; Ganglion cells
[ABSTRACT]Retinitis pigmentosa (RP) is a retina disease which leads to a progressive photoreceptors degeneration. Although the inner neurons that mainly include bipolar cells and ganglion cells of retina remain relative stable during the photoreceptors degeneration, studies show that their morphologies and functions are changed during this process. Stu-dies indicate that rod bipolar cells (RBCs) and cone bipolar cells (CBCs) undergo dendritic retraction and remodelling in retinal degenerated mice, and they show changes in expression of the glutamate receptors as well as responses to glutamate and light stimuli. In many animal models of RP, significant decreases in receptive field size, contrast sensitivity, and threshold sensitivity, as well as an increasing spontaneous spiking in retinal ganglion cells (RGCs) were detected. As these modifications may impact the choice and success of intervention strategies for treating retinal degeneration, it is important to understand the characteristics of any functional deficits resulting from photoreceptors degeneration.
[文章编号]1000- 4718(2016)01- 0179- 08
[收稿日期]2015- 08- 13[修回日期] 2015- 11- 05
*[基金项目]国家自然科学基金资助项目(No. 81470656)
通讯作者△Tel: 020-85227086; E-mail: xuying@jnu.edu.cn
[中图分类号]R774; R363
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.01.031
