大麻素受体二聚化及其激活机理*
2016-07-05郭晓汐徐天瑞
武 楠, 杨 洋, 安 输, 郭晓汐, 徐天瑞, 刘 莹
(昆明理工大学生命科学与技术学院信号传导实验室,云南 昆明 650500)
·综述·
大麻素受体二聚化及其激活机理*
武楠,杨洋,安输,郭晓汐,徐天瑞△,刘莹△
(昆明理工大学生命科学与技术学院信号传导实验室,云南 昆明 650500)
[关键词]大麻素受体; 二聚化
大麻素受体1(cannabinoid receptor 1,CB1)和大麻素受体2(cannabinoid receptor 2,CB2)可以形成同源二聚体,也可以与多种受体形成异源二聚体。异源二聚体大大增加了G蛋白偶联受体(G protein-coupled receptors,GPCRs)功能反应的范畴,对药物的开发存在很大的潜力。异源二聚体具有不同于单体和同源二聚体的高阶结构特点[1],CB1受体、CB2受体形成异源二聚体后呈现出了更高的信号特异性和多样性。异源二聚体的形成更像是2种或是多种蛋白功能的协同作用而非简单的单一蛋白功能的复合。因此,CB1受体、CB2受体异源二聚体的形成在调节疼痛、食欲、觉醒、肥胖、神经、肿瘤细胞等方面均有作用[2]。
CB1受体为内源性大麻素和大麻素的活性成分的主要靶向分子,是哺乳动物大脑中最丰富的GPCR。CB1受体由473个氨基酸,7个跨膜结构域构成(图1)[3]。CB1受体多定位于神经末梢突触前膜,广泛分布于整个大脑区域,尤其是额叶皮质,感觉和运动区、脑桥、延髓和边缘系统[4]。它能调节多巴胺和γ-氨基丁酸(γ-aminobutyric acid,GABA)神经递质的释放,参与记忆、认知、运动控制的调节。CB1受体定位于谷氨酸神经元而非GABA能神经元,从而可以保护细胞免受兴奋毒性的损伤。

Figure 1.Schematic structure of CB1.
图1CB1的结构示意图
CB2受体由360个氨基酸,7个跨膜结构域构成(图2)。人类CB2受体基因存在CB2a和CB2b2种剪接变异体,其中序列较长的CB2a亚型(包括外显子1a、1b、3)主要分布在睾丸,大脑的许多区域也有表达;序列较短的亚型CB2b(包括外显子2、3)则主要分布在脾脏和白细胞,大脑组织含量较少[5]。CB2受体高表达于免疫细胞的同时,在不同的免疫系统中也有差异。CB2受体的作用主要包括调节中枢神经系统内外的细胞因子释放和免疫细胞的迁移,其表达水平取决于细胞的活化状态和受到刺激的类型[6]。与CB1受体相比,CB2受体主要表达在外周免疫组织,参与机体的免疫应答[7]。因此深入研究大麻素受体的结构和功能关系及其信号转导途径,可以进一步阐明相关疾病的发病机制,为开发更有效的创新性治疗药物提供更好的理论基础和更广阔的思路[2]。CB2受体参与机体的免疫活动,尤其是在机体炎症的过程中起重要作用。CB2受体可以作为选择性靶向分子来调节不良免疫反应,包括高炎症神经等相关疾病[8]。

Figure 2.Schematic structure of CB2.
图2CB2的结构示意图
2大麻素受体介导的信号转导通路
CB1受体和CB2受体结构域均能偶联并活化Gi/o蛋白,抑制腺苷环化酶的活性,降低cAMP水平;它们亦可偶联并活化Gs蛋白,增强腺苷环化酶的活性。Gi/o和Gs在人体广泛分布,例如在心肌组织中,当机体发生心率失常时,Gi/o的表达受到抑制,而Gs被激活,Ca2+内流增多,房室传导速度增加[9]。此外,Gi/o、Gs也分布在大脑组织中,影响大脑神经元的发育。研究发现,甲状腺功能减退大鼠的海马中Gi/o表达水平明显高于正常组,而Gs表达水平无明显变化[10]。CB1受体和CB2受体还能抑制钙离子通道,活化钾离子通道及促丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)。此外,CB2受体能激活PI3K/Akt 通路,增加神经酰胺的合成。CB1受体可以结合某些离子通道,产生抑制电压门控钙离子通道和激活钾离子内流的生理作用,CB2受体则不能[11]。但是CB2受体二聚化后,可以激活神经细胞和免疫细胞内游离钙离子快速短暂性增加。最近的研究发现大麻药物作用于CB1受体或CB2受体后通过激活PI3K/Akt信号通路,发挥促进皮层细胞和少突胶质细胞祖细胞存活的作用(图3)。

Figure 3.CB1receptor or CB2receptor forms dimer activating PI3K/Akt signaling pathway.
图3CB1受体或CB2受体形成二聚体后介导PI3K/Akt 信号通路活化
3GPCRs的二聚化
传统观念认为,GPCR主要以单体的形式存在并发挥作用,目前大量证据表明,绝大多数GPCR存在二聚化甚至更高的聚合形式,形成功能单位,接受外界信号的刺激,将信号从细胞外传至细胞内(图4)。二聚化可以发生在相同受体、相似家族受体或不同家族受体分子之间,其作用体现在受体信号转导通路的诸多环节,例如与配体结合、受体的激活、失敏反应及蛋白运输等[12]。最初通过对γ-氨基丁酸b受体(γ-aminobutyric acid receptor b, GbR)的研究证实GPCR异源二聚体在信号转导过程中起关键作用。GbR由2个亚型组成,GbR1可以与配体GABA结合,GbR2与下游G蛋白偶联受体相互作用。
4大麻素受体形成二聚体结构及其激活的信号通路
CB1受体和CB2受体可以与很多受体结合形成异源二聚体,由于2受体形成二聚体后导致其结构发生改变,其功能也随着发生改变,其下游信号通路的开关也随着发生了变化(图5)。二聚化的形成同配体与受体的结合完全不同,其结构与功能的复杂性决定了二聚化形成后功能的复杂与多变性。相关研究认为细胞信号可以作为单体经常与不同的GPCR配对,彼此作为均聚物和异源二聚体来介导信号的转导,调节G蛋白介导的信号通路[13]。
那年,郭启明28岁。从吉林大学旅游专业毕业之后,他幸运地被北京某著名的旅游公司录用为高级策划师,策划了许多成功的商业活动。公司不仅给他开出了月薪15000元的高薪,还给他配备了一辆“雅阁”小轿车。至此,郭启明成功地跳出了“农门”,在他面朝黄土背朝天的父母眼中,他的前途可谓是一片光明。由于经常与商业人士交往合作,年纪轻轻的郭启明经常穿着高档服装,彬彬有礼,谈吐高雅,出入一些高档酒吧和高尔夫俱乐部,俨然一副少年得志须尽欢的模样。
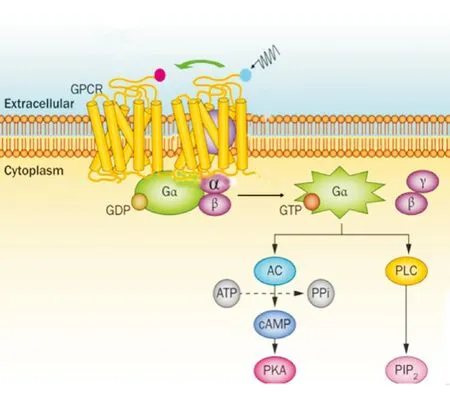
Figure 4.Schematic diagram of GPCR dimerization.AC: adenylate cyclase;PPi:pyrophosphates; cAMP:cyclic adenosine monophosphate; PKA:protein kinase A;PLC: phosphoipase C; PIP2: phosphatidylinositol 4,5-bisphosphate.
图4GPCR二聚化模式图
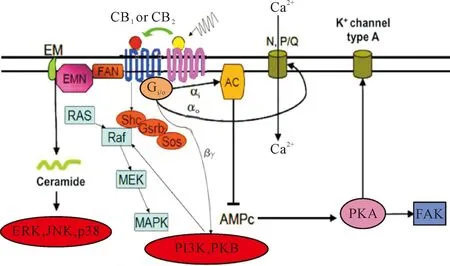
Figure 5.Downstream signaling pathways induced by CB1and CB2. RAS: rat sarcoma; Raf: rapidly accelerated fibrosarcoma; JNK: c-Jun N-terminal kinase; MEK: mitogen-activated protein kinase kinase; MAPK: mitogen- activated protein kinase; ERK:extracellular signal-regulated kinase; p38:MAPK subtype; PI3K: phosphatidylinositol 3-kinase; PKB: protein kinase B; PKA:protein kinase A; Shc: generic shell scriptcompile; FAK: focal adhesion kinase.
图5CB1和CB2形成异源二聚体后介导的下游信号通路
CB1受体是在神经细胞和脑的主要大麻素受体,但它也发生在内分泌细胞和其它外周组织。CB1受体主要与Gi/o蛋白偶联,抑制腺苷酸环化酶,并调节离子通道,包括钙和钾离子通道[14]。此外,活化的CB1受体也可以通过偶联Gs蛋白来激活腺苷酸环化酶,或通过偶联Gq蛋白来增加细胞内钙离子浓度[15]。CB1受体激活后能促进MAPK,如p42/p44 MAPK、p38蛋白和c-Jun N-末端活化激酶的磷酸化激活,它还可以调节核转录因子。活化和磷酸化CB1受体后,其可诱导CB1受体二聚体的形成,并参与调节GPCR信号转导(表1)。CB1受体可以形成同源和异源低聚物,这些受体复合物结构的空间变化会导致其相应的药理学性质发生改变,并且可以在各种组织中观察到药理差异[16]。
CB1受体二聚化激活后可以对胞内多种系统进行调节。CB1R可以介导MAPK通路,激活包括Ras-Raf-ERK1/2通路。CB1受体参与MAPK的激活不依赖于cAMP,但是需要Gi/o蛋白的参与。可能是由Gi/o的β和γ亚基活化PI3K,活化Raf-1,从而激活MAPK;也可能是通过膜磷脂的降解,触发了神经酰胺而活化了MAPK。CB1受体的主要介体是在Gi/o家族的G蛋白中,在大多数组织和细胞中能抑制腺苷酸环化酶,并调节钙离子和钾离子等离子通道。
4.1CB1受体与食欲肽受体1(orexin receptor 1,OXl)形成异源二聚体及其介导的信号通路单细胞荧光共振能量转移成像技术显示食欲素受体与CB1受体在细胞内囊泡中可以形成异/低聚物。CB1受体和OX1受体同属GPCR,两者在体内广泛分布于细胞膜上,均参与摄食、能量平衡、睡眠和觉醒、食物和药物成瘾性的调节。两者作用位点接近,足以形成异聚体共同参与各项功能的调节。多项研究表明CB1受体和OXl受体存在交叉激活作用[17]。当2个受体同时表达时,CBl受体增强食欲素介导的MAPK活性,CBl受体的特异性拮抗剂可阻断上述反应。目前对于CBI受体和OXl受体相互作用的研究主要集中在调节疼痛、食欲、觉醒、肥胖和成瘾性等方面[18]。关于CBI受体和OXl受体交叉激活作用的机制,近期多项研究表明突触后食欲素神经元可以释放内源性大麻素2-AG,通过逆行信使作用于突触前CB1受体,继而激活磷脂酶和二酰基甘油酯酶来发挥作用,该结果有待于进一步研究证实[19]。
4.2CB1受体与多巴胺D2受体形成异源二聚体及其介导的信号通路CB1受体与D2受体形成异源二聚体后介导的信号通路从Gi/o切换到Gs。这是CB1受体与D2受体形成异源二聚体后发生共活化的结果。多巴胺与内源性大麻素受体在基底节显示了较复杂的相互作用,这种相互作用可能是CB1受体和D2受体之间的相互作用,CB1受体和D2受体结合后明显地改变了CB1受体的信号转导途径。用激动剂刺激这2种受体,随后检测这2种受体的亚饱和浓度,发现该2种受体达到最高复合物的水平[20]。得出CB1/D2受体复合物的存在,并且以动态的形式结合。当D2受体被激活后,同时刺激CB1受体时,结果在受体复合物偶联Gs蛋白优先于预期的Gi/o蛋白。CB1受体和D2受体在纹状体神经元形成异源二聚体后发生共刺激,从而导致cAMP积累,而任一受体的刺激只会单独抑制cAMP的释放。纹状体神经元共激活这2种受体后,这2种受体激活不同的信号转导途径,包括CB1受体的假定偶联至Gs蛋白的转导途径[21]。CB1受体和D2受体形成二聚物后,可以介导相关的信号转导途径在相关复合物的基础水平发生。与GABA受体相比,CB1受体和D2受体形成二聚体以后,产生相应的信号转导进行膜定位仅表达单一受体型的细胞系,并且相互作用稳定,单独的CB1受体处于活跃状态,增加了与Gs偶联的机会[22]。

表1 CB1/CB2形成的异源二聚体及后分布的组织介导的信号通路、功能、及其相关的疾病
4.3CB1受体与阿片受体(μ-opioid receptor,μOR)形成异源二聚体及其介导的信号通路荧光共振能量转移技术分析表明,μOR和CB1受体可以形成异源二聚体,并且通过共同的G蛋白发送信号[23]。除了荧光共振能量转移实验,电生理实验也报道过μOR和CB1受体形成异源二聚体的实验结果。此外,该实验还证实在爪蟾卵母细胞中,Gi/o与μOR/CB1受体二聚体偶联,并且与G蛋白偶联的内向整合钾通道1/2(G protein-coupled inwardly potassium channels subunit 1/2,GIRK1/2)一起引起钾离子(K+)内流。由每个受体刺激所产生的信号发送到GIRK,通过Gi/o内源性释放β和γ亚基,从而激活下游通路。μOR和CB1受体形成二聚体后,二者在质膜上的功能是相互影响的,并且其介导的下游信号通路是通过共同的Gi/o蛋白家族完成的,这个家族包括复杂的五聚体结构,而不是在细胞中通过GPCR的内源性表达。与同源二聚体相比,异源二聚体显示出了更加广泛而有效的药理学作用。阿片大麻素类镇痛药药效的协同作用会对其二者单独激活的信号通路产生干扰,这也是μOR/CB1受体异源二聚体的缺陷所在[24]。在啮齿动物模型中探讨CB1受体和阿片受体异二聚体水平对神经性疼痛信号通路影响的实验结果显示,μOR和CB1受体在大鼠的伏隔核核心中均有大量表达,二者也会通过物理作用结合,并且同时刺激这2种受体将导致大鼠体内谷氨酸盐和GABA的释放[25]。此外,μOR/CB1受体异源二聚体激活后,与其二者单独存在时相比,异源二聚体导致细胞外受体调节激酶的活性显著降低。
4.4CB1受体与A2A腺苷受体形成异源二聚体及其介导的信号通路腺苷A2A受体是最丰富的纹状体受体,其优先定位于GABA能神经元。CB1受体也存在于GABA神经元,在树突棘和神经末梢也有分布。CB1受体和腺苷A2A受体可以在活细胞中形成异源二聚体,即使在激动剂刺激下对CB1/A2A异源二聚体也无影响。并且,CB1/D2/A2A可能形成低质异源多聚体,这种复杂的聚合物可能会导致更复杂的CB1受体的功能选择性和介导的细胞信号通路的改变。在共转染的HEK-293T细胞和大鼠纹状体中,CB1受体和腺苷A2A受体形成异源二聚体。在人神经母细胞瘤细胞系,CB1受体激活被认为是完全依赖腺苷A2A受体的活化,即CB1受体与腺苷A2A受体形成异源二聚体后即可激活其下游信号通路[26]。生物发光共振能量转移实验结果显示其下游信号转导通路的信号获得特别依赖A2A/CB1异源二聚化的存在。使用A2A腺苷受体的激动剂CGS刺激或用CB1受体的激动剂ACEA刺激都不会诱发生物发光共振能量转移(bioluminescence resonance energy transfer,BRET)信号的改变,并对A2A/CB1二聚体的形成没有任何影响。CB1受体与Gi/o受体偶联的前提是A2A受体激活Gi/o蛋白,A2A受体的活化并不影响大麻素激动剂激活Gi/o蛋白的能力。此外,Gi/o独立信号的存在也依赖于A2A受体功能的改变,在一定条件下,CB1受体也可以偶联到Gs上。GPCR信号转导通路中的Gi/o独立信号的存在并不依赖于单独的A2A受体,CB1受体与A2A受体形成异源二聚体后,在一定条件下CB1受体会与Gs发生偶联,共同在细胞传导通路中发挥作用。
4.5CB1受体与肾上腺素能β2受体(β2-adrenergic receptor,β2AR)形成异源二聚体及其激活后的信号通路在大脑、心血管、骨、眼和生殖道等组织,CB1/β2AR二聚体对CB1受体的相关信号都有共表达。具体地说,当CB1受体与β2AR形成二聚体进行共表达时,CB1受体介导Gs信号被抑制,Gi/o信号被激活。这种二聚化后形成的相互作用增加了CB1/Gi/o介导的pERK信号通路的活性,而降低了CB1/Gs介导的磷酸化cAMP应答元件的数量。这种作用,即使独立的活化的β2AR也有类似的作用,因为β2AR的激动剂与拮抗剂对CB1受体都无显著影响[26]。
5CB1受体和CB2受体形成二聚体后的主要生理功能
二聚体是最小的功能结构,但是大麻素形成二聚体前后的功能差异以及激动剂对配对四级结构作用的影响还是有很大差距的。某些G蛋白偶联受体似乎有一个严格的形成异二聚体的机制,从而来获得适当的细胞表面表达和相关的功能活性[28]。CB1和CB2大麻素受体是GPCR中识别各种内源性配体和激活多个信号通路的受体。配体和细胞内信号转导机制由内源性大麻素系统中复杂的控制性的生理功能进行调控,需要触发激活受体后对信号转导进行微调节[27]。大麻素受体与其配体成二聚体后,通过抑制cAMP的形成或者激活MAPK(是真核细胞介导细胞外信号到细胞内反应的主要信号系统[29])和磷脂酶A2(phospholipase A2,PLA2)与其它受体形成二聚体(CB1受体至少有一个变构位点)[30]。
5.1大麻素受体二聚化变构调节δ阿片受体从而抑制神经病理性疼痛受体信号转导的多样性增加了受体异二聚体的多样性,导致受体功能的动态改变。虽然一些研究已经表明,大麻素受体是能够在体外形成异聚体。随着周围神经的病变,CB1受体和μ阿片受体在大脑区域选择性表达增加。与此同时,CB1受体/δ阿片受体(delta-opioid receptor, DOR)异聚体在神经病理性疼痛中改变了皮质的功能,从而影响其疼痛感的强弱,这种新型的异聚体定向治疗的策略,可用于减少焦虑与相关慢性疼痛的可能性。
5.2CB1受体和CB2受体异聚化在大脑中的功能作用CB2受体可以与CB1受体形成异聚体在转染神经细胞以及大鼠脑松果体、伏隔核和苍白球中发挥作用。CB1/CB2受体二聚体在神经细胞内表达,激动剂共激活CB1受体和CB2受体导致反向干扰磷酸化Akt和神经突增生[31]。此外,CB1/CB2受体二聚体有一个具体的特征——CB1受体及其拮抗剂可以阻断CB2受体及其激动剂;反之,CB2受体及其拮抗剂可以阻断CB1受体及其激动剂的效果,呈现出双向交叉对立的现象。总之,CB2受体可负调节CB1受体的功能。
6结语和展望
GPCR可以接受胞外多种信号(如激素、神经递质、新陈代谢产物等)的刺激,激活胞内信号蛋白引发多种胞内信号级联反应[31]。目前上市的药物中,近30%是通过靶向作用GPCR发挥功效。GPCR通常以二聚体或寡聚体的形式存在,因此研究GPCR的二聚化及其激活机制显得尤为重要。大麻素受体发生二聚化后介导的下游细胞信号通路的改变在不同的生理机能中扮演了重要的角色,最显著的是对食欲和运动的调控。研究指出,利用一种内源性止痛的方法能够避免中枢大麻素受体对机体的有害副作用,因此,避免以神经中枢大麻素信号为目标的药物对人的精神产生不良影响将是治疗疼痛的一种新方法[32]。此外,一些GPCR受体还参与了轴突的髓鞘化过程,即脑胼胝体中髓鞘蛋白的成熟过程[33]。GPCR受体能够与同源或异源受体结合后能激活细胞内的G蛋白,从而通过不同的信号转导通路产生不同的生物学效应[34]。异源二聚体的发生大大增加了GPCR受体的结构变化和功能反应对药物的开发存在极大的潜力。CB1/D2、CB1/μ、κ、δ阿片受体、CB1/orexin-1受体、CB1/A2A腺苷受体和CB1/β2AR受体形成异源二聚体后介导的相应下游细胞信号通路发生了改变,这是其成为药物作用靶标的关键。
[参考文献]
[1]刘路路,陈京,白波. G蛋白偶联受体异源二聚体及其偏向性配体:未来药物研发的新主角[J]. 中国药理学通报,2013,29(10):1468-1472.
[2]张从芬,彭代银,李庆林,等. G蛋白偶联受体二聚化研究进展[J]. 中国药理学通报,2006,22(7):774-779.
[3]周孟华,莫书荣. G蛋白偶联受体的二聚化及其意义[J]. 现代医药卫生,2007,23(7):1005-1006.
[4]Chiarlone A, Bellocchio L, Blazquez C, et al. A restricted population of CB1 cannabinoid receptors with neuroprotective activity[J]. Proc Natl Acad Sci U S A,2014,111(22):8257-8262.
[5]Console-Bram L, Marcu J, Abood ME. Cannabinoid receptors: nomenclature and pharmacological principles[J]. Prog Neuropsychopharmacol Biol Psychiatry,2012,38(1):4-15.
[6]Paul RK, Ramamoorthy A, Scheers J, et al. Cannabinoid receptor activation correlates with the proapoptotic action of the beta2-adrenergic agonist (R,R')-4-methoxy-1-naphthylfenoterol in HepG2 hepatocarcinoma cells[J]. J Pharmacol Exp Ther,2012,343(1):157-166.
[7]Nagarkatti P, Pandey R, Rieder SA, et al. Cannabinoids as novel anti-inflammatory drugs[J]. Future Med Chem,2009,1(7):1333-1349.
[8]Cabral GA, Griffin-Thomas L. Emerging role of the cannabinoid receptor CB2in immune regulation: therapeutic prospects for neuroinflammation[J]. Expert Rev Mol Med,2009,11:e3.
[9]胡泊,胡婷婷,张小卿,等. 针刺对缓慢性心律失常大鼠心肌Gi Gs含量影响[J]. 中华中医药学刊,2008,26(5):1014-1015.
[10]方邦江,周爽,黄建华. 甲状腺功能减退大鼠海马Gs、Gi蛋白α亚基蛋白表达及半硫丸对其的调节作用[J]. 四川中医,2005,23(07):15-16.
[11]Milligan G. G protein-coupled receptor hetero-dimerization: contribution to pharmacology and function[J]. Br J Pharmacol,2009,158(1):5-14.
[12]Lohse MJ. Dimerization in GPCR mobility and signaling[J]. Curr Opin Pharmacol,2010,10(1):53-58.
[13]Prinster SC, Hague C, Hall RA. Heterodimerization of G protein-coupled receptors:specificity and functional significance[J]. Pharmacol Rev, 2005, 57(3):289-298.
[14]Hudson BD, Hébert TE, Kelly ME. Ligand- and hete-rodimer-directed signaling of the CB1cannabinoid receptor[J]. Mol Pharmacol,2009,77(1):1-9.
[15]Wang ZY, Wang P, Bjorling DE. Activation of cannabinoid receptor 2 inhibits experimental cystitis[J]. Am J Physiol Regul Integr Comp Physiol, 2013, 304(10): R846-R853.
[16]Turu G, Hunyady L. Signal transduction of the CB1cannabinoid receptor[J]. J Mol Endocrinol,2010,44(2):75-85.
[17]朱飞,王湘庆,陈亚楠,等. 大麻素受体1/食欲素受体1-G蛋白偶联受体异聚体及其交叉激活作用研究进展[J]. 解放军医学院学报,2015, 36(1):94-96.
[18]Ellis J, Pediani JD, Canals M, et al. Orexin-1 receptor-cannabinoid CB1receptor heterodimerization results in both ligand-dependent and -independent coordinated alterations of receptor localization and function[J]. J Biol Chem, 2006, 281(50):38812-38824.
[19]Clapper JR, Moreno-Sanz G, Russo R, et al. Anandamide suppresses pain initiation through a peripheral endocannabinoid mechanism[J]. Nature Neurosci,2010,13(10):1265-1270.
[20]Pertwee RG, Howlett AC, Abood ME, et al. International union of basic and clinical pharmacology. LXXIX. Cannabinoid receptors and their ligands: beyond CB1and CB2[J]. Pharmacol Rev,2010,62(4):588-631.
[21]Kearn CS, Blake-Palmer K, Daniel E, et al. Concurrent stimulation of cannabinoid CB1and dopamine D2receptors enhances heterodimer formation: a mechanism for receptor cross-talk?[J]. Mol Pharmacol, 2005, 67(5):1697-1704.
[22]Bushlin I, Gupta A, Stockton SJ, et al. Dimerization with cannabinoid receptors allosterically modulates delta opioid receptor activity during neuropathic pain[J]. PLoS One,2012,7(12):e49789.
[23]Hojo M, Sudo Y, Ando Y, et al. μ-Opioid receptor forms a functional heterodimer with cannabinoid CB1receptor: electrophysiological and FRET assay analysis[J]. J Pharmacol Sci, 2008, 108(3):308-319.
[24]Rios C, Gomes I, Devi LA. μ-Opioid and CB1cannabinoid receptor interactions: reciprocal inhibition of receptor signaling and neuritogenesis[J]. Br J Pharmacol, 2006, 148(4):387-395.
[25]Fattore L, Spano MS, Melis V, et al. Differential effect of opioid and cannabinoid receptor blockade on heroin-seeking reinstatement and cannabinoid substitution in heroin-abstinent rats[J]. Br J Pharmacol, 2011, 163(7):1550-1562.
[26]Carriba P, Ortiz O, Patkar K, et al. Striatal adenosine A2Aand cannabinoid CB1 receptors form functional heteromeric complexes that mediate the motor effects of cannabinoids[J]. Neuropsychopharmacology,2007,32(11):2249-2259.
[27]Hudson BD, Hébert TE, Kelly ME. Physical and functional interaction between CB1cannabinoid receptors and β2-adrenoceptors[J]. Br J Pharmacol, 2010, 160(3):627-642.
[28]Navarro G, Carriba P, Gandí J, et al. Detection of heteromers formed by cannabinoid CB1, dopamine D2, and adenosine A2AG-protein-coupled receptors by combining bimolecular fluorescence complementation and bioluminescence energy transfer[J]. Sci World J, 2008, 8:1088-1097.
[29]刘怒云,张璐,王小宁,等. 多巴胺受体在可卡因诱导的MAPK通路激活和c-fos基因表达中的作用[J]. 中国病理生理杂志,2006,22(06):1092-1095.
[30]李晶,王馨,龙云,等. 大麻CB2受体分子生物学信号及信号传导机制[J]. 中外医疗,2011,31(30):191-192.
[31]Blazquez C, Chiarlone A, Bellocchio L, et al. The CB1cannabinoid receptor signals striatal neuroprotection via a PI3K/Akt/mTORC1/BDNF pathway[J]. Cell Death Differentiation,2015, 22(10):1618-1629.
[32]张宁,陈京,龚磊,等. GPCR二聚体别构调节的药理学作用[J]. 生理科学进展,2013,44(2):93-98.
[33]邓医宇,朱高峰,方明,等. G蛋白偶联受体56基因敲除抑制少突胶质前体细胞成熟[J]. 中国病理生理杂志,2014,30(03):454-459.
[34]蔡欣,陈京,张敬美,等. G蛋白偶联受体激酶在细胞迁移和细胞信号转导中的作用[J]. 中国病理生理杂志,2011,27(07):1438-1444.
(责任编辑: 卢萍, 余小慧)
Mechanism of dimerization and activation of CB1and CB2receptor
WU Nan, YANG Yang, AN Shu, GUO Xiao-xi, XU Tian-rui, LIU Ying
(CellSignalingLaboratory,FacultyofLifeScienceandTechnology,KunmingUniversityofScienceandTechnology,Kunming650500,China.E-mail:xtrgfq@hotmail.com;lyhj_2002@163.com)
[KEY WORDS]Cannabinoid receptor; Dimerization
[ABSTRACT]Cannabinoid receptor 1 (CB1) and cannabinoid receptor 2 (CB2) are important members of G protein-coupled receptors (GPCRs). Numerous studies have shown that CB1receptor can form heterodimers with dopamine receptors (D2), μ-opioid receptor (μOR), orexin-1 receptor, adenosine receptor (A2A) or β2 adrenergic receptors, and then forming an essential functional entity. This review summarizes the research progress on heterodimers of cannabinoid CB1 or CB2, the function of heterodimers as well as the downstream signalings. The different pharmacological properties of the receptor heterodimer lead to bringing a change in receptor pharmacology, which will have a profound impact on drug development.
[文章编号]1000- 4718(2016)01- 0172- 07
[收稿日期]2015- 08- 17[修回日期] 2015- 10- 11
*[基金项目]国家自然科学基金资助项目(No. 81473342; No.U130225);云南省人培基金(No. KKSY201326116);云南省高端科技人才基金(No. 2012HA008)
通讯作者△Tel: 0871-65911300; 徐天瑞 E-mail: xtrgfq@hotmail.com; 刘莹E-mail: lyhj_2002@163.com
[中图分类号]R363
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.01.030
