乳腺癌细胞的容积敏感性氯电流*
2016-07-05张可凡厉冰雪马莲顺朱林燕陈丽新王立伟
张可凡, 厉冰雪, 马莲顺, 杨 琳, 朱林燕, 陈丽新, 王立伟
(暨南大学医学院药理学系,广东 广州 510632)
乳腺癌细胞的容积敏感性氯电流*
张可凡,厉冰雪,马莲顺,杨琳,朱林燕△,陈丽新,王立伟
(暨南大学医学院药理学系,广东 广州 510632)
[摘要]目的: 探讨乳腺癌细胞MCF-7和MDA-MB-231中的容积敏感性氯电流及其生理学和药理学特性。方法: 采用全细胞膜片钳记录模式,在等渗条件下记录MCF-7细胞和MDA-MB-231细胞的背景氯电流;在细胞外灌流47%低渗灌流液使细胞肿胀或灌流47%高渗灌流液使细胞皱缩时,记录氯电流的变化;加入氯通道阻断剂NPPB(100 μmol/L)或Tamoxifen(20 μmol/L)记录容积敏感性氯电流的改变,分析该电流的特性。结果: (1)等渗条件下,记录到MCF-7细胞与MDA-MB-231细胞的背景氯电流有显著差异;(2)胞外低渗诱导细胞肿胀时,可以激活MCF-7细胞和MDA-MB-231细胞容积敏感性氯电流;(3)胞外高渗诱导细胞皱缩时,抑制了低渗激活的容积敏感性氯电流;(4)低渗激活的容积敏感性氯电流能被氯通道阻断剂NPPB抑制;(5)雌激素受体(estrogen receptor,ER)调节剂,同时也是氯通道阻断剂的Tamoxifen也能抑制低渗激活的容积敏感性氯电流。结论: MCF-7细胞和MDA-MB-231细胞均可以记录到容积敏感性氯电流,高渗状态及使用氯通道阻断剂可抑制该氯电流。
[关键词]乳腺癌细胞; 背景氯电流; 容积敏感性氯电流
容积敏感性氯通道参与细胞容积调节功能:在正常生理条件下,细胞容积处于不断的变化中,并通过容积调节功能来维持正常生理活动。当细胞受到非等渗刺激而使容积增大或减小时,细胞自身会通过调节机制使细胞容积向正常恢复,称为调节性容积回缩(regulatory volume decrease,RVD)或调节性容积回升(regulatory volume increase,RVI)。研究表明[1]容积敏感性氯通道参与细胞增殖、细胞周期[2]及细胞迁移[3]过程;本实验室研究证明氯通道阻断剂NPPB能够浓度依赖性抑制容积激活性氯电流,从而抑制细胞RVD的过程[4],进而阻断细胞增殖过程。
乳腺癌是发生在乳腺上皮组织的恶性肿瘤,雌激素对乳腺组织的影响非常重要,它可以与雌激素受体(estrogen receptor, ER)结合形成一种雌激素受体复合物,影响转录和复制,从而产生生理效应[5]。MCF-7细胞是乳腺癌体外实验常用的细胞株,这个细胞系能够保持乳腺组织的许多特性,表达雌激素受体,MDA-MB-231细胞是乳腺癌体外实验的另一种重要的细胞株,该细胞株与MCF-7细胞不同的是不表达雌激素受体。Tamoxifen是一种ER调节剂,作为乳腺癌内分泌治疗的代表药物已被应用于临床30多年,被证实能显著提高乳腺癌患者的无复发生存率及总存活率[6]。经典的ER调节剂Tamoxifen也是常用的氯通道阻断剂。有报道[7],Tamoxifen也可以阻断低渗诱导的雌激素受体阴性细胞容积敏感性氯电流。鲜有文献报道容积敏感性氯通道在乳腺癌细胞是否有表达。本研究利用全细胞膜片钳技术观察记录MCF-7细胞、MDA-MB-231细胞容积敏感性氯电流及其生理学和药理学特性。
材料和方法
1细胞株
本实验采用MCF-7细胞以及MDA-MB-231细胞(购于ATCC细胞库,由本实验室保存)。
2主要药物、试剂和仪器
DMEM培养基、1640培养基、胎牛血清(Gibco);等渗灌流液(isotonic solution,ISO)含(mmol/L):NaCl 70、MgCl20.5、CaCl22、Hepes 10、D-甘露醇 140。47%高渗灌流液(hypotonic solution,HYPO)渗透压为440 mOsmol/L,除溶液中D-甘露醇为280 mmol/L外,其余同等渗液。47%低渗灌流液(hypertonic solution,HYPER)不含D-甘露醇,渗透压为160 mOsmol/L。配制好的液体用冰点渗透压计(Osmomat030)测定渗透压,Tris碱调pH值至7.4。氯通道阻断剂NPPB(Sigma)用二甲基亚砜(DMSO)配制成100 mmol/L的储存液,储存在4 ℃冰箱中,用时用等渗液稀释至最终浓度100 μmol/L。另一种常用的氯通道阻断剂Tamoxifen (Sigma)在使用当天用甲醇新鲜配制成50 mmol/L 原液,使用时用等渗液稀释到最终浓度20 μmol/L。电极内液是灌充在玻璃微电极中起交换细胞内离子作用,组成是(mmol/L):NMDG-Cl 70,MgCl21.2,HEPES 10,EGTA 1,D-甘露醇140,ATP 2,最后用Tris液调pH至7.25,渗透压调至300 mOsmol/L。
3主要方法
3.1细胞培养将MCF-7细胞接种于含有10%胎牛血清、青霉素(1×105U/L)和链霉素(100 mg/L)的DMEM培养基中,MDA-MB-231细胞接种于含有10%胎牛血清、青霉素(1×105U/L)和链霉素(100 mg/L)的1640培养基中,置于5% CO2、37 ℃的孵箱中常规培养,细胞贴壁生长,每2~3 d传代。用0.25%胰蛋白酶+0.02%乙二胺四乙酸消化,收集对数生长期细胞进行实验。
3.2膜片钳全细胞纪录使用外径为1.5 mm、内径为0.86 mm的硼硅酸盐毛细玻璃管,在微电极拉制器上拉制微电极,充灌电极内液,此时其电阻为5~10 MΩ。将贴有细胞的玻片放置在灌流槽中,使用时微电极尖端与细胞膜形成高阻封接,细胞被钳制在0、±40、±80 mV,不断反复循环,每个钳制脉冲波宽200 ms,间隔4 s。用膜片钳放大器记录MCF-7、MDA-MB-231细胞的氯电流,并将电流和电压信号用数模/模数转换器(Cambrige)数字化(采样频率3 kHZ),实验数据用膜片钳软件包(CED)进行软件分析。
4统计学处理
用SPSS 16.0统计软件进行分析。数据用均数±标准误(mean±SEM)表示,用t检验或单因素方差分析检验统计学差异,以P<0.05为差异有统计学意义。
结果
1MCF-7细胞与MDA-MB-231细胞的背景氯电流
全细胞膜片钳技术记录MCF-7细胞与MDA-MB-231细胞氯电流,给予0、±40和±80 mV的指令电压,往复循环。在等渗灌流液下MCF-7细胞有微弱而稳定的背景氯电流,±80 mV电压钳制下内、外向电流密度分别为(-4.86±0.74)pA/pF、(4.50±0.78)pA/pF,MDA-MB-231细胞在±80 mV电压下内、外向电流密度分别为(-16.09±1.75) pA/pF、(14.01±1.47)pA/pF,2种细胞间背景氯电流差异显著(P<0.01),见图1。
2低渗诱导的MCF-7细胞与MDA-MB-231细胞容积敏感性氯电流
当等渗状态下钳制的MCF-7的电流平稳后换47%低渗液进行灌流,可以在(1.58±0.45) min内迅速激活氯电流,在作用(10.42±1.93) min后电流达峰值;等渗灌流雌激素受体阴性乳腺癌细胞MDA-MB-231的电流平稳后,换47%低渗液进行灌流(1.73±0.33)min后,细胞的电流开始变大,在(12.66±2.84)min 后达峰值。2种细胞在低渗条件下细胞肿胀,氯电流明显增大(P<0.01),经计算该电流的翻转电位为(-5.67±0.61) mV,接近氯离子平衡电位。在本实验条件下,由于实验所用电极内液和灌流液均不含K+,并且根据本实验的细胞外液和细胞内液成分,应用能斯特方程[E非标准电极电势=E标准电极电势-(RT/Fn)×(LnJ)]计算出Na+、Ca2+平衡电位均大于200 mV,与翻转电位相差较远,故排除了该电流与K+、Na+、Ca2+3种阳离子的关系,而计算得出的Cl-平衡电位为-0.9 mV,相对来说翻转电位与其是非常接近的,故认为低渗激活的是氯电流,见图2。

Figure 1.The background chloride currents of MCF-7 cells and MDA-MB-231 cells in the isotonic bath solution. Whole cell currents in response to 200 ms voltage steps to 0, ±40 and ±80 mV from a holding potential of 0 mV were recorded. Mean±SEM.n=19.**P<0.01vsMCF-7.
图1MCF-7细胞与MDA-MB-231细胞基础氯电流图

Figure 2.The hypotonicity-induced chloride currents in MCF-7 cells and MDA-MB-231 cells. The typical time courses of MCF-7 cells and MDA-MB-231 cells in the hypotonic bath solution. Mean±SEM.n=9.**P<0.01vsISO.
图2低渗激活MCF-7细胞和MDA-MB-231细胞的氯电流
3MCF-7细胞与MDA-MB-231细胞容积敏感性氯电流的特性研究
3.1容积敏感性利用细胞外高渗刺激诱导MCF-7细胞皱缩,分析该低渗激活的氯电流是否具有容积敏感性。当低渗激活的电流平稳约3 min后,换为47%高渗液灌流细胞,电流迅速减小且完全被抑制;MDA-MB-231细胞低渗激活性氯电流同样具有容积敏感性,可以被高渗液完全抑制。MCF-7细胞在-80 mV钳制下电流密度抑制率为(98.77±1.80)%;在+80 mV钳制下,电流密度抑制率为(97.41±2.39)%,高渗组与低渗组相比差异有统计学意义(P<0.01);MDA-MB-231细胞外向电流密度抑制率为(105.77±5.45)%;内向电流密度抑制率为(103.34±2.13)%,高渗组与低渗组相比差异有统计学意义 (P<0.01),见图3。
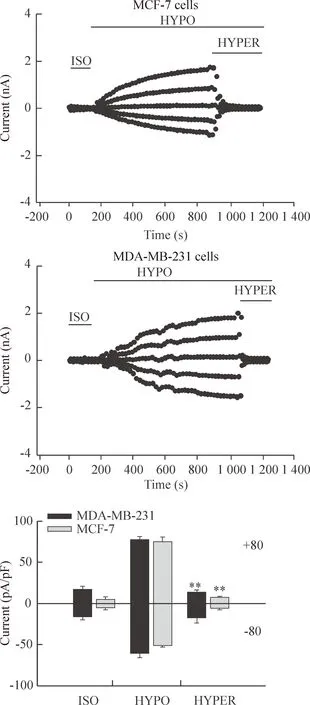
Figure 3.Inhibition of the hypotonicity-induced chloride currents by the hypertonic solution in MCF-7 cells and MDA-MB-231 cells. Means±SEM.n=5.**P<0.01vsHYPO.
图3高渗液抑制低渗激活的MCF-7细胞和MDA-MB-231细胞氯电流
3.2低渗激活性氯电流的药理学特性
3.2.1氯通道阻断剂NPPB对低渗激活性氯电流的作用为分析容积敏感性氯电流的药理学特性,采用氯通道的一种常用阻断剂NPPB作用于MCF-7细胞和MDA-MB-231细胞,可见到电流明显减小。在±80 mV钳制下,MCF-7细胞内向的电流密度抑制率为(77.34±2.79)%,外向电流密度抑制率为(77.61±2.72)%;MDA-MB-231细胞在±80 mV钳制下电流密度抑制率分别为(92.33±7.98)%、(90.92±5.31)%,NPPB抑制组与低渗组相比差异均有统计学意义(P<0.01),见图 4。
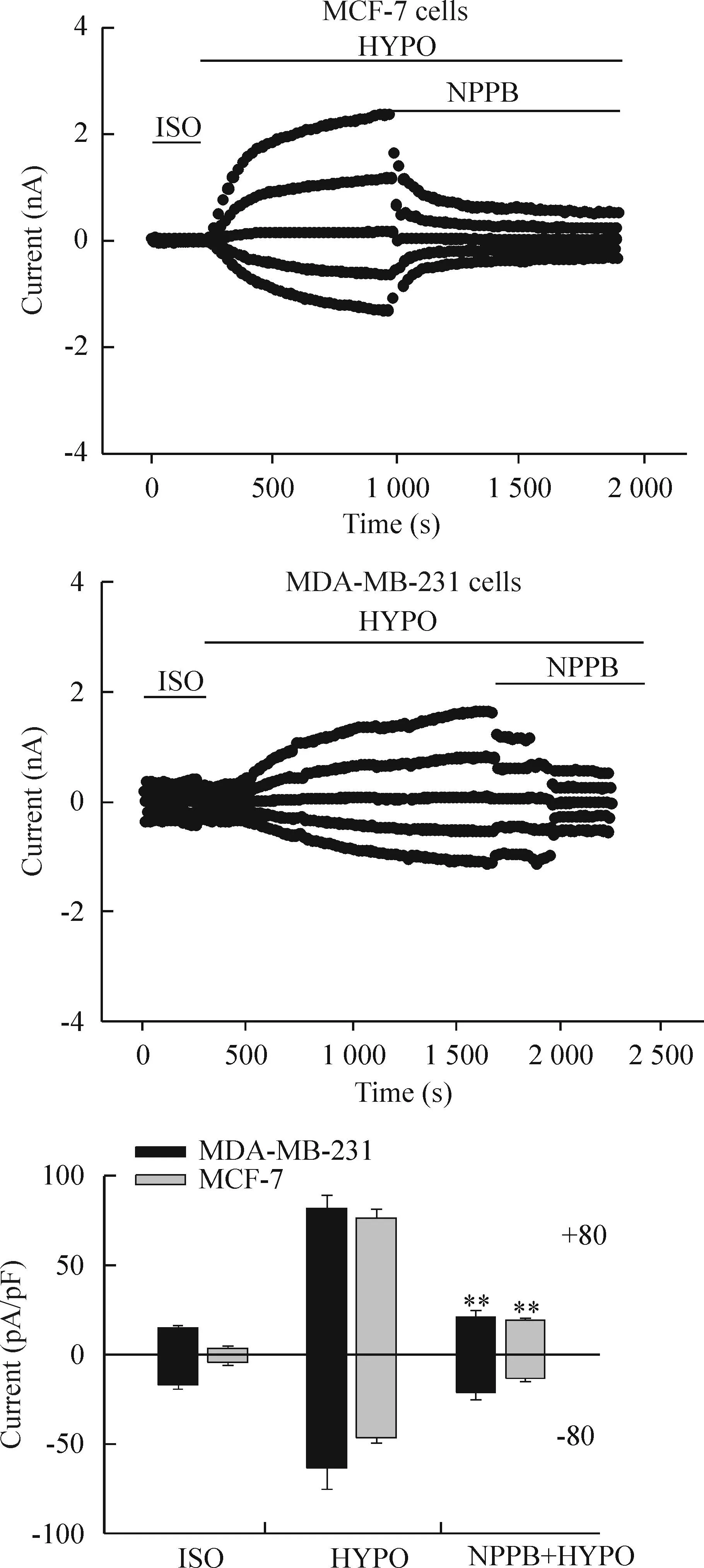
Figure 4.Inhibition of the hypotonicity-induced chloride currents by the chloride channel blocker NPPB in MCF-7 cells and MDA-MB-231 cells. The typical time courses of MCF-7 cells and MDA-MB-231 cells in the hypotonic bath solution, and in the hypotonic bath solution with 100 μmol/L NPPB. Mean±SEM.n=4.**P<0.01vsHYPO.
图4NPPB可抑制低渗激活的MCF-7细胞和MDA-MB-231细胞的全细胞氯电流
3.2.2氯通道阻断剂Tamoxifen抑制低渗激活的氯电流为进一步分析低渗激活氯电流的特性,观察Tamoxifen对该电流的作用,可见到MCF-7细胞和MDA-MB-231细胞低渗激活性氯电流同样明显减小且很快被完全抑制。MCF-7细胞在±80 mV钳制下,细胞内向的电流密度抑制率为(102.68±2.26)%;外向电流密度抑制率为(99.51±1.47)%; MDA-MB-231细胞在±80 mV钳制下电流密度抑制率分别为(104.49±10.08)%、(104.81±8.51)%,低渗组与Tamoxifen抑制组相比差异均有统计学意义(P<0.01),见图5。

Figure 5.Inhibition of hypotonicity-induced chloride currents by the Tamoxifen in MCF-7 cells and MDA-MB-231 cells. The typical time courses of MCF-7 cells and MDA-MB-231 cells in the hypotonic bath solution, and in the hypotonic bath solution with 20 μmol/L Tamoxifen. Mean±SEM.n=4.**P<0.01vsHYPO.
图5Tamoxifen可抑制低渗激活的MCF-7细胞和MDA-MB-231细胞的全细胞氯电流
讨论
在一定细胞内外离子的情况下,给予细胞一定的钳制电压,在不另外施加刺激的情况下可以记录细胞的背景电流,该电流可以被容积敏感性氯通道阻断剂所抑制[8]。在本实验前期的研究中发现,背景氯电流密度在增殖能力强的低分化鼻咽癌细胞比人永生化正常鼻咽上皮细胞明显增大[7]。MDA-MB-231细胞是雌激素受体表达阴性的细胞,恶性程度远高于MCF-7细胞。本实验首先观察等渗状态下2种细胞的背景氯电流,但在等渗条件下记录的MDA-MB-231细胞的背景电流密度明显高于MCF-7细胞,表明开放的氯通道数目在MDA-MB-231细胞明显多于MCF-7细胞,这很可能与MDA-MB-231细胞的高增殖能力相关。本实验室前期研究表明ClC-3(氯通道ClC家族之一)可能是鼻咽癌细胞背景氯电流的重要成分,ClC-3在低分化鼻咽癌细胞中的表达比人永生化正常鼻咽上皮细胞明显增多,那么本实验2种乳腺癌细胞背景氯电流的差异是否由于ClC-3的参与有待进一步实验论证。
细胞外渗透压的变化是研究容积敏感性离子通道的功能和作用的重要方法和手段。研究发现细胞外低渗能够诱导人星形胶质细胞[9]、人胎儿正常鼻咽细胞[10]、人急性淋巴细胞性白血病细胞[11]、鼠肝癌细胞[12]等多种细胞的氯离子外流,与等渗状态下相比,低渗激活的氯电流的电流密度明显增大。在本实验中灌流低渗溶液,观察到2种乳腺癌细胞均能被记录到增大的电流,翻转电位接近于氯离子的平衡电位,因此推断2种细胞均能被记录到低渗激活性的氯电流。经分析比较2种细胞的低渗激活性氯电流潜伏期均较短,增大速度很快,具有明显的外向优势,并且可被细胞外高渗抑制,表现出容积敏感性,而且都可以被氯通道阻断剂NPPB、Tamoxifen抑制。这些均与本实验室前期的低渗激活性的鼻咽癌细胞、正常鼻咽上皮细胞[7]等的氯电流特性相似。本实验研究所采用的是低渗刺激细胞激活氯电流,低渗刺激是一种纯物理刺激,这样激活的氯电流具有容积敏感性,可以被高渗溶液抑制,也能被实验室普遍使用的氯离子通道阻断剂NPPB和Tamoxifen所抑制。那么使用药物刺激,通过相应靶点结合后激活的氯电流是否仍具备容积敏感性,并能被抑制?另外本文所提到Tamoxifen在临床上用作一种内分泌治疗乳腺癌的常用药物,它依赖乳腺癌是否表达雌激素受体来作用,如果它仍可作为一种氯离子通道阻断剂,那么Tamoxifen在治疗乳腺癌的时候是否也通过氯离子通道的途径发挥作用呢?本研究为进一步探讨Tamoxifen抗乳腺癌的作用及机制奠定基础。
[参考文献]
[1]Ohkubo T, Yamazaki J. T-type voltage-activated calcium channel Cav3.1, but not Cav3.2, is involved in the inhibition of proliferation and apoptosis in MCF-7 human breast cancer cells[J]. Int J Oncol, 2012, 41(1):267-275.
[2]Wang L, Ma W, Zhu L, et al. ClC-3 is a candidate of the channel proteins mediating acid-activated chloride currents in nasopharyngeal carcinoma cells [J]. Am J Physiol Cell Physiol, 2012, 303(1):C14-C23.
[3]Mao J, Wang L, Fan A, et al. Blockage of volume-activated chloride channels inhibits migration of nasopharyngeal carcinoma cells [J]. Cell Physiol Biochem, 2007, 19(5-6):249-258.
[4]Yang L, Zhu L, Xu Y, et al. Uncoupling of K+and Cl-transport across the cell membrane in the process of regulatory volume decrease [J]. Biochem Pharmacol, 2012, 84 (3):292-302.
[5]Ascenzi P, Bocedi A, Marino M. Structure-function relationship of estrogen receptor alpha and beta: impact on human health [J]. Mol Aspects Med, 2006, 27(4):299-402.
[6]Sunderland MC, Osborne CK. Tamoxifen in premenopausal patients with metastatic breast cancer: a review [J]. J Clin Oncol, 1991, 9(7):1283-1297.
[7]Zhu L, Yang H, Zuo W, et al. Differential expression and roles of volume-activated chloride channels in control of growth of normal and cancerous nasopharyngeal epithelial cells [J]. Biochem Pharmacol, 2012, 83(3):324-334.
[8]Yang LJ, Ye D, Ye WC, et al. ClC-3 is a main component of background chloride channels activated under isotonic conditions by autocrine ATP in nasopharyngeal carcinoma cells [J]. Journal of Cellular Physiology,2011,226(10):2516-2526.
[9]Bakhramov A, Fenech C, Bolton TB. Chloride current activated by hypotonicity in cultured human astrocytoma cells [J]. Exp Physiol, 1995, 80(3):373-389.
[10]Sun X, Chen L, Luo H, et al. Volume-activated chloride currents in fetal human nasopharyngeal epithelial cells[J]. J Membr Biol, 2012, 245(2):107-115.
[11]Cao G, Zuo W, Fan A, et al. Volume-sensitive chloride channels are involved in maintenance of basal cell volume in human acute lymphoblastic leukemia cells [J]. J Membr Biol, 2011, 240(2):111-119.
[12]Varela D, Penna A, Simon F, et al. P2X4 activation modulates volume-sensitive outwardly rectifying chloride channels in rat hepatoma cells [J]. J Biol Chem, 2010, 285(10):7566-7574.
(责任编辑: 林白霜, 余小慧)
Volume-sensitive chloride current of breast cancer cells
ZHANG Ke-fan, LI Bing-xue, MA Lian-shun, YANG Lin, ZHU Lin-yan, CHEN Li-xin, WANG Li-wei
(PharmacologyDepartment,SchoolofMedicine,JinanUniversity,Guangzhou510632,China.E-mail:tzhuly@jnu.edu.cn)
[ABSTRACT]AIM: To investigate the volume-sensitive chloride current of breast cancer cells MCF-7 and MDA-MB-231. METHODS: The technique of whole-cell patch clamp was used to record the chloride current. The background chloride current of MCF-7 cells and MDA-MB-231 cells was recorded in isosmotic solution. The changes of chloride current were observed when the cells were perfused by 47% hypotonic or 47% hypertonic solutions. The changes of chloride current were observed after adding the chloride channel blocker NPPB (100 μmol/L) or tamoxifen (20 μmol/L). RESULTS: The background currents in estrogen receptor (ER) positive breast cancer MCF-7 cells and ER negative breast cancer MDA-MB-231 cells were statistically different under isotonic conditions. Perfusion of 47% hypotonic solution induced cellular swelling and activated volume-sensitive chloride current. Perfusion of 47% hypertonic solution induced cell shrinkage and inhibited the volume-sensitive chloride current. NPPB and Tamoxifen inhibited the hypotonicity-activated chloride current. CONCLUSION: The volume-sensitive chloride current was recorded in the breast cancer cells MCF-7 and MDA-MB-231, which was inhibited by hypertonic solution and chloride channel blockers.
[KEY WORDS]Breast cancer; Background chloride current; Volume-sensitive chloride current
[文章编号]1000- 4718(2016)01- 0083- 06
[收稿日期]2015- 07- 10[修回日期] 2015- 09- 21
*[基金项目]国家自然科学基金资助项目(No.31070997; No.81372382); 广东省自然科学基金资助项目(No.S201310013780)
通讯作者△Tel: 020-85220242; E-mail: tzhuly@jnu.edu.cn
[中图分类号]R329.2+5; R730.23
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.01.014
