阿瑞匹坦治疗化疗诱导的爆发性恶心呕吐的临床观察
2016-07-01廖子君郭亚焕张彦兵
郑 琪, 廖子君, 李 旭, 郭亚焕, 徐 瑞, 张彦兵, 周 菁, 翟 阳
(西安交通大学医学院附属陕西省肿瘤医院内一科,西安 710061)
阿瑞匹坦治疗化疗诱导的爆发性恶心呕吐的临床观察
郑琪, 廖子君, 李旭, 郭亚焕, 徐瑞, 张彦兵, 周菁, 翟阳
(西安交通大学医学院附属陕西省肿瘤医院内一科,西安710061)
摘要:目的评价阿瑞匹坦治疗化疗诱导的爆发性呕吐的有效性和安全性。 方法收集2014-01~2016-01我科出现化疗诱导的爆发性恶心呕吐病例24例,所有患者化疗前均使用包含5-羟色胺受体拮抗剂、地塞米松在内的两联预防止吐方案,之后的24-72 h所有患者均出现了难以忍受的Ⅱ-Ⅲ度爆发性恶心呕吐。给予患者肌肉注射甲氧氯普胺10 mg,待恶心呕吐症状有所减轻后,口服阿瑞匹坦(第1日口服125 mg,第2-3日口服80 mg)解救治疗,详细记录用药后72 h内反应情况,并对疗效和多种临床因素间的关系进行分析。结果用药患者的恶心呕吐总缓解率达到83.3%(20/24),完全缓解率62.5%(15/24),部分缓解率20.8%(5/24),无反应率16.7%(4/24),未见明显不良反应。统计分析显示,恶心呕吐的缓解率与患者性别、年龄、既往化疗史、化疗方案的致吐风险及患者活动状态评分等临床因素无明显相关性(P>0.05)。结论 阿瑞匹坦对化疗诱导的爆发性呕吐具有良好的疗效,安全性好,可作为解救性治疗的药物之一。
关键词:阿瑞匹坦;化疗诱导;爆发性恶心呕吐
化疗诱导的恶心呕吐(chemotherapy-induced nausea and vomiting,CINV)是化疗最常见的不良反应之一,恶心、呕吐对患者的生理、心理和社会功能均可能造成明显损害,未控制的CINV可导致患者出现代谢紊乱、营养失调及对治疗的恐惧心理,严重影响患者的生活质量和治疗依从性。科学合理地预防和处理CINV,是抗肿瘤治疗顺利进行的基本保障之一。
肿瘤治疗相关呕吐防治指南(2014版)指出,CINV可分为急性、延迟性、预期性、爆发性及难治性5种类型。急性CINV一般发生在给药数分钟至数小时,并在给药后5-6 h达高峰,多在24 h内缓解;延迟性CINV多在化疗24 h之后发生,可持续数天;预期性CINV是指患者在前一次化疗时经历了难以控制的恶心、呕吐之后,在下一次化疗开始之前即发生的恶心呕吐,是一种条件反射,主要由于精神、心理因素等引起;爆发性CINV是指即使进行了预防处理但仍出现的呕吐,并需要进行“解救性治疗”;难治性CINV是指以往的化疗周期中使用预防性和/或解救性止吐治疗失败,而在接下来的化疗周期中仍然出现呕吐[1]。
阿瑞匹坦、5-羟色胺受体拮抗剂加地塞米松的三药联合已被NCCN指南推荐用于高致吐性化疗方案的预防止吐治疗,无论在急性CINV还是在延迟性CINV的防治中均获得了良好的疗效,但有关阿瑞匹坦在爆发性CINV中的作用目前国内外文献罕有报道。
本文回顾性总结了2014-2015年我科在临床中使用阿瑞匹坦治疗爆发性CINV的病例,通过对疗效及其副反应分析,以评价阿瑞匹坦在爆发性CINV治疗中的有效性和安全性,现报道如下。
1资料与方法
1.1一般资料
收集2014-01~2016-01我科使用阿瑞匹坦治疗CINV的患者,从85例病例中筛选出24例使用阿瑞匹坦解救爆发性CINV的患者,包括肺癌8例,胃癌8例,结直肠癌4例,胆囊癌1例,卵巢癌1例,输尿管癌1例,肝小细胞癌1例。年龄28-70岁,男12例,女12例。其中19例患者接受了含有顺铂方案的化疗,5例接受了含有奥沙利铂方案的化疗。所有患者化疗前均常规使用了包含5-HT3受体拮抗剂、地塞米松在内的两联止吐方案。
CINV评价标准:化疗期间出现Ⅱ度或Ⅱ度以上的CINV定义为爆发性CINV。根据常见不良反应评价标准(common terminology criteria for adverse events,CTC-AE 4.0版)进行分级。①恶心程度分级:0 度,无恶心;Ⅰ度,食欲不振但无饮食习惯的改变;Ⅱ度,进食量减少但无明显的体重降低,脱水或营养不良输液补液<24 h ;Ⅲ度,热量或体液量不足需静脉补液或全静脉营养>24 h;Ⅳ度,出现危及生命的后果;Ⅴ度,死亡。②呕吐程度分级:0度,24 h内无呕吐;Ⅰ度,24 h内呕吐<1次;Ⅱ度,24 h内呕吐2-5次,需静脉补液但<24 h;Ⅲ度,24 h内呕吐>6次,需静脉补液或全胃肠外营养>24 h;Ⅳ度,出现危及生命的后果;Ⅴ度,死亡。
患者活动状态(performance status,PS)采用美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分系统,将患者的PS分为6个等级:0分,无症状,能正常活动;1分,有症状,一般行动自由,较重的体力活动受到限制;2分,不能工作,生活尚能自理,白天卧床时间不超过50%;3分,生活仅能部分自理,白天卧床时间超过50%;4分,卧床不起,生活不能自理;5分,死亡。
根据上述标准,评估24例患者在化疗后24-72 h内出现的恶心呕吐。所有患者均排除颅内压增高、胃肠道梗阻或其他药物所致的恶心、呕吐。
1.2治疗方法
当患者出现爆发性CINV后,首先使用甲氧氯普胺10 mg肌肉注射,待恶心呕吐症状有所缓解,不影响口服药物的情况下,给予阿瑞匹坦解救治疗方案(第1天阿瑞匹坦125 mg,第2-3天80 mg),同时输液营养支持治疗。观察所有患者用药期间(72 h)CINV的缓解情况。
1.3观察指标
完全缓解(complete response,CR):恶心、呕吐均为0度;部分缓解(partial response,PR):有Ⅰ度恶心或呕吐;无效:恶心或呕吐达Ⅱ度及以上。总有效率(RR)=(CR+PR)/总例数×100%。
1.4统计学方法
采用SPSS19.0统计学软件进行数据统计分析,采用四格表卡方检验,P<0.05表示差异具有统计学意义。
2结果
2.1基本特征
自2014-01~2016-01共收集到24例爆发性CINV患者的临床资料,患者的年龄、性别、既往化疗史、ECOG-PS评分见表1。
2.2疗效分析
24例患者的爆发性CINV均发生于化疗24 h后,属于迟发性CINV。解救治疗后,20例患者的CINV得到缓解,总有效率83.3%(20/24),其中完全缓解率62.5%(15/24),部分缓解率20.8%(5/24),无反应率16.7%(4/24)。通过统计学分析,CINV的缓解与患者性别、年龄、既往化疗史、化疗方案的致吐风险等级及ECOG-PS评分等临床因素无明显相关性(P>0.05,见表1)。
2.3不良反应
所有患者中,除2例患者出现轻度头晕外(无法确定是否与使用阿瑞匹坦有关),未发现其他明显不良反应。
3讨论
随着医学的进步,无论是急性CINV还是迟发性CINV的防治均取得了较大进展,但对于爆发性CINV的的治疗仍然是一个难题[2-4],爆发性CINV的临床研究也相对较少[5-7]。目前国内外呕吐治疗
表1阿瑞匹坦对爆发性CINV的疗效分析(例)
Table 1Effectiveness of aprepitant in treatment of breakthrough CINV(cases)
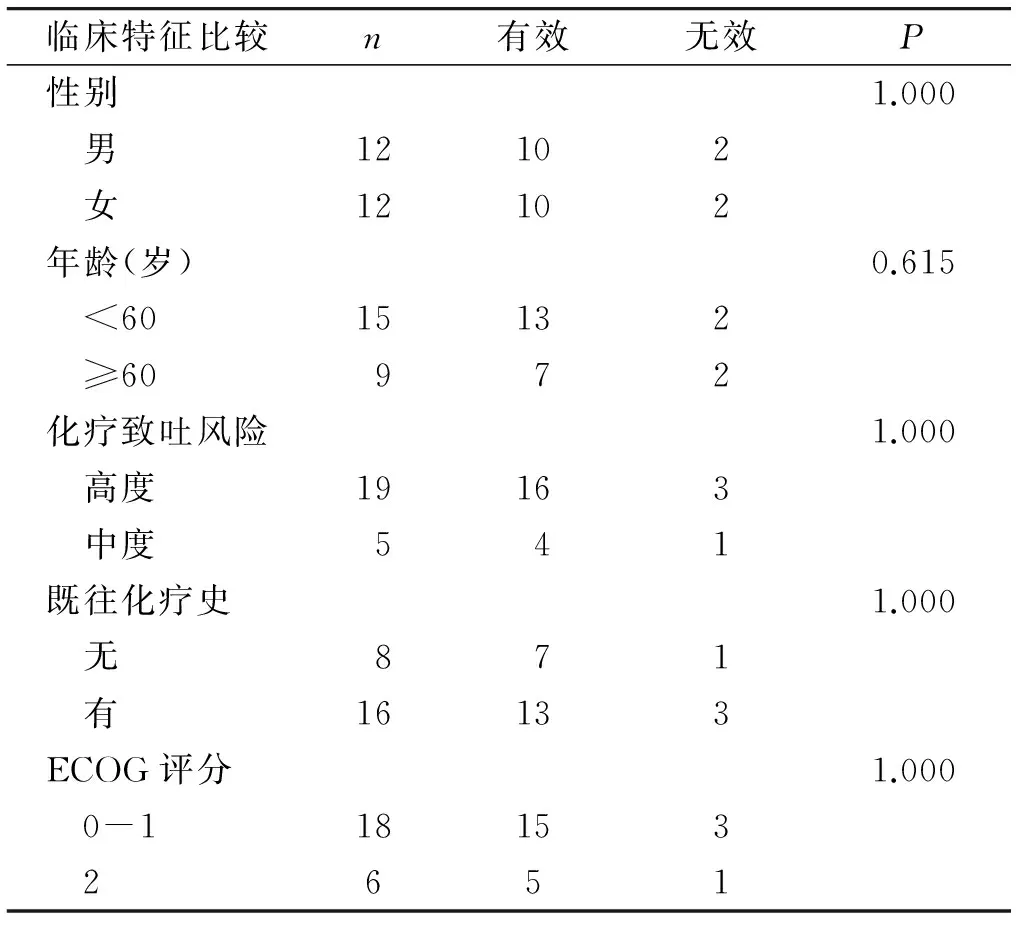
临床特征比较n有效无效P性别1.000 男12102 女12102年龄(岁)0.615 <6015132 ≥60972化疗致吐风险1.000 高度19163 中度541既往化疗史1.000 无871 有16133ECOG评分1.000 0-118153 2651
指南均建议,出现爆发性CINV的患者原则上应选用预防性止吐方案中未用过的止吐药物,如吩噻嗪类、甲氧氯普胺、地塞米松、丁酰苯类、大麻素类、抗胆碱能类药物和奥氮平[1,7]。一项Ⅱ期临床研究中指出,丙氯拉嗪(prochlorperazine,奋乃静)或口服5-HT3受体拮抗剂对CINV具有良好疗效,短期有效率达到了75%[8];另一项Ⅱ期临床研究报道,在CINV患者的掌面皮肤使用含有劳拉西泮(lorazepam)、苯海拉明(diphenhydramine)、氟哌啶醇(haloperidol)的透皮凝胶,对CINV亦有良好疗效[9];近期报道的一项Ⅱ期临床研究发现,口服精神类药物奥氮平(olanzapine)5 mg、12 h 1次,爆发性呕吐的完全缓解率、干呕的控制率和恶心的控制率分别达到了60.9%、71.7%和50.0%,副反应轻微[10]。奥氮平和甲氧氯普胺是国内外指南均推荐用于爆发性CINV的药物,一项Ⅲ期、双盲、随机对照研究对比了两者在爆发性CINV中的疗效。结果显示,奥氮平对于爆发性CINV的疗效要显著优于后者[11]。但在国内的临床实践中,奥氮平尚未被中国国家食品药品监督管理局(CFDA)批准用于治疗爆发性CINV,作为治疗精神分裂症的药物,其处方受到了严格限制,难以推广使用。
阿瑞匹坦是P物质/神经激肽-1(NK-1)受体的一种选择性高亲和力阻断剂,其对NK1受体的亲和力是其他受体的3 000倍以上,对5-羟色胺、多巴胺和皮质激素受体亲和力低或无,且可透过血脑屏障阻断NK1,通过中枢机制抑制CINV[12-14]。多项临床研究已经证实,在接受中、高度致吐药物治疗的患者中,阿瑞匹坦、5-羟色胺受体拮抗剂及地塞米松的三药联合可显著提高患者的完全缓解率(无呕吐且无需解救治疗),并且在肺癌、胃癌、大肠癌、乳腺癌、恶性黑色素瘤等多种恶性肿瘤中均有显著的止吐作用[15-17]。但是,目前国内外指南推荐阿瑞匹坦主要用于高致吐性化疗方案所致CINV的预防性治疗中,对于爆发性CINV的治疗罕见报道[18]。另一方面,阿瑞匹坦虽然于2013年被中国国家食品药品监督管理局批准在国内上市,用于预防高致吐性化疗的初次和重复给药过程中出现的CINV,但由于其价格较高、未能进入医保等因素,在西部地区仍然未能普遍用于高致吐性化疗方案的止吐治疗中。
我科从2014年开始在临床上使用阿瑞匹坦治疗CINV,其疗效显著。由于患者经费和报销问题(未进入医保目录,无法报销),部分患者化疗前不接受在预防止吐方案中加入阿瑞匹坦,但在出现爆发性恶心呕吐后试用阿瑞匹坦进行解救治疗,取得令人满意的疗效。本研究汇总了我科两年来24例使用阿瑞匹坦治疗爆发性CINV的临床病例,通过观察和统计分析,爆发性CINV患者使用阿瑞匹坦后,CINV的总缓解率达到了83.3%,化疗相关消化道反应明显减轻,生活质量得到改善,有利于后续治疗的顺利进行。经过随访后,三分之二的患者(16/24)在下一周期的化疗中选择阿瑞匹坦作为预防性止吐用药。
研究结果还提示,阿瑞匹坦控制爆发性CINV的疗效与患者性别、年龄、既往化疗史、化疗方案的致吐风险等级及ECOG-PS评分等临床因素无明显相关性。但由于研究样本量偏小(24例),尚需要大样本的临床研究进一步证实。国外一项随机对照的Ⅲ期临床研究显示,阿瑞匹坦在男性和≥55岁的人群中有效率更高,但可能受到不同化疗方案的影响。在各个年龄、性别、地域分组中阿瑞匹坦组止吐疗效均优于无阿瑞匹坦组[19]。本研究中,80%(19/24)的患者使用含有顺铂的高致吐性化疗方案,其余5例患者均为使用中度致吐性化疗方案(FOLFOX,奥沙利铂+氟尿嘧啶)。患者首次爆发性恶心呕吐均见于化疗24 h后,属于迟发性CINV。此时常规的两联止吐方案(5-HT3受体拮抗剂+地塞米松)仍然在使用过程中。研究发现,急性CINV的发生主要与5-HT3的释放有关,所以此时使用5-HT3受体拮抗剂效果较好,而迟发性CINV中主要与P物质有关,所以NK-1受体拮抗剂理论上对于迟发性CINV疗效更佳[1,20]。
国外研究结果显示,阿瑞匹坦的安全性良好[21],常见副反应主要有便秘,其他副反应少见且轻微。在本研究中,阿瑞匹坦使用后未观察到明显的不良反应,仅2人出现轻度头晕,不过由于化疗期间同时使用了多种药物,无法判定是否与阿瑞匹坦有关。虽然安全性良好,但阿瑞匹坦的主要代谢途径是经细胞色素P450同工酶CYP3A4参与完成的,因此需注意阿瑞匹坦与其他同样经CYP3A4代谢药物间的相互作用,必要时调整其他药物用量。
阿瑞匹坦的不足之处在于其剂型为口服制剂,部分发生CINV的患者由于恶心严重,饮水后即出现呕吐,无法顺利口服药物,此时服用阿瑞匹坦可能在药物未起效时即被呕出,造成失效和浪费。故建议爆发性CINV的患者首次使用阿瑞匹坦前,给予速效止吐针剂(如甲氧氯普胺,甲氧氯普胺禁忌患者可选用异丙嗪、溴米那普鲁卡因胺等药物)暂时缓解恶心呕吐,然后口服药物,同时加强补液支持治疗,维持水电解质平衡,保证治疗的顺利进行。甲氧氯普胺虽然对爆发性CINV有一定疗效,但其半衰期短,增加剂量和使用频率后锥体外系反应的发生率明显升高,所以用来配合阿瑞匹坦治疗更为适合。
另外,对于一些特殊患者,如食管癌、头颈部肿瘤导致吞咽困难的患者,阿瑞匹坦的应用受到限制。不过,该问题有望被阿瑞匹坦的静脉剂型(福沙匹坦)解决。福沙匹坦是阿瑞匹坦的前体药物,注射后在体内迅速转化成阿瑞匹坦,2010年该药物已在美国获批上市,但在我国尚未获批。临床研究显示,福沙匹坦与NK-1受体的结合效率和阿瑞匹坦相当[22]。国产福沙匹坦的Ⅲ期临床试验于2015年已经完成,如果顺利上市的话,可能解决国内口服给药困难的患者的问题。
综上所述,本研究结果表明,阿瑞匹坦对爆发性CINV具有良好的临床疗效,可改善化疗患者的生活质量,安全性良好,值得进一步研究。
参考文献:
[1]中国抗癌协会癌症康复与姑息治疗专业委员会(CRPC),中国临床肿瘤学会抗肿瘤药物安全管理专家委员会(ASMC).肿瘤治疗相关呕吐防治指南(2014版)[J].临床肿瘤学杂志,2014,19(3):263-273.
[2]Tina Shih YC,Xu Y,Elting LS.Costs of uncontrolled chemotherapy-induced nausea and vomiting among working-age cancer patients receiving highly or moderately emetogenic chemotherapy[J].Cancer,2007,110(3):678-685.
[3]Grunberg SM,Deuson RR,Mavros P,etal.Incidence of chemotherapy-induced nausea and emesis after modern antiemetics[J].Cancer,2004,100(10):2261-2268.
[4]Hickok JT,Roscoe JA,Morrow GR,etal.Nausea and emesis remain significant problems of chemotherapy despite prophylaxis with 5-hydroxytryptamine-3 antiemetics: a University of Rochester James P. Wilmot Cancer Center Community Clinical Oncology Program Study of 360 cancer patients treated in the community[J].Cancer,2003,97(11):2880-2886.
[5]Roila F,Herrstedt J,Aapro M,etal.Guideline update for MASCC and ESMO in the prevention of chemotherapy-and radiotherapy-induced nausea and vomiting:results of the Perugia consensus conference[J].Ann Oncol,2010,21 Suppl 5:v232-243.
[6]Basch E,Prestrud AA,Hesketh PJ,etal.Antiemetics:American Society of Clinical Oncology clinical practice guideline update[J].J Clin Oncol,2011,29(31):4189-4198.
[7]National Comprehensive Cancer Network(NCCN).NCCN Clinical Practice Guidelines in Oncology Version 2.2015:Antiemesis,National Comprehensive Cancer Network (NCCN),2015[EB/OL].http://www.nccn.org/professionals/physician gls/PDF/antiemesis.pdf[2016-03-06].
[8]Jones JM,Qin R,Bardia A,etal.Antiemetics for chemotherapy-induced nausea and vomiting occurring despite prophylactic antiemetic therapy[J].J Palliat Med,2011,14(7):810-814.
[9]Bleicher J,Bhaskara A,Huyck T,etal.Lorazepam,diphenhydramine,and haloperidol transdermal gel for rescue from chemotherapy-induced nausea/vomiting:results of two pilot trials[J].J Support Oncol,2008,6(1):27-32.
[10]Chanthawong S,Subongkot S,Sookprasert A.Effectiveness of olanzapine for the treatment of breakthrough chemotherapy induced nausea and vomiting[J].J Med Assoc Thai,2014,97(3):349-355.
[11]Navari RM,Nagy CK,Gray SE.The use of olanzapine versus metoclopramide for the treatment of breakthrough chemotherapy-induced nausea and vomiting in patients receiving highly emetogenic chemotherapy[J].Support Care Cancer,2013,21(6):1655-1663.
[12]Tattersall FD,Rycroft W,Francis B,etal.Tachykinin NK1 receptor antagonists act centrally to inhibit emesis induced by the chemotherapeutic agent cisplatin in ferrets[J].Neuropharmacology,1996,35(8):1121-1129.
[13]Huskey SE,Dean BJ,Bakhtiar R.Brain penetration of aprepitant,a substance P receptor antagonist,in ferrets[J].Drug Metab Dispos,2003,31(6):785-791.
[14]Bergström M,Hargreaves RJ,Burns HD,etal.Human positron emission tomography studies of brain neurokinin 1 receptor occupancy by aprepitant[J].Biol Psychiatry,2004,55(10):1007-1012.
[15]Aapro MS,Schmoll HJ,Jahn F,etal.Review of the efficacy of aprepitant for the prevention of chemotherapy-induced nausea and vomiting in a range of tumor types[J].Cancer Treat Rev,2013,39(1):113-117.
[16]Hesketh PJ,Grunberg SM,Gralla RJ.The oral neurokinin-1 antagonist aprepitant for the prevention of chemotherapy-induced nausea and vomiting:a multinational,randomized,double-blind,placebo-controlled trial in patients receiving high-dose cisplatin-the Aprepitant Protocol 052 Study Group[J].J Clin Oncol,2003,21(22):4112-4119.
[17]毛丽丽,斯璐,王轩.阿瑞匹坦对黑色素瘤患者顺铂治疗引起恶心呕吐的止吐作用[J].肿瘤防治研究,2015,42(7):712-715.[18]Navari RM.Treatment of Breakthrough and Refractory Chemotherapy-Induced Nausea and Vomiting[J].Biomed Res Int,2015,2015:595894.
[19]Uchino J,Hirano R,Tashiro N,etal.Efficacy of aprepitant in patients with advanced or recurrent lung cancer receiving moderately emetogenic chemotherapy[J].Asian Pac J Cancer Prev,2012,13(8):4187-4190.
[20]Curran MP,Robinson DM.Aprepitant:a review of its use in the prevention of nausea and vomiting[J].Drugs,2009,69(13):1853-1078.
[21]Ruhlmann CH,Herrstedt J.Safety evaluation of aprepitant for the prevention of chemotherapy-induced nausea and vomiting[J].Expert Opin Drug Saf,2011,10(3):449-462.
[22]Van Laere K,De Hoon J,Bormans G,etal.Equivalent dynamic human brain NK1-receptor occupancy following single-dose i.v.fosaprepitantvs.oral aprepitant as assessed by PET imaging[J].Clin Pharmacol Ther,2012,92(2):243-250.
Clinical observation on the effects of aprepitant in the treatment of breakthrough chemotherapy-induced nausea and vomiting
ZHENG Qi, LIAO Zijun, LI Xu, GUO Yahuan, XU Rui, ZHANG Yanbing, ZHOU Jing, ZHAI Yang
(FirstDepartmentofMedicalOncology,AffiliatedShaanxiProvincialCancerHospital,CollegeofMedicine,Xi’anJiaotongUniversity,Xi’an710061,China)
Abstract:ObjectiveTo evaluate the efficacy and safety of aprepitant in treating breakthrough chemotherapy-induced nausea and vomiting. MethodsTwenty-four patients who experienced breakthrough chemotherapy-induced nausea and vomiting from January 2014 to January 2016 were collected. All patients were given two-agent prophylaxis schedule including 5-HT3 receptor antagonists and dexamethasone before chemotherapy, and exhibited unbearable Ⅱ-Ⅲ nausea and vomiting in the following 24-72 h. Rescue schedule(oral 125 mg aprepitant at the first day,80 mg at the second and third day)was administered when the symptoms of nausea and vomiting were partly relieved by intramuscular injection of 10 mg metoclopramide. Then reactions of therapy in 72 h were recorded in detail, and the relationship between the efficacy and a series of clinical parameters were analyzed.ResultsThe overall successful rate of aprepitant was 83.3%(20/24), including a complete response rate of 62.5%(15/24), a partial response rate of 20.8%(5/24)and a non-response rate of 16.7%(4/24). No obvious adverse effects were observed. The successful rate was not related with gender, age, chemotherapy history, emetogenicity of chemotherapy regimens, and performance status score(P>0.05).ConclusionAprepitant demonstrate high efficacy and safety in the treatment of breakthrough chemotherapy-induced nausea and vomiting, and can serve as a rescue therapy agent.
Key words:aprepitant;chemotherapy induction;breakthrough nausea and vomiting
作者简介:郑琪,男,1979-03生,博士,主治医师,E-mail:snowpinezq@163.com
收稿日期:2016-03-06
中图分类号:R730.5
文献标志码:A
文章编号:1007-6611(2016)06-0539-05
DOI:10.13753/j.issn.1007-6611.2016.06.012
