miR-141表达抑制增强结肠癌细胞对5-Fu药物敏感性的研究
2016-07-01马一楠金迎迎王亚利陈青娟
马一楠, 金迎迎*, 王亚利, 陈青娟, 卫 阳
(1西安交通大学第二附属医院肿瘤科,西安 710004; 2咸阳市中心医院肿瘤科; 3西安交通大学第二附属医院科研中心实验室; *通讯作者,E-mail:yingyingjin717@sina.com)
miR-141表达抑制增强结肠癌细胞对5-Fu药物敏感性的研究
马一楠1, 金迎迎1*, 王亚利1, 陈青娟2, 卫阳3
(1西安交通大学第二附属医院肿瘤科,西安710004;2咸阳市中心医院肿瘤科;3西安交通大学第二附属医院科研中心实验室;*通讯作者,E-mail:yingyingjin717@sina.com)
摘要:目的建立人结肠癌5-氟尿嘧啶(5-Fu)耐药细胞株,并探讨miR-141靶向作用PPP2R1B介导结肠癌细胞对5-Fu耐药的机制。方法通过药物敏感性实验,选取5-Fu敏感细胞COLO-320细胞株采取大剂量冲击联合剂量递增法,诱导筛选5-Fu耐药结肠癌细胞株,稳定传代。四甲基偶氮唑盐法(MTT)检测耐药细胞和亲本细胞的半数抑制浓度(IC50)。PCR的微阵列技术比较亲本细胞和5-Fu耐药细胞差异表达的miRNA分子,从中筛选出1个差异表达的miR-141分子。利用数据库Targetscan和miRBase database预测miR-141的靶基因为PPP2R1B,利用双荧光素酶报告基因检测进行鉴定。基因敲除miR-141后分析miR-141对PPP2R1B的调控作用。结果COLO-320细胞株经大剂量冲击联合剂量递增的方法诱导后可在5.0 μmol/L的5-Fu培养液中稳定增殖,具有耐药性,命名为COLO-320/5-Fu,该细胞株5-Fu的IC50显著高于亲代细胞(P<0.05)。芯片结果显示共有13个miRNAs在耐药细胞株中差异性表达,其中miRNA-141表达增加最为显著(P<0.05)。敲除该miR-141后,耐药细胞的5-Fu敏感性显著增加,凋亡比例增加(P<0.05)。结果显示,PPP2R1B为miR-141的靶基因,miRNA-141表达抑制显著上调PPP2R1B的表达水平并进而影响Akt磷酸化过程。结论本实验成功构建COLO-320/5-Fu耐药细胞株,miR-141可能通过靶向调控PPP2R1B,进而参与调控结肠癌细胞对5-Fu的耐药。
关键词:结肠癌;5-氟尿嘧啶;蛋白质磷酸酶2调节亚基1B;耐药性;微小RNA
结肠癌是严重危及人类健康的常见恶性肿瘤之一,美国癌症数据显示其发病率居全球第三,结肠癌相关死亡率位居全球第二[1]。5-氟尿嘧啶(5-Fu)是目前治疗结肠癌使用最广的化疗药物。其主要作用为通过阻断胸苷合成酶的活性,中断嘧啶胸苷的合成,进而影响肿瘤细胞DNA复制。另外,5-Fu可以通过诱导细胞周期停滞、促进肿瘤细胞凋亡来达到治疗肿瘤的目的[2]。5-Fu常与其他化疗药物联合应用,虽能有效降低结肠癌患者的死亡率,但复发和转移阻碍了其疗效的进一步提高。研究发现5-Fu耐药是导致患者预后不良的主要原因[3]。因此,尽早发现结肠癌耐药患者,探索5-Fu的耐药机制,并对其进行干预治疗,对改善耐药患者的预后尤为重要。
研究发现耐药性的产生与许多分子机制相关,包括周期阻滞、凋亡抑制、代谢异常等[4-7]。微小RNA(microRNAs,miRNA)是一类长约22 nt非编码RNA分子,其主要是通过结合其靶基因mRNA的3′-非编码区以引发序列特异性mRNA切割或抑制翻译调节基因表达[8]。其中miRNA调节机体近1/3生命活动,与机体生长、发育、增殖、凋亡等代谢活动密切相关,病理状态下主要参与调控肿瘤的恶性生物学行为[9,10]。大量研究表明miRNA与肿瘤的发生密切相关,通过转录后调节肿瘤相关基因的表达,包括细胞增殖、凋亡、细胞周期阻滞、血管形成和转移等基因,促进肿瘤的发生发展[11-13]。miRNA在肿瘤耐药过程中发挥的作用近年来倍受关注,一些miRNA可能通过其靶基因参与化学药物耐药性的产生[14,15]。miRNA在5-Fu耐药过程中的作用及机制尚不清楚。
蛋白磷酸酶2A(protein phosphatase 2A,PP2A)是真核细胞内广泛表达的丝氨酸/苏氨酸蛋白磷酸酶家族的主要成员,在去磷酸化底物分子及调节大多数细胞事件和生物过程中具有关键性作用。PP2A是由不同亚基组成的结构复合体,其在细胞内生理功能的发挥有赖于各亚基的正常转录和表达[16]。其中,Aβ被认为是核心亚基,该亚基由蛋白质磷酸酶2调节亚基1B(PPP2R1B)基因编码。PPP2R1B基因共有15个外显子,总长度约有27 kb,位于染色体11q23区域,该区域是癌细胞常缺失的一段区域[17,18],研究报道PPP2R1B基因在结直肠癌及其他多种癌组织样本中表达下降[19,20]。体外实验发现PPP2R1B的表达改变可显著影响PP2A对Akt信号通路的去磷酸化作用,进而影响癌细胞对多种化疗药物的敏感性[21,22]。
本研究用5-Fu对人结肠癌细胞株进行诱导,建立结肠癌耐药细胞株,探讨其生物学特性,并筛选耐药细胞和亲本细胞中差异表达的miRNA分子及可能涉及的分子调控机制,为寻找耐药逆转剂的研究提供实验依据。
1材料与方法
1.1主要仪器与试剂
Eppendorf 5810R型台式大容量高速冷冻离心机(德国Eppendorf公司),Nikon Eclipse Ti-E型倒置显微镜(日本Nikon公司),AppliedBiosystems7500实时PCR仪(美国ABI公司),凝胶成像系统和FACS Calibur流式细胞仪(美国BD公司),倒置荧光显微镜(德国Leica),双荧光素酶分析系统(美国Promega公司)。
人结肠癌细胞株COLO320,Caco-2,RKO,HCT-116,HCT-29(美国American Types Culture Collection,ATCC),小牛血清和RPMI1640培养基(美国Gibco公司),TRizol试剂,Lipofectamin2000和Annexin Ⅴ/PI凋亡试剂盒(美国Invitrogen公司),miRNA表达芯片Human Apoptosis miRNA PCR Array:MIHS-114Z(德国Qiagen公司),miRNA提取试剂盒(美国Roche公司),miRNA抑制剂和模拟物(上海吉玛公司),miRNA-141引物(上海生工),四甲基偶氮唑盐(methylthiazolyl tetrazolium,MTT)和结晶紫染色试剂序列(美国Sigma公司),RT逆转录试剂盒(大连宝生物),蛋白质磷酸酶2调节亚基1B(PPP2R1B)抗体,β-actin,蛋白激酶B(AKT)和磷酸化的蛋白激酶B(Phospho-AKT)抗体(美国Cell Signaling公司)。
1.2细胞培养及耐药细胞系的建立
人结肠癌细胞株加入浓度为10%小牛血清的RPMI1640完全培养基,37 ℃、5%CO2孵箱培养。根据以往的结肠癌细胞特性的研究结果以及本次实验的药物敏感性测试结果,相对于其他结肠癌细胞系,COLO320对5-Fu最为敏感。因此,本实验采取大剂量冲击联合剂量递增的方法建立5-Fu耐药结肠癌耐药细胞株COLO320-R。先用50 mg/L 5-Fu的培养液作用约24 h,观察有70%细胞死亡时,停止药物作用,PBS缓冲液冲洗2次,此时仅有10%-20%细胞贴壁生长,用含100 ml/L胎牛血清的RPMI1640培养液持续培养至细胞铺满瓶底80%,然后在培养液中加入初始剂量为0.1 μmol/L的5-Fu,细胞在此剂量下培养3 d,然后在不含5-Fu的细胞培养液中达到70%生长。待细胞进入对数生长期时,分瓶传代,以梯度增加方式,给予2.0倍浓度的5-Fu继续培养,按照此方式逐渐增加剂量,直至细胞可以在含5.0 μmol/L 5-Fu的培养基中正常生长,将此耐药细胞系命名为COLO320/5-Fu。
1.3四甲基偶氮唑盐(MTT)测试细胞IC50
用MTT法检测比较耐药细胞和亲代细胞对5-Fu的敏感性。取对数生长期的细胞,用2.5 g/L胰酶消化,RPMI1640培养液制成单细胞悬液,接种到96孔板(100 μl/孔,5×103/孔),培养24 h,加入不同浓度的5-Fu(设4复孔和阴性对照),再培养72 h,每孔加入MTT液20 μl培养4 h,离心,弃上清,加入二甲亚砜100 μl/孔,震荡摇匀,紫色颗粒溶解后上酶标仪测定吸光度,波长570 nm,以药物浓度为横轴,细胞存活率为纵轴,绘制浓度-效应曲线,确定半数抑制浓度(IC50)。
1.4细胞克隆形成实验和凋亡实验
在集落形成测定中,1×103转染的细胞接种到6孔板,每孔用含不同浓度的5-Fu处理。每3 d替换1次含有5-Fu的培养基,直到形成可见菌落。菌落用4%多聚甲醛固定并用0.1%结晶紫染色。对菌落直径>50 μm的进行计数。流式细胞仪检测细胞凋亡率:用胰酶消化法收集细胞,预冷的PBS洗2次,Annexin Ⅴ室温下避光染色30 min,上流式细胞仪检测。每组实验重复3次。WinMDI2.8软件分析AnnexinⅤ-FITC单染细胞所占百分率即细胞凋亡率。
1.5miRNA拮抗剂转染细胞
耐药细胞和对照细胞在培养皿中生长至70%覆盖培养皿。然后按照厂商说明用siRORT转染试剂将5 nmol/L的miR-141拮抗剂或阴性对照分别转染入细胞。细胞继续培养72 h,然后收集细胞,RT-PCR测定转染效率,并进行细胞功能学测试。
1.6荧光报告基因实验
用Lipofectamine2000构建包含PPP2R1B野生和突变3′-UTR结合区域序列的荧光素酶报告构建体。耐药细胞以约1.5×104的密度接种到96孔板/孔,然后和共转染的miRNA-141模拟物以及荧光素酶报告构建体共转染,将细胞在裂解缓冲液转染后48 h裂解。使用双荧光素酶分析系统的海肾和萤火虫荧光素酶活性进行定量。
1.7基于PCR的miRNA微阵列及miRNA的RT-PCR逆转录实验
分别从亲代细胞和耐药细胞中提取RNA,采用Human Apoptosis miRNA PCR Array:MIHS-114Z 试剂盒利用qRT-PCR方法测试差异miRNA表达差异。RNU48作为内参基因计算标准化Ct值。耐药细胞的每个miRNA值与亲代对照细胞比较得到差异表达率。
定量PCR引物序列如下:miR-141Forward:5′-GCGAAAGCATTTGCCAAGAA-3′;Reverse:5′-CAATCACAGACCTGTTATTGC-3′,以RNU48作为内参。定量PCR条件如下:95 ℃预变性2 min,94 ℃变性1 min,60 ℃退火1 min,72 ℃延伸1 min,循环40次;5 ℃保温30 s,行熔解曲线分析。miRNA的相对含量根据2-ΔΔCt计算。
1.8蛋白印迹实验检测PPP2R1B,Akt和磷酸化Akt蛋白表达水平
用蛋白裂解液于冰上裂解细胞30 min,4 ℃, 10 000 r/min,离心40 min,取上清-80 ℃储存备用,上清用Bradford法测定蛋白浓度,样品95 ℃变性5 min后,每孔上样60 μg,SDS-PAGE(5%焦集胶、8%分离胶)电泳80 V 2 h转膜于聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF) 膜上,用4%脱脂奶粉/TBST 室温下封闭抗原1.5 h。一抗用4%脱脂奶粉/TBST稀释后4℃孵育PVDF膜过夜(稀释比例1∶400)。TBST洗膜3次,每次10 min,然后加入二抗,室温下摇床孵育1 h,再次TBST洗膜3次,每次10 min。ECL曝光显影。
1.9统计学分析
应用SPSS 13.0软件进行统计学处理,计量数据以均数±标准差表示,多组间均数比较采用单因素方差分析(One-way ANOVA),两两比较采用LSD法,双侧检验。P<0.05为差异有统计学意义。
2结果
2.15-Fu耐药细胞的建立和差异表达miRNAs
根据以往结肠癌细胞特性的研究结果以及本次实验的药物敏感性测试结果,相对于其他结肠癌细胞系(Caco-2,RKO,HCT-116,HCT-29),COLO320对5-Fu最为敏感(P<0.05,见图1A)。按照剂量逐步递增法,本实验成功构建了5-FU耐药的结肠癌细胞株,耐药细胞株的IC50比亲代细胞增长8.8倍[(9.50±0.47)μmol/Lvs(1.13±0.14)μmol/L,P<0.05,见图1B]。基于PCR的miRNA微阵列结果显示:与亲代细胞比较,耐药细胞中的7个miRNA表达增加大于1.5倍,6个表达改变减少小于1.5倍(见表1)。其中miRNA-141表达水平在两组细胞系中变化最大。
2.2miR-141的表达抑制可以逆转耐药细胞耐药性
为了进一步研究miR-141对COLO-320/5-Fu细胞增殖和药物敏感性的影响,给予COLO-320/5-Fu转染miR-141抑制剂。转染效果经过RT-PCR验证(P<0.05,见图2A)。MTT实验证实miR-141抑制剂转染的细胞,5-Fu药物敏感性与耐药细胞相比明显增加[(1.22±0.19)μmol/Lvs(9.47±0.53)μmol/L,P<0.05,见图2B]。
表15-Fu耐药细胞和亲代细胞差异表达的miRNA
Table 1Differential miRNA profile expression in 5-Fu resistant cell line and parental cell line
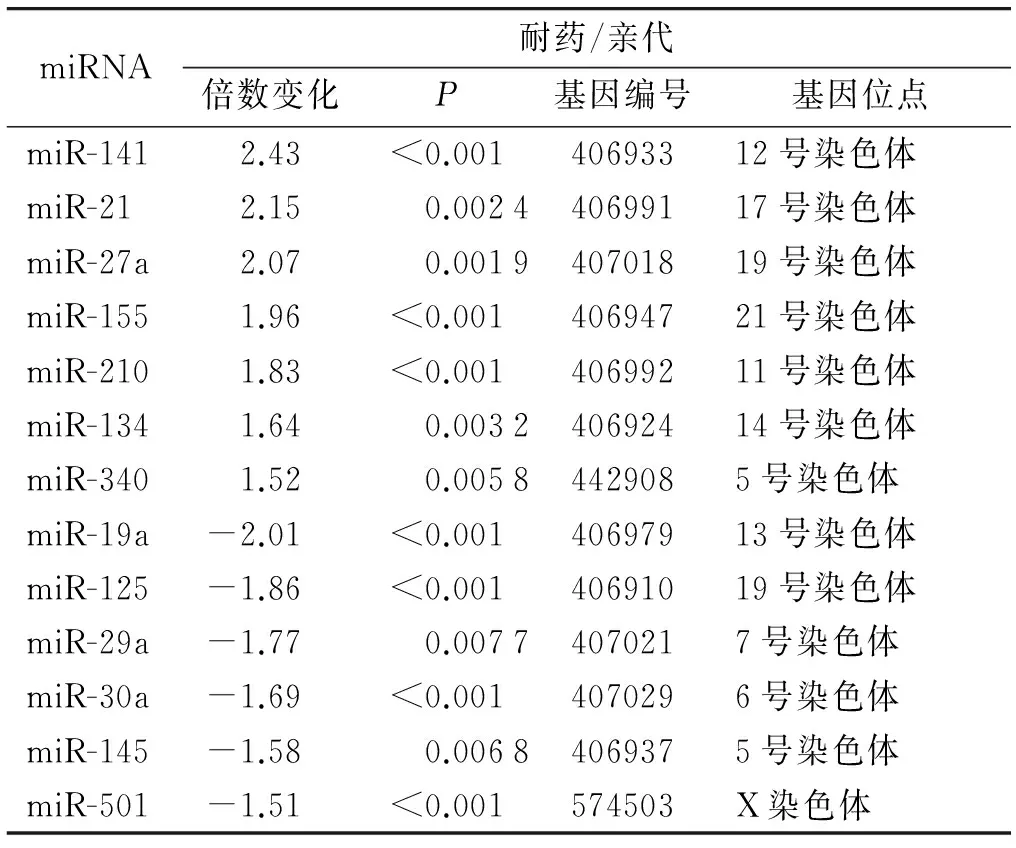
miRNA耐药/亲代倍数变化P基因编号基因位点miR-1412.43<0.00140693312号染色体miR-212.150.002440699117号染色体miR-27a2.070.001940701819号染色体miR-1551.96<0.00140694721号染色体miR-2101.83<0.00140699211号染色体miR-1341.640.003240692414号染色体miR-3401.520.00584429085号染色体miR-19a-2.01<0.00140697913号染色体miR-125-1.86<0.00140691019号染色体miR-29a-1.770.00774070217号染色体miR-30a-1.69<0.0014070296号染色体miR-145-1.580.00684069375号染色体miR-501-1.51<0.001574503X染色体
2.3miRNA-141影响细胞凋亡并通过靶向调控PPP2R1B导致5-Fu耐药
在接受同样剂量5-Fu处理后,转染miR-141抑制剂的癌细胞的克隆形成与耐药细胞相比明显下降(23.44±1.97vs218.12±23.46,P<0.05,见图3A,B)。进一步细胞凋亡实验发现,接受同样剂量的5-Fu,转染miR-141抑制剂的COLO-320/5-Fu细胞的凋亡变化比率与耐药细胞相比明显增加(3.75±0.26vs1.17±0.24,P<0.05,见图3C)。
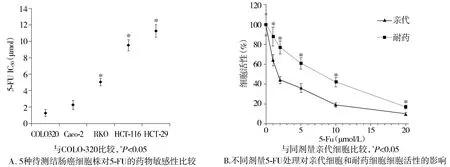
图1 不同结肠癌细胞株5-Fu药物敏感性测试及5-Fu耐药细胞株的验证Figure 1 Results of drug sensitivity to 5-Fu in different colon cancer cell lines and verification of 5-Fu-resistance cell
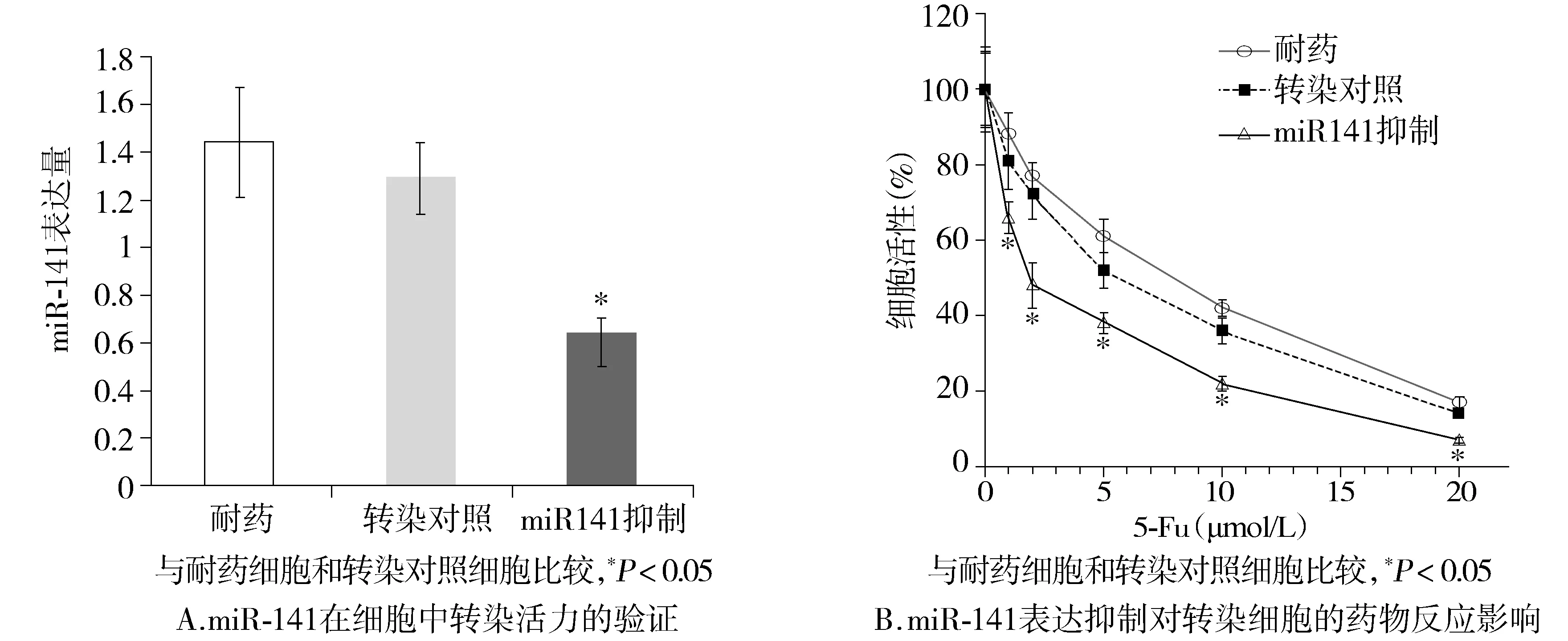
图2 miR-141表达抑制对5-Fu耐药性的影响Figure 2 Influence of miR-141 inhibition on sensitivity to 5-Fu
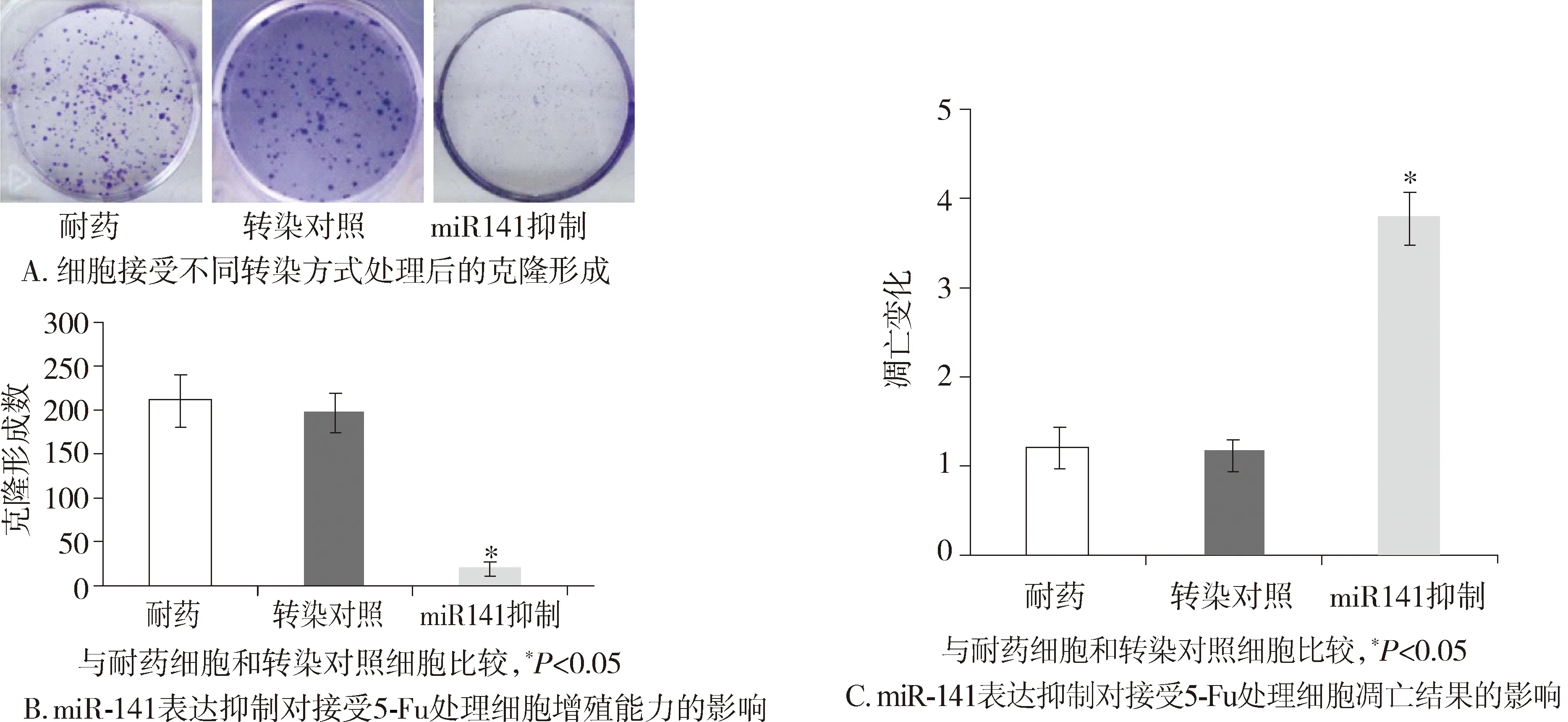
图3 miR-141表达抑制对细胞功能的影响Figure 3 Influence of down-regulation of miRNA-141 on cell proliferation and apoptosis
2.4miRNA-141靶向调控PPP2R1B导致细胞对5-Fu耐药
为进一步研究miRNA-141导致结肠癌细胞产生5-Fu耐药性的调控机制,本研究使用Targetscan和miRBase database等软件进行潜在靶基因预测,基于生物信息学分析结果,筛选出Akt通路亚基的PPP2R1B为可能的目标基因。为验证miR-141对PPP2R1B的直接调控作用,本研究将PPP2R1B启动区与miR-141结合序列中的部分碱基突变(见图4A), 以包含野生PPP2R1B启动区序列(PPP2R1B野生型)和突变PPP2R1B启动区序列(PPP2R1B突变型)的荧光酶报告载体与miR-141抑制剂共同转染耐药细胞,以不含PPP2R1B启动区的质粒作为对照(空白载体),结果显示,与转染试剂空白对照和阴性转染对照相比,miR-141抑制剂可以显著增加耐药细胞中包含野生PPP2R1B启动区序列的荧光酶活力(1.32±0.08,P<0.05),但对包含突变PPP2R1B启动区序列和空白载体的荧光酶活力没有影响(1.03±0.09vs0.97±0.09,P>0.05,见图4B)。由于PPP2R1B主要通过调节Akt去磷酸化过程影响细胞功能,通过蛋白印迹实验进一步研究敲除miR-141对PPP2R1B及Akt去磷酸化过程的影响,结果发现miR-141抑制剂可导致PPP2R1B蛋白表达量增加(1.39±0.09),同时引起磷酸化的Akt表达量下降(0.67±0.05)(P<0.05,见图4C,D)。
3讨论
手术是早期结肠癌主要的治疗手段,以5-Fu为基础的化疗则是术后辅助化疗和中晚期结肠癌患者的标准治疗方案。尽管目前5-Fu广泛应用于结肠癌患者,但部分患者经化疗后仍然出现肿瘤复发和转移,这可能与患者对5-Fu产生原发性或获得性耐药有关。因此,寻找影响5-Fu药物敏感性的生物学分子对提高结肠癌的疗效具有重要意义。本研究发现新的miR-141/PPP2R1B/AKT/信号调节通路可以影响结肠癌细胞对5-Fu治疗的反应性。miR-141抑制剂可以增加结肠癌细胞对5-Fu的治疗敏感性,其可能机制为抑制miR-141可以促进PPP2R1B的表达,导致AKT活化增强,进而促进结肠癌细胞对5-Fu的敏感性。另一方面,抑制miR-141可以促进5-Fu耐药细胞的凋亡并降低其增殖能力。
本研究通过比较结肠癌亲代细胞和5-Fu耐药细胞(表1)之间的miRNA表达谱,发现在5-Fu耐药细胞中miR-21、miR-27A和miR-155表达显著增高,miR-340、miR-145和miR-451的表达显著降低,有研究表明这些高表达的miRNA均表现出癌基因的性质[23-25],而表达降低的miRNA则具有肿瘤抑制作用[24]。研究证实miRNA在许多恶性肿瘤的发生发展中起重要作用,miRNA与肿瘤关系的研究日益受到关注。由于miRNA的转录后调节功能,其表达的改变会使多个关键的基因和通路受到影响。许多miRNA在结肠癌和5-Fu耐药过程中发挥着重要作用[27-30]。研究显示miR-192直接参与结直肠癌氟尿嘧啶和抗叶酸化疗耐药的过程[28]。Schetter等[29]指出miR-21可能与氟尿嘧啶类化疗药物的治疗反应相关,该研究分析了84例结肠腺癌组织及其配对的癌旁正常组织中miRNA的表达谱,发现miR-20a、miR-21、miR-106a、miR-181b和miR-203存在明显的异常表达,应用定量PCR技术在验证组中进一步分析这些miRNA的表达水平与肿瘤分期、预后以及对化疗反应之间的关系,发现在接受基于氟尿嘧啶类方案辅助化疗的Ⅱ期和Ⅲ期结肠腺癌患者中,miR-21高表达患者对氟尿嘧啶类化疗药物的反应较差,并与不良疗效相关。体外实验发现,在p53野生型的HCT116细胞系中过表达的miR-140作用于组蛋白去乙酰化酶4可导致5-Fu的耐药[30],进一步研究证实,结肠癌干细胞样细胞中的内源性miR-140表达上调可使这些细胞表现出化疗抗拒性;而利用小干扰RNA(small interfering RNA,siRNA)技术抑制结肠癌干细胞中miR-140的表达,可明显提高HCT116细胞对5-Fu的敏感性。这些研究表明,结肠癌患者接受5-Fu相关化疗方案的治疗效果与某些miRNA的异常表达相关。Akao等[31]发现,miR-34a在5-Fu耐药的结肠癌DLD-1/5-Fu细胞中的表达低于DLD-1细胞;DLD-1/5-Fu细胞经5-Fu处理后,miR-34a持续低表达。DLD-1细胞经5-Fu处理后,miR-34a的表达水平显著升高。进一步研究发现,DLD-1/5-Fu细胞中的Sirt1(sirtuin1)表达水平显著高于对照组。Sirt1是一种高度保守的基因和细胞凋亡负性调节因子,可编码烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)依赖的脱乙酰酶,并与化疗耐药相关。Sirt1是miR-34a的靶基因之一,因此miR-34a低表达可导致Sirt1高表达,从而降低DLD-1/5-Fu细胞对5-Fu的敏感性。本研究发现miR-141在5-Fu耐药结肠癌细胞中高表达。有研究报道结肠癌血清miR-141水平与临床分级和预后密切相关,高表达的miR-141血清水平可以作为临床较差分级和不良预后的潜在标志物[32]。体外实验和动物实验也发现,miR-141表达抑制可以降低胰腺癌细胞的增殖活性和侵袭性[33]。也有研究发现miR-141通过靶向调节KEAP1影响卵巢癌对顺铂的药物敏感性[34]。结合本研究结果,提示miR-141可能通过发挥类似促癌基因的作用影响细胞对化疗药物的耐药性。
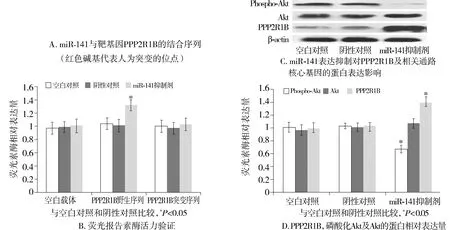
图4 miR-141与靶向基因PPP2R1B的结合及对Akt磷酸化的影响Figure 4 Binding effect of miRNA-141 on PPP2R1B and Akt phosphorylation

Akt是影响结肠癌细胞存活的一个重要因子,PP2A可以通过对Akt的两个主要活性基团位点苏氨酸308(Thr308)和丝氨酸473(Ser473)进行去磷酸化从而影响Akt的活性[16]。PPP2R1B是PP2A的一个重要组成亚基,可以通过二聚体形式调节PP2A的表达[17]。研究发现PPP2R1B对结肠癌细胞具有抑制作用,约有15%的原发性结肠肿瘤中出现PPP2R1B基因的缺失或突变,从而降低了的PPP2R1B基因的表达,进而减弱了PPP2R1B的肿瘤抑制作用[19,20]。本研究发现抑制miR-141可促进PPP2R1B和磷酸化Akt的表达,表明miRNA介导的转录后调控可能是一种调控结肠癌细胞PPP2R1B表达的新机制。由于癌细胞常通过多种机制减少抑癌基因的表达,因此恢复抑癌基因的表达活性,从小分子RNA的角度设计治疗策略成为治疗结肠癌患者的新思路。有研究证实Akt信号通路可以通过调节核转录因子(NF-κB),环磷酸腺苷反应元件结合蛋白(cAMP response element binding protein, CREB)以及Bcl-2相关蛋白的作用影响细胞凋亡[35,36],而本研究的凋亡和增殖实验观察到miR-141表达抑制的细胞,增殖能力减弱,同时凋亡比例增加,说明小分子RNA对肿瘤的发生发展有重大作用。本实验结果表明,结肠癌细胞系中抗凋亡效应是miR-141介导的5-Fu的化疗抗拒性的关键机制。由于5-Fu可治疗多种恶性肿瘤,抑制miR-141的表达能否提高5-Fu治疗其他肿瘤的临床疗效需要进一步的研究。
本实验研究确定了miR-141通过调节Akt通路途径参与5-Fu耐药机制。miR-141表达抑制可诱导结肠癌细胞凋亡并提高细胞对5-Fu的药物敏感性。因此,miR-141可以为治疗结肠癌药物的耐药反应的处理提供潜在的治疗靶标,为改善患者的临床治疗效果提供新的思路。
参考文献:
[1]Zhang Y,Talmon G,Wang J.MicroRNA-587 antagonizes 5-Fu-induced apoptosis and confers drug resistance by regulating PPP2R1B expression in colorectal cancer[J].Cell Death Dis,2015,6:e1845.
[2]Longley DB,Harkin DP,Johnston PG.5-fluorouracil:mechanisms of action and clinical strategies[J].Nat Rev Cancer,2003,3(5):330-338.
[3]Longley DB,Allen WL,Johnston PG.Drug resistance,predictive markers and pharmacogenomics in colorectal cancer[J].Biochim Biophys Acta,2006,1766(2):184-196.
[4]Liu YY,Han TY,Giuliano AE,etal.Ceramide glycosylation potentiates cellular multidrug resistance[J].FASEB J,2001,15(3):719-730.
[5]Longley DB,Johnston PG.Molecular mechanisms of drug resistance[J].J Pathol,2005,205(2):275-292.
[6]Synold TW,Dussault I,Forman BM.The orphan nuclear receptor SXR coordinately regulates drug metabolism and efflux[J].Nat Med,2001,7(5):584-590.
[7]Gottesman MM.Mechanisms of cancer drug resistance[J].Annu Rev Med,2002,53:615-627.
[8]Bartel DP.MicroRNAs:target recognition and regulatory functions[J].Cell,2009,136(2):215-233.
[9]Lewis BP,Burge CB,Bartel DP.Conserved seed pairing,often flanked by adenosines,indicates that thousands of human genes are microRNA targets[J].Cell,2005,120(1):15-20.
[10]Lujambio A,Lowe SW.The microcosmos of cancer[J].Nature,2012,482(7385):347-355.
[11]Calin GA,Sevignani C,Dumitru CD,etal.Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers[J].Proc Natl Acad Sci USA,2004,101(9):2999-3004.
[12]Zhang B,Pan X,Cobb GP,etal.microRNAs as oncogenes and tumor suppressors[J].Dev Biol,2007,302(1):1-12.
[13]Garzon R,Marcucci G,Croce CM.Targeting microRNAs in cancer:rationale,strategies and challenges[J].Nat Rev Drug Discov,2010,9(10):775-789.
[14]Garofalo M,Croce CM.MicroRNAs as therapeutic targets in chemoresistance[J].Drug Resist Updat,2013,16(3-5):47-59.
[15]Donzelli S,Mori F,Biagioni F,etal.MicroRNAs:short non-coding players in cancer chemoresistance[J].Mol Cell Ther,2014,2:16.
[16]Schonthal AH.Role of serine/threonine protein phosphatase 2A in cancer[J].Cancer Lett,2001,170(1):1-13.
[17]Sablina AA,Chen W,Arroyo JD,etal.The tumor suppressor PP2A Abeta regulates the RalA GTPase[J].Cell,2007,129(5):969-982.[18]Poretti G,Kwee I,Bernasconi B,etal.Chromosome 11q23.1 is an unstable region in B-cell tumor cell lines[J].Leuk Res,2011,35(6):808-813.
[19]Takagi Y,Futamura M,Yamaguchi K,etal.Alterations of the PPP2R1B gene located at 11q23 in human colorectal cancers[J].Gut,2000,47(2):268-271.[20]Wang SS,Esplin ED,Li JL,etal.Alterations of the PPP2R1B gene in human lung and colon cancer[J].Science,1998,282(5387):284-287.[21]Koti M,Gooding RJ,Nuin P,etal.Identification of the IGF1/PI3K/NF kappaB/ERK gene signalling networks associated with chemotherapy resistance and treatment response in high-grade serous epithelial ovarian cancer[J].BMC Cancer, 2013,13:549.
[22]Hamano R,Miyata H,Yamasaki M,etal.Overexpression of miR-200c induces chemoresistance in esophageal cancers mediated through activation of the Akt signaling pathway[J].Clin Cancer Res,2011,17(9):3029-3038.
[23]Ma X,Choudhury SN,Hua X,etal.Interaction of the oncogenic miR-21 microRNA and the p53 tumor suppressor pathway[J].Carcinogenesis,2013,34(6):1216-1223.
[24]Wu XJ,Li Y,Liu D,etal.miR-27a as an oncogenic microRNA of hepatitis B virus-related hepatocellular carcinoma[J].Asian Pac J Cancer Prev,2013,14(2):885-889.
[25]Rather MI,Nagashri MN,Swamy SS,etal.Oncogenic microRNA-155 down-regulates tumor suppressor CDC73 and promotes oral squamous cell carcinoma cell proliferation:implications for cancer therapeutics[J].J Biol Chem,2013,288(1):608-618.
[26]Gits CM,van Kuijk PF,Jonkers MB,etal.MicroRNA expression profiles distinguish liposarcoma subtypes and implicate miR-145 and miR-451 as tumor suppressors[J].Int J Cancer,2014,135(2):348-361.
[27]Slaby O,Svoboda M,Michalek J,etal.MicroRNAs in colorectal cancer: translation of molecular biology into clinical application[J].Mol Cancer,2009,8:102.
[28]Song B,Wang Y,Kudo K,etal.miR-192 Regulates dihydrofolate reductase and cellular proliferation through the p53-microRNA circuit[J].Clin Cancer Res, 2008,14(24):8080-8086.
[29]Schetter AJ,Leung SY,Sohn JJ,etal.MicroRNA expression profiles associated with prognosis and therapeutic outcome in colon adenocarcinoma[J].JAMA,2008,299(4):425-436.
[30]Song B,Wang Y,Xi Y,etal.Mechanism of chemoresistance mediated by miR-140 in human osteosarcoma and colon cancer cells[J].Oncogene,2009,28(46):4065-4074.
[31]Akao Y,Noguchi S,Iio A,etal.Dysregulation of microRNA-34a expression causes drug-resistance to 5-Fu in human colon cancer DLD-1 cells[J].Cancer Lett,2011,300(2):197-204.
[32]Cheng H,Zhang L,Cogdell DE,etal.Circulating plasma MiR-141 is a novel biomarker for metastatic colon cancer and predicts poor prognosis[J]. PLoS One,2011,6(3):e17745.
[33]Zhao G,Wang B,Liu Y,etal.miRNA-141,downregulated in pancreatic cancer,inhibits cell proliferation and invasion by directly targeting MAP4P4[J].Mol Cancer Ther,2013,12(11): 2569-2580.[34]van Jaarsveld MT,Helleman J,Boersma AW,etal.miR-141 regulates KEAP1 and modulates cisplatin sensitivity in ovarian cancer cells[J].Oncogene,2013,32(36):4284-4293.
[35]Koti M,Gooding RJ,Nuin P,etal.Identification of the IGF1/PI3K/NF-kB/ERK gene signaling networks associated with chemotherapy resistance and treatment response in high-grade serous epithelial ovarian cancer[J].BMC Cancer,213,13:549.
[36]Sakamaki J,Daitoku H,Ueno K,etal.Arginine methylation of BCL-2 antagonist of cell death(BAD) counteracts its phosphorylation and inactivation by Akt[J].Proc Natl Sci USA,2011,108(15):6085-6090.
Inhibition of miR-141 increases sensitivity of colon cancer cells to 5-Fu
MA Yinan1, JIN Yingying1*,WANG Yali1, CHEN Qingjuan2, WEI Yang3
(1DepartmentofOncology,SecondAffiliatedHospitalofXi’anJiaotongUniversity,Xi’an710004,China;2DepartmentofOncology,XianyangCenterHospital;3ScientificResearchCenter,SecondAffiliatedHospitalofXi’anJiaotongUniversity;*Correspondingauthor,E-mail:yingyingjin717@sina.com)
Abstract:ObjectiveTo establish a 5-fluorouracil(5-Fu)-resistant human colon cancer cell line and to explore the mechanism of resistance of miRNA-141 interaction with PPP2R1B to 5-Fu.MethodsBased on the results of drug sensitivity test, the 5-Fu sensitive cell line COLO-320 was initially given a high dose of 5-Fu followed by a stepwise treatment to establish a 5-Fu-resistant colon cancer cell line. IC50of 5-Fu-resistant cell line and parental cell line were calculated with MTT. PCR-based microarray technology was used to compare the differential expression of miRNAs between 5-Fu-resistant cells and the parental cells. The potential target gene of miR-141 was predicted with Targetscan, miRBase database. Furthermore, the predicated target gene was validated with a luciferase analysis. The miR-141 knockdown experiments were performed to investigate the binding effect of miR-141 on PPP2R1B.ResultsAn 5-Fu resistance colon cell line(COLO-320/5-Fu) was acquired at a final concentration of 5.0 μmol/L following the stepwise drug increments. The IC50of resistant cell line was significantly higher than that of parental cells(P<0.05). MicroRNA panel results indicated that a total of 13 miRNAs were differentially expressed, and miR-141 was highly overexpressed in resistant cells(P<0.05). After knockdown of miRNA-141 expression, the sensitivity of resistant cell to 5-Fu and the percentage of apoptosis increased(P<0.05). The luciferase result revealed that PPP2R1B was a target gene of miR-141. The inhibition of miRNA-141 significantly increased the expression level of PPP2R1B and consequently disturbed the Akt phosphorylation process.ConclusionThe COLO-320/5-Fu-resistant cell line is successfully established. The miRNA-141 may regulate the resistance of colon cancer cell to 5-Fu through targeted regulation of PPP2R1B.
Key words:colon cancer;5-fluorouracil;PPP2R1B;drug resistance;microRNA
作者简介:马一楠,女,1985-10生,硕士,住院医师,E-mail:2251990377@qq.com
收稿日期:2016-03-28
中图分类号:R735.35
文献标志码:A
文章编号:1007-6611(2016)06-0510-08
DOI:10.13753/j.issn.1007-6611.2016.06.006
